Щавелевая кислота с хлором
Для мытья посуды
Главные активные вещества в таких средствах – ПАВ, или поверхностно-активные вещества и регуляторы pH (уровень кислотности важен, чтобы кожа рук не сохла и не трескалась). Также в составе могут быть красители, глицерин и отдушки. В некоторые средства добавляют консерванты и антисептики. Даже после третьего полоскания водой на посуде остается от 5 до 15% моющего средства. Поэтому важно внимательно читать, что написано на этикетках. Обращайте внимание на ПАВ, они бывают трех основных типов: анионные, катионные и неионные. По некоторым данным, анионные ПАВ могут нарушать работу иммунной системы организма и снижать выработку некоторых ферментов. Самыми безопасными на сегодня считаются неионные ПАВ растительного происхождения – произведенные из отрубей или соломы.
Для стирки белья
В порошке главное – ПАВ и фосфаты. Фосфаты регулируют кислотность и смягчают воду, что улучшает качество стирки. К этим веществам в обществе накопилось много вопросов. Доказан их вред – правда, не для человека непосредственно, а для окружающей среды. Поэтому во многих странах Европы применение фосфатов в порошках ограничено. В качестве безопасной альтернативы используют цеолиты. По своей химической сути они похожи на песок, ракушки или стекло. Отстирывают белье порошки с цеолитами несколько хуже, и чтобы повысить качество стирки, рекомендуется стирать в горячей воде. Зато цеолиты безвредны и для природы, и для человека.
Для мытья унитазов
Для удаления известкового налета
Вода в наших домах обычно жесткая, поэтому на смесителях и стенках душевой кабины быстро образуются потеки, которые оттереть не так просто. Здесь понадобятся кислоты в сочетании с ПАВ. Самый лучший вариант средства против извести – с добавлением метансульфокислоты. Это самая сильная из кислот, при этом не слишком едкая, соответственно, достаточно безопасная. Однако при попадании на кожу и слизистые может вызвать ожог. Поэтому нужно работать в перчатках, маске и не вдыхать разбрызганное из пульверизатора средство.
Чаще всего в продаже бывают средства с соляной, щавелевой или лимонной кислотой. Соляная из них будет работать быстрее, но и потенциального вреда от нее больше. А вот щавелевая и лимонная кислоты настолько нетоксичны, что годятся даже для отмывания чайника – правда, потом его необходимо будет промыть 2-3 раза водой. В эко-средствах могут применять винный уксус, но с точки зрения безопасности для здоровья он ничем не отличается от той же лимонной кислоты.
Для удаления жира
Чтобы быстро справиться с жиром на плите или сковородке, нужна щелочь в сочетании в ПАВ, чтобы усилить эффект. Обычно в качестве щелочи добавляют гидроксид натрия. Другие его названия – каустическая сода и едкий натр. Это действительно очень едкое и агрессивное вещество, которое разъедает не только жир, но и руки, слизистые носа и глаз. Также не стоит подобными средствами пытаться отмыть алюминиевую сковороду – гидроксид натрия проест металл. Стекло после длительного контакта с этим веществом (особенно если его подогреть) мутнеет. Так что стеклокерамическую панель после сеанса удаления жира нужно очень хорошо промыть водой, прежде чем начинать на ней что-то готовить. Впрочем, хорошенько промывать – это главное правило использования жироудалителя с гидроксидом натрия. Второе – работать можно только в хорошо проветриваемом помещении (если моете плиту, включите вытяжку), в перчатках и желательно респираторе.
Если вам кажется, что едкий натр в вашем доме – это лишнее, попробуйте более мягкие средства без щелочи, только с ПАВ. Они тоже справляются с жиром, пусть и не так быстро и эффективно.
Плохой хороший запах

Щавелевая кислота (этавдиовая) – двухосновная предельная карбоновая кислота, которая представляет собой химическое вещество в виде бесцветных кристаллов, растворимых в воде, неполностью – в диэтиловом и этиловом спирте, нерастворимы в бензоле, хлороформе, петролейном эфире. Эфиры и соли такой кислоты называются оксалатами. Данный химический реактив относится к сильным органическим кислотам, температура плавления которого составляет -189,5 °C. В природе в свободном виде это химическое соединение, а также в виде оксалатов (эфиры и соли щавелевой кислоты) калия и кальция содержится во многих растениях: ревень, бобы, шпинат, орехи, соя. Данная кислота образуется при щавелевокислом брожении. Впервые данный вид кислоты был получен в процессе синтеза дициана химиком Фридрихом Вёлером (Германия, 1824 год).
Применение щавелевой кислоты
Как и любая кислота, щавелевая благодаря своим уникальным свойствам применяется в следующих отраслях промышленности:
- химической (при изготовлении пластмасс, красителей, чернил, пиротехники);
- металлургической (для чистки металлов от коррозии, оксидов, накипи, ржавчины);
- текстильной и кожевенной (как протрава, при покраске шелка и шерсти);
- пчеловодстве (для обработки пчел);
- бытовой химии (входит в состав многих моющих средств 
и порошков в качестве отбеливающего и дезинфицирующего средства);
- аналитической химии (осадитель редкоземельных элементов);
- микроскопии (отбеливатель срезов);
- косметологии (отбеливающий компонент от веснушек);
- медицине и фармакологии;
- деревообрабатывающей.
Важность щавелевой кислоты для организма
Данное химическое соединение в организме человека – это промежуточный продукт, который выделяется с мочой как соли кальция. При нарушении минерального обмена соли данной кислоты принимают участие в образовании камней в мочевом пузыре и почках. Данная органическая кислота, содержащаяся в сырых овощах, очень полезна для нашего организма. Она легко соединяется с кальцием и способствует его усвоению. Щавелевая кислота в отварных овощах негативно сказывается на здоровье, так как она становится неорганической. Это приводит к связыванию кальция, а как результат – к нехватке его в костной ткани, что является причиной ее поражения. Суточное выделение щавелевой кислоты вместе с мочой у взрослого человека составляет 20 мг, у детей до 1, 29 мг/кг.
Меры предосторожности

Щавелевая кислота относится к горючим, высокотоксичным и ядовитым химическим реактивам, поэтому для работы с ней допускаются только те сотрудники лаборатории, которые прошли специальный инструктаж по соблюдению мер безопасности:
- работы проводить в специальной лабораторной посуде из стекла. Если лабораторная посуда будет из другого материла, кислота может вступить с ней в реакцию;
- во избежание попадания щавелевой кислоты на кожу, дыхательные пути, слизистые оболочки все исследования следует проводить: в резинотехнических изделиях (сапоги, прорезиненные фартуки, перчатки смотровые, перчатки нитриловые), защитных средствах (противогаз или респиратор, очки), спецодежда;
- во время использования щавелевой кислоты запрещается принимать пищу, пить, курить;
- после завершения работ необходимо лицо и руки тщательно промыть теплой водой с мылом или нейтрализующим средством (раствором питьевой соды);
- запрещается транспортировка и хранение щавелевой кислоты совместно с пищевыми продуктами;
- соблюдать меры противопожарной безопасности, если есть необходимость в использовании нагревательных приборов.
Нужно знать, что щавелевая кислота относится к сильным органическим кислотам, употребление ее в большом количестве может стать причиной раздражения слизистой пищевода, кишечника, желудка, кожи и дыхательных путей. При попадании данного химического реактива в организм может появиться жжение, кровавая рвота. Первая помощь в таких ситуациях – обильно промыть водой пораженный участок кожи. Хранить кислоту нужно в закрытой полиэтиленовой упаковке в хорошо вентилируемом помещении на поддонах.
Щавелевую кислоту купить
“Prime Chemicals Group” – гарантия качества предлагаемой продукции.
Щавелевую кислоту купить с доставкой по городу и области можно Выгодно!
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
Щавелевая кислота, формула, характеристики:
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
Химическая формула щавелевой кислоты C2H2O4. Рациональная формула щавелевой кислоты HOOC−COOH либо (COOH)2. Изомеров не имеет.
Строение молекулы щавелевой кислоты:
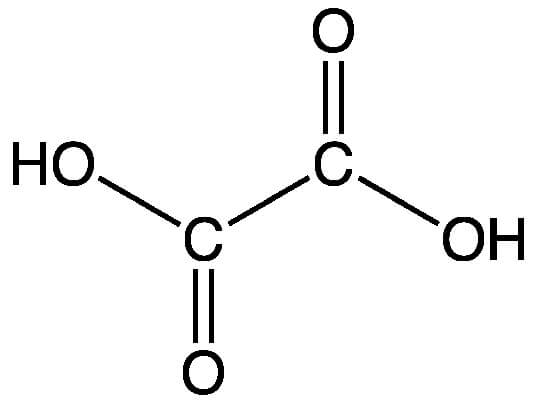
Щавелевая кислота (этандиовая кислота) – простейшая двухосновная кислота, первый член гомологического ряда двухосновных предельных карбоновых кислот.
Является сильной органической кислотой.
Щавелевая кислота по внешнему виду представляет собой бесцветные кристаллы. Имеет две кристаллические модификации: α – орторомбическая бипирамидальная (плотность 1,900 г/см 3 ), β – моноклинная призматическая (плотность 1,895 г/см 3 ).
Щавелевая кислота – горючее вещество. Температура самовоспламенения в слое 518 °С. Для пылевоздушной смеси нижний концентрационный предел воспламенения – 205 г/см 3 .
Хорошо растворяется в воде, неполностью – в диэтиловом и этиловом спирте, не растворяется в бензоле, хлороформе, петролейном эфире
Щавелевая кислота своё название получила из-за того, что образуется при щавелевокислом брожении. Впервые была получена в 1824 году немецким химиком Фридрихом Вёлером из дициана и воды.
В природе щавелевая кислота содержится в щавеле, ревене, кислице, карамболе и некоторых других растениях, а также в сырых овощах в свободном виде и в виде оксалатов калия и кальция.
Соли и сложные эфиры щавелевой кислоты называются оксалатами.
Название щавелевой кислоты на английском – oxalic acid.
Щавелевая кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Физические свойства щавелевой кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | бесцветные кристаллы |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см 3 | 1,9 |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м 3 | 1900 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см 3 | 1,895 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м 3 | 1895 |
| Температура плавления, °C | 189,5 |
| Температура самовоспламенения, °C | 518 |
| Константа диссоциации кислоты | 1,25; 4,14 |
| Удельная теплота сгорания, МДж/кг | 2,79 |
| Молярная масса, г/моль | 90,04 |
Химические свойства щавелевой кислоты:
Щавелевая кислота является сильной органической кислотой и проявляет кислотные свойства, характерные для карбоновых кислот.
Для нее характерны следующие химические реакции:
- реакция разложения щавелевой кислоты при нагревании:
C2H2O4 → CO + CO2 + H2O (t o , kat = H2SO4 (конц.)).При нагревании с концентрированной серной кислотой разлагается на моноксид углерода (угарный газ), углекислый газ и воду. - реакция щавелевой кислотыcхлоратом калия:
C2H2O4 + 2KClO3 → K2CO3 + 2ClO2 + CO2 + H2O.Щавелевая кислота вступает в реакцию с хлоратом калия. В результате реакции образуется карбонат калия, диоксид хлора, углекислый газ и вода.Данная реакция используется для лабораторного синтеза диоксида хлора. - реакция щавелевой кислотыcраствором аммиака:
C2H2O4 + 2NH3 → (NH4)2C2O4.Щавелевая кислота вступает в реакцию с аммиаком, растворенном в воде. В результате реакции образуется оксалат аммония. - реакция щавелевой кислотыcйодом:
C2H2O4 + I2 → 2HI + 2CO2.Щавелевая кислота вступает в реакцию с йодом. В результате реакции образуется йодоводород и углекислый газ.Аналогичная реакция проистекает с хлором.Данные реакции применяют для получения йодоводорода и хлороводорода. - реакция щавелевой кислотыcкарбонатом калия (или карбонатом натрия):
K2CO3 + H2C2O4 → K2C2O4 + CO2 + H2O,Na2CO3 + H2C2O4 → Na2C2O4 + CO2 + H2O.Щавелевая кислота вступает в реакцию с карбонатом калия (или карбонатом натрия). В результате реакции образуется оксалат калия (или оксалат натрия), углекислый газ и вода.Аналогичные реакции проистекают с карбонатом лития, карбонатом рубидия и карбонатом цезия. - 6. реакция диссоциации щавелевой кислоты в водном растворе:
H2C2O4 ↔ 2H + + C2O4 2- .В водном растворе щавелевая кислота диссоциирует на ионы.
Получение щавелевой кислоты:
Щавелевую кислоту получают:
- окислением углеводов, спиртов и гликолей смесью азотной и серной кислот в присутствии оксида ванадия (V2O5);
- окислением этилена и ацетилена азотной кислотой в присутствии хлорида палладия (PdCl2) или нитрата палладия (Pd(NO3)2);
- окислением пропилена жидким оксидом азота (NO2);
- из формиата натрия.
Безопасность при обращении с щавелевой кислотой. Требования ГОСТ:
Щавелевая кислота – сильная органическая кислота, в больших количествах может вызывать раздражение слизистых оболочек пищевода, желудка, кишечника, дыхательных путей и кожных покровов.
Предельно допустимая концентрация щавелевой кислоты в воде водных объектов хозяйственно-питьевого и культурно-бытового общепользования – 0,5 мг/дм 3 ., лимитирующий показатель вредности – общесанитарный. (см. ГОСТ 22180-76 Реактивы. Кислота щавелевая. Технические условия (с Изменениями N 1, 2)).
При работе с щавелевой кислотой следует применять индивидуальные средства защиты (респираторы типа “Лепесток” по ГОСТ 12.4.028, защитные очки по ГОСТ 12.4.013, резиновые перчатки по ГОСТ 20010), а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы непрерывно действующей приточно-вытяжной вентиляцией. Анализ препарата следует проводить в вытяжном шкафу лаборатории.
Щавелевая кислота – горючее вещество. Температура самовоспламенения в слое 518 °С. Для пылевоздушной смеси нижний концентрационный предел воспламенения – 205 г/см 3 . Средствами пожаротушения являются тонкораспыленная вода, химическая и воздушно-механические пены.
Применение щавелевой кислоты:
Щавелевая кислота применяется:
- в текстильной и кожевенной промышленности как протрава, при покраске шелка и шерсти,
- в металлургии для чистки металлов от коррозии, оксидов, накипи, ржавчины,
- в пчеловодстве для обработки пчел,
- в бытовой химии в качестве средства для удаления ржавчины, моющих, отбеливающих и дезинфицирующих средств,
- в медицине и фармакологии
- в аналитической и органической химии в качестве реагента и для осаждения редкоземельных элементов.
Характеристики и физические свойства щавелевой кислоты
Существует в двух полиморфных модификациях: ромбической бипирамидальной и моноклинной. Хорошо растворяется в воде. Нерастворима в хлороформе, петролейном эфире и бензоле.

Рис. 1. Щавелевая кислота. Внешний вид.
Таблица 1. Физические свойства щавелевой кислоты.
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура разложения, o С
Растворимость вводе, г/100 г
Получение щавелевой кислоты
Щавелевая кислота широко распространена в растительном мире. В виде солей она содержится в листьях щавеля, кислицы, ревеня. Соли и эфиры щавелевой кислоты имеют тривиальное название оксалаты. В промышленности щавелевую кислоту получают из формиата натрия:
2H-COONa→ Na-OOC-COO-Na + H2.
Химические свойства щавелевой кислоты
В водном растворе щавелевая кислота диссоциирует на ионы:
Щавелевая кислота проявляет восстановительные свойства: в кислом растворе окисляется перманганатом калия до диоксида углерода и воды. Эта реакция используется в аналитической химии для установления точной концентрации растворов перманганата калия. На восстановительных свойствах щевелевой кислоты основан способ удаления буро-коричневых пятен от перманганата калия.
При нагревании в присутствии серной кислоты сначала происходит декарбоксилирование щавелевой кислоты, а затем разложение образовавшейся из нее муравьиной кислоты:
HOOC-COOH → H-COOH + CO2;
Качественной реакцией для обнаружения щавелевой кислоты и её солей служит образование нерастворимого оксалата кальция:
Применение щавелевой кислоты
Щавелевая кислота используется в лабораторном синтезе, кожевенном деле, текстильной промышленности и в медицине.
Примеры решения задач
| Задание | Напишите уравнение материального баланса для раствора щавелевой кислоты. |
| Ответ | В результате диссоциации щавелевой кислоты в растворе существуют ионы HC2O4 — , C2O4 2- , H + и молекулы H2C2O4: |
Общая концентрация щавелевой кислоты есть сумма равновесных концентраций всех частиц (ионов, молекул), содержащих атомы С и О (обозначим в этом случае концентрацию символом c(C2O4 2- ), или же всех частиц, содержащих Н (сН). Тогда уравнение материального баланса можно записать так:
концентрация молекул H2C2O4 удвоена, поскольку щавелевая кислота содержит два атома водорода).
| Задание | Какова растворимость оксалата кальция (соль щавелевой кислоты), если Ks 0 (CaC2O4) = 2,29×10 -9 ? |
| Решение | Ks 0 (CaC2O4) – малая величина, поэтому можно принять ионную силу, создаваемую собственными ионами осадка, равной нулю. Конкурирующими реакциями |
Также можно пренебречь, поскольку C2O4 2- и HC2O4 — являются весьма слабыми основаниями. Итак,
s = Ks 0 = 2,29×10 -9 = 4,78×10 -5 М.
Сахарная, да не сладкая. Сахарной во второй половине 18-го века назвали одну из кислот .
Нынче ее именуют щавелевой, поскольку соединение содержится в листьях щавеля.

Однако, впервые вещество синтезировали, совместив азотную кислоту и сахар . В честь сладости и назвали.
Переименовали позже, обнаружив новое вещество в растениях. Могло быть и третье имя, ведь в чистом виде щавелевая кислота содержится лишь в грибах тутовиках.
В остальном, в природе встречаются лишь соли соединения. Об их свойствах и характеристиках чистой щавелевой кислоты , расскажем далее.
Свойства щавелевой кислоты
Соли щавелевой кислоты – это оксалаты. Они бывают средние, кислые и даже, молекулярные.
Большинство оксалатов не растворимы в воде. Чистая же кислота с ней смешивается легко. Из оксалатов с водой взаимодействуют лишь соли магния и щелочных металлов.
Во всех солях кислоты есть дианионы С2О4 2 , или (СОО)2 2 . Формула же чистой кислоты: — HOOCCOOH.
Получается, соединение относится к ряду двухосновных предельных карбоновых кислот .
Последняя характеристика указывает на присутствие карбоксильных групп COOH.
Двухосновными называют органические соединения с двумя атомами водорода . Предельными же именуют вещества, в молекулах которых нет кратных связей.
Формула щавелевой кислоты показывает, что соединение органическое. На это указывает присутствие углерода .
Водород и кислород – тоже типичные составные органики. В ней много энзимов – ферментов, помогающих пищеварению.
Однако, оксалаты щавелевой кислоты не полезны. Соли кальция , к примеру, формируют камни в почках. Образуются же оксалаты в печени.
Здесь организм формирует около 40% соединений. Еще 20% солей – итог метаболизма витамина С. Примерно 15% соединений поступают с пищей.
Если переборщить с овощами да фруктами, можно нарушить баланс оксалатов. Функция их вывода из организма, которому соли кислоты не нужны, возложена на печень.

Объединяет щавелевую кислоту и оксалаты кристаллическая форма. Героиня статьи тверда , бесцветна, не пахнет.
Единственное, что выдает принадлежность к классу кислот – вкус. Он, естественно, кислый.
Принадлежность к подклассу карбоновых кислот выдает число атомов углерода. В молекуле их два. Цифра четная. Значит, температурная обработка щавелевой кислоты затруднительна.
У кислот с четным количеством атомом углерода планка плавления выше, чем у нечетных соединений. Героиня статьи размягчается, лишь, когда температура за 100 градусов.
Если довести жар до 150-ти градусов, происходит отщепление от молекулы диоксида углерода. В народе его называют углекислым газом.
В итоге реакции, вместо щавелевой, получается муравьиная кислота . Наиболее быстро превращение протекает в присутствии концентрата серной кислоты .
Получить из щавелевой можно и угольную кислоту. Нужна кислая среда и перманганат калия .
Они запустят реакцию окисления, приводящую к появлению угольного соединения.
Дабы создать что-то из щавелевой кислоты, для начала, нужно найти ее саму. Вещество обнаруживают качественной реакцией с хлоридом кальция.
Взаимодействие дает нерастворимый осадок. Это оксалат кальция. Не зря же он образует камни в организме.
Так вот, если осадок выпал, значит, в исходном реагенте есть щавелевая кислота.

Где содержится героиня статьи, уже говорилось. Это щавель, фрукты и овощи. Но, список можно продолжить чаем , кофе , ревенем, шоколадом, бобами.
Есть щавелевая кислота и в арахисе, кукурузе и фасоли. Из приправ соединением богаты имбирь и кулинарный мак.
В молекуле щавелевой кислоты не только два атома углерода, но и две карбоксильных группы. Поэтому, героиню статьи зовут дикарбоновой.
Такой состав щавелевой кислоты обуславливает ее силу. Из ряда дикарбоновых вещество самое активное с химической точки зрения, поскольку карбоксильные группы наиболее близки друг к другу.
Два атома углерода – минимум для подгруппы. Три, четыре, пять углеродов отодвигают карбоксильные группы все дальше и дальше, уменьшая силу кислот.
Раствор щавелевой кислоты возможен не только на основе воды, но и этанола. Это соединение относится к группе спиртов.

Где пригождаются раствор кислоты и ее кристаллы , поведаем в следующей главе.
Применение щавелевой кислоты
Купить щавелевую кислоту стремятся пасечники. Им приходится сталкиваться с варроатозом пчел.
Заболевание поражает не только взрослых особей, но и их личинок. Вызывают недуг клещи.
Продукты, содержащие щавелевую кислоту, применяются, так же, в химической промышленности.
Реагент является составной пиротехнических смесей, пластмасс, чернил, а так же, участвует в синтезе красящих смесей.
В аналитической химии с помощью щавелевой кислоты осаждают редкоземельные металлы.
К металлам реагент применяют и как средство от ржавчины. Кислота легко растворяет ее, полируя поверхность металлургических сплавов .
В текстильной промышленности соединение пригождается при протравливании тканей.
Это обработка поверхности, необходимая, чтобы краситель лег на материю равномерно. Щавелевой кислотой протравляют ситцы, кожи , шерстяные нитки и шелк.
У героини статьи есть отбеливающие свойства. Не вошедшие в первую главу, они объяснят применение соединения в качестве компонента кремов, тоников и лосьонов против пигментных пятен, веснушек.
Отбеливание требуется и в изучении различных материалов под микроскопом. Рассматривают, как правило, срезы. На них и капают кислоту.
Другие отбеливающие соединения разрушают структуру подопытных. Щавелевое же вещество, лишь осветляет.
Функцию отбеливания щавелевая кислота выполняет, так же, в моющих средствах. В домашнем применении важны еще и дезинфицирующие свойства соединения.
Добыча щавелевой кислоты
Щавелевая кислота в организме формируется в ходе обменных процессов.
В промышленных масштабах соединение получают, нагревая формиат натрия . Его, так же, называют муравьинокислым соединением, а попросту, муравьиной кислотой.
Дабы реакция прошла успешно и эффективно, нагрев формиата должен быть быстрым. Процесс образования щавелевой кислоты двухстадийный.
Сначала, от муравьиного соединения отщепляется водород. Получается оксалат натрия. На второй стадии соль окисляют в присутствии серной кислоты.
Схема синтеза щавелевого вещества нетипична для дикарбоновых кислот. Обычно, их получают из соединений с двумя функциональными группами.

Такими группами именуют структурные элементы молекулы, определяющие ее химические свойства.
При стандартном синтезе дикарбоновых кислот их карбоксильные группы формируют именно из функциональных групп основополагающих соединений.
Цена щавелевой кислоты
Порошок щавелевой кислоты фасуют в мешки. Стандартная вместительность одного – 25 килограммов. За упаковку просят около 2000 рублей.

Если брать малую фасовку по одному кило, отдашь за него 100-130 рублей. Выгода приобретения соединения большими объемами очевидна. Встречаются и ценники в 80 рублей за килограмм кислоты.
Для производства щавелевого вещества установлен ГОСТ 2431-001-55980238-02.
Если продавец его не указывает, стоит уточнить соблюдение нормативов при переговорах о поставках.
Низкая цена может быть обусловлена несоответствием товара требованиям стандарта.
Ценник порошка зависит еще от одного фактора. Это чистота соединения. Если сторонних примесей 0,5% и меньше, вещество считается высокосортным.
В мелких поставках даже за полкило просят примерно 100 рублей. При загрязнении в 1-2% ценник падает до 50-60-ти рублей за те же 0,5 килограмма.
Слабо очищенное соединение берут, как правило, для химической промышленности, исключая производство косметики.
В рознице героиню статьи не продают. Найти кислоту в магазинах получается лишь в составах моющих средств.
Это в том случае, если реагент нужен для бытовых нужд, к примеру, выведения ржавчины.
Хотя, избавиться от коррозии металла можно и с помощью лимонной кислоты. Достаточно разрезать плод и полить заржавевшую поверхность его соком .
Так что, использование дорогостоящих смесей не всегда оправданно. Порой, выгоднее обойтись содержимым холодильника.
Читайте также:

