Щадящее воздействие на опухоль
Химиотерапия широко применяется в медицине для борьбы со злокачественными образованиями. Метод основан на введении в организм сильнодействующих токсичных препаратов, которые уничтожают раковые клетки или останавливают их развитие. Путем прямого вмешательства в процесс клеточного образования врач способен корректировать нарушения в организме пациента. Лечение рака химиотерапией во многих случаях становится единственным способом спасти человеку жизнь. В нашем обзоре рассмотрим подробнее, как проводят процедуру, какова ее эффективность и возможные осложнения.
Принцип действия химиотерапии
Химиотерапия — это системный метод борьбы со злокачественными опухолями. Пациенту назначают курс лекарственных препаратов, которые убивают быстро делящиеся клетки, к которым в том числе относятся и раковые. К сожалению, такое лечение воздействует не только на очаги болезни, но и на здоровые клетки: волосяных луковиц, костного мозга, желудочно-кишечного тракта и другие. Этим и обусловлены негативные побочные эффекты.
Химиотерапия является одним из трех ключевых методов лечения онкологических заболеваний наряду с хирургией и лучевой терапией. Их часто используют вместе. При многочисленных образованиях химиотерапия является единственным эффективным методом лечения. Она позволяет:
- уменьшить размер опухоли перед операцией или проведением лучевой терапии;
- уничтожить раковые клетки, которые могли остаться после хирургического вмешательства;
- улучшить результаты иных видов лечения;
- бороться с метастазами и рецидивами опухоли.
К сведению
Затраты на борьбу с онкологией являются самой большой статьей расходов в медицинской науке. Ежегодно фармацевты сообщают о новых достижениях в создании лекарств, и то, что совсем недавно было инновацией, превращается в обыденность. При этом каждый новый препарат стоит дороже предыдущего. Так, в ходе прошлогодней прямой линии президент России Владимир Путин сообщил, что к 2024 году на готовящуюся программу борьбы с онкологическими заболеваниями, в том числе на строительство и дооборудование онкоцентров, будет потрачен один триллион рублей.
Выбор конкретного метода лечения зависит от стадии онкологического заболевания, типа опухоли и ее локализации. Оптимальным считается сочетание нескольких типов и регулярная качественная диагностика.
Химиотерапия как основное лечение используется при системных онкологических заболеваниях, которые поражают весь организм: при лейкемии, злокачественной лимфоме и других. При других видах рака химическое лечение становится частью комплексной терапии, но прежде всего при наличии солидной опухоли. Солидной называют опухоль определенной локализации, которую можно прощупать или визуализировать при обследовании (УЗИ, рентген, МРТ, компьютерная томография). Например, карцинома или саркома, которые развиваются на коже, в слизистых оболочках, костной, мягкой и нервной тканях.
Иногда проведение химиотерапии назначают при отсутствии видимой опухоли после операции для улучшения результата и предотвращения рецидива (к примеру, при раке молочной железы). Если у пациента выявлены единичные злокачественные узелки, курс проводят до операции с целью уменьшения их размеров.
Лекарства применяют по разным схемам, чтобы максимально повысить эффективность и уменьшить побочное действие каждого препарата.
По механизму воздействия на организм химические препараты разделяют на две большие группы:
Лечение химиотерапией обычно проводят курсами — прием лекарств чередуют с перерывами, чтобы дать организму возможность восстановиться. Схему терапии, дозировку и способ введения определяет врач, опираясь на результаты детального обследования.
На выбор метода лечения онкологии влияют следующие факторы:
- тип опухоли и локализация;
- конечная цель (излечить полностью, уменьшить размер, предупредить рецидив и так далее);
- реакция пациента на конкретные препараты.
Во время обследования у больного выявляют тип онкологии и стадию развития болезни, оценивают общее физическое состояние и соотносят его с противопоказаниями. Химиотерапию проводят как амбулаторно, так и в стационаре. Большинство лекарств вводят внутривенно, хотя есть активные вещества, рассчитанные на пероральное применение (на основе бусульфана, мелфалана, капецитабина). Для лечения некоторых опухолей (рак печени или легкого, меланома) применяют изолированное вливание — на пораженный участок подают высокую дозу препарата, избегая повреждения всего организма. Однако данный метод позволяет контролировать только отдельные метастазы. Если рак касается центральной нервной системы, может быть использована интратекальная химиотерапия, когда препарат вводят в ликвор в головном или спинном мозге.
Комбинации конкретных препаратов зависят от вида рака и стоящих перед медиками задач. В таблице представлены некоторые схемы проведения химиотерапии при онкологических заболеваниях.
Таблица 1. Схемы проведения химиотерапии
Название
ABVD
Адриамицин, винбластин, блеомицин, дакарбазин
BEACOPP
Циклофосфамид, этопозид (фосфат), адриамицин, прокарбазин, винкристин, блеомицин, преднизолон
Сильно выраженный гранулематоз
CMF
Циклофосфамид, метотрексат, 5-фторурацил
Рак молочной железы
CVI
Циклофосфамид, винкристин, преднизолон
Саркома мягких тканей, лимфомы, скелетная саркома
MCF
Митомицин, цисплатин, 5-фторурацил
Костная саркома, опухоль желудка, поджелудочной железы, пищевода, молочной железы, печени, мочевого пузыря.
PEB
Цисплатин, этопозид, блеомицин
Опухоли яичек, яичников, легкого, шейки матки, мочевого пузыря
Сроки проведения химиотерапии и ее продолжительность зависят от тяжести заболевания. Как правило, длится такое лечение от нескольких недель до полугода с перерывами. Врач ведет постоянное наблюдение, корректируя курс по мере изменений в состоянии больного.
Эффективность химиотерапии варьируется от полного излечения (как правило, при лейкозе) до полной бесполезности (немеланомный рак кожи, рак почек). Крайне важно диагностировать онкологию на раннем этапе и начать терапию незамедлительно. Общая статистика выживаемости показывает, что большинство видов рака I степени могут быть излечены. К III стадии этот показатель опускается на уровень 50%. В IV стадии лишь 12–15% больных проживают пять лет.
Химиотерапия помогает контролировать течение болезни. Под воздействием препаратов клетки растут медленнее, уничтожаются метастазы. При паллиативном лечении химиотерапию применяют для уменьшения размеров опухоли, чтобы она не сдавливала органы и ткани и не вызывала боль.
Проблемой, которая снижает эффективность химиотерапии, является устойчивость части клеток к препаратам. Даже если 99% раковых клеток удастся уничтожить, 1% их может выжить и продолжить расти. Поэтому лекарства комбинируют между собой либо увеличивают дозу. Но здесь есть риск нанести серьезный вред нормальным клеткам.
От агрессивного химического воздействия, как уже было отмечено, страдают клетки кровеносной системы, ЖКТ, волосяных луковиц и ногтей, кожи, слизистых оболочек. Отсюда и следующие негативные последствия:
- выпадение волос — частичное или полное. После остановки лечения рост восстанавливается;
- остеопороз — ослабление костной ткани;
- тошнота, диарея, рвота — результат воздействия на ЖКТ;
- анемия и, следовательно, повышенная утомляемость;
- инфекционные заболевания. К ним приводит общее снижение иммунитета;
- нарушение репродуктивной функции, вплоть до временного или полного бесплодия (касается мужчин и женщин).
В чересчур ослабленном организме могут возникнуть серьезные осложнения: к примеру, тифлит (воспаление слепой кишки), аноректальная инфекция, пневмония. Поэтому, прежде чем назначить лечение, врач оценивает риски. Побочные эффекты должны быть такими, чтобы пациент смог их перенести.
Лечение онкологии химиотерапией в каждом случае имеет свои особенности. В первую очередь терапия определяется видом рака. Рассмотрим несколько наиболее частых диагнозов.
Рак легких. Лечение химиотерапией рака легких направлено на полное уничтожение раковых клеток. Курс лечения считается высокоэффективным, особенно если речь идет о мелкоклеточном раке в ранней стадии. Противоопухолевые препараты могут быть единственным средством лечения либо применяться в комплексе с другими. Обычно используют цитостатики, вводимые через капельницу. Перерывы между циклами — три–пять недель. Противопоказанием является интоксикация организма или наличие метастаз в печени. Дополнением к химии становится поддерживающая терапия для снижения побочных эффектов.
Лимфома. Химиотерапию при лимфоме принято считать эффективной ввиду того, что действующее вещество распространяется по организму и охватывает все пораженные участки лимфатической системы. Занимает лечение несколько месяцев. Хорошие результаты показывают такие лекарственные сочетания, как циклофосфан с винкристином, доксорубицином, винкристином, преднизолоном (речь идет о сочетании всех перечисленных веществ) и другими. Препараты вводятся внутривенно. Прогнозы часто положительные, и на I–II стадиях излечивается до 80% пациентов.
Рак молочной железы. Химиотерапия при раке молочной железы служит дополнением к хирургическому методу лечения. Она позволяет замедлить развитие раковых клеток, остановить метастазирование, предупредить рецидив. Для терапии используют препараты на основе бевацизумаба, трастузумаба, доцетаксела, капецитабина, которые вводят внутривенно. У женщин в пременопаузе с гормонально позитивным раком применяют терапию гормонами — как отдельно, так и совместно с химиотерапией.
Рак яичников. Лечение химиотерапией при раке яичников, которое длится не меньше года, используется до или после операции с целью прекратить метастазирование и предупредить рецидив. Применяют в основном цитотоксические препараты. Самый распространенный — на основе карбоплатина. Его вводят в вену. Для лечения используют также и внутрибрюшное введение, изредка — пероральное.
Рак желудка. Химиотерапия может быть единственным методом лечения больного с раком желудка, а может усиливать операционный эффект. Проводится строго в стационаре под наблюдением врача. Препараты вводят внутривенно или перорально. Они позволяют уменьшить количество метастазов и снизить выраженность симптомов. Последствия химиотерапии при этом виде рака особенно разрушительны, период реабилитации может затянуться на годы.
Таким образом, независимо от вида рака химиотерапия остается наиболее востребованным методом лечения. Ее преимущество — в способности бороться с распространенными метастазами и убивать невидимые при обследовании клетки, в то время как хирургия и лучевая терапия обладают точечным эффектом. Иногда курс применения химических препаратов — это единственный способ добиться выздоровления пациента.
В данной клинике также можно получить таргетную терапию, которая подразумевает точечное воздействие на раковые клетки. При составлении протокола по желанию пациента и показаниям врача могут привлекаться внешние консультанты — ведущие химиотерапевты Швейцарии и США.
* Лицензия №ЛО-77-01-017198 от 14 декабря 2018 года выдана Департаментом здравоохранения города Москвы.
Все опухоли подразделяют в зависимости от их потенций к прогрессии и клинико-морфологических особенностей на две основные группы:
• доброкачественные опухоли
• злокачественные опухоли
Имеются 5 классических особенностей опухолевой ткани: атипизм (тканевой, клеточный), органоидность строения, прогрессия, относительная автономность и неограниченный рост.
Доброкачественная опухоль
Доброкачественные (зрелые, гомологичные) опухоли состоят из клеток, дифференцированных в такой мере, что можно определить, из какой ткани они растут. Для этих опухолей характерен медленный экспансивный рост, отсутствие метастазов, отсутствие общего влияния на организм. Доброкачественные опухоли могут малигнизироваться (превращаться в злокачественные).
Злокачественная опухоль
Злокачественные (незрелые, гетерологичные) опухоли состоят из умеренно- и малодифференцированных клеток. Они могут утратить сходство с тканью, из которой они исходят. Для злокачественных опухолей характерен быстрый, чаще инфильтрирующий, рост, метастазирование и рецидивирование, наличие общего влияния на организм.
Для злокачественных опухолей характерен как клеточный (утолщение и атипизм базальной мембраны, изменение соотношения объемов цитоплазмы и ядра, изменение ядерной оболочки, увеличение объема, а иногда и числа ядрышек, увеличение числа фигур митоза, атипизм митоза и др.), так и тканевой атипизм (нарушение пространственных и количественных соотношений между компонентами ткани, например, стромой и паренхимой, сосудами и стромой и т. д.). Опухоли головного мозга, как правило, являются злокачественными.
Влияние опухоли на организм
Местное влияние заключается в сдавливании или разрушении (в зависимости от типа роста опухоли) окружающих тканей и органов. Конкретные проявления местного действия зависят от локализации опухоли.
Общее влияние на организм характерно для злокачественных опухолей, проявляется различными нарушениями метаболизма, вплоть до развития кахексии.
Лечение: иссечение изменённых опухолью тканей, частичное иссечение близлежащих тканей и метастаз по ходу распространения.
Лечение опухоли
Оно может быть паллиативным или же радикальным. Радикальное лечение новообразований ориентируется на полное уничтожение патологического очага ракового процесса, предполагает возможность перехода злокачественного процесса на этап продолжительной ремиссии.
Паллиативная медицина в онкологии занимается использованием всевозможных вариантов радикальной медикаментозной терапии, ее меры направлены в первую очередь не на лечение, а на продление и улучшение качества жизни. Основной принцип паллиативной медицины – это максимально уменьшить страдания онкологического больного. Рецидивы при этом случаются довольно часто, но предпринимаются всевозможные меры для того, чтобы больной был полноценным членом общества.
Стандартная схема терапия подразумевает комбинацию хирургического метода, лучевой терапии и химиотерапии, в редких запущенных случаях допускается применение биологических противоопухолевых препаратов. Планировка терапевтического курса происходит с учетом особенностей больного, его специфических нужд, общего состояния, семейного положения, статуса в обществе.
Онкологические заболевания стоят на одном из первых мест по смертности среди населения. За последние годы резко возросло количество раковых опухолей, которые диагностируются у пациентов. К сожалению, у них нет каких-либо ограничений по возрасту - данное заболевание как поражает взрослое население, так не щадит и детей.
В наше время применяются все новые и новые методы лечения рака, медицина в этом вопросе продвинулась уже далеко вперед. Одним из таких способов является фотодинамическая терапия в онкологии. С этим методом мы познакомимся немного подробнее в нашей статье.
Понятие фотодинамической терапии
Данный метод лечения имеет сокращенное название ФДТ, и его суть сводится к использованию света и определенных групп препаратов, которые называют фотосенсибилизаторами. Под воздействием света лекарственное вещество, накопленное в раковой опухоли, начинает разрушающе воздействовать на ее клетки.
В зависимости от локализации новообразования, препарат может вводиться в кровь или наноситься на кожные покровы. По прошествии короткого промежутка времени он абсорбируется тканями, а потом на этот участок направляется луч света.
Разберем, в чем заключается его биофизика. Фотодинамическая терапия в онкологии после попадания луча света сводится к химическому взаимодействию с участием кислорода, в результате этого и погибают раковые клетки. При такой терапии приходится удалять небольшие кровеносные сосуды, чтобы лишить опухоль подпитки.
Этапы ФД терапии
Фотодинамическая терапия в онкологии включает несколько этапов:
- Введение сенсибилизирующего раствора внутривенно.
- Накопление лекарственного средства в тканях, затронутых раковой опухолью. Учитывая разновидности тканей и препаратов, этот этап иногда длится до нескольких дней. Именно в это время специалисты диагностируют опухоль, опираясь на степень концентрации сенсибилизатора.
- Этап облучения опухоли лазерными лучами. Если раковая опухоль расположена слишком глубоко, то для доставки лучей используют светодиодные трубки. Под воздействием лазера начинается токсическая реакция, в результате которой раковые клетки погибают, при этом соседние здоровые ткани не затрагиваются.
- Этап распада раковой опухоли и восстановление тканей, подвергшихся мутации. Продолжительность составляет около месяца.
Как используется фотодинамическая терапия в онкологии
Данный вид терапии служит для существенного улучшения качества жизни больных пациентов. ФДТ не имеет длительных негативных проявлений, но применяется не так широко во всех странах.
Фотодинамическая терапия в онкологии в Москве используется с 1998 г. В настоящее время в столице функционирует 5 кабинетов, в которых проводят данную процедуру. Уже около 2 тыс. больных получили лечение данным методом.
В Онкологическом клиническом диспансере №1 была разработана и используется контактная ФДТ. Лазерное облучение, которое проводится таким способом, позволяет увеличить глубину проникновения лучей до 2 см.
Преимущества данного метода лечения
ФДТ – это инновационный метод борьбы с раковыми и предраковыми образованиями. В настоящее время на начальных стадиях онкологии его стараются применять, так как фотодинамическая терапия в онкологии преимущества имеет огромные:
- Есть возможность воздействовать только на раковые клетки.
- Пациенты легко переносят процедуру в любом возрасте.
- Терапия оказывает щадящее воздействие на органы и ткани, пораженные раковой опухолью.
- При раке кожных покровов процедура дает на 100% эффективный результат.
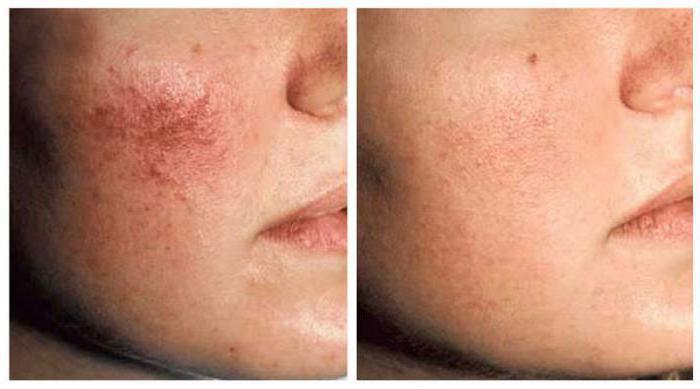
- При онкологии шейки матки этот метод самый эффективный, так как позволяет сохранить репродуктивную систему женщины.
- Лечение можно осуществлять амбулаторно.
- При необходимости можно применить повторно.
- Не имеет системных осложнений.
- Используя этот метод, можно удалять опухоли в труднодоступных местах.
- Во время процедуры пациент в сознании.
- Метод совершенно безболезненный.
- Фотодинамическая терапия в онкологии может применяться как самостоятельный способ лечения и в составе комплексной терапии.
Метод обладает разрушающим действием на раковые клетки, а также вируцидным (способен разрушить вирус папилломы человека), фунгицидным, бактерицидным и иммуномодулирующим. Наличие такого большого количества достоинств делает его популярным.
Недостатки метода
Кроме массы преимуществ, метод имеет и свои недостатки:
- Терапия ограничивается доступом света. То есть лечению поддается та часть, которая располагается непосредственно под кожей. Из-за этого нельзя использовать метод для избавления от раковых клеток, которые расселились практически по всем органам и тканям.
- После фотосенсибилизаторов некоторое время сохраняется чувствительность к свету.
Но из перечисленного все же видно, что фотодинамическая терапия в онкологии недостатки имеет совсем незначительные.
Показания к применению метода
Надо отметить, что ФДТ используют не только для избавления от раковых опухолей, но и для лечения псориаза, витилиго, волчанки и других кожных заболеваний. Фотодинамическую терапию используют для избавления от различных форм рака и терапии предраковых состояний. Она эффективна при болезнях глаз и дерматологических проблемах .
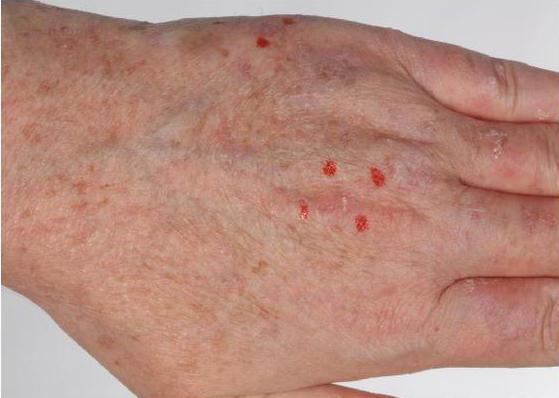
Кроме того, с помощью описанного метода проводят лечение незаживающих ран и трофических язв.
Кому не показана процедура ФДТ
Фотодинамическая терапия в онкологии противопоказания имеет, но незначительные. Ее не проводят:
- если имеются патологии почек и печени;
- в стадии декомпенсации болезни сердечно-сосудистой системы;
- при чрезмерной чувствительности к препарату;
- при заболеваниях крови.
Метод противопоказан и во время вынашивания ребенка, а также в период грудного вскармливания.
Фотодинамическая терапия в онкологии должна применяться только после консультации с врачом, чтобы можно было выявить все имеющиеся противопоказания.
Используемые препараты в терапии
Для проведения этого способа лечения врачи-онкологи используют лекарственные средства, которые можно разделить на две группы:
- Сенсибилизаторы первого поколения, с порфиринами.
- Фотосенсибилизаторы второго поколения.
Независимо от группы, к препарату предъявляются особые требования:
- обладает свойством концентрироваться в большом количестве в раковых опухолях и при этом не проникает в здоровые ткани;
- после проведения процедуры быстро выводится из организма и имеет низкую токсичность;
- не накапливается в коже;
- обладает устойчивостью к хранению и введению в кровеносное русло;
- обладает люминесцентными качествами.
Обзор препаратов для ФДТ
- Раковые опухоли гортани. После процедуры пациент лучше себя чувствует, особенно показано использование препарата, когда опухоль достигает размеров, практически блокирующих гортань, и лазерная терапия не может справиться с ней.
- Пищевод Беррета. Препарат используют в качестве профилактической процедуры для предотвращения развития онкологии.
- Рак легких.
Аминоливулиновая кислота используется в случае появления старческого кератоза. Наносится непосредственно на кожу и активируется синим цветом. Можно наносить только на лицо и голову.

Есть и другие препараты, но их используют гораздо реже.
Названное лекарственное средство вводится в организм внутривенно. Проникая внутрь, оно начинает абсорбироваться не только раковыми клетками, но и здоровыми по всему организму. Совершенно здоровые клетки в течение нескольких дней полностью очистятся от вещества, а в раковых оно сохранится.
Но если далее ничего не предпринимать, то ничего и не произойдет с опухолью. Реакция начинается только тогда, когда идет воздействие света, с определенной длиной волны, на клетки.
Если требуется провести процедуру для излечения рака легких, то для этого используют бронхоскоп, чтобы максимально проникнуть в пораженные ткани. Врачи для проведения ФДТ используют лазер с небольшой мощностью, поэтому никакие ожоги тканям не грозят.

Продолжительность процедуры зависит от размеров опухоли и ее расположения (обычно это составляет от 5 до 45 мин). Мертвые клетки и ткани исчезают за несколько дней. После проверки, если требуется, проводят повторную процедуру.
- фистула между пищеводом и бронхами;
- раковая опухоль, которая распространяется по большим кровеносным сосудам;
- язвенная болезнь желудка или увеличенные вены;
- аллергия на препарат.
Все вопросы обязательно обсуждаются с врачом перед процедурой.
Побочные эффекты ФДТ
После того как препарат попадает внутрь организма, он накапливается в клетках и тканях и через несколько дней, а иногда и недель, после процедуры может оставаться в клетках. Все это время глаза пациента и кожные покровы достаточно чувствительны к свету. От яркого света незащищенные участки начинают опухать и покрываться волдырями буквально через несколько минут.
Такая чувствительность может сохраняться несколько месяцев, все зависит от особенностей организма. Придется все это время избегать прямого солнечного света, но это вовсе не означает, что необходимо сидеть в темной комнате. Дозированный дневной свет помогает разрушению вещества в клетках и способствует их восстановлению.
Постепенно чувствительность будет снижаться, и можно будет это проверить, но не раньше, чем через месяц после ФДТ.
В роли других эффектов может выступать припухлость в месте терапии. Если процедура проводилась на горле, то первое время будут проблемы с глотанием, а после манипуляций на легких – с дыханием. При обнаружении таких симптомов надо срочно обращаться к врачу. Среди других побочных эффектов можно отметить следующие:
- тошнота, рвота, головная боль, икота - если ФДТ проводилась на пищеводе;
- одышка, развитие бронхита или пневмонии - может быть после лечения легких.
Обо всех таких проявлениях надо информировать доктора.
Рекомендации после терапии
Можно избежать существенных побочных явлений после терапии, если знать, как подготовиться к ней и правильно вести себя после процедуры. Для этого надо соблюдать следующие рекомендации:
- Отправляясь в больницу для проведения фотодинамической терапии, необходимо дома закрыть все окна и шторы, а также проследить, чтобы лампы были защищены абажурами или другим способом.
- Взять с собой в больницу обязательно солнцезащитные очки, головной убор (желательно шляпу с широкими полями), чтобы защитить лицо. Одежда должна иметь длинный рукав, а на ногах - брюки и носки (в такой ситуации надежда на солнцезащитный крем невелика).
- После процедуры в течение 30 дней желательно не бывать на улице в полуденные часы, а при выходе обязательно защищать кожу даже в пасмурную погоду.
- Все срочные и неотложные дела желательно перенести на вечернее время.
- Дома при чтении надо защищать глаза от прямого попадания света от лампы.
- После мытья головы не использовать для сушки фен - горячий воздух может активизировать оставшееся в клетках вещество и спровоцировать покраснение и ожог.
Если соблюдать все эти рекомендации, то фотодинамическая терапия в онкологии эффективность покажет максимальную, и пациент останется доволен результатом.
Отзывы о процедуре
Любой метод терапии не может одинаково успешно применяться для лечения всех пациентов. Но фотодинамическая терапия в онкологии отзывы имеет в основном хорошие. Пациенты отмечают, что после процедуры их состояние заметно улучшалось, это особенно касается раковых опухолей на коже, других кожных заболеваний. После ФДТ практически не остается шрамов, кожа становится более чистой.
Больные отмечают безболезненность терапии, небольшое количество побочных эффектов. Но надо заметить, что практически все пациенты говорят о повышенной светочувствительности после процедуры. Приходится избегать яркого света и надежно защищать глаза и кожу от его попадания.

Фотодинамическая терапия в онкологии отзывы имеет отрицательные только у тех, кто не соблюдал рекомендации врача и не сообщил об имеющихся сопутствующих заболеваниях. Надо заметить, что при раковых опухолях гортани или легких терапия сложная, и после нее могут возникнуть проблемы с глотанием и дыханием, но все это временные явления, которые постепенно пройдут.
После лечения практически все пациенты остаются довольны результатом, особенно если процедура проводилась высококлассным специалистом. Так, фотодинамическая терапия в онкологии в Новосибирске изучается замечательным профессором Сергеем Даниловичем Никоновым. Он разработал ФДТ для головного мозга, а также способ терапии канцероматозного плеврита, по этому поводу у него выпущено множество публикаций и научных трудов.
В других городах также имеются клиники, которые специализируются на лечении рака описанным способом. Фотодинамическая терапия в онкологии в Краснодаре доступна в клиническом онкологическом диспансере №1. Это медицинское учреждение оснащено по последнему слову техники, поэтому пациенты в успешности лечения могут не сомневаться.
К счастью, в настоящее время даже такое страшное заболевание, как рак, не является приговором. Самое главное - выявить его на той стадии, когда с ним еще можно успешно справиться. А для этого всего-то и требуется более внимательно относиться к своему здоровью и регулярно проходить медицинские обследования. Берегите себя и будьте здоровы!

фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко

фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко


фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко
фото предоставлено НМИЦ нейрохирургии им. академика Н.Н. Бурденко
Глиома — это аномальное разрастание опухолевой структуры в мозговой ткани человека. Это образование представлено совокупностью очень разных клеток, это "гетерогенная опухоль" по терминологии ученых. Особенностями глиомы считают ее отличное от других опухолей происхождение и отсутствие метастазирования. Однако ее опухолевые клетки обладают способностью мигрировать в здоровую ткань мозга, что значительно усложняет ее лечение. Глиобластома — самая агрессивная стадия глиомы.
Традиционные подходы: хирургическое удаление опухоли, лучевой метод и химиотерапия, к сожалению, не очень продлевают жизнь пациентам. Хирургическое вмешательство не позволяет полностью удалить опухолевые клетки, так как, во-первых, нейрохирург не может удалить лишнее, щадя жизненно важные ткани мозга; во-вторых, опухоль представляет собой неровную структуру без четких границ, и неизвестно, сколько опухолевых клеток уже проникло в ткани здорового мозга. Лучевое лечение и химиотерапия способны лишь притормозить рост опухоли, но не остановить его.
Развитие молекулярных методов позволило изучить глиомы на уровне генов. Результатом исследований явилось изменение классификации Всемирной организации здравоохранения в 2016 году, куда вошли понятия о ключевых для развития глиом мутациях нескольких генов. Классификация стала более четкой и основанной не на визуальных особенностях клеток опухоли, а на их молекулярных характеристиках.
Но и это не очень продвинуло терапию заболевания и не улучшило перспективы пациентов. Ученые во всем мире создают международные консорциумы для поиска решения.
Она объединила специалистов в области медицины, биологии, химии, физики и биоинформатики, которые разрабатывают новые подходы к диагностике и лечению глиомы. Физики, химики, биологи и медики активно ищут отличия между различными формами злокачественности глиомы.
Предполагается, что успех может быть достигнут при трех условиях: 1) максимально ранней диагностике, 2) усовершенствовании технологий, позволяющих четко визуализировать опухоль и максимально полно удалить ее, 3) индивидуальной терапии для целевого подавления опухолевых клеток на основе анализа молекулярных характеристик опухоли.
Демаркация границ опухоли
При хирургическом удалении опухоли крайне важно не затронуть жизненно важные зоны мозга. Одна из передовых технологий — это операция на головном мозге с пробуждением пациента во время удаления опухоли. В мозге нет болевых рецепторов, и достаточно местного обезболивания. Врач во время операции разговаривает с пациентом и просит его решать простые задачки. Нарушение поведения пациента говорит о том, что врач вторгся в опасную зону. Подобный подход позволяет оперировать опухоли, которые раньше считались неоперабельными.
К успешным достижениям в этой области можно отнести разработку российских нейрохирургов и физиков, которые используют методику интраоперационной нейровизуализации глиом. Перед операцией пациенту вводят перорально 5-аминолевулиновую кислоту (5-АЛК), которая совершенно безопасна для человека, поскольку является промежуточным продуктом обмена в организме. Эта кислота превращается во флуоресцирующее вещество протопорфирин IX.
«Одна из задач, поставленных перед наукой руководством России,— найти эффективные способы диагностики, обнаружения и лечения онкологических заболеваний, среди которых выделяются глиомы головного мозга человека. Российский фонд фундаментальных исследований в кратчайшее время создал соответствующее направление в своей работе: за несколько месяцев был сформирован рубрикатор, собран пул экспертов, проведены конкурсы и открыто финансирование.
Удивительным кажется тот факт, что это флуоресцирующее вещество накапливается именно в опухоли, делая ее видимой при использовании нейрохирургами специальной приставки к операционному микроскопу. Подобная технология позволяет максимально полно удалить опухоль.
На сегодня самый значительный технический прорыв наблюдается в области дооперационной диагностики опухоли. Магнитно-резонансная томография (МРТ) позволяет охарактеризовать расположение и объем опухоли еще до операции. Используют МРТ с контрастным усилением в трех проекциях и в трех режимах.
Также используют МРТ-спектроскопию для оценки метаболизма в опухоли и установки степени анаплазии (потеря клеткой внешних характеристик, по котором ее можно отнести к какому-нибудь типу), а МРТ-перфузию — для определения объема крови, проходящего через опухоль.
Появилось очень важное для пациента исследование — функциональное МРТ-картирование, которое необходимо для определения близости двигательных, речевых, зрительных зон мозга к опухоли. Это необходимо для того, чтобы нейрохирург мог рассчитать, как ему удалить опухоль, нанеся минимальный урон пациенту.
Всемирная организация здравоохранения в 2007 году ввела принцип классификации глиом, разбив их по степени злокачественности и по характеристикам клеток опухоли на четыре группы, которые назвали степенями (Grade). Самая доброкачественная I Grade, самая агрессивная IV Grade, или по-другому — глиобластома. Классификация использовала гистологические характеристики опухолевых клеток. В 2016 году ВОЗ вводит новую классификации глиом, которая требует при постановке диагноза опираться не только на гистологические особенности клеток опухоли, но и на результаты иммуногистохимии и FISH-анализа и секвенирования. Требуется оценивать мутации IDH1/2 и ТР53, делеции ATRX и ко-делеции 1p/19q.
Молекулярный паспорт опухоли
Но одних этих достижений оказывается недостаточно. Опухоли сильно отличаются друг от друга на генетическом уровне. Современные молекулярные подходы позволили характеризовать глиомы по ряду маркеров, однако ученые находят все новые генетические нарушения, которые влияют на чувствительность опухоли к терапии. Вполне вероятно, что через некоторое время ВОЗ предложит новую классификацию опухолей, основанную на большей выборке генетических нарушений и более приближенную к индивидуальной медицине.
Кроме того, растет понимание, что важны не только мутационные исследования генома пациента, но также нужно обратить внимание на транскриптом (результат прочтения генов в данном организме) и протеом опухолевых клеток (набор белков в них, синтезированных в результате прочтения их генома). Они сильно меняются и могут служить как диагностическим фактором, так и терапевтической мишенью. Так, например, обнаружено, что в опухоли часто изменяются транскрипты (молекула РНК) известных генов, подобное нарушение может приводить к продуцированию измененного белка или вовсе к тому, что белок не будет продуцироваться. Эти изменения могут служить для диагностики степени злокачественности, а также могут войти в панель прогностических признаков.
Новые направления в лекарственной терапии глиомы



Фото: предоставлено проф. А,В Головиным
Фото: предоставлено проф. А,В Головиным
Фото: предоставлено проф. А,В Головиным
Современные препараты химиотерапии стимулируют гибель опухолевых клеток. Но они также уничтожают и нормальные активно делящиеся клетки организма, что ухудшает общее состояние пациента. При этом не достигается полная гибель опухолевых клеток глиомы. Подобное лечение не позволяет продлить жизнь пациенту на длительный срок. Нужно искать новые подходы. Один из векторов таких исследований — это таргетная терапия, которая увеличивает вероятность доставки терапевтических молекул-киллеров непосредственно к клеткам опухоли. Например, есть разработки по использованию наночастиц, которые позволяют доставлять к клеткам глиомы пониженные дозы токсических веществ.
Как определить, преобладание какого типа клеток наблюдается в той или иной глиоме? Как понять, какое лекарство на нее подействует и насколько оно будет эффективно? Можно поставить еще много вопросов, ответы на которые можно дать, получив клеточные культуры из опухолевой ткани пациента. По ним мы можем проанализировать состав опухоли, оценить маркеры, характерные именно для этой опухоли, оценить способность клеток мигрировать и охарактеризовать их. Все современные технологии и новые лекарства могут быть проверены на клеточных культурах глиомы человека. Наконец, можно подобрать вариант терапии (условия лучевой терапии, химиотерапию), которые будут лучшими именно для этого пациента, а это большой шаг к индивидуальной терапии для каждого пациента.
Другой подход предполагает использование онколитических вирусов, которые могут как стимулировать апоптоз (образно говоря, принуждение к самоубийству) опухолевых клеток, так и вызывать иммунный ответ, который также приводит к гибели клеток опухоли. Несмотря на ряд недостатков этой терапии, известно, что некоторые из подобных вирусов уже проходят первую и вторую фазы клинических испытаний.
Появилось новое направление по применению структурированных малых молекул ДНК и РНК, называемых аптамерами, которые предполагают использовать в терапии глиом вместо антител, а также для диагностики опухолей. И такие разработки ведутся у нас в стране. Выбирается мембранный белок, наиболее характерный для опухолевой клетки, и подбирается к нему высокоточный аптамер (как ключ к замку). Подобный аптамер может служить для терапии, диагностики, а также для таргетной доставки другого лекарства.
Нельзя не упомянуть развитие иммунотерапии опухоли, за что была вручена Нобелевская премия по медицине 2018 года. Разрабатываются антитела, которые способны заставить клетки собственно иммунной системы пациента узнавать опухоль и уничтожать ее, как все чужеродное.
Понять происхождение глиом
Он не бессмертен.
Галина Павлова, доктор биологических наук, профессор РАН, заведующая лабораторией нейрогенетики и генетики развития Института биологии гена РАН
PDF-версия
- 18
- 19
- 20
Читайте также:

