С хлором в поваренной соли
Аноды электролизеров в обоих случаях изготавливают из одинаковых материалов: искусственного графита, пропитанного для уменьшения износа льняным маслом, или из титана, покрытого слоем оксидов рутения и титана. Аноды второго типа позволяют вести электролиз при высоких плотностях тока и более низком напряжении. Такие условия снижают расход электроэнергии на 10–12%. Поэтому оксидно-рутениевые аноды вытесняют графитовые: ими оснащено в настоящее время до 70% всех установок электролиза.
Технический электролиз водных растворов может осуществляться без выделения металлов или с их выделением на катоде. Среди электрохимических процессов разложения водных растворов без выделения металлов наибольшее распространение получил электролиз водных растворов хлорида натрия.
Электролиз водных растворов хлорида натрия.При электролизе водных растворов хлорида натрия получают хлор, водород и едкий натр (каустическая сода).
Хлор – при атмосферном давлении и обычной температуре газ желто-зеленого цвета с удушливым запахом. при атмосферном давлении температура кипения хлора –33,6° С, температура замерзания -102° С. Хлор растворяется в воде, органических растворителях и обладает высокой химической активностью.
Хлор потребляется прежде всего химической промышленностью для производства различных органических хлорпроизводных, идущих для получения пластических масс, синтетических каучуков, химических волокон, растворителей, инсектицидов и т.п. В настоящее время более 60% мирового производства хлора используется для органического синтеза. Помимо этого хлор используют для производства соляной кислоты, хлорной извести, хлоратов и других продуктов. Значительные количества хлора идут в металлургию для хлорирования при переработке полиметаллических руд, извлечения золота из руд, а также его используют в нефтеперерабатывающей промышленности, в сельском хозяйстве, в медицине и санитарии, для обезвреживания питьевой и сточных вод, в пиротехнике и ряде других областей народного хозяйства. В результате развития сфер использования хлора, главным образом благодаря успехам органического синтеза, мировое производство хлора составляет более 20 млн. т/год.
Едкий натр, или каустическая сода, – кристаллическое непрозрачное вещество, хорошо растворимое в воде, имеющее при атмосферном давлении температуру плавления 328° С. В промышленности выпускается твердый едкий натр и его водные растворы. Едкий натр широко используется во многих отраслях промышленности – целлюлозно-бумажной, химических волокон, нефтеперерабатывающей, органического синтеза, мыловаренной, лакокрасочной и в ряде других.
Водород – газ, температура кипения которого при атмосферном давлении –252,8 °С. Водород используют для синтеза важнейших неорганических и органических продуктов: аммиака, метанола и других спиртов, для гидрогенизации жиров, твердых и жидких топлив, очистки нефтепродуктов и др.
Сырьем для производства хлора и щелочи служат, главным образом, растворы поваренной соли, получаемые растворением твердой соли, или же природные рассолы. Растворы поваренной соли независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые гидроокиси кальция и магния, которые нарушают нормальный ход электролиза. Очистка рассолов производится раствором соды и известковым молоком. Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией. Электролиз растворов поваренной соли производится в ваннах с твердым железным (стальным) катодом и с диафрагмами и в ваннах с жидким ртутным катодом. Промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, должны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво.
Электролиз растворов хлорида натрия в ваннах со стальным катодом и графитовым анодом позволяет получать едкий натр, хлор и водород в одном электролизере. При прохождении постоянного электрического тока через водный раствор хлорида натрия можно ожидать выделения хлора, а также кислорода:
Нормальный электродный потенциал разряда OH – – ионов составляет +0,41 В, а нормальный электродный потенциал разряда ионов хлора равен +1,36 В. В нейтральном насыщенном растворе хлорида натрия концентрация гидроксильных ионов около 1·10 -7 г-экв/л. При 25° С равновесный потенциал разряда гидроксильных ионов будет φар=0,82 В. Равновесный потенциал разряда ионов хлора при концентрации NaCl в растворе 4,6 г-экв/л равен φар=1,32 В. Следовательно, на аноде с малым перенапряжением должен в первую очередь разряжаться кислород. Однако на графитовых анодах перенапряжение кислорода много выше перенапряжения хлора и поэтому на них будет происходить в основном разряд ионов Cl - с выделением газообразного хлора по реакции (а). Выделение хлора облегчается при увеличении концентрации NaCl в растворе в следствии уменьшения при этом равновесного потенциала. Это является одной из причин использования при электролизе концентрированных растворов хлорида натрия, содержащих 310–315 г./л. На катоде в щелочном растворе происходит разряд молекул воды по уравнению
Атомы водорода после рекомбинации выделяются в виде молекулярного водорода:
Разряд ионов натрия из водных растворов на твердом катоде невозможен в следствии более высокого потенциала их разряда по сравнению с водородом. Поэтому остающиеся в растворе гидроксильные ионы образуют с ионами натрия раствор щелочи. Процесс разложения NaCl можно выразить следующими реакциями:
Просуммировав уравнения получим:
То есть на аноде идет образование хлора, а у катода – водорода и едкого натра. При электролизе наряду с основными описанными процессами могут протекать и побочные, один из которых описывается уравнением (б). Помимо этого, хлор, выделяющийся на аноде, частично растворяется в электролите и гидролизуется по реакции
В случае диффузии щелочи (ионов ОН - ) к аноду или смешения катодных и анодных продуктов хлорноватистая и соляная кислоты нейтрализуются щелочью с образованием гипохлорита и хлорида натрия:
НОC + NaOH=NaOC + Н2О
HCl + NaOH=NaCl + Н2О
Ионы ClO – на аноде легко окисляются в ClO3 - Следовательно, из-за побочных процессов при электролизе будут образовываться гипохлорит, хлорид и хлорат натрия, что снижает выход по току и коэффициент использования энергии. В щелочной среде облегчается выделение кислорода на аноде, что также будет ухудшать показатели электролиза. Чтобы уменьшить протекание побочных реакций, следует создать условия, препятствующие смешению катодных и анодных продуктов. К ним относятся разделение катодного и анодного пространств диафрагмой и фильтрация электролита через диафрагму в направлении, противоположном движению ОН – – ионов к аноду. Такие диафрагмы называются фильтрующими диафрагмами и выполняются из асбеста.
Электролизеры БГК-17 рассчитаны на номинальную нагрузку 25 кА. Она выпускается для работы при 750 и 900 А/м 3 , но могут работать и при более высокой плотности тока. Электролизеры этого типа предназначены в основном для цехов электролиза мощностью 25–100 тыс. т хлора в год.
В электролизерах типа БГК-17 применена конструкция разветвленного катода, состоящего из узких плоских катодных пальцев, выполненных из стальной сетки и расположенных в виде четырех или шести гребенок. Катоды электролизеров имеют стальной каркас, что обеспечивает ток по поверхности катода. При правильном соотношении объемов катодного и анодного пространства в этих электролизерах можно значительно увеличить рабочую высоту электродов без опасения снизить выход по току.
Конструкция катодного блока предусматривает повышенное газонаполнение в катодном пространстве и исключает возможность снижения давления фильтрации через диафрагму в нижней части. В электролизерах применен нижний подвод тока к анодам. Верхняя часть анодного пространства свободна от анодов и моет быть достаточно развита в высоту.
Электролизеры БГК-17 отличаются большой высотой, что обеспечивает компактность конструкции и высокие съемы продукции с единицы площади производственного здания при сравнительно невысокой плотности тока, пониженные удельные расход электроэнергии и затраты цветных металлов по сравнению с электролизерами других типов. Достигнута хорошая герметичность в местах соединений катодного блока с анодным комплексом и крышкой.
Схема устройства электролизера БГК-17 на нагрузку 25 кА показана на рис. 1.
1 – перфорированный катод, 2 – диафрагма, 3 – катодное пространство, 4 – анод, 5 – анодное пространство.
Рис. 1. – Электролизер вертикального типа
Катодный блок представляет собой стальной корпус, внутри которого в четыре ряда вмонтированы гребенки катодных пальцев представляющих собой сплющенные полые карманы, выполненные из металлических каркасов с натянутой на них стальной проволочной сеткой. Толщина катодных пальцев 20 мм. Крайние каркасы катодных гребенок приварены к продольным стенкам корпуса катода, два средних образуют двухстороннюю гребенку, приваренную к торцевым стенкам корпуса.
Поваренная соль — это хлорид натрия, применяемый в качестве добавки к пище, консерванта продуктов питания. Используется также в химической промышленности, медицине. Служит важнейшим сырьем для получения едкого натра, соляной кислоты, соды и других веществ. Формула соли поваренной — NaCl.
Образование ионной связи между натрием и хлором
Химический состав хлорида натрия отражает условная формула NaCl, которая дает представление о равном количестве атомов натрия и хлора. Но вещество образовано не двухатомными молекулами, а состоит из кристаллов. При взаимодействии щелочного металла с сильным неметаллом каждый атом натрия отдает валентный электрон более электроотрицательному хлору. Возникают катионы натрия Na + и анионы кислотного остатка соляной кислоты Cl - . Разноименно заряженные частицы притягиваются, образуя вещество с ионной кристаллической решеткой. Маленькие катионы натрия расположены между крупными анионами хлора. Число положительных частиц в составе хлорида натрия равно количеству отрицательных, вещество в целом является нейтральным.
Химическая формула. Поваренная соль и галит
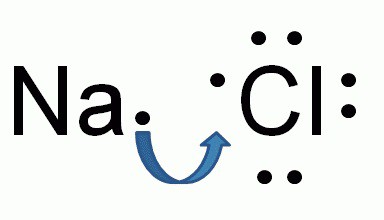
Проведем несложные расчеты по формуле вещества:
1) Mr (NaCl) = Ar (Na) + Ar (Cl) = 22,99 + 35,45 = 58,44.
Относительная молекулярная масса составляет 58,44 (в а.е.м.).
2) Численно равна молекулярному весу молярная масса, но эта величина имеет единицы измерения г/моль: М (NaCl) = 58,44 г/моль.
3) Образец соли массой 100 г содержит 60,663 г атомов хлора и 39,337 г натрия.
Физические свойства поваренной соли
Хрупкие кристаллы галита — бесцветные или белые. В природе также встречаются месторождения каменной соли, окрашенной в серый, желтый либо голубой цвет. Иногда минеральное вещество обладает красным оттенком, что обусловлено видами и количеством примесей. Твердость галита по шкале Мооса составляет всего 2-2,5, стекло оставляет на его поверхности черту.

Другие физические параметры хлорида натрия:
- запах — отсутствует;
- вкус — соленый;
- плотность — 2,165 г/ см3 (20 °C);
- температура плавления — 801 °C;
- точка кипения — 1413 °C;
- растворимость в воде — 359 г/л (25 °C);
Получение хлорида натрия в лаборатории
При взаимодействии металлического натрия с газообразным хлором в пробирке образуется вещество белого цвета — хлорид натрия NaCl (формула поваренной соли).
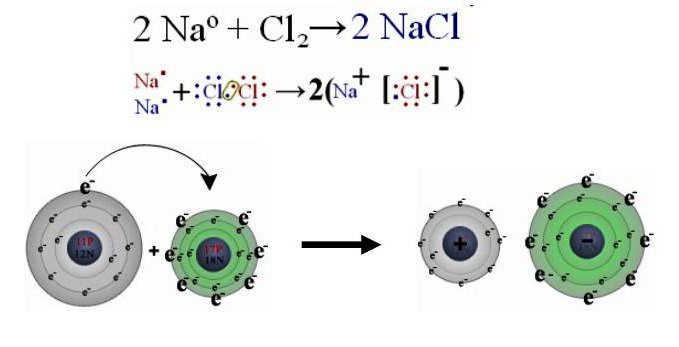
Химия дает представление о различных способах получения одного и того же соединения. Вот некоторые примеры:
Окислительно-восстановительная реакция между металлом и кислотой:
2Na + 2HCl = 2NaCl + Н2.
Действие кислоты на оксид металла: Na2O + 2HCl (водн.) = 2NaCl + H2O
Вытеснение слабой кислоты из раствора ее соли более сильной:
Для применения в промышленных масштабах все эти методы слишком дорогие и сложные.
Производство поваренной соли
Еще на заре цивилизации люди знали, что после засолки мясо и рыба сохраняются дольше. Прозрачные, правильной формы кристаллы галита использовались в некоторых древних странах вместо денег и были на вес золота. Поиск и разработка месторождений галита позволили удовлетворить растущие потребности населения и промышленности. Важнейшие природные источники поваренной соли:
- залежи минерала галита в разных странах;
- вода морей, океанов и соленых озер;
- прослойки и корки каменной соли на берегах соленых водоемов;
- кристаллы галита на стенках вулканических кратеров;
- солончаки.

В промышленности используются четыре основных способа получения поваренной соли:
- выщелачивание галита из подземного слоя, испарение полученного рассола;
- добыча в соляных шахтах;
- выпаривание морской воды или рассола соленых озер (77% от массы сухого остатка приходится на хлорид натрия);
- использование побочного продукта опреснения соленых вод.
Химические свойства хлорида натрия

Сферы применения каменной соли
Хлорид натрия снижает температуру плавления льда, поэтому зимой на дорогах и тротуарах используется смесь соли с песком. Она впитывает в себя большое количество примесей, при таянии загрязняет реки и ручьи. Дорожная соль также ускоряет процесс коррозии автомобильных кузовов, повреждает деревья, посаженные рядом с дорогами. В химической промышленности хлорид натрия используется как сырье для получения большой группы химических веществ:
- соляной кислоты;
- металлического натрия;
- газообразного хлора;
- каустической соды и других соединений.
Кроме того, поваренная соль применяется в производстве мыла, красителей. Как пищевой антисептик используется при консервировании, засолке грибов, рыбы и овощей. Для борьбы с нарушениями работы щитовидной железы у населения формула соли поваренной обогащается за счет добавления безопасных соединений йода, например, KIO3, KI, NaI. Такие добавки поддерживают выработку гормона щитовидной железы, предотвращают заболевание эндемическим зобом.
- Новости
- Статьи
Также для клиентов компании предусмотрены выгодные условия сотрудничества: низкие цены, разные формы оплаты, доставка оборудования по всем городам России. Для консультации или помощи в выборе средств механизации свяжитесь с сотрудниками компании по телефону, через онлайн-форму или другим удобным для вас способом.

Технологическая линия для получения ГПХН из поваренной соли
Система предназначена для производства гипохлорита натрия с большей эффективностью и более высоким качеством, чем с помощью периодических или непрерывных методов. Процесс универсален и обладает конструктивной способностью доводить любую концентрацию раствора гипохлорита натрия от 20 до 200 граммов на литр доступного хлора.
Установка изготовлена из высококачественных компонентов для обеспечения длительного срока эксплуатации при минимальном техническом обслуживании. Оборудование устроено таким образом, что для охлаждения раствора нет необходимости использовать механические способы. Для производства ГПХН путем электролиза поваренной соли потребуется:
Спецификации стандартного оборудования:
- Удельное потребление соли – 1.8 килограмма на 2.3 кг.
- Степень конверсии - до 99,9 процентов (соль в хлор).
- Содержание активного хлора в гипохлорите – до 8 грамм на литр.
Устройство размещено в раме из конструкционной стали, поэтому может быть полностью изготовлено на нашем заводе и доставлено как единое целое на ваш объект. Технологические системы могут быть разработаны для использования жидкости или паров хлора из электролизеров. Стандартные системы предназначены для получения концентраций от 125 до 200 граммов на литр хлора с производительностью от 40 до 150 галлонов в минуту.
Характеристики получаемого вещества
ГПХН – соединение, используемое для дезинфекции и очистки воды. Применяется для обработки поверхностей, отбеливания, удаления запаха и обеззараживания. Получают его двумя основными методами:
- Добавление соли в водный раствор с последующей электризацией.
- Добавление хлора в газообразном состоянии к каустической соде.
Первый метод уникальный. Он использует влажный пар хлора и гидроксид натрия, полученные непосредственно из хлор-щелочи. Таким способом можно безопасно производить высококачественное сырье при минимальных эксплуатационных расходах.
Завод оснащен многочисленными предохранительными устройствами, которые предназначены для отключения системы в случае нарушения технологического процесса. Система полностью автоматизирована и требует только внимания оператора при появлении сигналов о нарушениях технологического процесса. Установки доступны с различной производительностью.
Применение продукта
Раствор имеет обеззараживающий и дезинфицирующий состав, поэтому используется для уничтожения болезнетворных микроорганизмов. Основными тремя сферами применения сырья являются следующие:
- Медицина;
- Легкая промышленность;
- Сфера услуг.
Часто раствор применяется для обеззараживания воды в бассейнах, обработки различных тканей и поверхностей.
Процесс получения гипохлорита натрия электролизом поваренной соли
Получение гипохлорита натрия путем электролиза поваренной соли возможно двумя способами: с применением мембранного разделения катодного и анодного пространства и без.
Первый способ: в электролизной установке происходит отделение анодного и катодного пространства катион-проницаемой мембраной. В анодный резервуар подается раствор поваренной соли, а в катодный – вода. На катоде происходит разложение воды на ионы гидроксила и водород (под действием электротока). На аноде происходит окисление хлоридов до молекул хлора. Дальше катионы натрия переходят в католит (катодное пространство), где происходит образование едкого натрия. Потом анолит отправляется в сепаратор, где происходит конечное отделение хлора с перенаправлением в реактор, содержащий едкий натрий и водород, после чего образуется ГПХН.
Второй способ: метод прямого электролиза. Более простой и распространенный. Здесь в качестве электролизера выступает емкость, куда помещаются анод и катод. Гидрооксид натрия взаимодействует с хлорной и хлорноватистой кислотами, в результате чего образуется хлорид и гипохлорит натрия.
Преимуществом использования системы электролиза поваренной соли является безопасность. Не требуется транспортировка или хранение. При длительном хранении химикат становится неактивным.
- Экологическая безопасность.
- Соответствие рекомендациям в области защиты окружающей среды.
- Отсутствие необходимости хранения большого объема обеззараживающих веществ.
- Минимальные требования к содержанию поваренной соли (сухой и теплый склад).
- Полный контроль концентрации активного вещества при получении раствора ГПХН.
При других методах получения гипохлорита натрия образуется газообразный водород, который является взрывоопасным. Для предотвращения эксполяции необходимо оборудовать специальную вентиляционную систему. Обычно она работает медленно, поэтому необходимо использовать буфер дополнительной хлорной кислоты. Обслуживание и приобретение электролизной системы намного безопаснее.
Плюсы использования установок для получения гипохлорита натрия
Производители химических средств, использующие непрерывную систему нашего изготовления, значительно сократят количество человеко-часов, необходимых для получения стандартного объема сырья, по сравнению с другими производственными процессами. За всем сможет следить 1 оператор. К другим преимуществам нашего оборудования относится следующее:
- Система обеспечивает значительную экономию затрат на сырье благодаря 100% эффективности.
- Благодаря чрезвычайно высокой производительности установки достигается значительная экономия за счет использования меньшего количества сырья. Остаточные уровни могут быть снижены, а качество конечного продукта повышено.
- Тип охлаждения обеспечивает значительную экономию ресурсов.
Срок производства оборудования определяется индивидуально, поскольку зависит от индивидуальных эксплуатационных характеристик. После изготовления системы полностью проверяются и тестируются. Мы также производим монтаж и пуско-наладку, обучение сотрудников клиента. По интересующим вопросам можете связаться с нашими консультантами.
Электролизные установки для получения ГПХН из поваренной соли позволяют решить задачи, стоящие перед водоканалом и предприятиями, работающими с водоснабжением. Следует в первую очередь выделить безопасность технологического процесса. Поскольку гипохлорит натрия производится на месте, нет необходимости хранить хлор – опасное для здоровья окружающих вещество. Конструктивно установка состоит из следующих элементов:
- Электролизеры, оснащенные электродными блоками;
- Резервуары для приготовления раствора;
- Насос для дозирования;
- Трубы и фитинги;
- Выпрямитель.
Оборудование поставляется комплектно на стальной раме и собирается на месте. Процесс монтажа занимает около 6-8 часов.
- Изготовление средств механизации в кратчайшие сроки на заказ.
- Низкие цены на все виды оборудования.
- Оперативная поставка установок по России.
- Качественное техническое обслуживание оборудования.
- Гарантия от 1 года.
Производство хлора

Это процесс получения электролизом из растворов хлорида натрия в результате которого образуется газообразный хлор и щелочь.
Второй способ получения хлора и щелочи осуществляют в ваннах с ртутным катодом.
В лабораторных условиях хлор получают действием на оксид марганца соляной кислотой:
MnO2 + 4НСl → МnСl2 + Сl2 + 2 Н2O
Хлор и щелочь применяются в целом ряде областей промышленности. Особенно быстро растет потребность в хлоре в связи с бурным развитием хлорорганического синтеза. В технологии неорганических хлоропродуктов широкое распространение получило производство синтетического хлористого водорода сжиганием водорода в хлоре, производство четырех хлористого кремния, хлоридов цинка и алюминия, хлорной извести, гипохлорита и ряда других соединений. В металлургии некоторых цветных металлов (никель, кобальт и др.) хлор применяется в качестве сильного окислителя.
Большое развитие в технологии органических хлоропродуктов получило производство дихлорэтана, трихлорэтилена и гексахлор-этана, хлороформа, хлорвинила, перхлорвиниловой смолы, ядохимикатов и многих других ценных продуктов.
Области применения едкой щелочи также весьма разнообразны. Ее используют в мыловарении, производстве искусственного шелка и целлюлозы, в нефтяной промышленности, химии и металлургии.
Существует два принципиально различных способа получения хлора и щелочи электролизом растворов хлорида натрия, или, реже, калия. Первый из них, так называемый способ с твердым катодом, предложенный Н., Г. Глуховым и Ф. Ващуком в 1879 г., заключается в электролизе с железным катодом и анодом, стойким в отношении хлора. В этом случае на катоде выделяется водород и образуется щелочь, а на аноде выделяется в основном хлор.
Второй способ получения хлора и щелочи осуществляют в ваннах с ртутным катодом. Этот способ был изобретен А. П. Лидовым и В. А. Тихомировым в 1882—1883 гг. и получил промышленное применение благодаря работам Кастнера и Кельнера (1892 г.) почти одновременно с диафрагменным способом.
В СНГ существуют заводы, вырабатывающие хлор и щелочь как по первому, так и по второму способам. Способ с ртутным катодом будет развиваться лишь в той мере, в какой необходимо получение щелочи высокой чистоты, не могущей быть полученной в способе с твердым катодом.
При получении хлора и щелочи электролизом хлорида натрия с ртутным катодом на жидком ртутном катоде выделяется натрий, образуя амальгаму, а анодный процесс идет так же, как и в способе с твердым катодом. Таким образом, в ванне с жидким ртутным катодом образуются амальгама натрия и хлор. Переработка амальгамы натрия возможна несколькими путями.
В настоящее время амальгаму разлагают водой и получают щелочь и ртуть. Можно осуществить возгонку ртути и получать металлический натрий. Имеются также предложения использовать амальгаму как восстановитель при синтезе органических соединений. Возможность получения хлора без эквивалентного количества щелочи является важной особенностью способа с ртутным катодом, так как рост потребления хлора превышает рост потребления щелочи. Поэтому может наступить такой момент, когда необходимо будет получать хлор без щелочи.
Сырьем для производства хлора и щелочи электролитическим методом как с твердым, так и с ртутным жидким катодом является поваренная соль. Чистая поваренная соль содержит 39,4% натрия и 60,6%) хлора. В природной поваренной соли содержатся примеси — хлориды кальция и магния, сульфаты этих же элементов и другие.
Поваренная соль встречается в природе в виде залежей (каменная соль), самосадочной соли и рапы соляных озер, в виде естественных—подземных рассолов и в морской воде. Мощные запасы каменной соли известны во многих странах. В СНГ имеют промышленное значение месторождения Славянское, Артемовское, Илецкое, Соликамское и др. Соль, добываемая таким способом, содержит в большинстве случаев небольшой процент примесей. Например, каменная соль Артемовского месторождения содержит: 97,7—99,6% NaCl; 0,08% MgCl2; 0,3—1,4% CaSO4; до 1 % Н 2O. В тех случаях, когда электролизные заводы находятся вблизи месторождений каменной соли, для удешевления процесса ее добычи применяют подземное приготовление рассола.
При этом в буровую скважину, доходящую до пласта соли, накачивается вода и на поверхность извлекают рассол, близкий к насыщению. Метод этот, однако, не является совершенным, так как позволяет извлекать только несколько процентов от содержащейся в пласте соли (
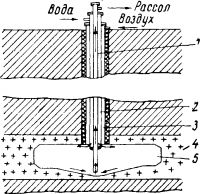
6%) и срок действия скважины не превышает 5—8 лет. В последнее время разработан более совершенный способ подземного выщелачивания, так называемый метод .гидровруба, схематически представленный на рис. 2. При растворении соли создается камера диаметром около 100 м. Способ гидровруба позволяет извлекать до 30% запасов соли и скважина может работать от 40 до 60 лет.
Самосадочная соль образуется за счет естественного испарения воды из насыщенных солью рассолов соляных озер. Эту соль добывают открытыми разработками. Таким путем в СНГ добывается поваренная соль в озерах Эльтон, Баскунчак и др. В самосадочной соли озера Баскунчак в среднем 97,2% NaCl; 0,5% MgCl2; 0,4% CaSO4; до 1,4% Н 2O и 0,1—0,6% нерастворимых веществ.
Рис. 2. Рассольная скважина для подземного растворения соли по методу гидровруба:
1 — труба для вывода рассола; 2 —труба для ввода воды; 3 — труба для ввода воздуха; 4 — пласт каменной соли; 5 — камера выщелачивания.
Во многих районах СНГ имеются подземные рассолы, богатые поваренной солью. Извлеченные из недр земли, они иногда могут непосредственно применяться в качестве промышленных рассолов.
Рассолы из буровых скважин Славянского и Березниковского месторождений имеют концентрацию: 300—303 г/л NaCl; около
2 ,0 г/л Са 2+ ; 0,14—1,4 г/л Mg 2+ ; 3,9—4,4 г/л SO 2- 4.
Добыча соли из морской воды представляет значительный интерес для стран с сухим, жарким климатом, при наличии морских (океанских) границ и удобной, отлогой конфигурации берега. Благоприятные в этом отношении условия имеются в ряде стран Европы, Америки и в КНР. Океанская вода содержит до 35 г/л поваренной соли, а также значительные количества солей магния и других элементов. Поваренная соль, полученная из морской воды, содержит несколько больше примесей, чем каменная соль. Так, например, соль из промыслов возле г. Тяньцзиня содержит, 87%
NaCl; 1,0% Mg 2+ ; 0,5% Са 2+ ; 1,0% SO 2- 4; 8 ,0% Н2O и нерастворимый остаток около 2,5%.
Приготовление электролита для способов с твердым или жидким катодом различно.
В способе с твердым катодом электролизные ванны питаются электролитом, который содержит примерно половину так называемой свежей соли, и половину оборотной соли. Приготовление электролита (рассола) заключается в растворении твердой соли (если сырьем является твердая соль) и очистке рассола, поскольку свежий рассол содержит примесей значительно больше, чем это допустимо. Рассол, поступающий из скважин при извлечении подземных рассолов или при подземном растворении твердой соли, также содержит значительное количество примесей и не может непосредственно направляться на электролиз.
Хлорид натрия хорошо растворяется в воде, причем с изменением температуры его растворимость меняется незначительно.
Небольшое изменение растворимости с температурой для практики очень существенно, так как позволяет работать с растворами, близкими к насыщению (
310 г /л), не опасаясь кристаллизации NaCl в трубопроводах, находящихся при более низких температурах, чем рабочая температура при электролизе.
Перед подачей в электролизеры рассол очищают от Mg 2+ , Са 2+ , а некоторых случаях и от ионов SO 2- 4 , оказывающих вредное влияние на ход электролиза. Допустимое содержание 0,005 г /л Са 2+ , 0,001 г /л Mg 2+ , остаточная щелочность после осаждения примесей не должна превышать 0,3 г /л (в расчете на NaOH).
Выделение Са 2+ из раствора производится в форме малорастворимого СаСO3 путем добавления раствора кальцинированной соды.
Осаждение Mg 2+ ведут раствором NaOH. При этом образуется малорастворимая гидроокись магния Mg(OH)2.
Разработан также способ, по которому осаждение гидроокиси магния ведут известковым молоком. При этом образуется гидроокись магния и в раствор переходят ионы кальция:
После осаждения ионов магния производят осаждение ионов кальция содой.
Образующиеся гидроокись магния и карбонат кальция отфильтровывают и затем раствор подкисляют соляной кислотой для нейтрализации избыточной щелочности.
Очистку от ионов SO 4 раньше вели осаждением в виде сульфата бария, добавляя к рассолу хлорид бария. Однако эта операция является слишком дорогой. От нее в последнее время отказались и ионы SO 2- 4 выводят при выпарке щелоков из оборотной соли.
Нерастворимые загрязнения отделяют отстаиванием и фильтрованием на фильтрпрессах. Очистка и отстаивание растворов производится обычно в деревянных или бетонных баках. Размер баков определяется масштабом производства и находится в пределах 100—400 м 3 .
При электролизе с ртутным катодом из ванны вытекает электролит с содержанием 260—270 г/л NaCl. Такой электролит поступает на донасыщение твердой солью. Однако перед этим раствор подкисляют до 0,1 г/л НСl и при разрежении (400—500 мм рт. ст.) из него удаляют растворенный хлор. После вакуумного дехлорирования содержание растворенного хлора в рассоле не выше 0,15 г/л. Затем рассол насосом подают в башню для отдувки хлора, где через слой рассола продувают сжатый воздух, уносящий растворенный в рассоле хлор. После продувки ртуть и другие металлы, содержащиеся в растворе, осаждают сульфидом натрия и щелочью. Для полного осаждения металлов требуется 3—5 ч. Шлам отфильтровывают, а осветленный раствор направляют на донасыщение в баки, куда подают твердый NaCl.
Если содержание примесей Са 2+ , Mg + и SO 2- 4 в до насыщенном растворе оказывается больше допустимых пределов, то электролит подвергают очистке от этих примесей как указано выше (очистку ot SO 2- 4 ведут хлоридом бария).
Статья на тему Производство хлора и щелочи
Читайте также:

