Презентация по генетике рак
Презентация была опубликована 6 лет назад пользователемИнга Новожилова
Презентация на тему: " Генетические аспекты онкогенеза Студентки 4 курса Датиевой И.А." — Транскрипт:
1 Генетические аспекты онкогенеза Студентки 4 курса Датиевой И.А.
2 Канцерогенез (лат. cancerogenesis; cancer рак + др.-греч. γένεσις зарождение, развитие) сложный патофизиологический процесс зарождения и развития опухоли. (сын. онкогенез). Выделяют следующие стадии формирования опухоли Гиперплазия ткани Доброкачественная опухоль Дисплазия Рак in situ Инвазивный рак Вторая стадия (формирование доброкачественной опухоли) может отсутствовать. Рак in situ прорастает базальную мембрану. Опухолевые клетки разрушают и замещают собой предсуществующий эпителий. В дальнейшем раковые клетки врастают в лимфатические и кровеносные сосуды с последующим переносом опухолевых клеток и образованием метастазов. Переход рака in situ в микрокарциному. Инвазия опухолевых клеток через базальную мембрану Прорастание опухолевых клеток через базальную мембрану и инвазия в подлежащую ткань. Врастание в кровеносные и лимфатические сосуды
3 Генетические аспекты этиологии и патогенеза злокачественных новообразований у человека изучаются очень давно. Первым предположил роль наследственности, как одного из механизмов канцерогенеза, французский хирург Брока, описавший в 1869 г. родословную семьи своей жены, где из 24 женщин 10 умерли от рака молочной железы. Как и для всех мультифакториальных заболеваний реализация механизмов канцерогенеза обеспечивается совместным действием целого ряда генетических и средовых факторов. Основными генетическими механизмами, запускающими процесс канцерогенеза, у человека являются мутации генов двух групп семейств, контролирующих процессы жизнеобеспечения клетки: протоонкогенов и антионкогенов (генов- супрессоров опухолевого роста).
4 Протоонкогены это группа нормальных генов клетки, оказывающая стимулирующее влияние на процессы клеточного деления, посредством специфических белков продуктов их экспрессии. Превращение протоонкогена в онкоген (ген – определяющий опухолевые свойства клеток) является одним из механизмов возникновения опухолевых клеток. Это может произойти в результате мутации генетического кода протоонкогена с изменением структуры специфического белка продукта экспрессии гена, либо же повышением уровня экспрессии протоонкогена при мутации его регулирующей последовательности (точечная мутация) или при переносе гена в активно транскрибируемую область хромосомы (хромосомные аберрации). Хромосомный набор нормальной (слева) и раковой клетки
5 На данный момент изучена канцерогенная активность протоонкогенов группы ras (HRAS, KRAS2). При различных онкологических заболеваниях регистрируется значительное повышение активности этих генов (рак поджелудочной железы, рак мочевого пузыря и т.д.). Так же раскрыт патогенез лимфомы Беркитта активация протоонкогена MYC происходит в случае его переноса в область хромосом где содержатся активно транскрибируемые коды иммуноглобулинов.
6 Гены-супрессоры представлены группой генов, чья функция противоположна функции протоонкогенов. Гены-супрессоры оказывают тормозящее влияние на процессы клеточного деления и выхода из процесса дифференцировки. Доказано, что в ряде случаев инактивация генов-супрессоров с исчезновением их антагонистического влияния по отношению к протоонкогенам ведет к развитию некоторых онкологических заболеваний. Так, потеря участка хромосомы, содержащего гены- супрессоры, ведет к развитию таких заболеваний, как ретинобластома, опухоль Вильмса и др.
7 Таким образом, система протоонкогенов и генов-супрессоров формирует сложный механизм контроля темпов клеточного деления, роста и дифференциации. Нарушения этого механизма возможны как под влиянием факторов внешней среды, так и в связи с геномной нестабильностью теория, предложенная Кристофом Лингауром и Бертом Фогельштейном. Питер Дюсберг из Калифорнийского университета в Беркли утверждает, что причиной опухолевой трансформации клетки может быть анеуплоидия (изменение числа хромосом или потеря их участков), являющаяся фактором повышенной нестабильности генома.
8 По мнению некоторых ученых, еще одной причиной возникновения опухолей мог бы быть врожденный или приобретенный дефект систем репарации клеточной ДНК. В здоровых клетках процесс репликации (удвоения) ДНК протекает с большой точностью благодаря функционированию специальной системы исправления пострепликационных ошибок. В геноме человека изучено по крайней мере 6 генов, участвующих в репарации ДНК. Повреждение этих генов влечет за собой нарушение функции всей репаративной системы, и, следовательно, значительное увеличение уровня пострепликационных ошибок, то есть мутаций (Lawrence A. Loeb).
9 Наименование гена Хромосома Заболевание APC (аденоматозного полипоза кишечника) 5q21Семейный полипоз кишечника Rb1 (ретинобластомы)13q14Ретинобластома, остеосаркома и др. WT-1 (опухоли Вильмса)11p13Опухоль Вильмса, другие опухоли p5317p12-13Опухолевый сындрои Ли- Фромени 2 NF-1 (нейрофиброматоза) 3 17q11Нейрофиброматоз (1 тип) DCC (делегированный при раке кишечника) 18q21Рак кишечника
10 Протоонкогены представляют собой группу семейств генов, которые играют ключевую роль в пролиферации и дифференцировке клеток, функционировании клеточных рецепторов, репарации ДНК и формировании ответа на внешние регуляторные сигналы. Продукты этих генов в норме регулируют многостадийный процесс сигнальной трансдукции. Передача сигналов опосредована тремя механизмами: фосфорилированием серина, треонина и тирозина в остатках белков путем отщепления фосфатной группы от АТР, в результате чего изменяется конфигурация белка-фермента и его активность; регуляцией активности GTPазы, осуществляющей GDP/GTP-превращение и выполняющей роль молекулярного медиатора мембрана-ассоциированных тирозин-киназы и серин-треонин-киназы; регуляцией репликации ДНК, экспрессии ядерных генов и процессов агюптоза. Гены-супрессоры опухолевого роста в норме отвечают за подавление клеточной пролиферации на определенных стадиях онтогенеза, т.е. регулируют (тормозят) экспрессию протоонкогенов.
12 Трансформация нормальной клетки в опухолевую представляет собой длинную цепь событий, инициируемых каскадом мутаций в протоонкогенах и генах-супрессорах. Механизмы канцерогенеза, запускаемые мутациями в генах этих двух групп семейств, несколько различаются. Мутации в протоонкогенах, обусловливающие их трансформацию в так называемые клеточные (целлюлярные) онкогены (с- опс), могут затрагивать структурную часть гена и приводить к изменению его продукта или повышать уровень экспрессии гена за счет хромосомных перестроек и/или мутаций в регуляторной части (в области промотора или энхансера) или амплификации (увеличения числа копий).
13 Мутации в структурной части гена - это, как правило, точковые мутации, меняющие конфигурацию белка, в результате чего активируется ауто фосфорилирование, увеличивается активность фермента и, следовательно, усиливается клеточный рост. Эти мутации аутосомно-доминантные, так как для злокачественной трансформации клетки не нужен второй сопутствующий онкоген.
Т (в белке - замена глицина на валин) приводит к развитию карциномы мочевого пузыря; точковая мутация в " title="Такие мутации описаны для семейства протоонкогенов ras: так в гене c-Ha-ras в кодоне, соответствующем 12-й аминокислоте белка p21ras, замена G -> Т (в белке - замена глицина на валин) приводит к развитию карциномы мочевого пузыря; точковая мутация в " > 14 Такие мутации описаны для семейства протоонкогенов ras: так в гене c-Ha-ras в кодоне, соответствующем 12-й аминокислоте белка p21ras, замена G -> Т (в белке - замена глицина на валин) приводит к развитию карциномы мочевого пузыря; точковая мутация в гене c-N-ras, приводящая к замене лизина на глицин в 61-м положении белка р 21ras, обусловливает развитие меланом и ряда карцином; активация протоонкогена c-Ki-ras2 вследствие двух различных точковых мутаций в одном и том же кодоне, соответствующем 12-й аминокислоте белка р 21 ras (замена глицина на валин или цистеин), приводит к развитию острого миелоидного лейкоза или карциномы щитовидной железы, соответственно. Точковые мутации выявлены и в гене erbA: замена ряда аминокислот в аминотерминальных положениях на валин в белке P75erb приводит к развитию эритробластозов. Т (в белке - замена глицина на валин) приводит к развитию карциномы мочевого пузыря; точковая мутация в "> Т (в белке - замена глицина на валин) приводит к развитию карциномы мочевого пузыря; точковая мутация в гене c-N-ras, приводящая к замене лизина на глицин в 61-м положении белка р 21ras, обусловливает развитие меланом и ряда карцином; активация протоонкогена c-Ki-ras2 вследствие двух различных точковых мутаций в одном и том же кодоне, соответствующем 12-й аминокислоте белка р 21 ras (замена глицина на валин или цистеин), приводит к развитию острого миелоидного лейкоза или карциномы щитовидной железы, соответственно. Точковые мутации выявлены и в гене erbA: замена ряда аминокислот в аминотерминальных положениях на валин в белке P75erb приводит к развитию эритробластозов."> Т (в белке - замена глицина на валин) приводит к развитию карциномы мочевого пузыря; точковая мутация в " title="Такие мутации описаны для семейства протоонкогенов ras: так в гене c-Ha-ras в кодоне, соответствующем 12-й аминокислоте белка p21ras, замена G -> Т (в белке - замена глицина на валин) приводит к развитию карциномы мочевого пузыря; точковая мутация в ">
15 При анализе кариотипа больных с различными типами опухолей часто выявляются транслокации, делеции и инсерции. В результате этих хромосомных перестроек протоонкоген может попасть в зону действия активного промотора, при этом транскрипция протоонкогена увеличится. Так протоонкогены c-mos, с-тус и с-аbl активируются вследствие транслокаций t(8;21), t(8;14), t(9;22), соответственно, что приводит к развитию следующих опухолей: острого миелоидного лейкоза, лимфомы Беркитта, хронического миелоидного лейкоза. Делеции 11 р рядом с областью расположения гена c-ras - Пр 13, могут привести к развитию аниридии или опухоли Вилмса.
16 Результатом транслокации может быть и амплификация гена, например, амплификация протоонкогена аЫ при хроническом миелолейкозе. Предполагается, что инсерции в регуляторные участки гена представлены преимущественно последовательностями генома некоторых ДНК-содержащих вирусов или про вирусной ДНК ретровирусов (РНК-содержащие). Встраивание в определенные участки генома регуляторных ДНК-последовательностей ретровирусов и/или активация провирусами промоторов клеточных онкогенов может привести к резкому усилению экспрессии протоонкогенов и развитию опухоли.
17 Возникновение опухолей, ассоциированных с ДНК-содержащими вирусами, обусловлено тем, что вирусная ДНК становится частью клеточного генома и вместе с ним передается дочерним клеткам. При этом репликация и экспрессия вирусной ДНК частично или полностью регулируются клеточными механизмами, в зависимости от степени интеграции генома вируса. Механизм регуляции экспрессии интегрированного генома вируса зависит от вида клеток. У большинства протоонкогенов человека выявлено некоторое сходство с нуклеотидной последовательностью дополнительных генов ретровирусов, обладающих онкогенным эффектом при внедрении в клетку- хозяина (вирусные онкогены - v-onc).
19 При рекомбинации и внедрении в геном вируса последовательности, соответствующей протоонкогену, вследствие высокого уровня мутирования ретровирусов, вероятность трансформации протоонкогена в онкоген возрастает. Далее процесс трансформации клетки может идти двумя путями: либо при последующей рекомбинации происходит обратное встраивание онкогена в клетку и экспрессия измененного белка, либо увеличение дозы аномального гена путем амплификации.
20 Гомология протоонкогенов и вирусных онкогенов лежит в основе и их обозначения. Для этого используется аббревиатура, состоящая из первых букв названия вируса, в котором впервые был обнаружен данный ген, а иногда индуцируемой им опухоли и поражаемого вида. Механизм амплификации гена имеется и в норме, гак как необходим для защиты клетки от стрессовых ситуаций. Например, резистентность опухолевых клеток к химиотерапии мегатрексатом при миелоидном лейкозе обусловлена амплификацией гена дигидрофолат-редуктазы - фермента, блокируемого этим препаратом. Наиболее часто наблюдается амплификация протоонкогенов тус-семейства. Этот механизм активации протоонкогена обнаружен при таких опухолях как нейробластома, около половины случаев которой обусловлено амплификацией гена N-тус, и мелкоклеточная карцинома легких, возникающая вследствие амплификации генов с-тус: N- myc и L-myc.
21 Амплификация гена может быть выявлена в виде малых добавочных хромосом, известных как минихромосомы, гомологичные соответствующим участкам хромосом. Увеличение числа копий некоторых протоонкогенов, например, N-myc при нейробластомах, характерно для поздних стадий малигнизации (озлокачествления) и предположительно может служить тестом для определения стадии развития рака и прогноза течения заболевания. Повышение экспрессии протоонкогена возможно и вследствие других механизмов, приводящих к эффекту дозы гена. Так усиление транскрипции гена может быть обусловлено эпигеномными изменениями: снижением/отсутствием действия специфического репрессора и гиперметилированием.
Рак — одна из наиболее частых и серьезных болезней, наблюдаемых в клинической медицине. Статистика показывает, что некоторые формы рака встречаются у более чем одной трети людей, вызывая более 20% всех смертей, и в развитых странах требуют более 10% общих расходов на медицинское обслуживание. Раковые опухоли при отсутствии лечения всегда приводят к летальному исходу.
Ранняя диагностика и раннее лечение жизненно необходимы, и немаловажная цель исследования рака — выявление людей с повышенным риском раковых опухолей до их развития.
В дальнейших статьях на нашем сайте МедУнивер попробуем разобраться, каким образом молекулярно-генетические исследования показывают, что рак — в основном генетическая болезнь. Во-первых, опишем типы генов, вовлеченных в развитие рака, и механизмы, благодаря которым дисфункция этих генов может заканчиваться болезнью.
Во-вторых, рассмотрим множество наследуемых онкологических синдромов и покажем, как понимание их патогенеза высветило основу более частых спорадических форм рака. Мы также изучим некоторые специальные проблемы, возникающие в медицинской генетике и генетическом консультировании в связи с наследуемыми синдромами.
В-третьих, покажем, как генетика и геномика изменили наши представления о причинах рака и методах его диагностики и лечения. Геномика за счет идентификации конкретных делеций и дупликаций сегментов генома раковых клеток и полного анализа экспрессии генов и мутаций в раковых клетках действительно изменила диагностику и лечение рака.
Рак — не одно заболевание, это название используют для обозначения злокачественных новообразований, характеризующихся неконтролируемым клеточным ростом, приводящим к их развитию. Новообразование, чтобы быть раком, должно также быть злокачественным.
Это означает, что его рост больше не контролируется, и опухоль способна прорастать смежные ткани или распространяться (метастазировать) в более отдаленные участки, или и то, и другое одновременно. Опухоли, не способные к прорастанию или метастазированию, не относятся к раковым и называются доброкачественными опухолями, хотя их размер и расположение могут вызывать беспокойство, но в целом они благоприятны для пациента.
Существует три основных формы злокачественных новоообразований: саркомы, когда опухоль возникает в мезенхимальной ткани, например в костях, мышцах, соединительной ткани или в тканях нервной системы; карциномы, возникающие в эпителиальной ткани, скажем, в эпителии клеток кишечника, бронхов или протоках грудной железы; и злокачественные неоплазии гемопоэтической и лимфоидной ткани, например лейкозы и лимфомы, захватывающие костный мозг, лимфатическую систему и периферическую кровь.
В пределах каждой из этих основных групп опухоли классифицируются по их расположению, типу ткани, гистологическим проявлениям и степени злокачественности.
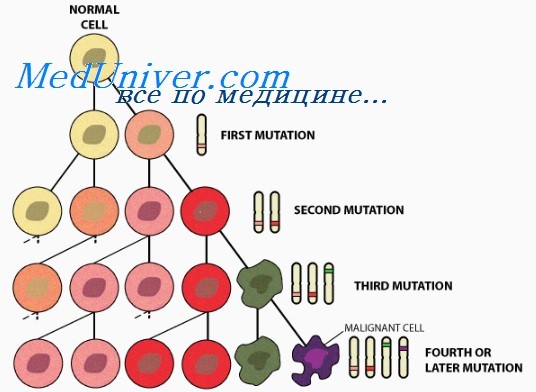
• Независимо от того, появился рак спорадически, в результате соматической мутации или у многих членов одной семьи как наследственный признак, это генетическое заболевание.
• Онкоген — мутантный аллель протоонкогена, класса нормальных генов, кодирующих белки клетки, обеспечивающие рост и выживание клеток. Онкогены облегчают злокачественное перерождение, стимулируя пролиферацию или тормозя апоптоз. Онкогены кодируют такие белки, как:
- белки сигнальных путей пролиферации клеток;
- факторы транскрипции, управляющие экспрессией обеспечивающих рост генов;
- ингибиторы механизмов программируемой смерти клетки.
• Развитие опухоли. После появления рак развивается, накапливая генетические поломки, благодаря мутациям или эпигенетическому подавлению генов ХКЦ, кодирующих механизмы репарации поврежденной ДНК и поддерживающих цитогенетически нормальное состояние. Другое последствие генетических дефектов — изменение экспрессии генов, приводящее к васкуляризации и распространению опухоли инвазивным ростом и метастазированием.
ГОУ ВПО СОГМА Росздрава Кафедра общей хирургии Лекция №28 Онкология.
Опухоль - патологическое образование, самостоятельно развивающееся в органах и тканях, отличающееся автономным ростом, полиморфизмом и атипией клеток.Основные свойства опухолей:Автономный рост – опухолевый рост не подлежит воздействию регуляторных механизмов (нервная и эндокринная регуляция, иммунная система и др.), т.е. не контролируется организмом.Полиморфизм и атипия – трансформировавшись, клетки начинают размножаться быстрее, при этом происходит нарушение дифференцировки клеток, что ведет к атипии (морфологическому отличию от клеток ткани, из которой они произошли) и полиморфизму (наличию в опухоли разнородный клеток). Чем менее дифференцированные клетки в опухоли, тем быстрее и агрессивнее ее рост.
Опухоль - патологическое образование, самостоятельно развивающееся в органах и тканях, отличающееся автономным ростом, полиморфизмом и атипией клеток. Основные свойства опухолей: Автономный рост – опухолевый рост не подлежит воздействию регуляторных механизмов (нервная и эндокринная регуляция, иммунная система и др.), т.е. не контролируется организмом. Полиморфизм и атипия – трансформировавшись, клетки начинают размножаться быстрее, при этом происходит нарушение дифференцировки клеток, что ведет к атипии (морфологическому отличию от клеток ткани, из которой они произошли) и полиморфизму (наличию в опухоли разнородный клеток). Чем менее дифференцированные клетки в опухоли, тем быстрее и агрессивнее ее рост.
Основные теории происхождения опухолей Теория раздражения Р.Вирхова – злокачественные опухоли чаще возникают в тех органах, где ткани чаще подвергаются травматизации Теория зародышевых зачатков Д.Конгейма – под влиянием определенных факторов зачатки, находящиеся в латентном состоянии, начинают расти, приобретая опухолевые свойства Регенерационно-мутационная теория Фишер-Вазельса – воздействие патологических факторов на регенерирующие ткани Вирусная теория Л.А.Зильбера – вирус, внедряясь в клетку, на генном уровне нарушает процессы регуляции деления Иммунологическая теория – нарушение идентификации и уничтожения трансформированных клеток иммунной системой.
Само по себе воздействие канцерогенных факторов не вызывает новообразования. Для возникновения опухоли необходимо наличие генетической предрасположенности и определенного состояния иммунной и нейрогуморальной систем Современная полиэтиологическая теория происхождения опухолей Канцерогенные факторы: Механические : частая, повторная травматизация тканей с последующей регенерацией Химические: местное и общее воздействие химических веществ Физические: УФО, ионизирующее облучение Онкогенные вирусы: вирус Эпстайна-Барр, вирус Т-клеточного лейкоза
вызывают интоксикацию, кахексию не оказывают влияния на общее состояние (за исключением редких форм) склонны к рецидивированию практически не дают рецидивов склонны к метастазированию не дают метастазов рост инфильтрирующий рост экспансивный атипия и полиморфизм клетки аналогичны клеткам ткани, из которой развились злокачественные опухоли доброкачественные опухоли Отличия доброкачественных и злокачественных опухолей
МАКРОСКОПИЧЕСКИЕ ФОРМЫ ОПУХОЛИ Инфильтрирующий рост Экспансивный рост ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
могут быть увеличены, безболезненные, плотные не изменены регионарные лимфатические узлы может быть изъязвление отсутствует нарушение целостности кожи определяется отсутствует связь с кожей может отсутствовать сохранена подвижность каменистой плотности, деревянистой плотности мягкоэластическая, плотноэластическая консистенция нечеткая четкая граница бугристая гладкая поверхность быстрый медленный рост злокачественна опухоль доброкачествен-ная опухоль характеристика Местные различия












25 апреля отмечается Всемирный день ДНК. Этот праздник установлен в честь признания важности генетики и научных открытий, сделанных в этой области. Наша ДНК, хранит в себе генетические данные, передающиеся нам от родителей, всю информацию о человеке и, в том числе, о болезнях.
Онкология и генетика
Например, человеку достались генные изменения, которые затрудняют вывод токсинов из организма. В этом случае, если он курит или работает на токсичном производстве, вероятность заболеть раком у него выше, чем у тех, кто не имеет такой генетической программы, так как организм не в силах справиться с выводом канцерогенов.
Некоторые из распространенных видов рака могут быть вызваны наследственными генетическими мутациями. В разных поколениях одной семьи могут появляться онкологические заболевания в определенной локализации. Самые распространенные из них — рак молочной железы (РМЖ) и яичников, рак предстательной железы.
Обычно РМЖ или рак яичников возникает у женщин в возрасте старше 50 лет. Если женщина заболевает в более раннем возрасте, это может означать, что она является носителем одной из мутации генов BRCA1 или BRCA2. В нормальном состоянии эти гены участвуют в восстановлении ДНК после различных повреждений, тем самым защищая клетки от злокачественного перерождения. Нарушение работы BRCA1/BRCA2 приводит к нарастанию ошибок в процессе репарации ДНК, что влечет за собой увеличение риска развития рака в этих локализациях.
Неблагоприятную наследственность не надо воспринимать как фатальную, поскольку существует большая вероятность избежать возникновения рака. Для этого нужно изучить свою медицинскую родословную. Если в вашей семье встречалось более одного случая рака в определенной локализации, заболевание в каждом из парных органов (почки, грудные железы) или несколько типов рака у родственников, то вам стоит обратиться к специалисту и сдать генетический тест. Он поможет выявить индивидуальную раковую предрасположенность, снизить риск развития патологии и своевременно принять профилактические меры, или диагностировать заболевание на ранней стадии и составить эффективный план лечения.
Не следует расслабляться и при отсутствии генетических мутаций, поскольку такой факт не дает 100% гарантии отсутствия риска.Даже если у вас нет тревожных симптомов, онкологи рекомендуют ежегодно проходить плановые осмотры у основных специалистов и проводить базовые исследования, такие как анализы мочи и крови, флюорография и другие. Комплексную проверку своего здоровья можно провести, например, в рамках диспансеризации. Существуют графики таких обследований в зависимости от возраста.
Внимание к собственному здоровью позволит обнаружить на ранней стадии или даже избежать развития не только рака, но и других заболеваний. Регулярные обследования позволяют выявить злокачественные новообразования на самом раннем этапе в 95% случаев. А это значительно повышает шансы на полное выздоровление.
Наша ДНК может изменяться вследствие многих факторов, поэтому важно заботиться о своем организме. Придерживайтесь здорового образа жизни, правильно и разнообразно питайтесь, контролируйте массу тела. Поддержание этих факторов в норме существенно снижает риск развития онкологических заболеваний. Отказ от вредных привычек и профилактика инфекционных заболеваний позволяют предотвратить поломки в генах и повышают вероятность сохранить свое здоровье как можно дольше.

Александр Олегович Иванцов, доктор медицинских наук
— Чтобы ответить на этот вопрос, стоит разобраться как развивается опухоль. Она имеет автономный характер роста. Что это значит? В норме количество клеток в организме человека регулируется балансировкой двух противоположных процессов – клеточного деления и клеточной гибели. При росте опухоли прибавление клеточной массы опережает клеточную гибель. Это возможно по двум причинам – либо активируются процессы пролиферации, т.е. деления клетки, либо угнетается апоптоз, т.е. запрограммированная клеточная гибель. Автономность опухоли состоит в том, что ее клетки не способны реагировать на внешние сигналы организма, и, как следствие, она продолжает рост.
Если изменения нуклеотидной последовательности ДНК происходят в значащих фрагментах ДНК (прим. – экзонах), то они могут привести к развитию опухоли. К развитию рака приводят в основном мутации, нарушающие баланс деления и гибели клеток, то есть мутации в генах, контролирующих именно эти процессы. Мутации могут возникать случайно, например, в процессе удвоения ДНК в результате деления клетки. А могут возникать под влиянием мутагенов: например, воздействия ультрафиолетового или рентгеновского излучения, высокой температуры, некоторых химических веществ. На последний вопрос, можно ответить, что патогенность мутации можно предположить в первую очередь по функции гена, который она затрагивает, по её структурным характеристикам (насколько сильно она нарушает или изменяет работу этого гена), и подтвердить путем функциональных исследований (например, на клеточных культурах).
— Что такое онкогены?
— Онкогеном называется ген, который в норме не оказывает влияние на процессы деления и гибели клеток, а в опухоли активизируется, вследствие чего раковые клетки приобретают способность к неконтролируемому размножению. Кроме того, в настоящее время известно о роли антионкогенов. В норме они подавляют процесс деления клеток или способствуют их гибели, а в опухоли этот сдерживающий эффект подобных генов отсутствует, тем самым провоцируется рост опухолевых масс. Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум пять-девять мутаций в разных онкогенах и антионкогенах.
— Эти мутации можно выявить с помощью генетического исследования?

— Кому и чем могут помочь генетические исследования? Верно ли, что от генетического исследования может зависеть успех лечения? Кому стоит пройти генетическое исследование на мутации?
— Сфера медицинского применения ДНК- и РНК-тестов в современной онкологии постоянно расширяется. Сейчас это тестирование позволяет диагностировать наследственные опухолевые синдромы, выявить предиктивные мутации, осуществить анализ экспрессионных характеристик опухоли. Также совершенствуются технологии, которые позволяют уточнять диагноз опухолей с невыявленным первичным очагом, эффективно контролировать течение заболевания и изменения свойств опухоли (жидкостная биопсия), выполнять различные биологические тесты с опухолевыми клетками.
Индивидуализация лечения онкологического пациента во многих случаях напрямую зависит от результатов генетического тестирования. Эмпирический подход, сопряжённый со случайным перебором биологически активных химикатов, постепенно замещается научно-обоснованным, молекулярно-направленным поиском специфических противоопухолевых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации.
Например, еще недавно клиническое деление всех первичных опухолей легкого на мелкоклеточный и немелкоклеточный рак было достаточным для определения стратегии лечения. Ситуация изменилась с открытием активирующих мутаций в гене, который кодирует рецептор эпидермального фактора роста — EGFR, сделавших этот онкогенный белок избирательной мишенью для воздействия препаратов ингибиторов EGFR. Мутации EGFR, как правило, встречаются у пациентов с аденокарциномой легкого. Тест на мутацию EGFR позволяет практически со 100%-й достоверностью отобрать тех больных, у которых гарантирован положительный результат применения гефитиниба, эрлотиниба или афатиниба.
— Может ли генетическое исследование помочь здоровому человеку предупредить рак или выявить его на ранней стадии?
Генетическое исследование при подозрении на наследственный раковый синдром носит комплексный характер. Оно начинается со сбора онкологического анамнеза ‒ уделяется внимание случаям злокачественных заболеваний у кровных родственников. В результате составляются родословные, позволяющие заподозрить наследственную патологию. На заключительном этапе проводится анализ ДНК, что позволяет установить наличие в генотипе больного, а также членов его семьи, подозреваемые мутации.
— Какие виды мутаций ученые уже выявили? Существует ли для каждого вида таргетный препарат? Как именно работает таргетный препарат?
— Много разных видов мутаций при разных опухолях известны, но наибольший интерес представляют мутации в онкогенах, в частности, в рецепторных протеинкиназах, для блокировки которых разрабатываются специфические препараты. Мутации в протеинкиназах изменяют конформацию белковых молекул и, таким образом, формируют идеальное терапевтическое окно. Таргетный препарат избирательно воздействует на клетки опухоли, содержащие молекулярную мишень, и этим выгодно отличается от химиотерапии. Известно об успешном использовании ингибитора тирозинкиназы ALK – кризотиниба – у больных с ALK-транслоцированными карциномами легкого. Успешным оказалось и применение специфических ингибиторов мутированного белка BRAF – вемурафениба и дабрафениба для лечения больных меланомой. Другой пример: ген BRCA1 кодирует фермент репарации ДНК. BRCA1-дефицитные клетки демонстрируют неспособность эффективно удалять сшивки ДНК, индуцированные препаратами платины. В наследственных BRCA1-ассоциированных раках отмечается наибольшая эффективность цисплатина, т.к. в опухолевых клетках наблюдается соматическая утрата оставшегося BRCA1-аллеля, в то время как нормальные клетки носительниц мутаций BRCA1 сохраняют интактную копию данного гена. Этим обусловлено уникальное терапевтическое окно и это объясняет высокую эффективность цисплатина при лечении BRCA1-ассоциировнного рака молочной железы, яичника. Конечно, по разным причинам, не для всех мутаций есть такие препараты, но их спектр и количество неуклонно возрастает.
— В настоящее время проводятся исследования в двух направлениях: диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и в некоторых случаях предотвращается неблагоприятный исход заболевания.
— В настоящее время проводятся исследования в двух направлениях – диагностика наследственных раковых синдромов и индивидуализация подбора лекарственных препаратов на основе молекулярных характеристик опухоли. Тем самым повышается клиническая эффективность применения дорогостоящих лекарственных препаратов, снижается частота и тяжесть побочных эффектов, и, в некоторых случаях, предотвращается неблагоприятный исход заболевания.
Читайте также:

