Рак вызывает альфа излучатель

В России в прошлом году зарегистрирован новый препарат для проведения радионуклидной терапии – радий-223. Он показан пациентам на последних стадиях рака предстательной железы и призван продлить им активную жизнь.
Новое поколение онко-препаратов
Василию Андреевичу К. 69 лет, у него жена, сын, внучка. Третий год он борется с раком предстательной железы. Опухоль уже дала метастазы в кости, и Василия Андреевича начинают беспокоить боли.
За эти три года он уже прошёл курс радиотерапии, ему вводили препараты стронция (тоже радиоактивный изотоп). Но прогресса в лечении не случилось. Как только ему предложили стать первым пациентом в Челябинской области и в УрФО, лечить которого будут новейшим препаратом, он тут же согласился.
С раком предстательной железы на последних стадиях, когда опухоль метастазировала в кости, о полном излечении речь не идёт. Ранее радионуклидная терапия в таких случаях применялась только для снятия болевого синдрома. Радий-223 делает следующий шаг – он практически останавливает развитие матастазов, цементируя очаг.
«Представьте, - рисует картинку для наглядности представитель фармацевтической компании-производителя нового препарата, - раковые клетки из очага поражения через кровь или лимфу разлетаются по организму, поражая соседние органы и ткани. Чаще всего при такой локации рака метастазы образуются на копчике, крестце и в пояснично-крестцовом отделе позвоночника.

Секрет радия
Историей одного из своих первый пациентов, кому вводили радий-223, поделился заведующий отделением радионуклидной терапии медицинского радиологического научного центра города Обнинск, д.м.н. Валерий Крылов. Он приехал в Челябинск, чтобы познакомить врачей ЧОКОД и ЯМ с новым препаратом:
«Нашему первому пациенту с раком предстательной железы и метастазами мы ввели препарат в 2014 году. Его снимок буквально светился очагами поражения: весь позвоночник, кости таза. После 6 инъекций с интервалами в 4 недели мы не увидели этих очагов. Произошёл полный метаболический эффект. Сейчас пациент жив. У него всё хорошо.
Чем же так уникален радий? В чем его секрет?
«На сегодняшний день это единственный в мире зарегистрированный радиофармпрепарат на основе альфа-эмиттера (альфа-излучателя), - продолжает доктор. - С этим, как раз связана его высокая эффективность и безопасность. Потому что альфа-частицы имеют очень мощное поражающее действие: 1 альфа-частица может вызвать смерть 1 раковой клетки. В ранее используемых радиоактивных препаратах облучение производилось бета-частицами, их эффект значительно ниже: от 50-200 бета-частиц различной энергии вызовут тот же самый эффект.

Безопасная радиация?
Примечательно, что препарат нового поколения, по сути, не требует особых условий для хранения и использования.
Например, радиопрепараты йода являются сильно-летучими. Чтобы их использовать, нужны спецвентиляция и спецканализация в больнице, изолированные палаты для пациентов. Радий этого не требует.
Мало того, этот препарат в большинстве стран мира применяется амбулаторно и согласно российским нормам радиационной безопасности при введении не требует специального помещения. Излучение настолько мало, что не оказывает вредного воздействия на окружающих.
«Новый этап развития ядерной медицины – это альфа-излучатели, которые раньше не применялись, - считает главный врач Челябинского областного клинического онкологического диспансера Андрей Важенин.
Вся радиология, вся ядерная медицина начиналась именно с радия. Первые препараты радия супруги Кюри подарили институту Герцена в 1903-05 году.
Новое лечение рака в Израиле уменьшило опухоли у 100% онкобольных, а у 78% пациентов они исчезли полностью. Израильская компания Alpha Tau Medical разработала новый метод лечения рака, который поражая опухоли, сохраняет здоровые окружающие ткани. Процедура называется Alpha DaRT (Diffusing alpha-emitters radiation therapy): радиотерапия с диффузными альфа-частицами, где впервые используется альфа-излучение для лечения солидных опухолей. Альфа-частицы обладают высокой способностью разрушать онкоклетки, не вызывая побочных эффектов в здоровых тканях.
В основе технологии Alpha DaRT лежит радиоактивный распад изотопа радия-224 для распространения альфа-частиц по всей опухоли. Это делает радиотерапию с диффузными альфа-излучателями мощным средством от рака с минимальными побочными эффектами. Клинические исследования показали многообещающий терапевтический результат и очень высокий уровень безопасности для пациентов. В брахитерапии диффузионных альфа-излучателей (DaRT) используются радиоактивные семена, которые постоянно высвобождают кратковременные альфа-излучающие частицы радия-224. Семена (длиной 10 мм и диаметром 0,7 мм) имплантируются в опухоль.
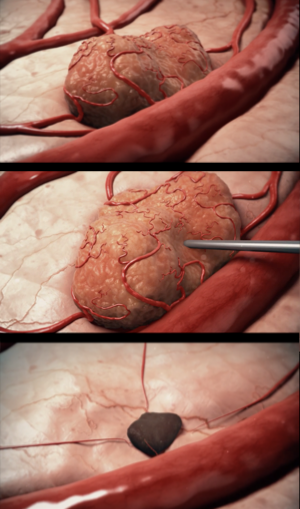
По мере распада радия-224, опухоль подвергается воздействию альфа-частиц. Благодаря диффузии и конвекции альфа-частицы рассеиваются до терапевтически значимого диапазона в несколько миллиметров, доставляя высокую дозу радиации внутрь опухоли. Альфа-излучение обладает высокой относительной биологической эффективностью, что позволяет использовать более низкую дозу облучения, чтобы вызвать повреждение онкоклетки. Рассеивающие излучатели создают кластер альфа-частиц высокой энергии, которые разрушают опухолевую ткань в радиусе 3 мм и не влияют на здоровые окружающие ткани.
Первое испытание брахитерапии Alpha DaRT на людях провел профессор онкорадиолог Аарон Поповицер: 22 пациента лечили в Медицинском центре Рабина в Израиле и шесть пациентов в Институте исследования опухолей в Италии. У всех пациентов была плоскоклеточная карцинома кожи и карциномы головы и шеи, у 39% были первичные опухоли, а у 61% рецидивные опухоли, размером не более 5 см.
Группа пациентов была пожилой (средний возраст 81 год) и представляла крайне неблагоприятную прогностическую группу риска. Многие не были кандидатами на операцию из-за повышенного риска заболеваемости и осложнений. Все пациенты с рецидивирующим онкозаболеванием раньше проходили лучевую терапию, хирургическое удаление опухолей или и то и другое.
Перед процедурой Alpha DaRT, которая проводилась в амбулаторных условиях под местной анестезией, пациенты проходили компьютерную томографию, чтобы определить объем опухоли и спланировать необходимое количество радиоактивного материала. Семена Alpha DaRT помещали с интервалами в 5 мм, выходя на 5 мм за край опухоли для достижения адекватного дозиметрического охвата, и на расстоянии не менее 10 мм от основных кровеносных сосудов. После процедуры делалось КТ, чтобы подтвердить, что положение семян соответствовало плану лечения.
В каждую опухоль было введено от трех до 169 семян, в среднем 28 семян. Лечение длилось в среднем 16 дней. Пациенты амбулаторно наблюдались в течение 45 дней, во время которых делались разные анализы, включая измерения радиоактивности в месте опухоли, в разных местах тела, а также в образцах крови и мочи. Результаты показали, что уровни излучения в легких, почках и костном мозге находились в пределах максимально допустимых доз и что в образцах крови и мочи через 30 дней после лечения не было обнаружено никакой измеримой радиоактивности.
Уменьшение опухоли произошло уже в течение 14 дней после завершения лечения. Пятнадцать из 16 пациентов, которые раньше не проходили лучевую терапию, имели полный ответ, а семь из 12 пациентов, которые раньше проходили стандартную радиотерапию, также имели полный ответ. В процессе Alpha DaRT терапии онкобольные испытывали только слабую и умеренную токсичность. У тех, где семена были вставлены рядом (менее 5 мм) с костью и зубами — ни у одного остеорадионекроз не развился.
Высокая эффективность лечения рака в Израиле, достигнутая с помощью радиотерапии Alpha DaRT одинакова при рецидивах также, как и при первичных опухолях. Эти результаты связаны с улучшенными радиобиологическими характеристиками альфа-частиц, которые глубже проникают в твердые опухоли. В настоящее время компания Alpha Tau Medical проводит и инициирует клинические испытания в Канаде, Франции, Израиле, Японии и России на предмет лечения рака молочной железы, опухолей головы и шеи и рака кожи. Технология Alpha DaRT была изобретена профессорами Тель-Авивского университета Ицхаком Келсоном и Йоной Кейсари. Компания Alpha Tau Medical была основана в 2016 году и сейчас быстро растет. В 2016 году в ней работало 10 человек, а сейчас — более 40.
Есть много видов лечения рака с различными уровнями эффективности. Тем не менее, все существующие методы лечения имеют существенные риски для здоровья пациента. Брахитерапия Alpha DaRT обеспечивает высокоэффективное и конформное радиационное лечение солидных злокачественных опухолей. Имплантируемые в опухоль, семена Alpha DaRT высвобождают высокоэнергетические дозы излучения в диапазоне нескольких миллиметров, обеспечивая лечение рака без поражения окружающих здоровых тканей и системных побочных эффектов.
Многообещающие предварительные клинические результаты не показали системных побочных эффектов и даже минимального повреждения здоровых тканей. Клинические исследования показали, что брахитерапия Alpha DaRT эффективна и безопасна при различных показаниях, включая опухоли, которые считаются устойчивыми к стандартной лучевой терапии. Размер семян Alpha DaRT позволяет лечить метастазы и небольшие опухоли.
Брахитерапия Alpha DaRT эффективна независимо от уровня кислорода в опухоли и стадии клеточного цикла. Процедура может применяться к гипоксическим опухолям, которые проявляют большую устойчивость к гамма-излучению. Благодаря короткому периоду полураспада Radium-224 (3,7 дня) Alpha DaRT достигает быстрых клинических результатов в течение нескольких дней, при этом разрушение опухоли альфа-частицами стимулирует противоопухолевый иммунитет, который отвечает за устранение отдаленных метастазов.
Радиотерапия Alpha DaRT выполняется под местной анестезией за один короткий сеанс и ее можно комбинировать с другими методами лечения, такими как химиотерапия и иммунотерапия. Уровень воздействия облучения во время и после лечения незначителен, что обеспечивает высокую безопасность как для пациента, так и для врачей. Компания разработала ультра минимально инвазивные аппликаторы, которые могут быть использованы для различных типов опухолей в различных анатомических областях. Поскольку аппликаторы Alpha DaRT являются одноразовыми и лечение не требует стационарного оборудования или специального экранирования, Alpha DaRT будет доступен для миллионов пациентов по всему миру.
Для составления предварительной программы диагностики и лечения в нашей клинике, а также оценки примерной стоимости, пожалуйста, заполните контактную форму и пришлите нам выписку истории болезни.

Свяжитесь с нами:
Tel Aviv CLINIC
Viber, WhatsApp, Telegram
Тел: +972544942762
Эл. почта:
[email protected]
Skype: medicaltourisrael
Адрес: ул. Вайцман 14,
Тель Авив, Израиль
Альфа-излучение (альфа-лучи) — один из видов ионизирующих излучений; представляет собой поток быстро движущихся, обладающих значительной энергией, положительно заряженных частиц (альфа-частиц). Основным источником альфа-излучения служат альфа-излучатели — радиоактивные изотопы, испускающие альфа-частицы в процессе распада. Особенностью альфа-излучений является его малая проникающая способность. Пробег альфа-частиц в веществе (то есть путь, на котором они производят ионизацию) оказывается очень коротким (сотые доли миллиметра в биологических средах, 2,5—8 см в воздухе). Однако вдоль короткого пути альфа-частицы создают большое число ионов, то есть обусловливают большую линейную плотность ионизации. Это обеспечивает выраженную относительную биологическую эффективность, в 10 раз большую, чем при воздействии рентгеновского и гамма-излучений. При внешнем облучении тела альфачастицы могут (при достаточно большой поглощенной дозе излучения) вызывать сильные, хотя и поверхностные (короткий пробег) ожоги; при попадании через рот долгоживущие альфа-излучатели разносятся по телу током крови и депонируются в органах ретикулоэндотелиальной системы и др., вызывая внутреннее облучение организма. Альфа-излучение применяют для лечения некоторых заболеваний.
7.Краткая характеристика бета-излучения. Бета-излучение (бета-лучи) — поток электронов или позитронов, испускаемых при бета-радиоактивном распаде атомов. Радиоактивные изотопы, распад которых сопровождается бета-излучением, называют бета-излучателями. Если такому распаду не сопутствует гамма-излучение, говорят о чистом бета-излучателе. К ним относятся радиоактивные изотопы фосфора (Р32), серы (S35), кальция (Са45) и др. При прохождении через вещество бета-излучение взаимодействует с электронами и ядрами его атомов, расходуя на это свою энергию и замедляя движение вплоть до полной остановки. Путь, проходимый бета-частицей в веществе, называется ее пробегом. Пробег бета-частиц выражают обычно в граммах на квадратный сантиметр (г/см2). В ткани организма бета-излучение проникает на глубину от десятых долей миллиметра до 1—2 см. Благодаря таким свойствам для защиты от бета-излучения достаточно иметь соответствующей толщины экран из органического стекла. На этих же свойствах основано применение бета-излучения в медицине для поверхностной, внутритканевой и внутриполостной лучевой терапии. Многие бета-излучатели (С14, Р32, S35, Са45 и др.) нашли применение в качестве метки для экспериментальных целей и радиоизотопной диагностики. Для измерения бета-излучения служат специальные бета-счетчики, бета-спектрометры, ионизационные камеры также дозиметры ионизирующих излучений, излучения ионизирующие, лучевая терапия, счетчики ядерных излучен.
8. Характеристика нейтронного излучения, понятие о наведенной радиоактивности.Нейтронное облучение – представляет собой нейтральное не несущие электрического заряда частицы. Нейтронное излучение непосредственно взаимодействует с ядрами атомов и вызывает ядерную реакцию. Оно обладает большой проникающей способность, которая в воздухе может составлять 1 000 м. Нейтроны глубоко проникают в организм человека.Отличительной особенностью нейтронного излучения является их способность превращать атомы стабильных элементов в их радиоактивные изотопы. Это называется наведенной радиоактивностью.Для защиты от нейтронного облучения используется специализированное убежище или укрытия, построенные из бетона и свинца.
9. Радиочувствительность живых организмов, органов, клеток, тканей.Понятие радиочувствительности – определяет собой способность организма проявить наблюдаемую реакцию при малых дозах ионизирующей радиации. Радиочувствительность — каждому биологическому виду свойственна своя мера чувствительности к действию ионизирующей радиации. Степень радиочувствительности сильно варьирует и в пределах одного вида — индивидуальная радиочувствительность, а для определенного индивидуума зависит также от возраста и пола.Понятие радиоустойчивости (радиорезистентности) – подразумевает способность организма выжить при облучении в определенных дозах или проявить ту или иную реакцию на облучение.
Радиочувствительность различных органов и тканей: В общем случае радиочувствительность органов зависит не только от радиочувствительности тканей, которые оставляют орган, но и от его функций. Желудочно-кишечный синдром, приводящий к гибели при облучении дозами 10–100 Гр, обусловлен в основном радиочувствительностью тонкого кишечника.Легкие являются наиболее чувствительным органом грудной клетки. Радиационные пневмониты (воспалительная реакция легкого на действие ионизирующего излучения) сопровождаются потерей эпителиальных клеток, которые выстилают дыхательные пути и легочные альвеолы, воспалением дыхательных путей, легочных альвеол и кровеносных сосудов, приводя к фиброзам. Эти эффекты могут вызывать легочную недостаточность и даже гибель в течение нескольких месяцев после облучения грудной клетки.В течение интенсивного роста кости и хрящи более радиочувствительны. После его окончания облучение приводит к омертвению участков кости — остеонекрозу — и возникновению спонтанных переломов в зоне облучения. Другим проявлением радиационного поражения является замедленное заживление переломов и даже образование ложных суставов.
Эмбрион и плод. Наиболее серьезные последствия облучения — гибель до или во время родов, задержка развития, аномалии многих тканей и органов тела, возникновение опухолей в первые годы жизни.
Органы зрения. Известны 2 вида поражения органов зрения – воспалительн6ые процессы в кнъюктевите и катаракта при дозе 6 Гр у человека.
Репродуктивные органы. При 2 Гр и более наступает полная стерилизация. Острые дозы порядка 4 Гр приводят к бесплодию.
Органы дыхания, ЦНС, эндокринные железы, органы выделения относятся к довольно устойчивы тканям. Исключение составляет щитовидная железа при облучении ее J131.
Очень высокая устойчивость костей, сухожилий, мышц. Абсолютно устойчива жировая ткань.
Радиочувствительность определяется, как правило, по отношению к острому облучению, притом однократному. Поэтому получается, что системы, состоящие из быстро обновляющихся клеток, более радиочувствительны.
10. Понятие радиационной безопасности. Задачи радиационной безопасности. Радиационная безопасность — это состояние защищенности настоящего и будущего поколения людей от вредного воздействия ионизирующего излучения.Радионуклиды — это изотопы, ядра которых способны самопроизвольно распадаться. Период полураспада радионуклида – это промежуток времени, в течение которого количество исходных атомных ядер уменьшается вдвое .Ионизирующее излучение – это излучение, которое создается при радиоактивном распаде ядерных превращений торможения заряженных частиц в веществе и образует при взаимодействии со средой ионы разных знаков. Сходство между разными излучениями состоит в том, что все они обладают высокой энергией и осуществляют свое действие через эффекты ионизации и последующее развитие химических реакций в биологических структурах клетки. Что может привести к ее гибели. Ионизирующее излучение не воспринимается органами чувств человека, мы не чувствуем его воздействия на наше тело.
11.Особенности аварий на атомных электростанциях (внешнее и внутреннее облучение).Аварийные ситуации: ДляАС с реакторами с водой под давлением наиболее тяжелыми могут стать аварии, связанные с разрывом трубопроводов контура теплоносителя первого контура, оголением активной зоны; разгерметизацией всех оболочек твэлов и оплавлением активной зоны. При проектировании АС должны быть предусмотрены противоаварийные меры безопасности. Система безопасности АС, обеспечивающая защиту населения при максимальной проектной аварии, должна быть спроектирована так, чтобы рассчитанная при наихудших погодных условиях на границе санитарно-защитной зоны и за ее пределами ожидаемая индивидуальная доза на щитовидную железу детей, обусловленная изотопами йода, не превосходила 30 бэр, а ожидаемая доза от внешнего излучения на все тело и любые другие органы (за исключением щитовидной железы) не превосходила 10 бэр.
Основными факторами радиационного воздействия на население при аварии на АС являются р*- и у-излучения продуктов деления. Вклад в дозу а-излучателей при поступлении радиоактивных веществ внутрь организма должен учитываться, если из-за особенностей реактора и аварии происходит выброс значительных количеств плутония. При поступлении во внешнюю среду только ИРГ (криптона и ксенона) радиационная опасность обусловлена одним внешним излучением при прохождении радиоактивного облака.
В случае выброса смеси продуктов деления наиболее вероятно, что основным компонентом, в первую очередь обуславливающим наибольшую опасность внутреннего облучения, явится 131I, особенно в первые несколько недель после аварии.
На первом этапе после аварии (от 0,5 ч до 1 сут) основной вклад в дозу облучения персонала и населения вносит поступление всех радиоизотопов йода с вдыхаемым воздухом, а доза внешнего облучения от облака будет примерно в 100 раз меньше дозы облучения щитовидной железы.
Радиационная обстановка на территории аварийной АС и степень радиационной опасности для населения обусловливаются количеством и радионуклидным составом выброшенных во внешнюю среду радиоактивных веществ, расстоянием от источника аварийного выброса до населенных пунктов, характером их застройки и плотностью заселения, метеорологическими, гидрологическими и почвенными характеристиками территории, метеорологическими условиями во время аварии, временем года, характером сельскохозяйственного использования территории, водоснабжения и питания населения.
В результате аварийного выброса в атмосферу возможны следующие виды радиационного воздействия на население (в порядке очередности): внешнее облучение при прохождении радиоактивного облака; внутреннее облучение при вдыхании радиоактивных продуктов деления; контактное облучение вследствие радиоактивного загрязнения кожных покровов и одежды; внешнее облучение, обусловленное радиоактивным загрязнением поверхности земли, зданий, сооружений и т. п.; внутреннее облучение в результате потребления загрязненных продуктов питания и воды.
В зависимости от складывающейся обстановки для защиты населения от радиационного воздействия могут быть приняты следующие меры: ограничение пребывания населения на открытой местности (укрытие в домах и убежищах); максимально возможная герметизация жилых и служебных помещений (плотное закрытие дверей, окон, дымоходов и вентиляционных отверстий) на время формирования радиоактивного загрязнения территории; применение лекарственных препаратов, препятствующих накоплению биологически опасных радионуклидов в организме (например, йодная профилактика—прием внутрь препаратов стабильногоиода); временная эвакуация населения; санитарная обработка лиц в случае загрязнения их одежды и кожных покровов радиоактивными веществами; исключение потребления пищевых продуктов местного производства.Ионизирующее излучение может двумя способами оказывать воздействие на человека. Первый способ — внешнее облучение от источника, расположенного вне организма, которое в основном зависит от радиационного фона местности на которой проживает человек или от других внешних факторов. Второй — внутреннее облучение, обусловленное поступлением внутрь организма радиоактивного вещества, главным образом с продуктами питания.
Продукты питания, не соответствующие радиационным нормам, имеют повышенное содержание радионуклидов, инкорпорируются с пищей и становятся источником излучения непосредственно внутри организма.
Большую опасность представляют продукты питания и воздух, содержащие изотопы плутония и америция, которые обладают высокой альфа активностью. Плутоний, выпавший в результате Чернобыльской катастрофы, является самым опасным канцерогенным веществом. Альфа излучение имеет высокую степень ионизации и, следовательно, большую поражающую способность для биологических тканей.
Попадание плутония, а также америция через дыхательные пути в организм человека вызывает онкологию легочных заболеваний. Однако следует учесть, что отношение общего количества плутония и его эквивалентов америция, кюрия к общему количеству плутония, попавшего в организм ингаляционным путем незначительно. Как установил Беннетт, при анализе ядерных испытаний в атмосфере, на территории США соотношение выпадения и ингаляции равно 2,4 млн. к 1, то есть подавляющее большинство альфа-содержащих радионуклидов от испытаний ядерного оружия ушли в землю не оказав влияния на человека. В выбросах Чернобыльского следа наблюдались также частицы ядерного топлива, так называемые горячие частицы размером около 0,1 микрона. Эти частицы также могут проникать ингаляционным путем в легкие и представлять серьезную опасность.
Внешнее облучение в основном создается гамма содержащими радионуклидами, а также рентгеновским излучением. Его поражающая способность зависит от:а) энергии излучения;б) продолжительности действия излучения;в) расстояния от источника излучения до объекта;г) защитных мероприятий.

Альфа DaRT, разработанный в одном из университетов Тель-Авива и коммерциализированный Альфа Tau Medical, даёт возможность использования первой терапии на основе альфа-лучей для твёрдых опухолей. Высокоэнергетические альфа-частицы попадают в опухоль и разрушают ДНК опухолевых клеток, вызывая немедленную гибель опухолевых клеток с незначительными побочными эффектами. Многочисленные доклинические и клинические испытания показали, что Альфа DaRT эффективен и безопасен для лечения твёрдых опухолей, обеспечивая высокий контроль над местным и метастатическим раком, и может быть использован в сочетании с химиотерапией и иммунотерапией.
Согласно Национальному институту рака (NCI) рак, который известен как рак головы и шеи, или плоскоклеточный рак головы и шеи, обычно начинается в плоскоклеточных клетках. Клетки выстилают влажные поверхности слизистой оболочки внутри головы и шеи (например, во рту, носу и горле).
Рак головы и шеи составляет около 4% всех случаев рака в Соединенных Штатах, более чем в два раза чаще встречается среди мужчин, чем среди женщин, и чаще диагностируется среди людей старше 50 лет.
Рак головы и шеи далее классифицируется по области головы или шеи, в которой они начинаются, включая полость рта, глотку (горло), гортань, околоносовые пазухи и носовую полость, а также слюнные железы. Они могут включать рак гортаноглотки, рак гортани, губ и полости рта, рак полости, метастатический плоскоклеточный рак шеи с оккультным первичным, рак носоглотки, рак ротоглотки, околоносовые пазухи и рак полости носа, рак слюнной железы.
По данным Alpha Tau Medical, лечение Alpha DaRT может проводиться под местной анестезией за один короткий сеанс и может сочетаться с химиотерапией и иммунотерапией для повышения эффективности. Alpha DaRT может даже вызвать противоопухолевый иммунитет для устранения отдаленных метастазов, сообщает NoCamels.
Зачем использовать альфа-излучение?
Существует много видов лечения рака с разным уровнем эффективности. Тем не менее все существующие методы лечения включают существенные риски для здоровья или повреждения пациента. Альфа-частицы оказывают летальное воздействие на раковые клетки, создавая сложные разрывы двухцепочечной ДНК, ведь всего нескольких попаданий частиц в ядро клетки достаточно для уничтожения раковой клетки. Тем не менее из-за их малого расстояния в ткани альфа-частицы редко используются для лечения рака.
Революционные открытия из Тель-Авивского университета преодолевают это ограничение диапазона и позволяют использовать альфа-излучение для эффективного лечения серьезных опухолей, в том числе устойчивых к стандартной лучевой терапии. Клинические и доклинические исследования показали, что лечение избавляет от окружающих здоровых тканей и исключает неблагоприятные системные эффекты.
Лечение
Альфа DaRT радиотерапия опухолей кожи проводится за один сеанс длительностью около 60 минут в комнате с нормальной процедурой под местной анестезией. Семена альфа-DaRT непосредственно вводятся в опухоль с помощью методов брахитерапии. При соприкосновении с опухолевой тканью радиоактивные атомы радия-224 выпускают дочерние атомы альфа-излучения в опухоль. Путём диффузии и конвекции эти атомы рассеиваются до терапевтически значимого диапазона в несколько миллиметров, испуская альфа-частицы и разрушая опухоль изнутри. Благодаря короткому периоду полураспада радия-224 (3,66 дня) высокая доза облучения происходит за короткий период.
Первоначальное исследование рассматривает поверхностные признаки – плоскоклеточный рак кожи и полости рта. В таких случаях семена временно (под местной анестезией) помещают в очаг опухоли с использованием минимально инвазивных аппликаторов и удаляют через 15 дней. Alpha DaRT может применяться в качестве односеансового лечения, которое достигает клинического результата в течение нескольких дней.
Восемь моделей опухолей мышей и десять человеческих опухолей, имплантированных безтимусным мышам, устанавливают терапевтический эффект DaRT. После лечения DaRT команда получила колоссальные результаты: альфа-излучение убило опухолевые клетки и активировало сильный противоопухолевый иммунитет, который уменьшал метастазы в легких.
В настоящее время компания проводит клинические испытания в Европе и в Израиле для лечения плоскоклеточного рака головы и шеи, кожи. Испытания показали весьма многообещающие результаты, и ведущие онкологические центры по всему миру объединяют усилия с протоколами для получения большего количества показаний к раку.
Первые результаты этого технико-экономического обоснования продемонстрировали полный локальный контроль около 80% и нулевую системную токсичность. Руководство отмечает, что у компании также есть протоколы для лечения рака поджелудочной железы и простаты. Для таких глубоких опухолей биосовместимые семена просто остаются на месте.
Недавно FDA и Институт исследований в области биомедицины (IRB) получили разрешение на проведение нового исследования в онкологическом центре Memorial Sloan Kettering, Нью-Йорк, и одобрение IRB в Instituti Fisioterapici Ospitalieri (IFO), Сан-Галликано, Рим.
Кроме того, простота лечения Альфа DaRT, основанного на одноразовых аппликаторах, является важным преимуществом для клиник. Клиники смогут применять лучевую терапию без необходимости капитального оборудования или инвестиций.
Разбираемся, что такое мирная радиация.

Кибернож — это линейный ускоритель, который позволяет облучать опухоль при минимальном повреждении окружающих тканей
О возможностях лучевой терапии расскажет член Российской ассоциации терапевтических радиационных онкологов, заведующая радиологическим отделением общего профиля, 2-м радиологическим, к.м.н., Татьяна Шарабура.
— Лучевая терапия — это один из методов лечения злокачественных опухолей. Радиоактивное излучение оказывает повреждающее действие на опухолевые клетки в большей степени, чем на здоровые клетки. После такого облучения нормальные клетки способны восстановиться, а у клеток опухоли потенциал к восстановлению значительно меньше. На таком различии радиочувствительности опухолевых и здоровых клеток и основан метод радиотерапии. Кроме того, сам процесс облучения построен таким образом, чтобы максимальная энергия излучения локализовалась в опухоли с минимальными потерями для окружающих тканей.
Лучевая терапия на кибер-ноже эффективна при одних локализациях и бесполезна при других
— Правда ли, что есть опухоли, до которых вообще невозможно добраться хирургическим путем по определению?
— Не всякую опухоль можно удалить хирургическим путем. Либо она может быть очень распространенной, либо сама операционная нагрузка окажется слишком тяжелой для пациента. Например, есть такие распространенные опухоли, которые убрать без каких-то серьезных повреждений технически невозможно, или операция неизбежно приведет к разного рода дефектам — функциональным или косметическим. В таких случаях лучевая терапия имеет преимущество. Кроме того, при многих опухолях ранних стадий эффективность лучевой терапии сопоставима с результатами операции, поэтому нередко предпочтение и специалисты, и сами пациенты отдают неинвазивным методам лечения.
— Какие бывают виды лучевой терапии? Что есть в челябинском онкоцентре?
— Есть разные способы доставки энергии (дозы радиации) к опухоли. Основу лучевой терапии составляет дистанционное наружное облучение, когда сам источник излучения расположен вне пациента. Большинство пациентов получает именно такой вариант лечения. Облучать можно опухоли любых локализаций, как поверхностных, так и глубоких. Можно использовать разные виды излучений — это может быть гамма-излучение кобальта-60, оно проводится на гамма-терапевтических установках.
Это может быть терапия фотонами высоких энергий на линейных ускорителях. Для облучения могут использоваться также нейтроны. Этот этап дистанционного лечения проводится в Центре нейтронной терапии в Снежинске. Что касается гамма-аппаратов и линейных ускорителей, то на этих аппаратах можно облучать опухоли любых локализаций. Для нейтронной терапии и для облучения на кибер-ноже существуют ограниченные показания.
— Кроме дистанционного, какие еще есть методы?
— Источник излучения может быть введен и в саму опухоль. Этот метод называется контактная лучевая терапия, или брахитерапия. Сначала в саму опухоль или в полость, где опухоль располагается, вводится интрастат. Это такая полая трубочка, в которую потом будет подаваться источник излучения. Их может быть сразу несколько. В зависимости от того, где располагается опухоль, интрастаты вводятся под контролем УЗИ, рентгенографии (опухоль крупных бронхов), под визуальным контролем (слизистые оболочки полости рта), либо эзофагоскопа (опухоль пищевода).После того, как интрастаты введены и зафиксированы, на аппарате Multisource в автоматическом режиме вводится сам источник излучения — радиоактивный изотоп кобальт-60. Во время сеанса облучения пациент изолирован и находится в специальном каньоне, что исключает облучение самого медицинского персонала.
Это дополнительная возможность подвести дозу прямо к самой опухоли с минимальным воздействием на окружающие ткани. Возможности дистанционного облучения все-таки ограничены толерантностью (устойчивостью) нормальных тканей к облучению, и увеличивать дозу до бесконечности нельзя. Для некоторых опухолей дозы от дистанционного облучения бывает недостаточной. Подвести дополнительную дозу можно с помощью вот такого контактного облучения, или брахитерапии. Это стандарт лечения опухолей женской половой сферы. Брахитерапия расширяет возможности лучевого лечения первичных и рецидивных опухолей слизистой полости рта, нижней губы, пищевода, крупных бронхов, мягкотканных сарком, рака молочной железы и других локализаций.
Возможности радиационного излучения с каждым годом увеличиваются, уверена Татьяна Шарабура
— Насколько этот метод рискованный? После такого облучения опасен пациент для окружающих или нет?
— Для окружающих людей такие пациенты совсем не опасны. Когда мы облучаем пациента дистанционно, то источника излучения в пациенте нет по определению. Если источники вводятся в опухоль или в полость, где есть опухоль, то после сеанса облучения они удаляются. Сам сеанс продолжается несколько минут. Брахитерапия выполняется за несколько сеансов лечения, в результате чего повреждения в опухоли накапливаются, и она постепенно разрушается. Как правило, брахитерапия дополняет дистанционное облучение.
Пациенты, прошедший лечение в радиологическом отделении, выходит из нашего центра, не представляя никакой радиационной угрозы для окружающих его людей и среды.
— Насколько можно говорить об эффективности лучевой терапии?
— Все зависит от стадии заболевания и локализации опухоли. При некоторых равных условиях результат сопоставим по эффективности с хирургическим лечением: удаление опухоли или ее полное разрушение. Но злокачественные новообразования тем и коварны, что никогда нельзя гарантировать стопроцентный результат. Есть среднестатистические показатели выживаемости, рисков рецидива — они разные для разных локализаций и стадий. Понятно, что если опухоль распространенная, стадия большая, то одним только облучением, скорей всего, нам не удастся ее излечить — в этих случаях облучение комбинируют с операцией. При ранних стадиях результаты лучевого лечения не хуже результатов операции. У нас наблюдаются пациенты, которые получили лечение лет десять назад и даже более с помощью только лучевого метода и чувствуют себя по сей день прекрасно.
Кроме того, технологии радиотерапии постоянно совершенствуются. Ее возможности расширяются за счет применения таких факторов, повышающих ее эффективность облучения, как химиотерапия, гипертермия (локальное повышение температуры в опухоли), возможности сочетания дистанционного и контактного методов и так далее. Таким образом расширяется список показаний к лучевому лечению, и все большему числу пациентов удается помочь. Даже у пациентов с генерализированным процессом (при наличии метастазов) применяя лучевой и оперативный метод можно добиться длительного эффекта, перевести онкологическое заболевание в хроническое и поддерживать жизнь больного многие годы. Современная радиотерапия позволяет за счет повышения точности подведения дозы уменьшать проявления реакций и осложнений, возможных в результате лечения. Для пациента это тоже очень важно.
Второй линейный ускоритель Elekta-Synergy имеет многолепестковый коллиматор и систему портальной визуализации
— А какие реакции возможны? Это потом проходит?
— В процессе облучения могут повреждаться и здоровые ткани, но они способны восстанавливаться. В процессе лечения могут наблюдаться разного рода лучевые реакции. Возникают болевые ощущения, возможно нарушение питания, расстройство стула, мочеиспускания и так далее. Но все эти реакции, во-первых, обратимы, во-вторых, мы помогаем справиться с ними, конечно же.
— Каковы перспективы развития лучевой терапии?
— Перспективы фантастические! Например, это касается дистанционного фотонного облучения на линейных ускорителях. Там можно повышать точность доставки дозы за счет различных технологий конформного облучения и провести его за более короткое время, что тоже важно — это технология лучевой терапии с модуляцией интенсивности (IMRT). Мы осваиваем это направление.
Протонная терапия — еще один очень интересный и перспективный метод лечения. Протоны оказывают больший биологический эффект, чем фотоны, которыми мы лечим всех пациентов. Кроме того, протонная терапия позволяет получить более конформное распределение дозы. Преимущества протонной терапии реализуются в первую очередь в детской онкологии и при облучении опухолей, расположенных близко к органам риска, где важно ограничить дозу. И у нас такой протонный ускоритель появится в ближайшее время.
Энергия радиоактивного излучения позволяет побеждать опухоли
— Боятся пациенты лучевой терапии или нет?
— Мы с этим не сталкиваемся! ( Улыбается.) Наши пациенты рвутся на лечение. Их больше пугает отказ от лечения. Радиотерапия, действительно, эффективный, перспективный, надежный метод лечения онкологических и ряда неонкологических заболеваний. За те 20 лет, что я работаю, заметно, как изменились возможности техники и как это повлияло на самочувствие пациентов во время и после облучения, на риск каких-то последствий и осложнений в последующем. Риск осложнений значительно снизился. А перспективы метода есть, мы их видим.
Читайте также:


