Рак щитовидной железы обзоры литературы
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Рассматривается вопрос о современных возможностях комплексной диагностики рака щитовидной железы. Несмотря на большое число проведенных исследований, остается дискутабельным вопрос о роли магнитно-резонансной томографии в диагностических алгоритмах при опухолях щитовидной железы
1. Абдулхалимова М.М., Митьков В.В., Бондаренко В.О. и др. Диагностика узловых образований щитовидной железы с использованием современных методов исследования//Ультразвуковая диагностика. 2002. № 2. С. 7-15
2. Алиев З.О. Дифференциальная диагностика узловых эутиреоидных образований щитовидной железы и выбор оперативного вмешательства: Автореф. дис. … канд. мед. наук. М., 2000. 26 с
6. Валдина Е.А. Заболевания щитовидной железы. СПб.: Питер. 2005. 368 с
8. Ветшев П.С., Чилингариди К.Е., Габаидзе Д.И. Аденомы щитовидной железы//Хирургия. 2005. № 7. С. 4-8
9. Дедов И.И., Трошина Е.А., Юшков П.В. и др. Диагностика заболеваний щитовидной железы. М.: Видар, 2001. 70 с
10. Демидчик Е.П., Цыб А.Ф., Лушников Е.Ф. Рак щитовидной железы у детей. М., 1996. 152 с
11. Денисова Л.Б., Воронцова С.В., Яурова Н.В. Возможности новых лучевых технологий (УЗИ, КТ, МРТ) в диагностике эндокринной патологии//Вестник рентгенологии и радиологии. 2006. № 1. C. 29-43
12. Евдокимова Е.Ю., Жестовская С.И. Ультразвуковая диагностика очаговых образований щитовидной железы с помощью тонкоигольной аспирационной биопсии под контролем ультразвука//Материалы 5-го съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. М., 2007. С. 170
13. Евтюхина А.Н. Комплексная лучевая диагностика очагового поражения щитовидной железы: Автореф. дис. … канд. мед. наук. СПб., 2009. 20 с
14. Заболотская Н.В. Применение ультразвукового исследования для оценки состояния поверхностных групп лимфатических узлов//Sonoace International. 1999. № 5. C. 42-45
15. Зубарев А.В. Ультразвуковая диагностика сегодня//Радиология-практика. 2005. № 4. C. 30-32
16. Зубарев А.Р., Федорова В.Н., Демидова А.К. и др. Ультразвуковая эластография как новая ступень в дифференциальной диагностике узловых образований щитовидной железы: обзор литературы и предварительные клинические данные//Медицинская визуализация. 2010. № 1. С. 11-16
17. Зубовский Г.А., Тарарухина О.Б. Микросцинтиграфия в диагностике опухолей щитовидной железы//Материалы конференции, посвящённой 80-летию РНЦРР МЗ РФ. 1924-2004. М., 2004. С. 92
18. Ионова Е.А., Тамбовцева Н.М. Диагностическая значимость ультразвукового исследования у больных раком щитовидной железы//Материалы 5-го съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. М., 2007. С. 173
19. Кеон В.К., Сеок К.К., Хан С.К. и др. Распространённость и риск малигнизации доброкачественных опухолей щитовидной железы, выявленных случайно при позитронно-эмиссионной томографии с 18F-фтордиоксиглюкозой//Клиническая эндокринология и метаболизм. 2003. Т. 88, № 9. С. 4100-4104
20. Колокасидис И., Ахадов Т.А., Снегирева Р.Я. Магнитнорезонансная томография в исследовании щитовидной железы//Вестник рентгенологии и радиологии. 2000. № 4. С. 43-46
21. Комбинированное и комплексное лечение больных со злокачественными опухолями: Руководство для врачей/Под ред. В.И. Чиссова. М.: Медицина, 1989. 560 с
22. Кондратьева Т.Т., Павловская А.И., Врублевская Е.А. Морфологическая диагностика узловых образований щитовидной железы//Практическая онкология. 2007. Т. 8, № 1. С. 9-16
23. Кононенко С.Н. Ранняя диагностика и дифференцированное лечение рака щитовидной железы//Хирургия. 2000. № 3. С. 38-41
26. Максимова Н.А., Козель Ю.Ю. Эхография в дифференциальной диагностике опухолей щитовидной железы у детей и подростков//Материалы 5-го съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. М., 2007. С. 177
27. Маркова Е.Н., Башилов В.П. Современные возможности ультразвукового исследования в предоперационной диагностике фолликулярных опухолей щитовидной железы//Материалы 5-го съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. М., 2007. С. 178
28. Маркова Н.В., Зубарев А.В. и др. Ультразвуковые методики исследования объемных образований щитовидной железы//Хирургия. Журнал им. Н.И. Пирогова. 2001. № 1. С. 67-71
30. Мерабишвили В.М. Онкологическая служба в Санкт-Петербурге и районах города в 2005 г. СПб., 2006. 123 с
31. Петрова Г. В., Грецова О. П., Харченко Н. В. Злокачественные новообразования щитовидной железы в России (1989-2005 гг.)//Матер. межрегион. конф. с междунар. участием. Екатеринбург, 2007. С. 224-225
32. Радионуклидная диагностика для практических врачей/Под ред. Ю.Б. Лишманова, В.И. Чернова. Томск: СТТ, 2004. 394 с
33. Романко С.И., Паршин В.С., Желонкина Н.В. и др. Возможности эхографии с применением ангиографических технологий в диагностике рецидивов рака щитовидной железы у послеоперационных больных//Материалы 5-го съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. М., 2007. С. 183
34. Румянцев П.О., Ильин А.А., Румянцева У.В., Саенко В.А. Рак щитовидной железы. М.: ГЭОТАР-Медиа, 2009. 448 с
38. Семиков В.И. Лечебно-диагностическая стратегия при узловых образованиях щитовидной железы: Автореф. дис. … д-ра мед. наук. М., 2004. 48 с
39. Сенча А.Н., Могутов М.С., Беляев Д.В., Сергеева Е.Д. Ультразвуковая эластография в диагностике рака шитовидной железы//Ультразвуковая и функциональная диагностика. 2010. № 3. С. 8-17
40. Сенча А.Н., Буйлов В.М., Бахтин А.Л. и др. Место ультразвукового исследования в комплексной лучевой диагностике рака щитовидной железы//Материалы 5-го съезда Российской ассоциации специалистов ультразвуковой диагностики в медицине. М., 2007. С. 184
41. Серов А.С., Попова Н.А., Жогова Л.Н. Значение тонкоигольной аспирационной пункционной биопсии под контролем УЗИвдиагностике очаговых образований щитовидной железы//Материалы XXI межрегион. научно-практ. конф. Липецк, 2008. С. 158-160
42. Сперанская А.А., Черемисин В.М. Компьютернотомографическая диагностика новообразований глотки, челюстнолицевой области и гортани. СПб.: Элби, 2006. 118 с
43. Тимофеева Л.А., Алешина Т.Н., Быкова А.В. Применение радионуклидной сцинтиграфии в дифференциальной диагностике опухолевых образований щитовидной железы//Вестник Чувашского университета. 2012. № 3. С. 538-541
44. Тимофеева Л.А., Диомидова В.Н., Воропаева Л.А. и др. Сравнение диагностической ценности лучевых методов визуализации при узловых образованиях щитовидной железы//Медицинскийальманах. 2012. № 4. С. 120-123
45. Трофимова Е.Ю. Диагностическая пункция под контролем ультразвукового исследования//Визуализация в клинике. 1998. № 13. C. 46-49
46. Фролова И. Г., Чойнзонов Е. Л., Боберь Е. Е. и др. Диагностика рака щитовидной железы с применением высокопольной магнитнорезонансной томографии//Сибирский онкологический журнал. 2013. № 4 (58). С. 31-35
47. Харченко В.П., Котляров П.М., Могутов М.С. и др. Ультразвуковая диагностика заболеваний щитовидной железы. М.: Видар, 2007. 227 с
48. Шойхет Я.Н., Баженова Е.А., Баженов А.А. Диагностика микрокарцином щитовидной железы//Проблемы клинической медицины. 2005. № 2. C. 126-132
49. bboud B., Allam S., Chacra L.A. et.al. Use of fine-needle aspiration cytology and frozen section in the management of nodular goiters//Head Neck. 2003. Vol. 25 (1). P. 32-36
50. Bakanidze L., Mardaleishvili K. Diagnostic and tactic mistakes in thyroid cancer//Ann. Biomed. Res. Educ. 2002. Vol. 2 (2). P. 42-44
51. Bard R.L. Dynamic Contrast Enhanced MRI Atlas of Prostate Cancer//Berlin-Heidelberg: Springer-Verlag, 2009
52. Barth M.M., Smith M.P., Pedrosa I. Body MR Imaging at 3T: Understanding the opportunities and challengers//Radiographics. 2007. Vol. 27 (5). P.1445-1461
53. Chen F., Tatsumi A. Metastatic thyroid cancer manifesting as a mediastinal mass in a man with an aberrant right subclavian artery//Jap. J. Thorac. Cardiov. Surg. 2001. Vol. 49 (7). P. 470-472
54. Chin B., Patel P., Cohade C. et.al. Recombinant human thyrotropin stimulation оf fluoro-D-glucose Positron emission tomography uptake in well-differentiated thyroid carcinoma//J. Clin. Endocrinol. Metab. 2004. Vol. 89 (1). P. 91-95
55. Cooper D.S., Doberty G.M., Haugen B.R. et al. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer. The American Thyroid Association Guidelines Taskforce//Thyroid. 2006. Vol.16 (2) P. 1-34
56. Consorti F., Benvenuti C., Boncompagni A. et al. A. Related Articles, Links Clinical significance of thyroid nodule calcification//J. Chir. 2003. Vol. 24 (3). Р. 78-81
57. Erdem S., Bashekim С., Kizilkaya E. et. al. Clinical application of Tc-99m tetrofosmin scintigraphy in patients with cold thyroid nodules. Comparison with color Doppler sonography//Clin. Nucl. Med. 1997. Vol. 22 (2). P. 76-79
58. Frilling A., Tecklenborg K., Gorges R., et. al. Preoperative diagnostic value of [(18)F] fluorodeoxyglucose positron emission tomography in patients with radioiodine-negative recurrent well-differentiated thyroid carcinoma//Ann. Surg. 2001. Vol. 234. P. 804-811
59. Gong Y., Krishnamurthy S. Fine-needle aspiration of an unusual case of poorly Differentiated insular carcinoma of the thyroid//Diagn. Cytopathol. 2005. Vol. 32 (2). P. 103-107
60. Gorges R., Eising E.G., Fotescu D. et.al. Diagnostic value of high resolution B-mode and power-mode sonography in the follow-up of thyroid cancer//Eur. J. Ultrasound. 2003. Vol.16 (3). P. 191-206
61. Held P., Zilch H.G., Baumgartl W., Maccio A. Diagnosis of thyroid diseases using imaging procedures with reference to nuclear magnetic resonance tomography//Acta Med. Austriaca. 1986. Vol. 13 (3). P. 77-78
62. Holm Н.Н., Skjoldbye В. Interventional ultrasound//Ultrasound Med. Biol. 1996. Vol. 22 (7). P. 773-789
63. Hung M., Wu H., Kao C. et. al. P18-fluorodeoxyglucose positron emission Tomography in detecting metastatic papillary thyroid carcinoma with elevated human serum thyroglobulin levels but negative I-131 whole body scan//Endocr. Pract. 2003. Vol. 29 (2). P. 169-175
64. Knittel A., Alexander С., Кirsch C.M. Compression of FDG-PET Tc-99m-tetrofosmin and iodine-131 in the detection of thyroid cancer metastases of recitivity of local carcinoma//Eur. J. Nucl. Med. Mol. Imag. 2002. Vol.29 (1). Р. 260-265
65. Krausz Y. Nuclear endocrinology as a monitoring tool//Semin. Nucl. Med. 2001. Vol. 31 (3). P. 238-250
66. Kwekkenboom D. J., Krenning E.P. Research of a thyroid gland in nuclear medicine//Thyroid international. 2002. Vol. 4. P. 34
67. Messina G., Viceconti N., Trim B. Echography and color Doppler in the diagnosis of thyroid carcinoma//Ann. Ital. Med. Int. 1996. Vol. 11 (4). P. 263-267
68. Nanni C., Rubello D., Fanti S. et al. Role of 18-FDG-PET/CT imaging in thyroid cancer//Biomed. Pharmacother. 2006. Vol. 60 (8). P. 409-413
69. Okour K.J., Khalil I. Diseases of a thyroid gland. Comparison of ultrasonic of other methods//Sonoace International. 1999. Vol. 5. P. 51-59
70. Shetty S.K., Maher M.M., Hahn P.F. et al. Significance of incidental thyroid lesions detected on CT: correlation among CT, sonography, and pathology//AJR. 2006. Vol. 187 (5). P. 1349-1356
71. Takashima S., Fukuda H., Nomura N. et. al. Thyroid nodules: reevaluation with ultrasound//J. Clin. Ultrasound. 1995. Vol. 23 (3). P. 179-184
72. Talbot J.N., Montravers F., Younsi N. et al. PET in thyroid cancers//Presse Med. 2006. Vol. 35 (9). P. 1377-1385
Боберь Е.Е., Фролова И.Г., Чойнзонов Е.Л., Величко С.А., Быстрова Н.Ю., Мухамедов М.Р. СОВРЕМЕНЫЕ ВОЗМОЖНОСТИ ДИАГНОСТИКИ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ (ОБЗОР ЛИТЕРАТУРЫ). Сибирский онкологический журнал. 2013;(5):59-65.
Bober E.E., Frolova I.G., Choinzonov E.L., Velichko S.A., Bystrova N.Yu., Mukhamedov M.R. Current capabilities of thyroid cancer diagnosis (literature review). Siberian journal of oncology. 2013;(5):59-65. (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
- 2587
- 1,8
- 1
- 3
![]()
Аполлинария Боголюбова![]()
Андрей Панов



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Несомненно, XXI век — время развития научно-технического прогресса. Вместе с совершенствованием технологий приходит и их доступность в повсеместном использовании. Медицина не является исключением. Благодаря развитию технологий диагностики и лечения самых разных заболеваний мы стали спасать тех пациентов, которые когда-то входили в число неизлечимых. Однако не на все сферы медицины прогресс повлиял так положительно. Поэтому сегодня мы бы хотели познакомить вас с такими животрепещущими вопросами медицины, как гипердиагностика и гиперлечение. Сейчас мы остановимся лишь на одной, но весьма значимой стороне данной проблемы — гипердиагностика узлов щитовидной железы, а также гиперлечение этих узлов и рака щитовидной железы.
Что мы знаем сегодня про узлы щитовидной железы?
Однако то, что эта проблема была озвучена совсем недавно, не значит, что о ней больше не надо писать. Мы не хотим загружать вас медицинской терминологией, вновь писать о TI-RADS и разбирать по кусочкам, что может написать функциональный диагност в заключении. Мы обращаемся к вам в качестве потенциальных пациентов и хотим донести мысль, что не всегда узел в щитовидной железе опасен, а рак априори смертелен.
База, с которой нам нужно познакомиться: щитовидная железа
Немножко о щитовидной железе (ЩЖ). Это орган эндокринной системы человека, который располагается на передней поверхности шеи в области гортани, прямо перед щитовидным хрящом. Состоит железа из левой и правой долей и перешейка. ЩЖ богато кровоснабжается разными артериями, а иннервируется гортанными нервами.
Главной функцией щитовидной железы (лат. glandula thyroidea) является синтез тиреоидных гормонов, необходимых нашему организму. Под тиреоидными гормонами мы подразумеваем два соединения: тироксин (Т4) и трийодтиронин (Т3). Основной функцией Т4 и Т3 является увеличение потребления клетками кислорода. Иначе говоря, эти гормоны стимулируют все энергетические процессы в клетке и обмен веществ, причем их влияние распространяется на все клетки организма.
Также клетки ЩЖ производят кальцитонин, ответственный за обмен кальция в организме.
Прямо за щитовидной железой располагаются четыре небольшие паращитовидные железы. Последние производят паратиреоидный гормон, который также отвечает за поддержание уровня кальция в организме, причем в большей степени, чем кальцитонин.
Откуда берется столько случаев рака щитовидки?
Рак щитовидной железы (РЩЖ) — наиболее распространенное злокачественное новообразование эндокринной системы [2]. Все чаще мы слышим, что заболеваемость РЩЖ неуклонно растет. И звучит это ужасающе, однако так ли всё просто на самом деле? Возможно, вы будете шокированы, какая правда скрывается за этими, на первый взгляд, однозначными научными фактами. И прежде, чем мы разберемся с истинной причиной роста заболеваемости РЩЖ, необходимо ознакомиться с тем, какие виды рака щитовидки существуют.
Итак, начнем. Сейчас нам понадобится привести немного численных данных, но не пугайтесь их, всё крайне просто. В научном сообществе выделяют пять типов РЩЖ:
- Папиллярный (80–85% случаев).
- Фолликулярный (10–15% случаев).
- Медуллярный (5% случаев).
- Низкодифференцированный (1% случаев).
- Недифференцированный (0,1–0,2% случаев).
Наиболее благоприятными принято считать два первых типа РЩЖ. И как мы можем заметить, они встречаются наиболее часто. Их также называют высокодифференцированными типами рака. Медуллярный, низкодифференцированный и недифференцированный типы считаются агрессивными формами РЩЖ. В нашей статье мы сделаем акцент лишь на первых двух типах РЩЖ, так как они являются наиболее распространенными.
Что касается рака — если клетки, из которых состоит опухоль, являются высокодифференцированными, в большинстве случаев врачи считают исход благоприятным. Однако если опухоль состоит из низкодифференцированных клеток, то с большой вероятностью она склонна к агрессивному течению. Как уже было сказано, наиболее часто выявляемые РЩЖ являются высокодифференцированными.
Папиллярный РЩЖ — наиболее распространенная форма: 80–85%. И с самым хорошим прогнозом. Пятилетняя выживаемость пациентов с РЩЖ — 98,1% [2]. Что это значит для пациента? Что наиболее часто выявляемые случаи РЩЖ имеют благоприятный исход!
Рак, ушедший в себя
Подбираемся к корню проблемы: статистика и диагностика
Вернемся к распространенности РЩЖ. Теперь мы готовы понять, что возросшее число случаев данной патологии не является поводом для беспокойства.
В 1975 году заболеваемость РЩЖ составляла 4,9 на 100 000 человек и оставалась относительно стабильной до начала 1990-х годов [6]. За последние 25 лет заболеваемость РЩЖ выросла более чем в 3 раза, то есть на 300% (рис. 1) [7], [8], причем в большинстве случаев за счет высокодифференцированного папиллярного РЩЖ. При этом очень важно понимать, что, несмотря на такой значительный рост, смертность от РЩЖ остается стабильной, примерно 0,5 случаев на 100 000 человек [6].
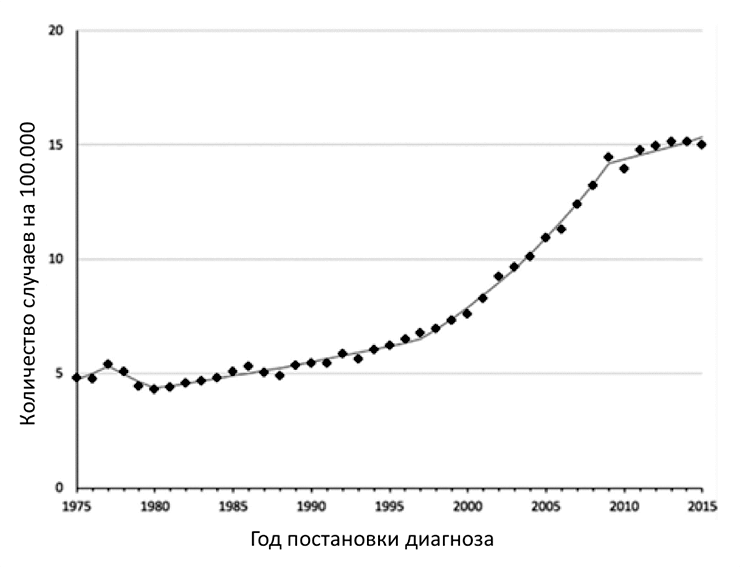
Рисунок 1. Данные заболеваемости раком щитовидной железы в период с 1975 по 2015 годы
Чувствуете, что тут что-то не так? Нет связи между возросшим числом случаев РЩЖ и смертностью от этой патологии! Среди врачей и ученых до сих пор продолжаются дебаты, почему так происходит. Сейчас выделяют несколько теорий. Наиболее вероятная — широкое распространение методов ультразвуковой диагностики (УЗИ). Пусть корни УЗИ уходят к Леонардо да Винчи и XV веку, широкое медицинское распространение данный метод получил с 50-х годов XX века [9], [10]. Сегодня УЗИ является наиболее простым, дешевым, неинвазивным и информативным методом выявления опухолевых образований щитовидной железы. Поэтому, как вы можете догадаться, УЗИ стали делать почти всем, причем независимо от показаний.
Сейчас научное сообщество активно дискутирует на тему, связаны ли такие показатели с истинным увеличением заболеваемости РЩЖ, или же проблема в гипердиагностике тех небольших образований ЩЖ, которые не требуют никакого вмешательства со стороны человека [11], [12].
Для более полного понимания проблемы вернемся на чуть более ранний этап диагностики РЩЖ.
Что такое узлы и как их найти?
Узлы ЩЖ — это радиологически различимые объемные образования в ЩЖ, которые могут быть доброкачественными и злокачественными. Узлы можно найти в 50% случаев всех проводимых УЗИ ЩЖ. При этом только 5% выявляемых образований будут злокачественными [13], [14].
Весомый вклад УЗИ в возросшее количество диагностированных узлов и РЩЖ можно показать на примере одного нашумевшего исследования в Южной Корее [3], [15], [16]. В 1999 году там была утверждена национальная программа, направленная на скрининг злокачественных заболеваний. Под программу попала и щитовидная железы. В результате повсеместного внедрения УЗИ щитовидки частота выявления рака выросла в 15 (!) раз с 1993 по 2011 год. И это мы еще не говорим просто об узлах, которые также могут быть психологической проблемой пациента. Большинство выявляемых случаев — папиллярный РЩЖ. Как вы помните, этот вид рака имеет весьма благоприятный исход. Однако простому населению идея жить с раком настолько чужда и неприятна, что было проведено огромное число полного удаления щитовидных желез, причем часто без видимой на то необходимости! А такая операция имеет серьезные последствия, о которых мы расскажем чуть ниже.
Врачи, осознав свою ошибку, убрали УЗИ щитовидки из списка обязательных скрининговых тестов. И результат не заставил себя ждать. В последней на эту тему публикации 2015 года сказано, что на 30% снизилась заболеваемость РЩЖ, а число операций на щитовидной железе снижалось на 35% ежегодно. Вывод напрашивается сам собой: в основе увеличения числа диагностированных случаев узлов щитовидки (в том числе и РЩЖ) является ставшее таким доступным УЗИ.
Думаем, следует также сказать, что образования ЩЖ выявляются не только при выполнении УЗИ, но и при использовании других методов лучевой диагностики (КТ, МРТ, ПЭТ), что стало возможным благодаря улучшению разрешающей способности оборудования. Следовательно, увеличилось чисто случайно выявляемых образований щитовидной железы (в том числе, рака) — инциденталóм (от англ. incidence — случайность) [17]. Инциденталомы клинически никак себя не проявляют и могут оставаться в организме бессимптомно всю жизнь. И многие из таких инциденталом обнаруживались лишь посмертно, случайно, и не являлись причиной кончины человека. Это позволяет говорить нам о существовании резервуара пациентов с узлами или раком щитовидной железы, который клинически является скрытым и никак себя не проявляет до его случайного обнаружения [18].
Приведенные данные обобщены на рисунке 2.

Рисунок 2. Что даст нам УЗИ щитовидки на самом деле?
рисунок авторов статьи
Напомним, что в нашей статье мы делаем акцент на наиболее распространенных типах РЩЖ (папиллярный, фолликулярный). Агрессивные формы РЩЖ (медуллярный, низкодифференцированный, недифференцированный и редко папиллярный) требуют дальнейшего более детального изучения
Самое главное: почему гипердиагностика и гиперлечение РЩЖ являются проблемой?
В связи с выявленным фактом, что в оперативном лечении таких РЩЖ, вполне возможно, нет необходимости (а ведь удаление ЩЖ сопровождается серьезными последствиями, о чем мы расскажем далее), с 2015 года в США уже принимаются меры по снижению частоты гипердиагностики и гиперлечения [24]. Например, уже настоятельно рекомендовано не проходить скрининг РЩЖ пациентам, у которых нет никаких симптомов, поскольку выявление агрессивных типов рака в этом случае крайне маловероятно.
Что врачи думают о данной проблеме?
Проблема гиперлечения РЩЖ существует не только среди пациентов, но и среди медицинского сообщества.
Конечно, выбор, удалять ли щитовидную железу или нет, стоит больше перед пациентом, нежели перед лечащим врачом. И пациент вполне может выбрать хирургическую тактику лечения. А врач должен определять, сколько ткани щитовидной железы в конкретном случае нужно убирать.
В качестве уменьшения гипердиагностики Американская тиреоидологическая ассоциация рекомендует воздержаться от скрининга и биопсии мелких образований щитовидной железы при отсутствии на то иных клинических симптомов [6].
Как вообще лечат рак щитовидной железы?
Давайте разберемся, какие существуют пути лечения РЩЖ [26].
- Полное удаление ЩЖ, тотальная тиреоидэктомия, вместе с окружающей клетчаткой, а иногда и рядом лежащими лимфатическими узлами.
- Терапия радиоактивным йодом I 131 после тотальной тиреиодэктомии. Не пугайтесь — это не опасно! Такой йод влияет только на клетки щитовидной железы и убивает их.
Почему мы, авторы, так не хотим, чтобы щитовидную железу удаляли без серьезных на то причин? Казалось бы, мы уберем орган, где сидит рак, и будем жить себе спокойно, только лишь принимая препараты гормонов щитовидной железы. Это ведь лучше, чем жить с раком. Или все-таки нет? Так вот, сама сложность вопроса заключается в операции.
Чем чревато полное удаление щитовидки (или, как говорят врачи, тотальная тиреоидэктомия)?
Существует два серьезных осложнения тотальной тиреоидэктомии [27].
- Стойкое снижение функции щитовидной железы (гипопаратиреоз). Наиболее серьезное и жизнеугрожающее осложнение. Итак, прямо за щитовидной железой располагаются четыре паращитовидные железы. Они производят паратиреоидный гормон, который отвечает за обмен кальция в нашем организме (а из него состоит бóльшая часть наших костей!). Паращитовидные железы совсем маленькие: диаметром 5 мм и весом 0,5 г. Их легко не заметить во время операции и удалить вместе с щитовидной железой. К тому же, даже если сохранить эти железы, высока вероятность повреждения питающих их кровеносных сосудов и нервов. А значит, железы просто перестанут работать, и в организм перестанет поступать паратиреиодный гормон. Это чревато возникновением тетанических приступов (подергиваний, которые могут переходит в судороги), нарушением питания волос и ногтей, кожи, эмали зубов, а также отложением кальция вне костей, например, между нервными клетками, что может проявляться в виде паркинсонизма или хореоатетоза — комбинации быстрых порывистых движений с медленными судорожными.
- Повреждение возвратного гортанного нерва и парез гортани. Щитовидная железа располагается прямо перед гортанью. Там же рядом находятся голосовые связки. Все эти структуры иннервируются гортанными нервами. И в случае повреждение некоторых из них — возвратных гортанных нервов — у пациента будет наблюдаться уменьшение активности гортанных мышц, что влечет за собой проблемы работы голосовых связок (в основном, осиплость голоса) и нарушения функций дыхания.
Какой существует выход?
Одним из наиболее перспективных выходов из ситуации является частичное удаление ткани ЩЖ, а именно поврежденной доли. В таком случае пациент, во-первых, избавляется от необходимости принимать пожизненную заместительную терапию гормонами щитовидной железы, а во-вторых, избегает тех серьезных последствий, которые несет за собой операция полного удаления ЩЖ. Однако стоит понимать, что такой вариант не касается опухолей большого размера, а также тех новообразований, которые потенциально могут быть агрессивными (это решает врач!).
Сейчас терапевты и хирурги, которые занимаются патологией щитовидной железы, разделились на два лагеря: те, кто считает, что лучше перестраховаться, и при выявлении даже самой маленькой опухоли удалить всю щитовидную железу, и те, кто считает, что лучшим выходом будет частичное удаление ткани железы, а именно поврежденной ее доли. К сожалению, этот вопрос до сих пор остается открытым. Врачи все еще не могут прийти к единому знаменателю в данном вопросе. Проблема в том, что достоверная объективная доказательная база, на которую врачи могли бы опираться в качестве актуального клинического руководства, вовсе отсутствует. Существуют лишь отдельные исследования, которые обозревают вопрос лишь с одной субъективной стороны [21]. Оптимальным решением данной проблемы, на наш взгляд, стало бы объединение всех существующих статей с объективным и всесторонним взглядом на этот вопрос. Однако подобное исследование лишь ожидает нас в будущем.
Финальный аккорд
С этими и другими мыслями вы можете ознакомится по оставленной нами ссылке [26].
Итак, дорогие наши читатели! Опираясь на всё, о чем мы рассказали выше, мы бы хотели, чтобы вы сделали три главных вывода:
Всем хорошего дня, и берегите свои щитовидки и нервы. :)
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Сергей Валерьевич Васильков.
249036 Обнинск, ул. Королева, 4.
1. O’Neill C. J., Oucharek J., Learoyd D., Sidhu S. B. Standard and emerging therapies for metastatic differentiated thyroid cancer. The Oncologist 2010;15:146–56. PMCID: PMC3227939.
2. Kilfoy B. A., Zheng T., Holford T. R. et al. International patterns and trends in thyroid cancer incidence, 1973–2002. Cancer Causes Control 2009;20:525–31. DOI: 10.1007/s10552-008-9260-4. PMCID: PMC2788231.
3. Altekruse S. F., Kosary C. L., Krapcho M. et al. SEER Cancer Statistics Review, 1975–2007. National Cancer Institute: Bethesda, MD, 2010.
4. Gilliland F. D., Hunt W. C., Morris D. M. et al. Prognostic factors for thyroid carcinoma: a population-based study of 15,698 cases from the Surveillance, Epidemiology and End Results (SEER) program 1973–1991. Cancer 1997;79:564–73. PMID: 9028369.
6. Altekruse S. F., Kosary C. L., Krapcho M. et al. SEER Cancer Statistics Review, 1975–2007. National Cancer Institute: Bethesda, MD, 2010.
7. Radio-iodine halts one type of cancer. Life Magazine 1949; October 31: 54–6.
8. Trunnell J. B. The treatment of human thyroid disease with radioactive iodine. Trans N Y Acad Sci 1949;11(6):195–201. PMID: 18150148.
9. Maloof F., Vickery A. L., Rapp B. An evaluation of various factors influencing the treatment of metastatic thyroid carcinoma with I 131. J Clin Endocrinol Metab 1956;16:1–27. DOI: 10.1210/jcem-16-1-1. PMID: 13278379.
10. Ronga G., Filesi M., Montesano T. et al. Lung metastases from differentiated thyroid carcinoma. A 40 years’ experience. Q J Nucl Med Mol Imaging 2004;48:12–9. PMID: 15194999.
11. Sherman S. I. Target therapy of thyroid cancer. Biochem Pharmacol 2010;80(5):592–601. DOI: 10.1016/j.bcp.2010.05.003. PMID: 20471374.
12. Chougent C., Brassard M., Leboulleux S. et al. Molecular targeted therapies for patients with refractory thyroid cancer. Clin Oncol (R Coll Radiol) 2010;22(6):448–55. DOI: 10.1016/j.clon.2010.04.008. PMID: 20554167.
13. Licitra L., Locati L. D., Greco A. et al. Multikinase inhibitors in thyroid cancer. Eur J Cancer. 2010;46(6):1012–8. DOI: 10.1016/j.ejca.2010.01.010. PMID: 20171085.
14. Kondo T., Ezzat S., Asa S. L. Pathogenetic mechanisms in thyroid follicular-cell neoplasia. Nat Rev Cancer 2006;6:292–306. DOI: 10.1038/nrc1836. PMID: 16557281.
15. Roman S., Lin R., Sosa J. A. Prognosis of medullary thyroid carcinoma: demographic, clinical, and pathologic predictors of survival in 1252 cases. Cancer 2006;107:2134–42. DOI: 10.1002/cncr.22244. PMID: 17019736.
16. Sherman S. I. Cytotoxic chemotherapy for differentiated thyroid carcinoma. Clin Oncol (R Coll Radiol) 2010;22:464–8. DOI: 10.1016/j.clon.2010.03.014. PMID: 20452757.
17. American Thyroid Association Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer. Cooper D. S., Doherty G. M., Haugen B. R. et al. Revised American Thyroid Association Guidelines management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009;9(11):1167–214. DOI: 10.1089/thy.2009.0110. PMID: 19860577.
18. Segev D. L., Umbricht C., Zeiger M. A. Mollecular pathogenesis of thyroid cancer. Surg Oncol 2003;12:69–90. PMID: 12946479.
19. Pierotti M. A., Santoro M., Jenkins R. B. et al. Characterization of an inversion on the long arm of chromosome 10 juxtaposing D10S170 and RET and creating the oncogenic sequence RET/PTC. Proc Natl Acad Sci USA 1992;89:1616–20. PMID: 1542652.
20. Salassidis K., Bruch J., Zizelsberger H. et al. Translocation t(10;14)(q11.2:q22.1) fusing the kinetin to the RET gene creates a novel rearranged from(PTC8) of the RET proto-oncogene in radiation-induced childhood papillary thyroid carcinoma. Cancer Res 2000;60:2786–9. PMID: 10850414.
21. Fagin J. A. Molecular genetics of human thyroid neoplasm. Annu Rev Med 1994;45:45–52. DOI: 10.1146/annurev. med.45.1.45. PMID: 8198395.
22. Santoro M., Carlomagno F., Hay I. D. et al. Ret oncogene activation in human thyroid neoplasms in restricted to the papillary cancer subtype. J Clin Invest 1992;89:1517–22. DOI: 10.1172/JCI115743. PMID: 1569189.
23. Ishizaka Y., Kobayashi S., Ushijima Т. et al. Direction of retTPC/PTC transcripts in thyroid adenomas and adenomatous goiter by an RT-PCR method. Oncogene 1991;6(9):1667–72. PMID: 1717926.
24. Jhiang S. M., Caruso D. R., Gilmore E. et al. Detection of the PTC/retTPC oncogene in human thyroid cancer. Oncogene 1992;7:1331–7. PMID: 1620547.
25. Mitsutake N., Knauf J. A., Mitsutake S. et al. Conditional BRAFV600E expression induced DNA synthesis, apoptosis, dedifferentiation, and chromosomal instability in thyroid PCCL3 cells. Cancer Res 2005;65:2465–73. DOI: 10.1158/0008-5472.CAN-04-3314. PMID: 15781663.
26. Salvatore G., DeFalco V., Salerno P. et al. BRAF is therapeutic target in aggressive thyroid carcinoma. Clin Cancer Res 2006;12:1623–9. DOI: 10.1158/1078–0432.CCR-05-2378. PMID: 16533790.
27. Espinosa A., Porchia L., Ringel M. Targeting BRAF in thyroid cancer. Br J Cancer 2007;96:16–20. DOI: 10.1038/sj.bjc.6603520. PMID: 17179987.
28. Xing M. BRAF mutation in thyroid cancer. Endocr Relat Cancer 2005;12:245–62. DOI: 10.1677/erc.1.0978. PMID: 15947100.
29. Polverino A., Coxon A., Starnes C. et al. AMG 706, an oral, multikinase inhibitor that selectively targets vascular endothelial growth factor, platelet-derived growth factor, and kit receptors, potently inhibits angiogenesis and induces regression in tumor xenografts. Cancer Res 2006;66(17):8715–21. DOI: 10.1158/0008-5472.CAN-05-4665. PMID: 16951187.
30. Coxon A., Bready J., Fiorino M. et al. Anti-tumor activity of AMG 706, an oral multi-kinase inhibitor, in human medullary thyroid carcinoma xenografts. Thyroid 2006;16:920.
31. Gruber J. J., Colevas A. D. Differentiated thyroid cancer: focus on emerging treatments for radioactive iodine-refractory patients. Oncologist 2015;20(2):113–26. DOI: 10.1634/theoncologist.2014-0313. PMCID: PMC4319630.
32. Rosen L. S., Kurzrock R., Mulay M. et al. Safety, pharmacokinetics, and efficacy of AMG 706, an oral multikinase inhibitor, in patients with advanced solid tumors. J Clin Oncol 2007;25:2369–76. DOI: 10.1200/JCO.2006.07.8170. PMID: 17557949.
33. Bass M. B., Davis M. T., Kivman L. et al. Placental growth factor as a marker of therapeutic response to treatment with motesanib in patients with progressive advanced thyroid cancer, advanced nonsquamous non-small cell lung cancer, and locally recurrent or advanced metastatic breast cancer. J Clin Oncol (Meeting Abstracts) 2010;28(Suppl):3037. DOI: 10.1210/jc.2010-0947. PMID: 20739388.
34. Shoup M., Stojadinovic A., Nissan A. et al. Prognostic indicators of outcomes in patients with distant metastases from differentiated thyroid carcinoma. J Am Coll Surg 2003;197(2):191–7. DOI: 10.1016/S1072-7515(03)00332-6. PMID: 12892796.
35. Sala E., Mologni L., Truffa S. et al. BRAF silencing by short hairpin RNA or chemical blockade by PLX4032 leads to different responses in melanoma and thyroid carcinoma cells. Mol Cancer Res 2008;6:751–9. DOI: 10.1158/1541-7786.MCR-07-2001. PMID: 18458053.
36. Flaherty K., Puzanov I., Sosman J. et al. Phase I study of PLX4032: proof of concept for V600E BRAF mutation as a therapeutic target in human cancer. J Clin Oncol (Meeting Abstracts) 2009;27(Suppl):9000.
37. Schwartz G. K., Robertson S., Shen A. A. Phase I study of XL281, a selective oral RAF kinase inhibitor, in patients with advanced solid tumors. J Clin Oncol (Meeting Abstracts) 2009;27(Suppl):3513. DOI: 10.1007/s10637-014-0191-5. PMID: 25476894.
38. Schlumberger M., Tahara M., Wirth L. J. et al. Lenvantinib versus Placebo in Radioiodine-Refractory Thyroid Cancer. N Engl J Med 2015:72(7):621–30. DOI: 10.1056/NEJMoa1406470. PMID: 25671254.
39. Cohen E. E., Rosen L. S., Vokes E. E. et al. Axitinib is an active treatment for all histologic subtypes of advanced thyroid cancer: results from a phase II study. J Clin Oncol 2008;26:4708–13. DOI: 10.1200/JCO.2007.15.9566. PMID: 18541897.
40. Bocci G., Man S., Green S. K. et al. Increased plasma vascular endothelial growth factor (VEGF) as a surrogate marker for optimal therapeutic dosing of VEGF receptor-2 monoclonal antibodies. Cancer Res 2004;64:6616–25. DOI: 10.1158/0008-5472.CAN-04-0401. PMID: 15374976.
41. Kumar R., Knick V.B., Rudolph S.K. et al. Pharmacokinetic-pharmacodynamic correlation from mouse to human with pazopanib, a multikinase angiogenesis inhibitor with potent antitumor and antiangiogenic activity. Mol Cancer Ther 2007;6:2012–21. DOI: 10.1158/1535-7163.MCT-07-0193. PMID: 17620431.
42. Bible K.C., Smallridge R.C., Maples W.J. et al. Phase II trial of pazopanib in progressive,metastatic, iodineinsensitive differentiated thyroid cancers. J Clin Oncol (Meeting Abstracts) 2009; 27(Suppl):3521.
43. Kim D. W., Jo Y. S., Jung H. S. et al. An orally administered multitarget tyrosine kinase inhibitor, SU11248, is a novel potent inhibitor of thyroid oncogenic RET/papillary thyroid cancer kinases. J Clin Endocrinol Metab 2006;91:4070–6. DOI: 10.1210/jc.2005-2845. PMID: 16849418.
44. Dawson S. J., Conus N. M., Toner G. C. et al. Sustained clinical responses to tyrosine kinase inhibitor sunitinib in thyroid carcinoma. Anticancer Drugs 2008;19:547–52.
46. Wedge S. R., Ogilvie D. J., Dukes M. et al. ZD6474 inhibits vascular endothelian growth factor signalling angiogenesis, and tumor growth following oral administration. Cancer Research 2002;62:4645–55. PMID: 12183421.
47. Nikiforova M. N., Kimura E. T., Gandhi M. et al. BRAF mutations in thyroid tumors are restricted to papillary carcinomas and anaplastic or poorly differentiated carcinomas arising from papillary carcinomas. J Clin Endocrinol Metab 2003;88:5399–404. DOI: 10.1210/jc.2003-030838. PMID: 14602780.
48. Leboulleux S., Bastholt L., Krause T. et al. Vandetanib in locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 2 trial. Lancet Oncol 2012;13:897–905. DOI: 10.1016/S1470-2045(12)70335–2. PMID: 22898678.
49. Garcia-Rostan G., Zhao H., Camp R. L. et al. Ras mutation are associated with aggressive tumor phenotypes and poor prognosis in thyroid cancer. J Clin Oncol 2003;21:3226–35. PubMed Abstract | Publisher Full Text. DOI: 10.1200/JCO.2003.10.130. PMID: 12947056.
50. Ricarte-Filho J. C., Ryder M., Chitale D. A. et al. Mutational profile of advanced primary and metastatic radioactive iodinerefractory thyroid cancers reveals distinct pathogenetic roles for BRAF, PIK3CA, and AKT1. Cancer Res 2009;69(11):4885–93. DOI: 10.1158/0008-5472.CAN-09-0727. PMID: 19487299.
51. Wilhelm S. M., Carter C., Tang L. Y. et al. BAY 43–9006 exhibits broad spectrum oral antitumor activity and targets the RAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis. Cancer Res 2004;64:7099–109. DOI: 10.1158/0008-5472.CAN-04-1443. PMID: 15466206.
52. Wells S. A., Nevins J. R. Evolving strategies for targeted cancer therapy past, present, and future. J Natl cancer Inst 2004;96:980–1. PMID: 15240773.
53. Plaza-Menacho I., Mologni L., Sala E. et al. Sorafenib functions to potently suppress RET tyrosine kinase activity by direct enzymatic inhibition and promoting RET lysosomal degradation independent of proteasomal targeting. J Biol Chem 2007;282:29230–40. DOI: 10.1074/jbc.M703461200. PMID: 17664273.
54. Salvatore G., De Falco V., Salerno P. et al. BRAF is a therapeutic target in aggressive thyroid carcinoma. Clin Cancer Res 2006;12:1623–9. DOI: 10.1158/1078-0432.CCR-05-2378. PMID: 16533790.
55. Carlomagno F., Guida T., Anaganti S. et al. Disease associated mutations at valine 804 in the RET receptor tyrosine kinase conferresistance to selective kinase inhibitors. Oncogene 2004;23:6056–63. DOI: 10.1038/sj.onc.1207810. PMID: 15184865.
56. Brose M. S., Troxel A. B., Harlacker K. Completion of a phase II study of sorafenib for advanced thyroid cancer [abstract].Eur J Cancer Suppl 2009;7:22.
57. Gupta-Abramson V., Troxel A. B., Nellore A: Phase II trial of sorafenib in advanced thyroid cancer. J Clin Oncol 2008;26:4714–9. DOI: 10.1200/JCO.2008.16.3279. PMID: 18541894.
58. Kloos R. T., Ringel M. D., Knopp M. V. et al. Phase II trial of sorafenib in metastatic thyroid cancer. J Clin Oncol 2009; 27:1675–84. DOI: 10.1200/JCO.2008.18.2717. PMCID: PMC2668972.
59. Ahmed M., Barbachano Y., Riddell A. M. Preliminary results of an open labelled phase 2 study evaluating the safety and efficacy of sorafenib in metastatic advanced thyroid cancer [abstract]. J Clin Oncol 2008;26:6060.
60. Румянцев П. О. Рефрактерность высокодифференцированного рака щитовидной железы к лечению радиоактивным йодом. Опухоли головы и шеи 2013;3:11–15. [Rumyantsev P. O. Refractory of well-differentiated thyroid cancer to the treatment with radioactive iodin. Opukholigolovy i shei = Head and Neck Tumors 2013;3:11–15. (In Russ.)]. DOI: 10.17650/2222-1468-2013-0-3-11-15.
61. Brose M., Nutting C. M., Sherman S. I. et al. Rationale and design of decision: a doublе-blind, randomized, placebo-controlled phase III trial evaluating the efficacy and safety of sorafenib in patients with locally advanced or metastatic radioactive iodine (RAI) – refractory, differentiated thyroid cancer. BMC Cancer 2011;11:349–70. DOI: 10.1186/1471-2407-11-349. PMID: 21834960.
62. Brose M. S., Nutting C. M., Jarzab B. et al. Sorafenib in locally advanced or metastatic patients with radioactive iodine-refractory differentiated thyroid cancer: The phase III DECISION trial. Presented at ASCO 2013. J Clin Oncol 2013;31:2(suppl): Abstract 4. DOI: 10.1016/S0140-6736(14)60421-9. PMID: 24768112.
63. Резолюция экспертного совета по вопросам таргетной терапии дифференцированного рака щитовидной железы, резистентного к терапии радио активным йодом. Опухоли головы и шеи 2014;3:10–11. [The resolution of the expert council for targeted therapy of radioiodine refractory differentiated thyroid cancer. Opukholigolovy i shei = Head and Neck Tumors 2014;3:10–11. (In Russ.)].

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:



