Рак с диффузией что это
Вопрос: Что такое диффузный рак желудка?
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Что собой представляет диффузная злокачественная опухоль желудка?
Диффузный рак желудка представляет собой одну из разновидностей опухоли. Диффузный тип рака характеризуется слабой связью между опухолевыми клетками, за счет чего они способны инфильтрировать все слои желудка. В результате невозможно обнаружить очаг опухоли, поскольку раковые клетки диффузно разбросаны по всей площади желудка, поражая орган целиком. Раковые клетки не образуют желез и не вырабатывают большое количество слизи.
Диффузный рак состоит из опухолевых переродившихся клеток, которые разбросаны среди соединительной ткани. Данные клетки располагаются по одной или формируют небольшие группы. Благодаря таким особенностям роста диффузный рак не имеет четкой границы.
Разделение рака желудка на диффузный и интестинальный типы было предложено и разработано финским ученым P. Lauren в 1953 году. С того момента данная классификация используется по сей день довольно широко. Диффузный тип рака по P. Lauren соответствует недифференцированным и низкодифференцированным (молодым) формам опухоли согласно другим классификациям. Диффузный рак обычно представлен вариантами недифференцированной карциномой и перстеневидно-клеточными типами.
Диффузный тип рака желудка связан с генетическими наследственными признаками. Это означает, что по наследству передается предрасположенность к раку желудка. Если данная предрасположенность реализуется и у человека формируется рак, то он будет именно диффузного типа, а не интестинального. Спорадически, без наследственной предрасположенности, диффузный рак формируется очень редко. Если у кого-либо из родственников был диффузный рак желудка, то риск заболевания увеличен в 6 раз.
В настоящее время диффузный тип рака составляет 20 – 25 % от всех случаев развития злокачественных новообразований желудка. При диффузном раке опухоль растет не в просвет желудка, а в его слои, внутрь. В результате раковые клетки находятся и в слизистой, и в подслизистой, и в мышечном слое. Кроме того, раковые клетки быстро распространяются по соединительнотканным прослойкам. В результате такого прорастания опухоли в слои органа, стенка желудка становится толще и плотнее. Стенка желудка обездвиживается и приобретает белесую окраску.
Рельеф слизистой желудка изменяется – поверхность становится неровной, складки имеют разную толщину, часто встречаются небольшие эрозии. Диффузный рак может поражать весь желудок целиком или только его часть. По мере увеличения опухоли желудок сморщивается, уменьшаясь в размере, и его объем существенно уменьшается.
Диффузный рак обладает более высоким уровнем злокачественности по сравнению с интестинальным типом. Относительно высокая степень злокачественности диффузного типа рака обусловлена тем, что онкоклетки слабо связаны между собой, а потому легко переносятся с током лимфы и межклеточной жидкости в различные отделы органа. Диффузный рак растет относительно медленно, а потому опухоль длительное время протекает совершенно бессимптомно. В такой ситуации рак чаще всего обнаруживается на поздних стадиях и имеет неблагоприятный прогноз по жизни и лечению.
При диффузном типе рака чаще всего имеются фоновые патологические процессы – неатрофические формы гастрита и гипертрофия слизистой желудка.
Наследственный диффузный рак желудка является наследственным заболеванием, которое значительно увеличивает вероятность развития одной из форм рака желудка, главной особенностью которой является отсутствие твердых опухолей. Эти раковые (злокачественные) клетки делятся под слизистой желудка, что приводит у увеличению толщины и жесткости стенки желудка. Инвазивная природа этого типа рака делает его весьма агрессивным, это говорит о том, что раковые клетки будут распространяться (метастазировать) в другие ткани, в первую очередь в печень и близлежащие кости.
Наследственный диффузный рак желудка. Причины
Рак желудка является четвертой наиболее распространенной формой рака во всем мире, затрагивая 900000 человек в год, а на наследственный диффузный рак желудка приходится менее 1 процента от всех случаев рака желудка.
Вполне вероятно, что от 30 до 40 процентов людей с этим типом рака имеют мутацию в гене CDH1 (16q22.1).
Ген CDH1 кодирует белок, называемый эпителиальным кадгерином (E-кадгерин). Этот белок находится внутри мембраны, которая окружает клетки эпителия, выстилающего поверхность и полости нашего тела. E-кадгерин помогает этим клеткам прилипать друг к другу (адгезия клеток), тем самым образуя организованные ткани. E-кадгерин также выполняет множество других функций, например, он выступает в качестве супрессора опухоли, а это означает, что он предотвращает чрезмерно быстрое и неконтролируемое деление клеток (отличительная черта злокачественных новообразований).
Люди с наследственным диффузным раком желудка рождаются с одной мутировавшей копией гена CDH1, а это, в сврю очередь, приводит к выработке аномально короткой, нефункциональной версии Е-кадгерина. Отсутствие активности Е-кадгерина ухудшает адгезию клеток, в результате чего злокачественные клетки не будут слипаться в опухоли. Во многих случаях это становится причиной вторжения злокачественных клеток в стенку желудка и их распространения в соседние ткани.
Мутации в гене CDH1 также приводят к 60-процентному шансу развития лобулярного рака молочной железы, слегка повышенному риску развития рака простаты и слегка повышенному риску развития колоректального рака. Однако от 60 до 70 процентов людей с наследственным диффузным раком желудка не имеют мутаций в гене CDH1. Механизм, вызывающий рак у этих лиц – неизвестен.
Наследственный диффузный рак желудка. Симптомы и признаки
Первые симптомы и признаки наследственного диффузного рака желудка появляются уже в конечной фазе заболевания: боль в животе, тошнота, рвота, затрудненное глотание (дисфагия), снижение аппетита и потеря веса. Если рак метастазирует в другие ткани, то это может привести к увеличению печени, пожелтению глаз и кожи (желтуха), ненормальному накоплению жидкости в брюшной полости (асцит), образованию твердых комков под кожей и спонтанным переломам костей.
Наследственный диффузный рак желудка, как правило, начинает развиваться в возрасте около тридцати лет и если он обнаруживается рано, то выживаемость будет высокой. Однако, поскольку этот тип рака скрывается под слизистой желудка, то он, как правило, диагностируется уже на широко инвазивной стадии. На этом этапе заболевания, выживаемость составляет примерно 20 процентов.
Некоторые люди с этим типом рака имеют повышенный риск развития других типов рака, таких как рак молочной железы у женщин, рак предстательной железы и колоректальный рак.
Наследственный диффузный рак желудка. Диагностика
Пациенты с подозрением на наследственный диффузный рак желудка должны проходить консультации и обследования у следующих специалистов: генетики, гастроэнтерологи, хирурги, патологоанатомы, онкологи, диетологи и другие специалисты из этой области. Верхняя эндоскопия с биопсией тканей желудка является лучшим методом скрининга рака желудка. К сожалению, на эндоскопии диффузный рак желудка обнаруживается сложно, а результаты анализа биопсии часто отрицательны, поэтому верхняя эндоскопия с биопсией должны проводиться на ежегодной основе. Как мы уже говорили, этот тип рака желудка почти невозможно обнаружить на ранней стадии, однако, в некоторых случаях, при очень сильном подозрении или после возможного подтверждения диагноза на лабораторных тестах, хирург может рекомендовать некоторые процедуры по предотвращению дальнейшего развития рака желудка. К таким методам можно отнести резекцию части желудка или полное удаление желудка. И несмотря на то, что эта процедура сложна и часто приводит к потере веса, диареям, дефициту витаминов и серьезным диетическим ограничениям, это, возможно, является единственным способ предотвращения развития рака желудка.
Наследственный диффузный рак желудка. Лечение
Основным методом лечения этого типа рака желудка является хирургическая резекция части или всего желудка. Это очень сложная операция и если она будет проводиться опытным хирургом, то смертность будет состовлять менее 1%. Тем не менее, после операции у всех людей развиваются послеоперационные, а также долгосрочные осложнения, включая быстрое кишечное опорожнение, демпинг-синдром, диареи, диетические изменения и потеря веса. Кроме того, после полной резекции желудка увеличивается риск мальабсорбции (мальабсорбция несет ответственность за увеличение риска развития остеопороза, остеомаляции и недоедания).
В свете этих возможных осложнений, лечение пациентов должно осуществляться многопрофильной группой, включающей хирурга, гастроэнтеролога и диетолога. Для лиц, которые не являются хорошими кандидатами на хирургию, химиотерапия или лучевая терапия могут улучшить симптомы и продлить жизнь, но, скорее всего, этими методами не удастся вылечить рак.
Наследственный диффузный рак желудка. Прогноз
Прогноз может сильно изменяться в зависимости от того, насколько далеко распространился рак (на момент постановки диагноза). Вероятность излечения также зависит от того, насколько раковые клетки вторглись в стенку желудка и лимфатические узлы. Если рак уже распространился за пределы желудка, то полное излечение будет уже невозможным. В этом случае основной целью лечения будет улучшение симптомов.
Кроме того, из-за большого количества редких заболеваний, информация по некоторым расстройствам и состояниям может быть изложена только в виде краткого введения. Для получения более подробной, конкретной и актуальной информации, пожалуйста, свяжитесь с вашим персональным врачом или с медицинским учреждением.

Злокачественные опухоли выглядят под микроскопом по-разному. В одних случаях они напоминают нормальную ткань, а в других сильно от неё отличаются. В зависимости от этого, патологоанатомы и врачи условно делят злокачественные новообразования на два типа:
- Высокодифференцированные опухоли сохраняют многие черты нормальных клеток и тканей. Они прорастают в соседние органы и метастазируют достаточно медленно.
- Низкодифференцированные опухоли содержат клетки и ткани, которые сильно отличаются от нормальных. Они ведут себя намного агрессивнее, быстрее распространяются по организму.
От степени дифференцировки рака зависит то, насколько быстро он способен распространяться по организму. А это, в свою очередь, напрямую влияет на прогноз для пациента. Кроме того, низкодифференцированные опухоли хуже реагируют на лучевую терапию и химиотерапию. Врач-онколог учитывает это, составляя программу лечения.

Какие бывают степени дифференцировки рака?
Показатель степени дифференцировки опухоли в онкологии принято обозначать латинской буквой G. Возможны пять вариантов:
- Gx — степень дифференцировки определить не удается.
- G1 — высокодифференцированные злокачественные новообразования.
- G2 — средняя степень дифференцировки.
- G3 — низкодифференцированные опухоли.
- G4 — недифференцированный рак. Опухолевые клетки утратили все внешние признаки и функции нормальных клеток. Они похожи друг на друга, как две капли воды, их единственными занятиями становятся рост и размножение.
Так выглядит общая схема, но для разных видов рака степень дифференцировки определяют по-разному. Например, во время осмотра под микроскопом опухолевой ткани из молочной железы учитывают наличие молочных канальцев, форму и размеры клеточных ядер, активность деления клеток. Каждый из трех признаков оценивают в баллах, затем подсчитывают их общее количество.
При раке простаты используют специальную систему Глисона. В ней предусмотрено 5 градаций, каждой из которых присвоено определенное количество баллов, в соответствии с нумерацией, от 1 до 5:
- В состав опухоли входят однородные железы, ядра клеток изменены в минимальной степени.
- В состав опухоли входят скопления желез, которые разделены перегородками из соединительной ткани, но расположены друг к другу ближе, чем в норме.
- В состав опухоли входят железы, имеющие разное строение и размеры, опухолевая ткань прорастает в перегородки из соединительной ткани и в соседние структуры.
- В состав опухоли входят клетки, которые сильно отличаются от нормальных. Опухоль прорастает в соседние ткани.
- Опухоль состоит из недифференцированных клеток.
Обычно рак простаты имеет неоднородное строение, поэтому врач должен выбрать из списка две градации, которые встречаются в большей части опухоли. Складывают баллы, по полученной цифре определяют степень дифференцировки.

Степень дифференцировки и стадия рака — это одно и то же?
Для описания злокачественной опухоли используют разные показатели. Деление в зависимости от степени дифференцировки — лишь одна из возможных классификаций.
Стадию рака определяют в зависимости от трех параметров, которые обозначают аббревиатурой TNM: насколько сильно опухоль проросла в соседние ткани, успела ли распространиться в лимфоузлы и дать метастазы.
Чем отличается лечение высокодифференцированного рака от низкодифференцированного?
Однозначно на этот вопрос ответить не получится, так как рак бывает очень разным. Для одних злокачественных опухолей (например, рак молочной железы, рак простаты) степень дифференцировки имеет особенно важное значение, в случаях с другими онкологическими заболеваниями данный показатель отходит на второй план.
В целом можно сказать, что низкодифференцированные опухоли более агрессивны и нуждаются в более агрессивном лечении.
Похожие темы научных работ по клинической медицине , автор научной работы — Берген Т. А., Трофименко И. А.
Методика МР-диффузии и ее применение в исследовании опухолей малого таза у женщин
Берген Т.А., Трофименко И.А.
Technique of MR diffusion and its application in the study of small-pelvis tumors in women
Bergen T.A., Trofimenko I.A.
На сегодняшний день магнитно-резонансная томография (МРТ) позволяет не только исследовать морфологию органов и тканей тела человека, но и предоставляет возможность судить о функциональных изменениях благодаря методикам перфузии, диффузии и спектроскопии. Количественная оценка МР-диффузии достигается путем построения карт измеряемого коэффициента диффузии (ИКД). Данная методика позволяет в короткое время и без необходимости
введения контрастного препарата получить данные о контрастности, отличной от традиционной Т1- и Т2-контрастности.
На базе наших учреждений ДВИ были выполнены 2 500 пациенткам в период с мая 2008 г. по март 2012 г. в структуре стандартизированного протокола MP-исследования малого таза. Плоскость получения изображений выбиралась в соответствии с клинической ситуацией. ДВИ выполнялись с b-фактором 0, 400 и 800 с/мм2. Для количественного анализа ДВИ применялись карты ИКД, автоматически генерируемые МР-системой.
ДВИ позволяет дифференцировать доброкачественную гиперплазию и полипы эндометрия от рака тела матки, средние значения ИКД при доброкачественных гиперпластических процессах значимо ниже, чем у злокачественных опухолей (0,8—0,9 • 10-3 против 1,3—1,5 • 10-3 мм2/с); полученные данные согласуются с результатами, опубликованными в литературе. На основании анализа ИКД более чем 100 пациенток с раком тела матки наблюдали тенденцию к понижению ИКД в группе низкодифференцированных опухолей эндометрия по сравнению с высокодиффе-
ренцированными, которая, однако, не явилась статистически значимой. Идентичную закономерность также отметили некоторые зарубежные авторы.
Злокачественные опухоли тела матки характеризуются ярким сигналом на ДВИ и демонстрируют высокую контрастность по отношению к миометрию, что делает изображения с высокими факторами взвешенности полезными для определения границ опухоли (рис. 1).
Рис. 1. ДВИ в оценке распространенности рака тела матки. Пациентка с 02 эндометриоидной аденокарциномой эндометрия и гема-тометрой. На Т2-ВИ (а) опухоль имеет низкую контрастность с мио-метрием, что затрудняет оценку ее распространенности, на ДВИ (б) опухолевая ткань выглядит контрастной, очевидна поверхностная инфильтрация мышечного слоя тела матки
Стадирование рака тела матки с помощью ДВИ требует получения изображений как минимум в двух плоскостях. По данным ряда исследований, диагностические возможности ДВИ в оценке глубины инвазии рака тела матки в миометрий сопоставимы с показателями динамического контрастного усиления. При интерпретации ДВИ эндометрия важно помнить, что, во-первых, в секреторную фазу менструального цикла эндометрий в норме демонстрирует ограничение
Достижения современной лучевой диагностики в клинической практике, г. Томск, 27—28 сентября 2012 г.
диффузии; во-вторых, высокодифференцированные опухоли могут быть изоинтенсивными на ДВИ и характеризоваться ИКД, близким к показателям, характерным для доброкачественных гиперпластических процессов, и, в-третьих, что участки некроза в опухолевой ткани по сигнальным характеристикам, ДВИ и ИКД идентичны простой жидкости и при количественных измерениях их необходимо исключать из области интереса.
Методика МР-диффузии также нашла применение в дифференциальной диагностике сарком тела матки и лейомиом со сложными типами дегенерации. В своей работе Т. МатшоЮ показал, что сочетанная интерпретация Т2-ВИ и ИКД позволяет с высокой точностью дифференцировать доброкачественные и злокачественные опухоли миометрия, с чувствительностью и специфичностью 100%.
При оценке распространенности злокачественных опухолей шейки матки МР-диффузия также находит применение, так как неопластическая ткань характеризуется гораздо более ярким сигналом по отношению к строме шейки (рис. 2). Отдельной областью применения ДВИ является оценка эффективности лучевой терапии рака шейки матки: ранним маркером ответа опухоли на проводимое лечение является увеличение ИКД.
Рис. 2. ДВИ в оценке распространенности рака шейки матки. Т2-ВИ (а) и ДВИ (б) в косоаксиальной плоскости у пациентки с плоскоклеточным раком шейки матки. На ДВИ опухолевая ткань демонстрирует яркий сигнал и высокую контрастность по сравнению со стромой шейки матки и параметральной клетчаткой
В дифференциальной диагностике сложных по структуре опухолей яичников МР-диффузия также находит применение, позволяя дифференцировать тубоовариальные абсцессы от истинных опухолей. При использовании традиционных Т1- и Т2-ВИ и даже при введении контрастного препарата дифференцировать эти нозологии затруднительно, так как и опухоли, и абсцессы нередко имеют сходную МР-
семиотику в виде сложных многокамерных кистозных структур с неравномерно утолщенными стенками и перегородками. При этом на ДВИ жидкостная часть абсцессов демонстрирует характерный яркий сигнал, а ИКД понижен до 0,4—0,6 • 10-3 мм2/с, что обусловлено высокой вязкостью жидкости (рис. 3). В свою очередь, для опухолей снижение ИКД в кистозном компоненте не характерно и ограничение диффузии в виде яркого сигнала на изображениях с высоким фактором взвешенности может наблюдаться лишь в тканном компоненте неоплазии.
Рис. 3. МР-диффузия в дифференциальной диагностике опухолей яичников и тубоовариальных абсцессов. Т2-ВИ (а, в) и ДВИ (б, г) в аксиальной плоскости у пациенток с двусторонним тубоовариальным абсцессом (а, б) и 02 аденокарциномой левого яичника (в, г). Жидкостное содержимое в абсцессе демонстрирует ограничение диффузии, тогда
как в кистозной части опухоли диффузия не ограничена
При интерпретации ДВИ в применении к опухолям яичников необходимо учитывать тот факт, что дермоидные и эндометриоидные кисты ввиду высокой вязкости жидкостного компонента демонстрируют сниженный ИКД, однако, если принимать во внимание сигнальные характеристики этих образований на Т1- и Т2-ВИ, ошибок можно легко избежать. Исследование ИКД в солидной части яичниковых опухолей также имеет высокий потенциал, так как злокачественные образования в отличие от доброкачественных не дают ограничения диффузии в тканевом компоненте.
Берген Т.А., Трофименко И.А. Методика МР-диффузии и ее применение в исследовании опухолей малого таза у женщин
Одним из наиболее успешных применений ДВИ является выявление метастазов рака яичника по брюшине, так как на изображениях с высоким фактором взвешенности перитонеальные имплантаты имеют вид контрастных ярких капель на фоне темной асцитиче-ской
Рис. 4. ДВИ в выявлении перитонеальных метастазов при раке яичника. Т2-ВИ (а) и ДВИ (б) в аксиальной плоскости у пациентки с 03 серозной аденокарциномой яичников, асцитом и перитонеаль-ным канцероматозом. Опухолевые отсевы по брюшине демонстрируют
яркий сигнал на ДВИ, асцитическая жидкость остается темной
жидкости (рис. 4). По чувствительности и специфичности данная методика в выявлении перитонеального
канцероматоза не уступает возможностям контрастного усиления, и при этом ДВИ менее чувствительны к артефактам от движения асцитической жидкости.
Таким образом, МР-диффузия является информативным дополнением к традиционным последовательностям, применяемым в МРТ. Ее использование позволяет в ряде случаев избежать введения дорогостоящих контрастных препаратов и не сопряжено с существенными временными или техническими затратами, повышая диагностическую эффективность метода и уверенность диагноста в интерпретации выявленных изменений. Анализ ДВИ требует учета ряда факторов, обусловленных физическими особенностями методики, и обязательной оценки количественного параметра (ИКД).
Поступила в редакцию 24.05.2012 г. Утверждена к печати 27.06.2012 г.

Диффузная фиброзно-кистозная мастопатия являет собой доброкачественную болезнь женской груди, что отличается нарушением гистологии тканей. Кроме того, данная проблема носит название хронического кистозного мастита, болезни Реклю, фиброаденоматоза.
Появляется у 30-70% женщин в репродуктивном возрасте, а при определенных проблемах в гинекологической сфере риск достигает 90%. Часто поражает две молочные железы сразу. Риски болезни увеличиваются после 40-45 лет.
Причины появления фиброзно-кистозной мастопатии
Главная роль в появлении болезни отведена изменениям гормонального фона организма. Под влиянием гормонов грудь меняется – от начала процесса полового созревания и роста груди до периода вынашивания ребенка и лактации.
При появлении любого гормонального сбоя в таких процессах развивается дисфункция молочных желез, изменение в тканях. В итоге возникают кистозные или фиброзные новообразования.
Дисбаланс в гормональный фон женщин вносят следующие факторы:
![]()
стрессы;- чрезмерное утомление;
- беременность и лактация;
- наследственные факторы;
- болезни печени;
- нерегулярные сексуальные отношения;
- болезни в гинекологической сфере;
- нарушения в эндокринной системе.
Но самой главной причиной появления двухсторонней мастопатии выступает увеличение уровня эстрогена, а также уменьшения прогестерона. Эстроген становится причиной роста стромы и эпителиальной ткани протоков, а прогестерон не позволяет данному процессу случиться и дифференцирует эпителий.
Когда прогестерона недостаточно, то в груди возникает отечность, увеличивается соединительная ткань. Из-за пролиферации протоков появляются кисты, а пролактин (гормон лактации), повышаясь вне периода лактации и во 2-й фазе цикла, становится причиной отека, нагрубания, боли в груди.
Существуют болезни, что сочетаются с фиброзно-кистозной мастопатией:
- миома в матке;
- гиперплазия эндометрия;
- эндометриоз;
- воспаления маточных придатков;
- болезни щитовидной железы и печени;
- склерополикистоз яичников;
- заболевания, сопровождающиеся высоким уровнем эстрогена.
Клиническая картина
Клиническая картина подобных процессов в груди не обладает выраженной симптоматикой. Главная жалоба – болезненные ощущения в груди. Они бывают постоянными или периодическими, усиливающимися при ПМС или на протяжении 2-й фазы цикла.
Каковы симптомы двусторонней диффузной ФКМ?
Наиболее частый симптом двусторонней фиброзно-кистозной мастопатии – это обнаружение плотного участка ткани при пальпации в тканях обеих молочных желез. Во 2-й фазе цикла и до начала менструации уплотнение может болеть, отличается тянущими и ноющими болевыми ощущениями, порой жгучими.
В процессе самостоятельного обследования или у маммолога выявляются одиночные уплотнения или множественные узелки в виде виноградных гроздьев. Диффузная форма заболевания чаще поражает верхние части желез.
Еще отмечаются следующие симптомы:
![]()
отечность и повышение размера молочных желез;- жидкость из сосков (прозрачная или кровянистая);
- изменение размера лимфоузлов в подмышках.
Приблизительно 15% женщин, которые страдают данной болезнью, не отмечают боли. Это связывается с разным уровнем чувствительности, особенным расположением нервных окончаний в груди.
Кроме того, кисты первое время могут никак не проявляться при пальпации. То же самое происходит при преобладании фиброзных элементов. По этой причине, для диагностики и своевременного обнаружения болезни требуется регулярно посещать маммолога.
Прочитать о том, какие симптомы имеет диффузная фиброзно-кистозная мастопатия с преобладанием кистозного компонента, вы можете здесь.
Опасно ли заболевание для женщин?
Мастопатия сама по себе не является болезнью, опасной для жизни. Но она ухудшает качество жизни женщины. Кроме того, мастопатия не считается предраковым состоянием, то есть не переходит в него. Но узловые разновидности способны симулировать рак груди.
Часто мастопатия выступает в роли фона для возникновения рака (важно принять во внимание некоторую схожесть факторов риска образования рака и мастопатии).
Диагностика и лечение
Диагноз ставится на итогах осмотра врачом-маммологом, маммографического исследования, УЗИ, анализов. Порой требуется биопсия и МРТ груди.
Наружные изменения груди при диффузной разновидности заболевания не проявляются.При пальпации обнаруживаются разные по размеру и длине, без явных ограничений, болезненные новообразования с дольчатой и зернистой поверхностью.

Эхографическая картина при УЗИ отличается увеличением толщины ткани желез, фиброзными изменениями протоковых стенок, перегородок между дольками, множественными кистами.
Маммография обнаруживает неоднородную структуру ткани с мелкими уплотнениями или кистами.
Это исследование помогает исключить злокачественную опухоль в груди, выявляет форму мастопатии.
Что касается лечения, то при диффузной разновидности заболевания показано консервативное лечение, а также наблюдение в динамике.
Рекомендуется поменять пищевой рацион:
- добавить больше клетчатки растительного происхождения;
- употреблять молочные продукты;
- лимитировать поступление с пищей животных жиров.
Если присутствует дисбактериоз кишечника, что нарушает процесс усвоения полезных веществ, требуется вмешательство гастроэнтеролога.
Назначаются витаминные и минеральные комплексы, йодид калия, гомеопатические препараты, БАДы, фитопрепараты адаптогены. Что касается негормональной терапии, то доктор может выписать седативные, мочегонные и ферментативные препараты.
При диффузной форме следует повысить физическую активность. Среди физиологических процедур допускается:
- магнитотерапия;
- лазеротерапия;
- гальванизация;
- бальнеолечение;
- электрофорез.
В заключении следует сказать, что профилактика всегда лучше лечения. Во избежание развития такой болезни нужно вести здоровый образ жизни, проходить вовремя осмотры у доктора, соблюдать правила гигиены. Важно следить, чтобы не было травм груди, соблюдать правильное питание, избегать стрессов и высыпаться.
Полезное видео
Из видео вы узнаете, что такое диффузная фиброзно-кистозная мастопатия и как ее следует лечить:
Диффузная мастопатия – дисгормональная дисплазия, характеризующаяся диффузным изменением структуры молочных желез, нарушением нормального соотношения эпителиальных и соединительнотканных компонентов. К проявлениям диффузной мастопатии относятся масталгия во второй половине менструального цикла, набухание и уплотнение ткани желез, молозивоподобные выделения из сосков. Диагностика диффузной формы мастопатии включает осмотр молочных желез маммологом, проведение УЗИ желез и маммографии. Лечение диффузной мастопатии консервативное, включающее гормональную и негормональную медикаментозную терапию, физиопроцедуры.
- Причины диффузной мастопатии
- Классификация диффузной мастопатии
- Симптомы диффузной мастопатии
- Диагностика диффузной мастопатии
- Лечение диффузной мастопатии
- Профилактика и рекомендации при диффузной мастопатии
- Цены на лечение
Общие сведения
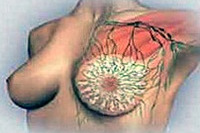
Диффузные изменения в молочной железе маммология рассматривает как начальную стадию мастопатии, характеризующуюся неравномерным разрастанием в тканях соединительнотканных элементов в виде неоформившихся узелков и тяжей. Такие процессы приводят к нарушению строения протоков и долек железы, образованию мелких кист. При определенных условиях диффузная форма может трансформироваться в узловую мастопатию с очаговыми уплотнениями либо узловыми пролифератами, что рассматривается как фактор риска возникновения рака молочной железы.

Причины диффузной мастопатии
Диффузная мастопатия является полиэтиологической патологией, связанной с наследственностью, факторами среды, образом жизни, эндогенными причинами. Ведущим патогенетическим звеном в развитии диффузной мастопатии выступает нарушение нейрогуморальной регуляции, гиперэстрогения и прогестерондефицит. Предрасположенность к развитию диффузной мастопатии может быть обусловлена наследственными механизмами, в первую очередь, наличием заболеваний молочных желез у близких родственниц по материнской линии. Наличие в жизни женщины фрустирующих ситуаций (неудовлетворенности интимной жизнью, семейным или социальным положением, конфликтных ситуаций в быту и на работе, психических стрессов) может вызывать различные функциональные нарушения в функционировании нейроэндокринной системы.
Среди репродуктивных факторов развитию диффузной мастопатии могут способствовать отсутствие беременностей и родов, аборты, поздняя беременность, различные женские болезни (аднекситы, оофориты, дисфункция яичников), лечение бесплодия и др. Негативно на последующем состоянии молочных желез сказываются перенесенные маститы, травмы груди (ушиб молочных желез), отказ от грудного вскармливания или короткий период лактации. Известно, что у женщин, которым трижды и более выполнялось искусственное прерывание беременности, вероятность развития диффузной и узловой мастопатии повышается в 7,2 раза. Имеется связь повышенного риска диффузной мастопатии с ранним началом менструаций и их поздним прекращением.
В ряду экстрагенитальных факторов первостепенная роль отводится гипотиреозу, при котором риск диффузной мастопатии увеличивается в 3,8 раза. Неблагоприятными моментами также служат ожирение, сахарный диабет, артериальная гипертензия, гепатиты, холециститы, холангиты, заболевания надпочечников и др. С повышенным риском возникновения диффузной мастопатии ассоциируется пристрастие к курению и алкоголю, ионизирующая радиация, загар на пляже или в солярии топлесс, неблагополучная экология мегаполисов. К защитным факторам, снижающим вероятность развития диффузной мастопатии, относят ранние роды (в 20-25), двое и более родов с полноценным периодом лактации, прием оральной контрацепции.
Классификация диффузной мастопатии
В соответствии с клинико-рентгено-морфологическими изменениями тканей молочных желез среди форм диффузной мастопатии различают:
- аденоз, или диффузную мастопатию с преобладающим железистым компонентом
- фиброаденоматоз, или диффузную мастопатию с преобладающим фиброзным компонентом
- диффузную мастопатию с преобладающим кистозным компонентом
- смешанную фиброзно-кистозную форму диффузной мастопатии
- склерозирующую форму аденоза
При определении того или иного клинического варианта исходят из соотношения соединительнотканного, железистого и жирового компонента на маммограммах.
По степени имеющихся изменений выделяют незначительно выраженную, умеренную и резко выраженную диффузную мастопатию.
Симптомы диффузной мастопатии
Проявления диффузной мастопатии тесно связаны со сменой фаз менструального цикла. Ведущей жалобой служит боль в молочных железах (масталгия), которая возникает в середине или второй половине цикла. Характер боли может быть ноющим, колющим, распирающим, с иррадиацией в шею, плечо, подреберье или спину. Отмечается набухание и равномерное уплотнение тканей молочных желез; при пальпации прощупываются небольшие зернистые структуры. При надавливании на сосок из него появляются прозрачные или молозивоподобные выделения, интенсивность которых также усиливается в предменструальный период.
После начала месячных боли постепенно стихают, уплотнения становятся менее болезненными, а затем на какое-то время пропадают. В поздние стадии диффузной мастопатии уплотнение и болезненность в железах сохраняются независимо от фаз менструального цикла. Боль может вызываться даже легким прикосновением к молочным железам. В связи с выраженностью масталгии у женщин часто развивается канцерофобия, нарушается сон, появляется повышенная тревожность и нервозность.
Наличие гиперэстрогении и прогестерондефицита при диффузной мастопатии может сопровождаться задержкой месячных, выраженным предменструальным синдромом, альгодисменореей, олигоменореей или меноррагиями (обильными менструациями), ановуляцией. Нередко на фоне диффузной мастопатии выявляются фибромы матки, кисты яичников, эндометриоз, гиперплазия эндометрия. Многие женщины с диффузной мастопатией также отмечают повышенную сухость кожи, ломкость волос и ногтей.
Диагностика диффузной мастопатии
Постановка диагноза диффузной мастопатии основывается на результатах осмотра молочных желез маммологом, УЗИ, маммографического обследования, лабораторных анализов, по показаниям – МРТ молочных желез и биопсии.
Внешние изменения молочных желез при диффузной мастопатии не выявляются. Пальпаторно определяются различные по протяженности и величине, без четких границ, болезненные уплотнения с зернистой или дольчатой поверхностью. Уплотнения при диффузной мастопатии чаще локализуются в верхне–наружных квадрантах желез.
Типичная эхографическая картина диффузной мастопатии, определяемая методом УЗИ молочных желез, характеризуется утолщением железистой ткани, фиброзными изменениями стенок протоков и междольковых перегородок, изменением эхоплотности железистой ткани, множественными кистами, дуктэктазией, несоответствием типа строения железы возрасту.
Обзорная рентгенография (маммография) при диффузной мастопатии обнаруживает неоднородность ткани желез с мелкими очагами уплотнения или кистозными образованиями, плотной тяжистостью. Проведение маммографии позволяет исключить наличие опухолей в железе и определить форму мастопатии.
Наличие выделений из сосков при диффузной мастопатии может диктовать необходимость проведения дуктографии, обычно выявляющей деформацию млечных протоков и различной величины кисты. Исследование мазка из соска позволяет дифференцировать диффузную мастопатию от специфических поражений – актиномикоза молочных желез, туберкулеза, сифилиса молочных желез.
В случаях сопутствующего экстрагенитального и генитального фона назначается исследование гормонов щитовидной железы и половых гормонов, печеночных ферментов, консультация гинеколога-эндокринолога, УЗИ малого таза.
При сомнительных данных предшествующей диагностики прибегают к проведению МРТ, биопсии молочной железы под контролем УЗИ с цитологическим исследованием биоптата, определению CA 15 - 3 в крови.
Лечение диффузной мастопатии
При диффузной мастопатии показана консервативная тактика и динамическое наблюдение. Рекомендуется изменение пищевого рациона с включением в него большого количества растительной клетчатки и молочных продуктов, ограничением животных жиров. При наличии у пациентки дисбактериоза кишечника, нарушающего всасывание витаминов и микроэлементов, необходимо лечение у гастроэнтеролога. Показано назначение витаминно-минеральных комплексов, йодида калия, БАДов, гомеопатии, фитопрепаратов, адаптогенов. Из негормональной терапии назначаются препараты мочегонного, седативного, ферментативного действия.
При диффузной мастопатии целесообразно увеличение физической активности, занятия ЛФК, психотерапия. Среди физиотерапевтических процедур возможно применение лазеротерапии, магнитотерапии, гальванизации, электрофореза, бальнеолечения (климатотерапии, грязелечения, глинолечения, минеральных и морских лечебных ванн и т. д.). Важно, что при диффузной мастопатии любые процедуры и аппликации должны производиться в холодном или слегка теплом виде.
Регулирующая гормонотерапия при диффузной мастопатии направлена на устранение гормональных нарушений и может включать в себя назначение гестагенов (прогестерона, дидрогестерона и др.), гормонов щитовидной железы, рациональный подбор контрацепции. Для уменьшения болезненности и ощущений напряжения в молочных железах местно используется нанесение геля с прогестероном.
Профилактика и рекомендации при диффузной мастопатии
Прохождение периодических осмотров врача-маммолога с проведением комплекса инструментальных исследований является залогом успешной профилактики и раннего выявления диффузной мастопатии. Необходимо своевременное пролечивание гинекологической патологии и сопутствующих экстрагенитальных заболеваний.
Важное значение имеет регулярное проведение самообследования молочных желез, при котором особое внимание следует обращать на изменение формы груди, появление болезненности и уплотнений, выделений из сосков, пятен на коже груди. Рекомендуется правильный подбор бюстгальтера, не сдавливающего грудь, защита молочных желез от травм, давления, ударов. Во время лактации следует не допускать развития трещин сосков, лактостаза и мастита. Для профилактики диффузной мастопатии необходимо применять современные методы контрацепции и не допускать проведения абортов.
Наличие диффузной мастопатии служит противопоказанием к проведению увеличивающей маммопластики, посещению саун, бань, использованию горячих компрессов на грудь и локальных обертываний, загару как в солярии, так и на солнце.
Читайте также:



