Рак простаты с распространением на семенные пузырьки
Медицинский эксперт статьи

Местнораспространённый рак простаты рак (Т3), который распространяется за капсулу простаты с инвазией в парзпростатические ткани, шейку мочевого пузыря, семенные пузырьки, но без поражения лимфатических узлов или отдалённых метастазов.
Многочисленные исследования свидетельствуют, что результаты лечения больных местнораспространённым раком простаты уступают показателям в группе пациентов с локализованным риском. Тем не менее несовершенство методов стадирования рака простаты на этом этапе диагностики реже приводит к завышению клинической стадии болезни, чаще - к её занижению.
Говоря о пациентах с раком простаты в стадии T3 необходимо помнить, что они представляют достаточно разнообразную группу, различную по патогистологическим критериям, серьезно влияющим на выбор метода лечения и продолжительность жизни. На сегодняшний день оптимальный метод для этой категории больных ещё не определён.

[1], [2], [3], [4], [5], [6]
Местнораспространённый рак простаты рак: операции
Согласно руководству Европейской ассоциации урологов выполнение резекции простаты у пациентов с местнораспространённым раком простаты считают возможным (ПСА менее 20 нг мл; стадия Т3а: G равное 8 и меньше). В тоже время работы ряда специалистов показали, что операция (как моиотерапия) наиболее эффективна в группе больных со стадией Т3а при уровне ПСА менее 10 нг/мл. Так у 60% больных в течение 5 лет не отмечали рецидивов заболевания, а общая выживаемость в течение 6 -8 мес наблюдения составила 97,6%.
Выполнение резекции простаты у больных с ПСА менее 20 нг/мл и G равным 8 и меньше может принести пользу, однако вероятность применения адъювантного лечения (гормонального, лучевого) крайне высока.
Оперативное лечение больных со стадией Т3а включает удаление простаты с расширенной лимфодиссекцией, тщательной апикальной диссекцией, полным удалением семенных пузырьков, резекцией сосудисто-нервных пучков и шейки мочевого пузыря.
Частота послеоперационных осложнений при резекции простаты у больных раком простаты Т3, таких, как импотенция, недержание мочи, выше, чем при оперативном лечении локализованных форм.
Для пациентов с хорошо, умеренно и плохо дифференцированной опухолью (рТ3) раково-специфическая выживаемость в течение 10 лет составляет 73, 67 и 29% соответственно. Отношение к применению неоадъювантного лечения неоднозначно. Несмотря на то что её применение снижает частоту позитивных хирургических краёв на 50%, сроки выживаемости больных в этой группе достоверно не отличаются от тех, кому проводили только оперативное лечение. Проходят исследования по эффективности комбинации химиопрепаратов в качестве неоадъювантного лечения, а также по увеличению его длительности до 9-12 мес.
Применение адъювантной (гормональной, химио- или лучевой терапии) терапии, особенно в группе больных высокого риска (G равно 8 и менее), стадии с Т3а может существенно улучшить результаты лечения. По данным последних исследований, 56-78% больных раком простаты в стадии Т3а необходимо адъювантное лечение после резекции простаты; при этом 5- и 10-летняя канцероспецифическая выживаемость составляла 95-98 и 90-91% соответственно.
Показания для проведения адъювантного лечения:
- протяжённый хирургический край;
- выявленные метастазы в лимфатических узлах;
- группа высокого риска (G равно 8 и меньше);
- инвазия опухоли в семенные пузырьки.
В настоящее время существуют работы, в которых резекцию простаты в сочетании с адъювантной терапией рассматривают как альтернативу неинвазивному мультимодальному лечению (сочетание лучевой и гормональной терапии) у больных в стадии Т3а.
Таким образом, резекция простаты эффективный метод лечения больных с местнораспространённым раком простаты. Лучшие кандидаты для резекции простаты - пациенты, у которых завышена стадия местного процесса, непротяжённая экстракапсулярная экстензия, высоко- или умеренно дифференцированные опухоли. ПСА менее 10 нг/мл.
У молодых пациентов низкодифференцированная опухоль или прорастание в семенные пузырьки не могут быть противопоказаниями к резекции простаты.
Местнораспространённый рак простаты рак: другие методы лечения
Лучевую терапию как основной метод лечения больных с местнораспространенным раком простаты предпочитают радиологи. В тоже время многие специалисты предлагают мультимодальный подход, т.е. сочетание лучевого и гормонального лечения.
Таким образом, для лечения больных раком простаты в стадии Т3а необходим взвешенный подход. Врач должен сопоставить такие критерии, как возраст пациента, данные обследования, показания для выбора того или иного метода лечения возможные осложнения, лишь после этого с учётом пожеланий самого больного и его информированного согласия начать лечение.
Лучевая терапия рака простаты
Дистанционная лучевая терапия рака простаты включает использование у-облучения (обычно фотоны), направленного на простату и окружающие ткани через множественные поля облучения. Для минимизации лучевых повреждений мочевого пузыря и прямой кишки получила развитие трёхмерная конформная лучевая терапия, в которой поля облучения фокусируют на простате. Наиболее эффективная форма трёхмерной конформной лучевой терапии модуляция интенсивности облучения. Лучевая терапия с модуляцией интенсивности обеспечивает локализацию облучения в геометрически сложных полях. Модуляция интенсивности облучения возможна на линейном ускорителе, оснащённом современным многолепестковым коллиматором и специальной программой: движение створок коллиматора равномерно распределяет дозу в поле облучения, создавая вогнутые изодозные кривые. Лучевую терапию тяжёлыми частицами, проводимую высокоэнергетическими протонами или нейтронами, также используют для лечения рака простаты.
Показания для лучевой терапии: локализованный и местнораспространённый рак простаты. Паллиативную терапию применяют при костных метастазах, компрессии спинного мозга, метастазах в головной мозг. Радионуклидное лечение Str используют для паллиативного лечения гормонорефрактерного рака простаты.
Противопоказания к проведению лучевой терапии: общее тяжёлое состояние больного, раковая кахексия, выраженный цистит и пиелонефрит, хроническая задержка мочеиспускания, хроническая почечная недостаточность. Относительные противопоказания к проведению лучевой терапии: предшествующая ТУР простаты, выраженные обструктивные симптомы, воспалительные заболевания кишечника.
В подходах к лучевой терапии у авторов есть существенные различия, касающиеся техники и методики облучения, объёма лучевого воздействия и суммарных очаговых доз.
Основные серьёзные побочные эффекты лучевой терапии связаны с повреждением микроциркуляции мочевого пузыря, прямой кишки и ее сфинктера, мочеиспускательного канала. Примерно одна треть пациентов имеют симптомы острого проктита и цистита во время курса лучевой терапии. У 5-10% присутствуют постоянные симптомы (синдром раздраженной толстой кишки, периодические кровотечения из прямой кишки, симптомы раздражения мочевого пузыря и периодическая макрогематурия). Частота развития поздних осложнений после лучевой терапии по данным Европейской организации по исследованию и лечению рака: цистит - 5,3%, гематурия - 4,7%, стриктуры мочеиспускательного канала - 7,1%, недержание мочи - 5,3%, проктит - 8,2%, хроническая диарея - 3,7%, тонкокишечная непроходимость - 0,5%, лимфостаз нижних конечностей - 1.5%. Примерно у половины пациентов возникает импотенция. которая обычно развивается примерно через 1 год после завершения лечения. Это происходит вследствие повреждения кровоснабжения кавернозных нервов и кавернозных тел полового члена
Локализованный рак простаты: лучевая терапия
Для пациентов с опухолями Tl-2aN0M0, суммой Глисона равной 6 или менее и ПСА менее 10 нг/мл (группа низкого риска) рекомендована лучевая терапия в дозировке 72 Гр. Продемонстрировано, что безрецидивиая выживаемость выше при дозе 72 Гр и более по сравнению с дозой менее 72 Гр.
По данным ряда работ, при опухоли Т2b или уровне ПСА 10-20 нг/мл. либо сумме Глисона 7 (группа среднего риска) повышение дозы до 76-81 Гр заметно улучшает 5-летнюю безрецидивную выживаемость, не вызывая тяжёлых осложнений. Для повседневной практики используют дозу 78 Гр.
При опухоли Т2с или количестве ПСА более 20 нг/мл. либо сумме Глисона более 7 (группа высокого риска) эскалация дозы облучения увеличивает безрецидивную выживаемость, но не предотвращает рецидивы за пределами малого таза. В одном из рандомизированных исследований из Франции показано преимущество дозы 80 Гр по сравнению с 70 Гр.
Для конформной лучевой терапии с эскалацией дозы получены впечатляющие результаты, свидетельствующие о повышении 5-летней безрецидивной выживаемости с 43 до 62% при увеличении дозы облучения с 70 до 78 Гр для больных раком простаты промежуточного и высокого риска. При глубине прорастания первичной опухоли Т1 или Т2, сумме Глисона не более 7, уровне ПСА не более 10 нг/мл безрецидивная выживаемость составляет 75%.
Нет завершённых рандомизированных исследований, свидетельствующих о том, что добавление антиандрогенного лечения к лучевой терапии имеет преимущество у больных высокого риска локализованным раком простаты. Однако на основе исследований, посвященных местнораспространённому раку простаты, назначение гормонального лечения совместно с лучевой терапией поддерживают у больных высокого риска с локализованным раком простаты.
Применение антиандрогенов в течение 6 мес (за 2 мес до начала, 2 мес во время и 2 мес - после лучевой терапии) улучшает результаты лечения у больных раком простаты среднего риска. Лугевая терапия при местнораспространённом раке простаты Лечение антиандрогенами в течение 3 лет. назначаемое вместе с лучевой терапией. улучшает выживаемость у больных местнораспространённым раком простаты. Комбинация антиандрогенного лечения до, во время и после лучевой терапии продолжительностью 28 мес по сравнению с 4 мес гормонотерапии до и во время облучения имеет лучшие онкологические показатели эффективности лечения за исключением общей выживаемости. Преимущество в общей выживаемости при более длительной гормонотерапии в комбинации с лучевой терапией доказано для больных с местнораспространённым раком простаты с суммой Глисона 8-10.
Биохимическая точка отсчёта, используемая для определения успеха лечения после дистанционной лучевой терапии, противоречива. Оптимально снижение количества ПСА менее 0,5 нг/мл, это позволяет прогнозировать благоприятный результат после облучения. В Американской ассоциации терапевтической радиологии и онкологии биохимическим рецидивом после лучевой терапии считают значение ПСА более 2 нг/мл, при условии, что этот уровень ПСА больше минимального (надира). По уровню ПСА после лучевой терапии можно предсказать характер рецидива. У пациентов с местным рецидивом время удвоения ПСА составляет 13 мес. у больных с системным рецидивом - 3 мес. Лучевая терапия после радикальной простатэктомии Необходимость адъювантной лучевой терапии или выжидательной тактики со спасительной лучевой терапией при возникновении рецидива после РПЭ обсуждают в настоящее время. Рандомизированных исследований, сравнивающих адъювантное облучение с ранней спасительной лучевой терапией после операции, нет. Существуют лишь данные, подтверждающие преимущество выживаемости при адъювантной лучевой терапии по сравнению с наблюдением у больных при позитивном хирургическом крае, экстракалсуляриой экстензии и инвазии в семенные пузырьки. Спасительную дистанционную лучевую терапию проводят при рецидиве, пока уровень ПСА не достиг 1 -1,5 нг/мл.
У больных высокого риска с локализованным раком простаты возможно сочетание брахитерапии с дистанционной лучевой терапией. Брахитерапию в этом случае выполняют первой.
В последнее время дистанционную лучевую терапию тяжёлыми частицами (высокоэнергетические фотоны и нейтроны) позиционируют как более эффективный метод конформного облучения, однако убедительных доказательств преимущества над стандартным фотонным облучением нет. Более того, отмечена более высокая частота развития стриктур мочеиспускательного канала после применения тяжёлых частиц.
В современных исследованиях изучают возможности применения более высоких доз облучения в метаболически более активные очаги по данным магнитно-резонансной спектроскопии.
Следует отметить, что основная точка приложения лучевой терапии рака простаты локализованная опухоль. Появление трёхмерной конформной лучевой терапии и модуляции интенсивности облучения, как одной из её совершенных форм, позволило увеличить дозу облучения, уменьшить осложнения традиционной лучевой терапии, получить онкологические результаты, конкурирующие с радикальным оперативным лечением.
Материал, полученный при трансуретральной резекции
В тех случаях, когда трансуретральная резекция предстательной железы выполняется без клинического подозрения на карциному, злокачественные опухоли обнаруживают примерно в 8-10% препаратов.
Большинство опухолей, обнаруживаемых при трансуретральной резекции, происходит из переходной зоны, однако они могут прорастать в нее и из периферической зоны.
Различить это при микроскопическом исследовании практически невозможно.
Так как выяснение источника роста опухоли в предстательной железе важно для планирования лечения, при случайном обнаружении опухоли в материале при трансуретральной резекции в дальнейшем следует выполнить полифокальную биопсию из периферической зоны. Для стадирования опухоли морфолог должен указать объем, приходящийся на опухолевую ткань и оценить степень дифференцировки по Глисону.
Иногда материал, получаемый при трансуретральной резекции является большим по объему, вследствие чего не весь подвергается гистологическому исследованию. В этом случае, если трансуретральная биопсия была проведена у молодого мужчины, должен исследоваться весь объем материала.
При отборе материала, полученного у пожилых лиц, выборка объема должна быть репрезентативной. Обязательному исследованию должны подвергаться кусочки ткани, макроскопически имеющие опухолевый вид. Биоптаты опухоли плотные, имеют цвет от бело-серого до желто-оранжевого, опухоли контрастируют с прилежащей доброкачественной паренхимой, обычно рыжевато-коричневой и губчатой.
Материал, полученный при радикальной простатэктомии
Имеется прямая зависимость правильности стадирования патологического процесса от полноты забора матриала для гистологического исследования органа, удаленного при радикальной простатэктомии. Только полное, стандартизированное гистологическое исследование может определить наличие или отсутствие положительного хирургического края и дать достоверные данные для опеределния стадии патологического процесса и правильного прогноза течения заболевания.
Наиболее тщательно разработанный в клинике Мейо метод гистологического забора материала при радикальной простатэктомии подразумевает получение серии срезов, перпендикулярных уретре, через каждые 5 мм. Особенно тщательно исследуются проксимальный и дистальный края резекции (рис. 2.20-1).

Рис. 2.20-1. Последовательность срезов в препарате предстательной железы, полученном при радикальной простатэктомии. A. После отсечения верхушки и основания делают поперечные параллельные срезы (см. текст). B. Так как верхушка предстательной железы имеет коническую форму, ее можно разделить на квадранты.
Мы предпочитаем препарировать нефиксированную ткань предстательной железы, так как это позволяет в случае необходимости провести цитологическое исследование, обеспечить правильную фиксацию материала забуференным 10% раствором формалина и придерживаться естественых анатомических ориентиров, которые после фиксации могут изменить свое месторасположение.
Исследование начинается с описания линейных размеров и массы удаленного органа.
Прежде всего на исследование забираются срезанные перпендикулярно мочеиспускательному каналу края шейки мочевого пузыря и верхушки на расстоянии 5 мм. Края резекции рассекаются радиально от уретры, получая секстантные конусовидные блоки толщиной 4-5 мм.
Отсекают выходящие из предстательной железы культи сосудисто-нервных пучков.
Этот материал в полном объеме должен быть исследован гистологически.
Из серии параллельных срезов отбираются срезы на уровне верхушки, на уровне отхождения сосудисто-нервных пучков и в области основания предстательной железы. При обнаружении макроскопических изменений в исследование берутся дополнительные срезы. Каждый поперечный срез разделяют на 4 квадранта; в более крупных железах из каждого поперечного среза образуется 8 блоков.
Для маркировки блоков мы применяем термины, содержащие следующие сведения:
• номер плоскости среза от верхушки;
• правая или левая половина;
• передний или задний квадрант.
В случае больших размеров блоков и рассечения плоскостного среза на 8 частей применяются термины: медиально и латерально.
Например: 2-я плоскость на уровне сосудисто-нервных пучков, правая сторона передний медиальный квадрант.
При гистологическом описании препаратов, чрезвычайно полезным является использование карты препаратов карциномы предстательной железы для образцов, полученных при радикальной простатэктомии разработанной в клинике Мейо (рис. 2.21).

Рис. 2.21. Карты препаратов карциномы предстательной железы, используемые в клинике Мейо для образцов, полученных при радикальной простатэктомии. A. Частичный забор материала. B. Полный забор материала с изготовлением срезов из всей ткани железы. 1 — apex, верхушка; 2 — base, основание; 3 — mid. средняя часть; 4 — inferior, нижняя часть; 5 — superior, верхний участок; 6 — семенные пузырьки; 7 — аденокарцинома; 8 — инвазия капсулы; 9 — распространение опухоли за пределы предстательной железы; 10 — точные границы резекции (нет ни в одном препарате) средний объем опухоли.
Главной целью исследования препаратов радикальной простатэктомии является установление патологической стадии по системе TNM. А при опухолях, происходящих из секреторного эпителия, — оценка степени дифференцировки по Глисону.
Для хирурга и морфолога макроскопическая оценка удаленной предстательной железы для идентификации карциномы часто затруднительна, а порой и невозможна. Материал для гистологического исследования берется в соответствии со стандартом исследования, а не только из макроскопически измененных участков.
Любая опухоль, обнаруживаемая в этих срезах, считается положительной хирургической границей. Объем предстательной железы определяет большое число блоков, которое понадобится для репрезентативного суждения об объеме патологического процесса.
Максимальное сокращение, которое мы допускаем, — это изготовление срезов, перпендикулярных мочеиспускательному каналу, на уровне верхушки, на уровне отхождения сосудисто-нервных пучков и среза в области основания. Площадь таких срезов может быть большой и не помещаться в блок.
В этом случае материал будет разделен на правую и левую половину, среднюю и заднюю части, а в случае необходимости — на медиальный и латеральные блоки. Ориентиром для медиальных блоков являемся наличие фрагмента стенки мочеиспускательного канала, а для либеральных блоков — наличие капсулы в срезе.
Минимальное количество блоков, требующихся для представления всей предстательной железы и нижней части семенных пузырьков, — 26 блоков ткани. Меньшее число блоков наносит ущерб чувствительности обнаружения положительных хирургических границ шли экстрапростатического распространения.
Определение гистогенеза опухоли
Гистологическая степень (индекс Глисона)
Исследование индекса Глисона выполняется в случаях, если опухоль происходит из секреторных клеток. Оценка по Глисону препарата радикальной простатэктомии является одним из самых убедительных прогностических параметров прогрессирования после хсирургической операции.
Оценка по Глисону материалов пункционной биопсии также сильно скоррелирована с прогнозом течения опухолевого процесса. Точная оценка степени по Глисону часто требует примещения дополнительных иммуногистохимических методов с целью проведения дифференциальной диагностики.
Экстрапростатическое распространение
Существует 3 критерия экстрапростатического распространения, основанных на локализации и компонентах, образующих внеорганный очаг опухоли, — карцинома в жировой ткани; карцинома в периневральных пространствах сосудисто-нервных пучков; карцинома в передней группе мышц.
Предстательная железа не имеет настоящей капсулы, хотя на заднебоковой стороне имеется слой, более волокнистый, чем мышечный, который условно обозначается морфологами как капсула предстательной железы.
У верхушки и в передней части железы проследить границу предстательной железы и окружающих структур невозможно. Обнаружение опухолевой ткани в крае резекции, как в верхушечном, так и в области шейки мочевого пузыря, трактуется как положительный хирургический край.
Прорастание опухоли за пределы предстательной железы диагностируют по распространению опухоли за наружный мышечный слой предстательной железы, обнаружению клеток опухоли в жировой клетчатке. Однако следует учитывать, что опухоль, распространяясь за пределы предстательной железы, часто вызывает десмопластическую стромальную реакцию, вследствие чего не всегда удается обнаружить опухоль в экстрапростатической жировой ткани.
Существуют объективные данные, указывающие на то, что экстрапростатическая инвазия и состояние хирургического края являются существенными независимыми прогностическими факторами. Тем не менее точность морфологических данных определяется тщательностью исследования анатомии фибромускулярной оболочки. Особую важность представляет четкое различие между позитивным хирургическим краем в сочетании с экстрапростатической инвазией или без нее, поскольку это имеет разное прогностическое и лечебное значение.
Объем прорастания опухоли за пределелы предстательной железы может быть описан следующими терминами, имеющими прогностическое значение для клиницистов:
• фокальное, когда лишь несколько желез опухоли обнаруживается вне предстательной железы;
• диффузное, или многоочаговое, т.е. все, что больше фокального.
Прорастание в семенные пузырьки
Под прорастанием опухоли в семенные пузырьки понимается прорастание карциномы в мышечный слой семенных пузырьков.
М. Ohori, Р.Т. Scardino, S.L. Lapin, С. Seale-Hawkins, J. Link, T.M. Wheeler (1993) описали 3 механизма прорастания карциномы предстательной железы в семенные пузырьки:
1) за счет распространения вверх, в комплекс семявыводяших протоков;
2) за счет распространения через основание предстательной железы или посредством прорастания в семенные пузырьки из перипростатической жировой ткани или жировой ткани у семенных пузырьков;
3) в виде изолированного метастаза опухоли без непрерывной связи с очагом первичной карциномы предстательной железы.
Клетки опухоли в отличие от эпителия семенных пузырьков не содержат липофусцина. Обнаружение очагов прорастания опухоли в семенные пузырьки значительно ухудшают прогноз и требует изменения стадирования опухоли по системе TNM.
Рост по лимфатическим сосудам
Метастазы в лимфатические узлы
Прорастание опухоли в хирургический край
Обнаружение опухолевых клеток в хирургическом крае показывает, что опухоль не полностью иссечена во время хирургической операции и является важным прогностическим параметром. Чаще всего положительный хирургический край обнаруживается в верхушке и в месте выхода сосудисто-нервного пучка из предстательной железы.
При обнаружении положительного хирургического края железы стадия классифицируется как рТ2Х и рТ2+, поскольку нельзя исключать экстрапростатическую инвазию опухоли в области положительного хирургического края. Обнаружение опухолевых клеток в шейке мочевого пузыря не следует рассматривать как заболевание рТ4.
Жировая ткань обычно прилежит к латеральной, заднелатеральной и задней поверхностям предстательной железы. В предстательной железе жировая ткань отсутствует, т.е. обнаружение опухолевых клеток в жировой ткани указывает на экстрапростатическое распространение опухоли.
Распространение карциномы в переднюю группу мышц встречается очень редко и отмечается при опухолях переходной зоны. При наличии четких признаков распространения карциномы за пределы достоверных границ предстательной железы в скелетные мышцы, а также за пределы округлой прослойки, разделяющей фибромышечную строму и скелетные мышцы, допустимо заключение о внеорганном распространении опухоли.
Периневральный рост опухоли
Сосудисто-нервные пучки — путь наименьшего сопротивления распространению карциномы за пределы предстательной железы. Эти пучки сконцентрированы в заднелатеральных узлах предстательной железы. Опухоль может и не контактировать с жировой тканью, однако наличие опухоли в периневральных пространствах сосудистонервных пучков указывает на внеорганное распространение опухоли. О наличии злокачественной опухоли в сосудисто-нервных пучках следует говорить только тогда, когда малигнизированные ацинусы обнаруживаются за пределами достоверных контуров.
Периневральное распространение карциномы предстательной железы наблюдается в 75-84% случаев. Обнаружение очагов периневрального роста опухоли в пункционных биоптатах косвенно говорит о более высокой вероятности прорастания опухоли за пределы предстательной железы по сосудисто-нервному пучку и предполагает, что это может привести к более высокой распространенности и прогрессированию заболевания после лучевой терапии и радикальной простатэктомии.
Поскольку при пункционной биопсии обнаружение роста опухоли по периневральным пространствам имеет диагностическую значимость, то этот признак следует включать в протокол исследования пункционной биопсии.
Объем опухоли
Объем опухоли используется как дополнительный критерий для определения стадии процесса. Для характеристики объема опухоли, ограниченного пределами предстательной железы, выделяют три основных степени: V1 — объем опухоли менее 1 см3; V2a — объем опухоли от 1 до 5 см3; V2b — объем опухоли более 5 см3.
Объем опухоли можно измерить с применением компьютерных планиметрических методов. В практике применяется более простой метод с использованием планиметрической сетки. Общий объем опухоли является важным прогностическим параметром и коррелирует с другими патологическими характеристиками.
Однако мы не обнаружили прямой корреляционной связи между объемом опухоли и уровнем PSA в крови. Уровень простатического специфического антигена обусловлен не столько количеством клеток секретирующих PSA, сколько сохранением этой функции в процессе дедифференцировки опухоли, а также состоянием микроциркуляторного русла.
Косвенно о размерах опухоли можно судить исходя из результатов пункционной биопсии, основываясь на числе биоптатов с опухолью, процента от общего объема, занимаемого опухолью среди общего объема биоптатов, а также от объема поражения опухолью каждого биоптата. Учет этих признаков позволяет судить об объеме опухоли, т.е. оценивать, одну долю или больше охватывает опухоль, а также оценивать объем распространения опухали в доле, что позволяет классифицировать опухоль по системе TNM.
Морфологические изменения. Пре- и псевдонеопластические изменения
Для описания атипичных изменений в периферической зоне используют термин простатическая интраэпителиальная неоплазия (PIN), в центральной зоне — атипическая аденоматозная гиперплазия.
Все виды атипической гиперплазии предстательной железы — факультативный предрак и должны рассматриваться как возможные предшественники аденокарциномы.
Стадии рака предстательной железы стоит определять не самостоятельно, а с помощью врача. Только проанализировав симптомы, проведя ряд анализов (в том числе инструментальных вроде КТ, МРТ, УЗИ и пр.), можно точно узнать, насколько осложнена онкология. Самим можно только примерно предположить стадии рака простаты – для этого можно воспользоваться информацией из этой статьи.
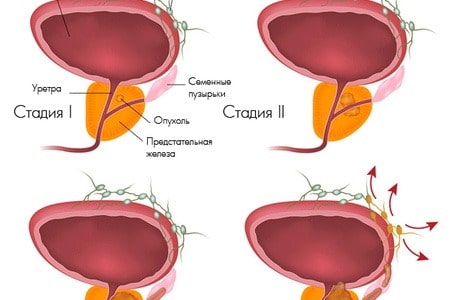
- От чего зависит классификация
- Начальная форма
- Средняя тяжесть
- Запущенный случай
- Последняя степень
От чего зависит классификация
Стадии рака предстательной железы – это четкая классификация. Для обозначения применяют римские цифры:
- I стадия – ранняя форма развития рака предстательной железы с неявными симптомами.
- II стадия – средняя форма онкологии предстательной железы со слабыми симптомами.
- III стадия – тяжелая форма онкологии предстательной железы с четкими симптомами.
- IV стадия – крайне тяжелая форма рака предстательной железы с мучительными симптомами.
Определяется стадия на основе показателей трех систем – TNM, системе Глисона и по уровню Джюит-Уайтмор.
Первая метрика позволяет врачу определить масштаб распространения онкологии, основываясь на трех аспектах процесса роста опухоли (tumor), узлов (nodes) и метастазов (metastasis). Показатель Т определяет, какие размеры у онкологии, показателем N отображается распространение онкологии на лимфоузлы, показатель М означает поражение раком отдаленных тканей, выходящих за границы предстательной железы. Например, если врач определит, что у мужчины T0.N0.M0, то это значит, что нет причин для беспокойства – размеры опухоли не определены, узлы не затронуты, метастазов не выявлено.
Вторая метрика, необходимая для установки стадии рака простаты, – шкала Глисона. Она выстраивается на основе сравнения здоровых и больных клеток в железе. Если внешних различий нет, то ставится 1 балл, при максимальном различии – 5 баллов. Если в предстательной железе раком затронуты разные участки, то для каждого из них устанавливаются свои баллы, которые потом суммируются. В итоге получается градация: менее злокачественные (по шкале Глисона до 6 баллов), средне-злокачественные (по шкале Глисона 6-7 баллов), сильно злокачественные (по шкале Глиссона 8-10 баллов).
Наконец, третья система, помогающая узнать степень онкологии, – Джюит-Уайтмор. Согласно этой методике, стадии надо определять на основе таких показателей, как ПСА, место локализации опухоли и выявление при пальпации.
Задайте вопрос врачу-урологу!

Начальная форма
Опухоль в самом начале развития болезни имеет небольшие размеры. Симптомы не выражены – чаще всего мужчина не испытывает никакого дискомфорта и чувствует себя нормально.
- Показатели TNM первой степени рака простаты могут быть двух типов: 1) IА: (T1.N0.M0) означает наличие опухоли размерами до 2 см в пределах предстательной железы, не распространившейся на лимфатические узлы или другие органы; 2) IВ: (T2.N0.M0) ставится, когда опухоль имеет размеры более 2 см в пределах предстательной железы, но не распространяется на лимфатические узлы или другие органы.
- Шкала Глисона при первой степени рака: количество определенных баллов от 2 до 4, что характерно для слабо дифференцированных опухолей. Ставится при малой однородности ткани предстательной железы, наличии умеренных просветов в структуре железистой паренхимы и отсутствии распространенности (то есть когда опухоль локализована в одном месте).
- Обследование Джюит-Уайтмор при начальном раке простаты: опухоль не определяется при пальцевом ректальном методе обследования, не видно ее и на УЗИ. Значение ПСА от 4 до 10 нг/мл, что не является отклонением от нормы, а лишь говорит о подозрении на рак предстательной железы.
Из-за отсутствия четких симптомов рак простаты первой стадии чаще обнаруживается случайно – например, в ходе операции или при компьютерном обследовании при подозрении на другие болезни предстательной железы и близкорасположенных к ней органов.
Средняя тяжесть
При второй стадии опухоль вырастает в размерах, но локализация больных клеток все еще сосредоточена в границах предстательной железы.
- Показатели TNM на второй стадии рака простаты могут быть двух типов: 1) IIА: (T3.N0.M0) ставится, когда опухоль выходит за пределы предстательной железы, но не распространяется на соседние артерии или вены и не затрагивает лимфатические узлы и соседние органы; 2) IIВ: (T1-3.N1.M0) – при этом показателе размеры опухоли могут быть любыми, но она распространяется на лимфатические узлы и ткани других органов. Артерии и вены при этом не затрагиваются.
- Шкала Глисона на второй стадии рака в простате: количество получаемых при сравнении здоровых и раковых клеток предстательной железы от 5 до 7, что означает высокое количество наиболее агрессивных онкологических участков (несколько участков в простате, подверженных раку, или распространение за границы предстательной железы).
- Обследование Джюит-Уайтмор при второй стадии рака в простате: опухоль прощупывается при пальцевом обследовании, она также становится различимой на УЗИ. При исследовании ПСА выявляется соотношение фракций (свободный + связанный ПСА) – если доля свободного ПСА меньше 15%, то это очень плохой сигнал.
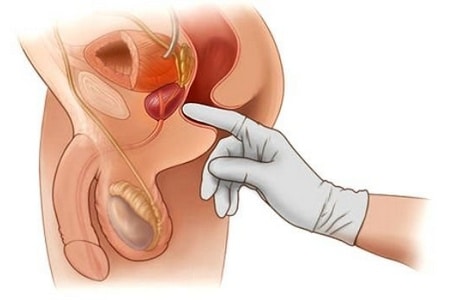
Что касается симптомов, то они, в отличие от первой стадии, начинают проявляться. Мужчину беспокоят боли в нижней части тела, ему трудно ходить в туалет, чувствуется напряжение в районе кишечника, в моче могут присутствовать капли крови. В целом симптомы похожи на признаки простатита и аденомы предстательной железы.
Запущенный случай
Рак простаты третьей степени распространяется на окружающие органы (то есть выходит за пределы предстательной железы). Возможно начало поражения прямой кишки, семенных пузырьков, мочевого пузыря, но лимфоузлы не затрагиваются.
- Показатели TNM на третьей стадии – T4.N1.M0. Это означает, что опухоль распространяется на рядом расположенные артерии, вены.
- Шкала Глисона на третьей стадии: чаще всего характерна масса клеток неправильной формы, с небольшим количеством железистой ткани, что позволяет поставить высокий балл каждому обнаруженному раковому участку.
- Обследование Джюит-Уайтмор при третьей стадии: опухоль хорошо прощупывается при ректальной пальпации. Уровень ПСА повышенный: свободного ПСА становится в районе 10.1 нг/мл, а общего около 58 нг/мл.
Рак третьей степени имеет неприятные симптомы. Пациенты часто жалуются на сильные боли в малом тазу, дискомфорт при мочеиспускании, болезненность в области заднего прохода. С мочой и спермой может выделять кровь. Общее самочувствие у пациента плохое – он резко худеет, чувствует слабость, снижение концентрации, частую тошноту, головокружение, апатию, потерю аппетита.
Последняя степень
Запущенный рак предстательной железы опасен, так как почти не поддается лечению (можно только облегчить симптомы и немного продлить жизнь больного). На этой стадии распространяются метастазы, которыми поражаются соседние органы – кишечник, мочевой пузырь, уретра, лимфоузлы, кости и пр. Причем рак на 4 стадии развивается молниеносно – новые метастазы могут образоваться за несколько дней.
-
Показатели TNM на третьей стадии рака в предстательной железы: T
.M1, то есть опухоль может быть любого размера. Лимфатические узлы, артерии и вены могут затрагиваться или нет, но есть опасные и быстрорастущие метастазы в другие органы.
Симптомы 4 степени тяжелые: пациент испытывает мучительные боли во всех местах, куда метастазировалась опухоль, общее самочувствие плохое, часто происходит нарушение сознания, истощение.
Увы, но очень плохо, если онкология обнаружена уже на запущенной стадии. Прогноз жизни у пациента с четвертой степенью онкологии низкий – только в 20% случаев пациенты живут дольше трех лет. Вот почему крайне важно, чтобы рак был обнаружен сразу, – чем раньше будет диагностирована онкология, тем выше вероятность успешного лечения.
Если у вас остались вопросы, задайте их в комментариях (это абсолютно анонимно и бесплатно). По возможности, я или другие посетители сайта помогут вам.
Читайте также:

