Рак молочной железы her морфологическо
При подтвержденном РМЖ консультация онколога-маммолога Портного Сергея Михайловича — БЕСПЛАТНО .
Всемирная организация здравоохранения, 2012.
- Инвазивный рак без дополнительных уточнений (БДУ)
- плеоморфный рак
- рак с остеокластоподобными стормальными гигантскими клетками
- рак с меланоподобными чертами
- Инвазивный дольковый рак
- классический дольковый рак
- солидный вариант
- альвеолярный вариант
- плеоморфный вариант
- тубулолобулярный вариант
- смешанный дольковый рак
- Тубулярный рак
- Крибриформный рак
- Слизистый рак
- Рак с медуллярными чертами
- медуллярный рак
- атипичный медуллярный рак
- инвазивный рак БДУ с медуллярными чертами
- Рак с апокриновой дифференцировкой
- Рак с перстневидноклеточной дифференцировкой
- Инвазивный микропапиллярный рак
- Метапластический рак
- без специальных черт
- низкодифференцированный железистоплоскоклеточный рак
- фиброзноподобный вариант метапластического рака
- плоскоклеточный рак
- веретеноклеточный рак
- Метапластический рак с мезенхимальной дифференцировкой
- хондроидная дифференцировка
- остеоидная дифференцировка
- другие типы дифференцировки
- Смешанный метапластический рак
- Миоэпителиальный рак
- Редкие типы рака
- Рак с нейроэндокринными чертами
- нейроэндокринноклеточный рак высокодифференцированный
- нейроэндокринноклеточный низкодифференцированный (мелкоклеточный рак)
- рак с нейроэндокринноклеточной дифференцировкой
- Секреторный рак
- Инвазивный папиллярный рак
- Ацинозноклеточный рак
- Мукоэпидермоидный рак
- Полиморфный рак
- Онкоцитарный рак
- Липидоклеточный рак
- Рак богатый гликогеном
- Рак подобный сальноклеточному
- Опухоли подобные опухолям слюнных желез или придатков кожи
- цилиндрома
- светлоклеточная гидроаденома
- Плеоморфная аденома
- Аденомиоэпителиома
- аденомиоэпителиома с раком
- Аденокистозный рак
- Протоковый рак in situ
- Дольковая неоплазия
- Дольковый рак in situ
- Классический дольковый рак in situ
- Плеоморфный дольковый рак in situ
- Атипичная дольковая гиперплазия
- Дольковый рак in situ
Внутрипротоковые Пролиферативные Поражения
- Типичная протоковая гиперплазия
- Цилиндроклеточные поражения, включая плоскоэпителиальную атипию
- Атипичная протоковая гиперплазия
- Внутрипротоковая папиллома
- внутрипротоковая папиллома с атипичной гиперплазией
- внутрипротоковая папиллома с протоковым раком in situ
- внутрипротоковая папиллома с дольковым раком in situ
- Внутрипротоковый папиллярный рак
- Инкапсулированный папиллярный рак
- Инкапсулированный папиллярный рак с инвазией
- Солидный папиллярный рак in situ
- Солидный папиллярный рак с инвазией
Доброкачественные Эпителиальные Пролифераты
- Склерозирующий аденоз
- Апокриновый аденоз
- Микрогландулярный аденоз
- Микрогландулярный аденоз
- Тубулярная аденома
- Лактирующая аденома
- Апокриновая аденома
- Протоковая аденома
- Фиброаденома
- Листовидные опухоли
- доброкачественная
- пограничная
- злокачественная
- перидуктальная стромальная опухоль
- низкой степени злокачественности
- Гамартома
- Аденома соска
- Сирингоматоидная опухоль
- Болезнь Педжета соска
- Рак молочной железы
- Профилактика рака молочной железы
- Лечение рака молочной железы
- Мастопатия
- Выделения из сосков
- Атерома молочной железы
- Киста молочной железы
- Уплотнение в груди
- Узлы в молочной железе

- Боль в области подмышки
- Боль в молочной железе
- Подтянуть овал лица
- Убрать второй подбородок
- Омоложение шеи и зоны декольте
- Устранить дряблость кожи
- Убрать морщины
- Убрать носогубные складки
- Убрать мешки и круги под глазами
- Омоложение влагалища
- Коррекция половых губ
- Лечение недержания
- Избавиться от потливости
- Календарь акций и скидок
- Специалисты клиники
- Отзывы пациентов
Календарь скидок
Москва, м. Проспект Мира, ул. Гиляровского, д. 55
Москва, м. Чкаловская или м. Курская, пер. Подсосенский, д. 20А
Москва, м. Авиамоторная, ул. Лефортовский вал, д. 5, стр. 7
Акции в Frau Klinik!
Звезды в клинике
Подпишитесь на нашу рассылку, чтобы оставаться в курсе акций и новостей клиники:
График работы клиники: ежедневно с 09:00 до 21:00
Посещение клиники с детьми до 12 лет запрещено!
Москва,
м. Проспект Мира,
ул. Гиляровского,
д. 55
Москва,
м. Чкаловская или м. Курская,
пер. Подсосенский,
д. 20А
Москва,
м. Авиамоторная,
ул. Лефортовский вал,
д. 5, стр. 7
Москва, м. Чкаловская или м. Курская, пер. Казарменный, д. 10, стр. 5
Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса Российской Федерации.
Информация о ценах носит уведомительный характер и не является публичной офертой. Стоимость медицинских услуг определяется после очной консультации у специалистов. Действующий прейскурант, заверенный печатью и подписью руководителя, находится на информационном стенде Клиники. Деятельность организации осуществляется на основании действующей лицензии, выданной Департаментом Здравоохранения РФ.
Адъювантная терапия HER-положительного рака молочной железы
Герцептин — первый таргетный препарат, разработанный для лечения больных раком молочной железы (РМЖ) более 10 лет назад.
Процесс производства герцептина начинается с иммунизации мышей фрагментом HER-2-белка, отбора антителопродуцирующих В-лимфоцитов мышей и слияния последних с бессмертными клетками миеломы.
В результате образуются клеточные гибриды, которые могут бесконечно пассироваться в условиях лаборатории и служить неограниченным, хорошо воспроизводимым источником выработки антител.
При введении человеку такие моноклональные антитела (МКАт) вызывают реакцию иммунного отторжения. Для предотвращения иммунологической реакции методом генной инженерии наиболее активную часть мышиного антитела "вырезают" и встраивают в каркас человеческого антитела, в результате получается химерный гибрид с содержанием специфического мышиного фрагмента не более 5%, что позволяет исключить реакцию отторжения (рис. 5).

Рис. 5. Строение гуманизированного МКАт к HER-2 — герцептина.
В результате введения герцептина блокируется путь HER-зависимого сигнального каскада, приводящего к инициации клеточного деления, поддержанию жизнеспособности клеток, инвазии, метастазированию и клеточному делению. Кроме того, препарат обладает антиангиогенной активностью, ингибирует синтез TGF-p, ангиопоэтина-1, ингибитора активатора плазминогена-1 (PAI-1) и, возможно, VEGF. Кроме того, описана индукция герцептином синтеза тромбоспондина-1 (ингибитор ангиогенеза).
В 1998 г. герцептин был зарегистрирован в качестве противоопухолевого препарата для лечения HER-позитивного метастатического РМЖ, сначала во 2-3-й линии лечения метастатического рака молочной железы, затем как компонент 1-й линии терапии в комбинации с паклитакселом (исследования HO648g и HO649g).
Следующим важным этапом стала регистрация в 2006 г. герцептина в качестве первого таргетного прапарата, одобренного для использования в адъювантном режиме у больных РМЖ. В основу регистрации препарата легли результаты исследования HERA (с включением 5081 больного) и исследований NSABP B-31 и NCCTG N9831 (3500 пациенток).
В исследование HERA, проводившееся c декабря 2001 по март 2005 г. в различных центрах мира, была включена 5081 пациентка с ранними стадиями рака молочной железы и гиперэкспрессией HER-2; все пациентки до начала исследования полностью завершили стандартное неоадъювантное или адъювантное лечение: операция ± лучевая терапия; как минимум 4 курса химиотерапии: антрациклины (максимальная кумулятивная доза не более 360 мг/м2 для доксорубицина или не более 720 мг/м2 для эпирубицина) и/или таксаны или CMF.
При наличии положительного рецепторного статуса больным назначали эндокринотерапию в течение 5 лет. Больные были рандомизированы на 3 группы: 1694 пациентки получали герцептин в течение 1 года, 1694 — герцептин в течение 2 лет и 1693 пациентки составили группу контроля (рис. 6).

Рис. 6. Дизайн исследования HERA.
Средний возраст пациенток 49 лет, 2/3 больных имели метастазы в подмышечных лимфатических узлах, у 48% женщин обнаружены негативные в отношении гормональных рецепторов опухоли. Обязательным условием включения больных в исследование HERA было сохранение фракции выброса левого желудочка на уровне 45% и более (по данным эхокардиографии или MUGA).
В группе терапии герцептином было зафиксировано 127 неблагоприятных исходов против 220 в группе наблюдения (табл. 7).
Таблица 7. Исследование HERA: частота неблагоприятных исходов
| Исход | Группа наблюдения, число больных (%) | Группа герцептина, число больных (%) |
| Локальный рецидив | 37 (2,2) | 17 (1,0) |
| Регионарный рецидив | 13 (0,8) | 10 (0,6) |
| Отдаленные метастазы | 154 (9,1) | 85 (5,0) |
| В том числе в: | | |
| мягкие ткани | 19 (1,1) | 6 (0,3) |
| кости | 38 (2,2) | 24 (1,4) |
| ЦНС | 15 (0,9) | 21 (1,2) |
| другие органы | 82 (4,8) | 34 (2,0) |
| Контралатеральный РМЖ | 7 (0,4) | 6 (0,4) |
| Метахронный рак (кроме рака второй молочной железы) | 6 (0,4) | 3 (0,2) |
| Смерть от различных причин, включая РМЖ | 37 (2,2) | 29 (1,7) |
В исследовании HERA показано, что использование герцептина статистически значимо снижало риск развития отдаленных метастазов и тем самым увеличивало выживаемость без признаков заболевания. При применении герцептина не было отмечено случаев смерти от кардиологических причин; появление симптомов сердечной недостаточности любой степени (включая III-IV) отмечено у 1,7% больных, а III-IV степени (по критериям NYHA) — всего у 0,54% больных.
Полученные данные об эффективности и безопасности применения герцептина у больных с ранними стадиями рака молочной железы были подтверждены дальнейшими исследованиями: N9831 под руководством Североамериканской центральной группы по лечению рака (NCCTG) и BCIRG006, проведенное Международной исследовательской группой по изучению РМЖ. Результаты исследований доложены на ежегодном Симпозиуме по проблемам рака молочной железы (SABCS) в Сан-Антонио.
Оба исследования показали, что добавление герцептина к адъювантной терапии (одновременно или в последовательном режиме) при HER-2-положительном РМЖ снижает риск рецидива заболевания на 30% и обеспечивает 5-летнюю выживаемость без признаков прогрессирования болезни более 80% больных.
Таким образом, герцептин является современным безопасным обязательным компонентом адекватной адъювантной терапии HER-2-положительного рака молочной железы, достоверно снижающим риск возникновения рецидивов заболевания и увеличивающим не только длительность безрецидивного периода, но и качество жизни пациенток.
Гормоноположительный рак молочной железы
Рецепторы стероидных гормонов (рецепторы прогестерона (РП) и/или рецепторы эстрогена (РЭ)) экспрессируются на поверхности опухолевых клеток у 70-80% больных РМЖ, чаще у пациенток в менопаузе. Именно для группы гормоноположительного рака молочной железы использование эндокринотерапии является наиболее выигрышным в отношении снижения риска возникновения рецидивов болезни (как локальных, так и генерализованных).
Эстрогены участвуют в инициации, промоции и прогрессии РМЖ, поэтому эндокринотерапия гормоноположительного РМЖ строится на попытках лишить опухолевые клетки стимулирующего влияния эстрогенов. Это может быть достигнуто несколькими путями:
1) конкурирующим захватом РЭ антиэстрогенами, например тамоксифеном;
2) снижением уровня эстрогенов в крови и в самой опухоли с помощью ингибиторов ароматазы (ИА) — в постменопаузе, кастрации (хирургической или лекарственной), в пременопаузе;
3) разрушением рецепторов эстрогена с помощью "чистых" антиэстрогенов, например фульвестранта.
До 2004 г. золотым стандартом адъювантной эндокринной терапии являлся ингибитор РЭ тамоксифен в дозе 20 мг/сут в течение 5 лет. В Оксфордском обзоре Группы по изучению ранних стадий рака молочной железы (Early Breast Cancer Trialists' Collaborative Group) показано, что именно такой режим является оптимальным и позволяет снизить ежегодный риск рецидива болезни (на 41%) и ежегодный риск смерти от ее прогрессирования (на 34%) у больных с гормонозависимыми опухолями.
Группой EBCTCG на основании анализа результатов 15-летней выживаемости пациенток был сделан вывод о том, что эффект от приема тамоксифена реализуется в первые 5 лет, а более 50% рецидивов болезни и смертей, обусловленных прогрессированием, фиксируются после окончания 5-летнего срока адъювантной гормонотерапии. В то же время более длительный прием тамоксифена существенно повышает риск серьезных нежелательных явлений и не приводит к улучшению отсроченных результатов лечения.
Выявленные недостатки существующего стандарта адъювантной гормонотерапии тамоксифеном послужили основанием для инициации ряда исследований, направленных на поиск более совершенных подходов к лечению раннего гормонозависимого РМЖ. Такая возможность появилась с внедрением в клиническую практику ИА.
Продукция эстрогенов в организме обеспечивается ароматазой, энзимом суперсемейства цитохрома Р-450 (продукта гена CYP19), трансформирующей андростендиол и тестостерон в эстрон и эстрадиол.
Ароматаза высоко экспрессируется в плаценте и гранулезных клетках фолликулов яичников, и ее активность зависит от циклической гонадотропиновой стимуляции, поэтому в пременопаузе снижение уровня эстрогенов достигается за счет различных вариантов кастрации (хирургической, лучевой и медикаментозной). В значительно меньшем количестве фермент присутствует в друг их тканях, включая подкожную жировую клетчатку, печень, мышцы и др.
Резидуальная продукция эстрогенов в менопаузе обеспечивается этими неяичниковыми источниками, особенно подкожной жировой клетчаткой (именно поэтому периферическая активность ароматазы и соответственно уровень эстрогенов в плазме крови коррелируют в постменопаузе с индексом массы тела).
Применение ингибиторов ароматазы у больных в постменопаузе обеспечивает эффективную блокаду фермента и подавление синтеза эстрогенов. Предшественником селективных ИА, применяемых в настоящее время, был аминоглутетимид, полностью угнетающий продукцию стероидных гормонов надпочечниками и требующий применения глюкокортикоидов для заместительной терапии.
Путем синтеза и отбора веществ, более избирательно влияющих на продукцию эстрогенов, были получены нестероидные антиароматазные препараты следующих поколений. В настоящее время группа ингибиторов ароматазы включает два обратимых нестероидных ингибитора: летрозол (фемара) и анастрозол (аримидекс) и необратимый стероидный инактиватор экземестан (аромазин).
ИА могут быть использованы только у пациенток с подавленной функцией яичников (в менопаузе или после хирургической или лекарственной кастрации), а использование их у молодых женщин с сохраненной менструальной функцией приведет к повышению уровня эстрогенов, что недопустимо при гормоноположительном раке молочной железы.
Ингибиторы ароматазы убедительно продемонстрировали преимущества в эффективности и токсичности по сравнению с тамоксифеном при лечении диссеминированного гормонозависимого РМЖ, как в 1-й линии гормонотерапии, так и при резистентности к другим препаратам гормонотерапии. В настоящее время изучается использование ИА для адъювантной гормонотерапии РМЖ.
Исследования последних лет продемонстрировали преимущество ингибиторов ароматазы в режиме как монотерапии (исследования BIG и ATAC), так и последовательного использования после эндокринной терапии тамоксифеном (исследования IES, ABCSG8/ARNO-95) у женщин в постменопаузе при ранних операбельных стадиях рака молочной железы.
В исследовании АТАС рандомизировано 9366 женщин в постменопаузе, получающих тамоксифен по 20 мг в день, анастрозол по 1 мг в день или оба препарата одновременно в течение 5 лет. Адъювантная терапия анастрозолом сопровождалась снижением частоты возникновения локальных рецидивов (ЛР) на 17% и отдаленных метастазов на 7% в первые 2-2,5 года, что особенно ценно, так как ранние рецидивы болезни имеют особо неблагоприятное течение и прогноз.
Благодаря этой работе удалось также установить, что одновременное комбинированное применение антиэстрогенов и ИА является нецелесообразным и даже нежелательным вследствие парадоксального увеличения продукции эстрогенов при взаимодействии эндокринных препаратов.
В рандомизированном двойном слепом многоцентровом исследовании IES (Intergroup Exemestane Study) проведено сравнение двух режимов эндокринной терапии: последовательного режима (тамоксифен в течение 2-3 лет, затем экземестан до 5 лет) и монотерапии тамоксифеном до 5 лет у 4742 женщин в постменопаузе c гормоночувствительным РМЖ ранних стадий.
Полученные результаты свидетельствуют о преимуществе режима переключения на экземестан в сравнении с режимом 5-летней терапии тамоксифеном по всем основным показателям. В группе экземестана было продемонстрировано увеличение безрецидивной выживаемости на 24% (р=0,00015), снижение риска развития рецидива и смерти на 25% (HR=0,74; р=0,0001), снижение риска развития отдаленных метастазов на 18% (Roombs, 2007). Кроме того, на 44% снижалась частота контралатерального РМЖ в группе экземестана по сравнению с терапией тамоксифеном (HR=0,56; р=0,04).
В комбинированное Австрийское исследование АBCSG8/ARNO 95 включено 3224 больных при среднем периоде наблюдения 28 мес. Результаты исследования показали, что переключение на анастрозол после 2-3 лет приема тамоксифена пролонгирует и увеличивает "бессобытийную", безрецидивную и общую выживаемость по сравнению с продолжающимся до 5 лет лечением тамоксифеном (HR=0,60; р=0,0009).
Согласно предварительным исследованиям ингибиторов ароматазы летрозол также имеет преимущество в снижении риска отдаленного метастазирования у больных рака молочной железы по сравнению с монотерапией тамоксифеном.
В рамках исследования BIG 1-98 (рандомизированное двойное слепое исследование 3-й фазы, в которое с 1998 по 2003 г. включено 8010 больных в постменопаузе с ранними стадиями гормоноположительного РМЖ) проведено сравнение адъювантной эндокринной монотерапии (тамоксифен или летрозол), а также двух последовательных режимов адъювантной эндокринной терапии: тамоксифен в течение 2 лет с последующей терапией летрозолом в течение 3 лет и летрозол в течение 2 лет с последующей терапией тамоксифеном в течение 3 лет.
При анализе эффективности режимов эндокринной терапии в 4 исследуемых группах (медиана наблюдения 71 мес) не выявлено статистически значимой разницы в показателях безрецидивной, общей выживаемости и времени до прогрессирования.
Процентная доля больных с безрецидивным течением болезни спустя 5 лет после рандомизации в группе монотерапии летрозолом составила 87,9%, в группе последовательной терапии летрозол — тамоксифен -> 87,6%; в группе последовательной терапии тамоксифен — летрозол -> 86,2%.
При анализе показателей 5-летней общей выживаемости в группах получены аналогичные данные: 93,4% в группе монотерапии летрозолом, 92,4% в группе последовательной терапии тамоксифен -> летрозол, 93,7% при последовательном режиме летрозол -> тамоксифен. Не получено статистически значимой разницы при сравнении времени до прогрессирования в изучаемых группах. Немаловажно, что различия в группах отсутствовали независимо от статуса лимфатических узлов.
Согласно дизайну исследования BIG 1-98 у больных оценены суммарная частота рецидивов, включающая частоту локального, регионарного и отдаленного рецидивов, и развитие опухоли в контралатеральной молочной железе. Частота возникновения рецидивов РМЖ в течение 5 лет после рандомизации идентична в группах: 7,3% при монотерапии летрозолом, 7,3% при последовательном режиме летрозол -> тамоксифен и 9,1% в группе последовательного режима тамоксифен -> летрозол, причем вне зависимости от статуса лимфатических узлов.
Частота первых рецидивов рака молочной железы и конкурирующих событий абсолютно идентична в анализируемых группах и наглядно представлена в табл. 8.
Таблица 8. Сравнительная частота рецидивов и конкурирующих событий в группах эндокринной терапии
рак в контралате-ральной молочной железе
метахронный рак (не в молочной железе)
В рамках проведенного анализа было выявлено преимущество летрозола по сравнению с терапией тамоксифеном в снижении доли ранних рецидивов (в течение 2 лет после рандомизации): 2,5% против 4,1%, причем разница в доле ранних рецидивов более выражена у больных с N(+)-статусом лимфатических узлов.
Преимущества в терапии летрозолом имеют пациентки с крупными опухолями и наличием сосудистой инвазии. Согласно данным BIG 1-98, результаты последовательного режима летрозол — тамоксифен соответствовали результатам монотерапии летрозолом, что может быть объяснено переносимой пользой первоначальной терапии препаратом.
Этот факт указывает на возможность переключения на тамоксифен после 2 лет адъювантной терапии летрозолом в случае необходимости с целью завершения 5-летней эндокринной терапии.
Исследование BIG 1-98 показало, что профиль токсичности тамоксифена, летрозола и их комбинированных режимов различен: при приеме тамоксифена чаще отмечены тромбоэмболические осложнения, вагинальные кровотечения, приливы и ночное потоотделение, в то время как при применении летрозола преобладали гиперхолестеринемия, артралгия, миалгия и переломы костей.
В целом во всех группах лечения отсутствовали какие-либо непредвиденные угрожающие жизни нежелательные явления, что делает проведение эндокринной терапии у больных РМЖ в постменопаузе многообещающим.
Таким образом, многочисленные исследования по адъювантной эндокринной терапии гормоночувствительного рака молочной железы показали, что тамоксифен остается эффективным препаратом, снижающим риск рецидива болезни и риск смерти от ее прогрессирования. Применение ИА существенно расширяет возможности адъювантной эндокринотерапии.
Оптимальной стратегией является переход на прием ингибиторов ароматазы после 2-3 лет приема тамоксифена. В качестве ранней адъювантной гормонотерапии ИА могут иметь преимущество перед тамоксифеном у пациенток с высоким риском рецидива, а также при противопоказаниях к приему тамоксифена (гиперпластические процессы в эндометрии, гиперкоагуляция, тромбоэмболии и тромбофлебит в анамнезе и др.).
Необходимо отметить, что даже через 5 лет после адъювантной эндокринной терапии у женщин с ранними стадиями РЭ- и ПЭ-положительного рака молочной железы продолжают развиваться рецидивы болезни. Очевидно, дальнейшие исследования (SOLE; NCT00553410) определят оптимальный срок эндокринной терапии, обеспечивающий максимальный срок жизни больных без признаков заболевания.
И.В. Поддубная, Д.В. Комов, И.В. Колядина
В настоящее время рак молочной железы (РМЖ) является самым распространенным заболеванием у женщин. Ежегодно в мире выявляется более 1,7 миллионов случаев этого заболевания. Существует несколько патогенетических разновидностей РМЖ, которые принципиально отличаются друг от друга по эпидемиологии, факторам риска, ответу на лечение и прогнозам.
Наиболее частой категорией злокачественных образований молочной железы является ER/PgR-позитивный РМЖ. Риск возникновения таких опухолей напрямую зависит от современного образа жизни женщин, важными составляющими которого являются контроль рождаемости и ожирение. Непривычные условия функционирования молочной железы, заключающиеся в отсутствии постоянных беременностей и лактаций, избыточном питании и ведущие к ожирению, нарушают физиологические циклы колебаний уровня стероидных гормонов и обновления клеток.
Факторы риска других разновидностей РМЖ (HER2-позитивных или трижды негативных карцином) изучены в значительно меньшей степени, но их существование напрямую сказывается на результатах скрининга и лечения данного заболевания. Несомненным с точки зрения эпидемиологии является феноменальное улучшение отдаленных результатов лечения рака молочной железы. Смертность от РМЖ с 1990 по 2014 гг. в США упала на целых 34 % — беспрецедентная динамика за период, охватывающий всего лишь четверть века.
Этот колоссальный прогресс связывают с появлением тамоксифена и других препаратов для лечения гормон-чувствительных карцином, внедрением трастузумаба и иных антагонистов рецептора HER2, появлением тестирования генов наследственного рака BRCA1 и BRCA2, совершенствованием химиотерапии и т. д.
К сожалению, столь очевидный прогресс не затрагивает страны с ограниченными ресурсами, которые не имеют полного доступа ко всем разновидностям системного лечения РМЖ. Для лучшего понимания биологии рака молочной железы необходимы знания о факторах риска его развития. К таким относятся:
1. Генетические мутации
В некоторых случаях РМЖ передается в соответствии с классической Менделевской моделью наследования. Самые распространенные гены предрасположенности — BRCA1 и BRCA2, чей вклад в частоту наследственных заболеваний раком молочной железы составляет около 20 %. Исследования на семьях с таким типом карцином продемонстрировали фатальный риск развития рака у носительниц мутаций BRCA. Кроме того, в качестве генов предрасположенности к развитию РМЖ могут быть рассмотрены гены ATM, PTEN, p53 и др., поскольку было отмечено значительное увеличение частоты РМЖ среди их гетерозиготных носительниц.
2. Соматические изменения
Взаимодействие между различными факторами, предрасполагающими к возникновению РМЖ, приводит к аккумуляции соматических мутаций в эпителиальных клетках. Хромосомная нестабильность, проявляющаяся в патологическом количестве крупных хромосомных перестроек, отдельные изменения в генах, ассоциированных с РМЖ — все это служит пусковым механизмом для возникновения соматических изменений. Различные комбинации мутаций и эпигенетических событий являются причиной появления совокупности свойств, характерных для раковых клеток, таких как способность противостоять процессу апоптоза, неограниченное деление и самодостаточность в отношении ростовых факторов, возможность инвазии и метастазирования, непрерывный ангиогенез и т. д.
3. Образ жизни и влияние окружающей среды
Ожирение, сопровождающееся наличием висцерального жира, и постоянный набор веса неразрывно связаны с увеличением риска возникновения РМЖ как до наступления менопаузы, так и после. В тоже время было замечено, что у женщин, ведущих активный образ жизни с регулярными физическими нагрузками, риск возникновения РМЖ после менопаузы меньше. Кроме того, риск возрастает вместе с увеличением потребления алкоголя.
4. Воздействие облучения
Любое облучение грудной клетки (лучевая терапия, атомный взрыв и т.д.) повышает риск заболеваемости раком молочной железы. При этом, риск выше у молодых пациенток и возрастает с увеличением дозы облучения. Например, у девушек моложе 20 лет после лучевой терапии по поводу лимфомы Ходжкина вероятность развития рака в течение 10–30 лет составляет от 20 до 30 %. В связи с этим лучевую терапию злокачественных опухолей у молодых пациенток используют ограниченно. В зависимости от локализации злокачественного образования и молекулярных особенностей его клеток карциномы молочной железы подразделяют на дольковые и протоковые (аденокарциномы специфического и неспецифического типа соответственно).
Кроме того, опухоли, ограниченные базальной мембраной протока или дольки, получили название неинвазивных (карциномы in situ), а образования, обладающие способностью к проникновению через базальную мембрану в строму, назвали инвазивными (опухолевые клетки в строме могут инвазировать сосуды, что является причиной поражения лимфатических узлов и развития отдаленных метастазов).
Неинвазивная протоковая карцинома (DCIS — ductal carcinoma in situ)
Среди всех опухолей молочной железы примерно 20 % составляют неинвазивные протоковые карциномы. Их выявление в большинстве случаев происходит благодаря обнаружению микрокальцификатов. Однако клинически DCIS может проявляться в виде:
- перидуктального фиброза, окружающего патологический очаг;
- инверсии соска при микропапиллярном варианте;
- формирования объемного образования и т. д.
Неинвазивная протоковая карцинома представляет собой скопление злокачественных клеток, окруженных базальной мембраной протоков. Тем не менее DCIS может распространяться за пределы протока и инфильтрировать прилежащие ткани молочной железы. В зависимости от гистологического строения протоковый РМЖ in situ подразделяется на следующие типы:
Комедокарцинома
Опухоль, характеризующаяся наличием очагов некроза, солидных полей плеоморфных клеток с ярко выраженной гиперхроматией ядер и кальцификацией мембран, которые можно выявить при маммографии (линейные и/или ветвящиеся микрокальцификаты). Вследствие обтурации протоков возникает перидуктальный фиброз, сопровождающийся хроническим воспалением.
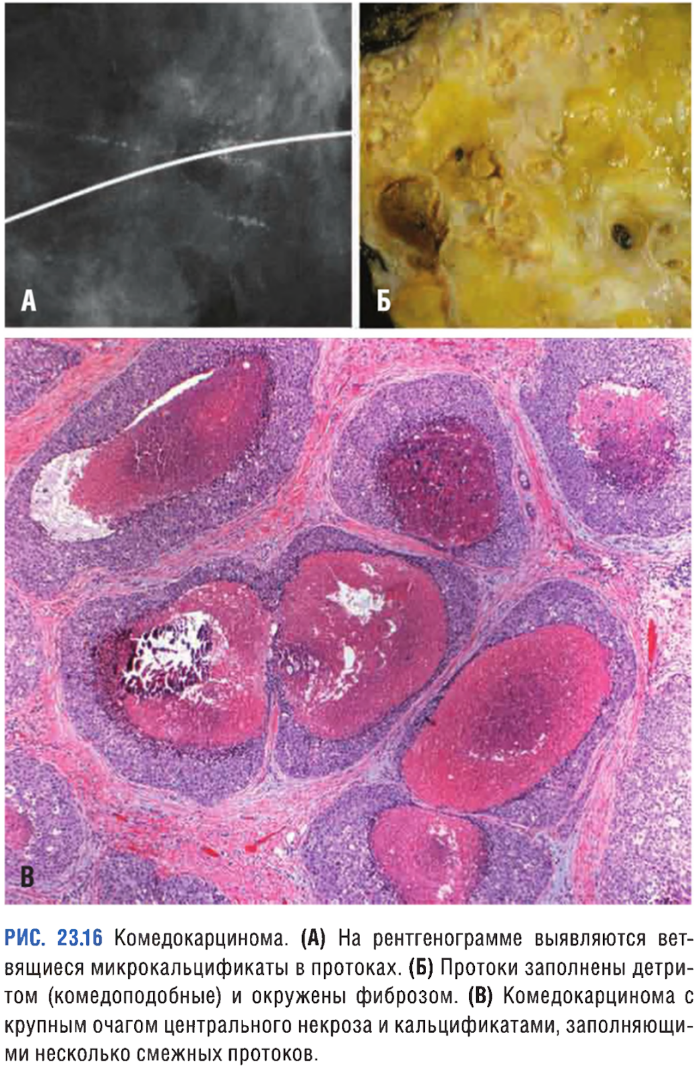
Некомедозные карциномы
Опухоли, отличающиеся отсутствием выраженной атипии у злокачественных клеток:
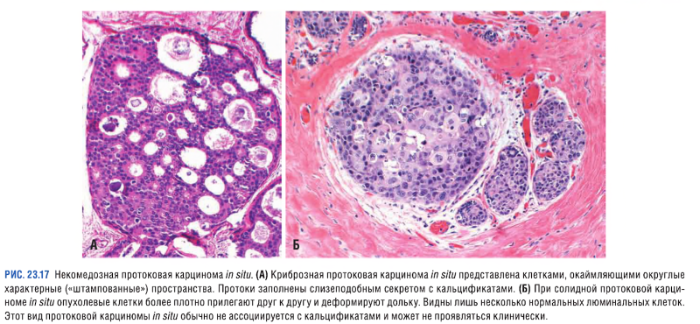
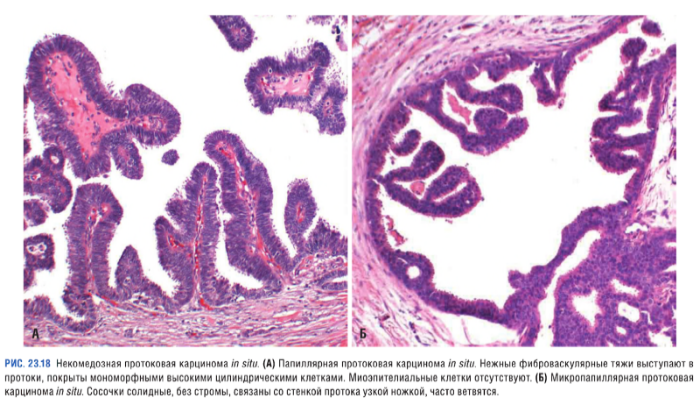
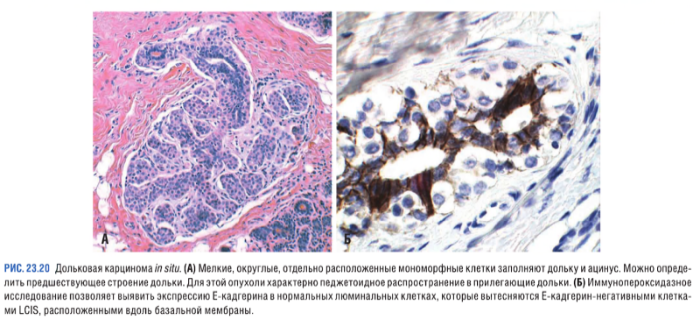
Неинвазивная дольковая карцинома (LCIS — lobular carcinoma in situ)
Такие опухоли клинически никак не не проявляются (микрокальцификаты и уплотнения отсутствуют), поэтому даже после внедрения скрининга распространенность LCIS не изменилась — 1–6 % от общего числа карцином. LCIS характеризуются наличием идентичных атипичных клеток с измененными круглыми ядрами. Клетки достаточно слабо связаны между собой вследствие нарушения экспрессии E-кадгерина, участвующего в образовании межклеточных контактов. Кроме того, клетки неинвазивных дольковых карцином характеризуются негативной экспрессией рецепторов к факторам роста и наличием гиперэкспрессии рецепторов к эстрогенам и прогестероны (ER+/Pgr+, HER2-).
Инвазивные карциномы
Инвазивная протоковая карцинома является самым распространенным типом карциномы и представляет 80 % всех РМЖ. Макроскопически такие опухоли отличаются плотной, твердой консистенцией (объясняется наличием очагов и некроза и скоплениями кальцификатов), разрезание или скобление сопровождается характерным звуком. Карциномы могут содержать клетки различной степени дифференцировки:
- У высокодифференцированных опухолей клетки преимущественно тубулярные, их ядро мелкое и круглое, фигуры митоза встречаются достаточно редко (рис. А).
- При умеренной дифференцировке присутствуют как участки солидного строения, так и единичные инфильтрирующие опухолевые клетки. Митотическое деление встречается намного чаще (рис. Б).
- Для низкодифференцированных опухолей характерно наличие тяжей из клеток, обладающих высокой пролиферативной активностью, и ядер различных размеров (рис. В).
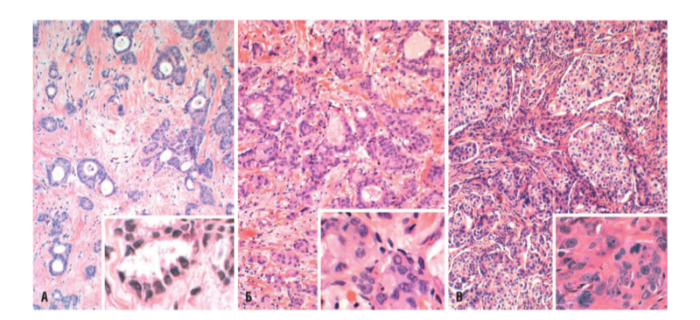
Источник:
Devita Jr V. T., Lawrence T. S., Rosenberg S. A. DeVita, Hellman, and Rosenberg's cancer: principles & practice of oncology. – Lippincott Williams & Wilkins, 2015.
Читайте также:


