Рак метастазы ничего не есть
Самое сложное в онкологии – когда диагностируют метастазы рака в разных органах, а первичного очага не находят. Обратился больной, метастазы рака в легких, в позвонках, в надпочечниках – в одном 10 см, в другом – 4. А где первичная опухоль – неизвестно.
Лечение надо проводить? Надо! А какое лечение? Какая опухоль?
Опухоли сейчас настолько изменились, что даже при иммуногистохимическом исследовании метастазов трудно сказать где очаг. На КТ, МРТ всего тела также не всегда удается его найти, т.к. при шаге срезов в 1,5-2 см легко пропустить большинство начальных опухолей.
Лечение недопустимо затягивается и упускается шанс для направленного противоопухолевого лечения. Таких больных становится все больше…
В таких случаях действовать нужно путем исключения, перебирая все варианты. А чтобы не уходило время, можно, сдерживать рост метастазирования общей электромагнитной гипертермией, и уже параллельно проводить дополнительные обследования, пытаясь найти очаг.
Метастазы рака нужно начинать лечить
Общая электромагнитная гипертермия – универсальное средство лечения онкологии: температурный фактор работает как при высоко- так и при низкодифференцируемых опухолях, независимо от локализации очага и метастаз. Но, его надо стараться дополнить химиотерапией, иммунотерапией для усиления эффекта и получения устойчивого результата.
Химиотерапия в условиях общей гипертермии эффективнее обычной. Принципиальная разница, что действующих фактора при гипертермии два – температура и химиопрепараты. Разогрев больного в температурных интервалах 42,5–43 °С приводит к прямой гибели опухолевых клеток. Вводимые в момент нагрева химиопрепараты дают больший противоопухолевый эффект и снижение токсического действия. В ходе общей гипертермии стимулируется иммунная система организма, которая и сама начинает оказывать сопротивление раку.
Выживаемость при лечении рака с метастазами методом общей гипертермии:
| Диагноз | 1 год | 3 года | 5 лет |
| Рак желудка, 4-я стадия | 57,0 | 26,3 | 21,5 |
| Рак ободочной кишки, 4-я стадия | 64,5 | 15,2 | 15,2 |
| Рак прямой кишки, 4-я стадия | 61,3 | 52,5 | 27,3 |
| Рак молочной железы (с обширными метастазами), 4-я стадия | 86,6 | 50,9 | 49,3 |
| Саркомы мягких тканей, 4-я стадия | 94,2 | 68,2 | 49,8 |
Расчет произведен с даты первого сеанса общей гипертермии для больных, у которых в результате лечения был получен клинический эффект (полная регрессия, частичная регрессия, стабилизация).
Подсчет показателей выживаемости проводился по методу Каплана — Майера. Результаты достоверны (P Рубрики
- Блог профессора Карева И.Д.
- Истории пациентов
- Новости клиники
- СМИ о клинике
- Услуги

- Что такое метастазы?
- Из-за чего возникают метастазы?
- С какой вероятностью возникают метастазы?
- От чего зависит скорость распространения метастазов по организму?
- Как метастазируют различные виды рака?
- Как проявляются метастазы?
- Как диагностируются метастазы?
- Можно ли вылечить метастазы, и что это дает?
- Где лучше лечить рак с метастазами — в Москве, в Израиле или в Германии?
Что такое метастазы?
Современные концепции развития метастазов основаны на том, что метастазы развиваются практически сразу, как только появляется сама злокачественная опухоль. Отдельные оторвавшиеся от нее клетки сначала проникают в просвет кровеносного (гематогенный путь диссеминирования) или лимфатического (лимфогенный путь диссеминирования) сосуда, а затем переносятся с током крови или лимфы, останавливаются на новом месте, выходят из сосуда и растут, образуя метастазы. Вначале этот процесс идет медленно и незаметно, поскольку раковые клетки из материнского очага подавляют активность вторичных очагов.
С момента, когда возникают вторичные очаги, рак называют метастатическим. Процесс распространения раковых клеток называют метастазированием.
Способность к метастазированию — один из ключевых признаков злокачественных опухолей, который отличает их от доброкачественных новообразований.
Из-за чего возникают метастазы?
Будут ли отдельные клетки отрываться от материнской опухоли и формировать метастазы? Опухолевые клетки отрываются и будут отрываться всегда. Местные факторы иммунной системы очень долгое время защищают организм от быстрого роста опухолевых клеток. Вопрос лишь в вероятности возникновения метастазов, а она зависит от типа опухоли, скорости ее роста, степени дифференцировки клеток (насколько они отличаются от нормальных), стадии, на которой был диагностирован рак, и других факторов.
Распространившись, опухолевые клетки долго, на протяжении ряда лет, могут оставаться неактивными или расти очень медленно. Точные механизмы запуска быстрого роста метастазов в организме не изучены.
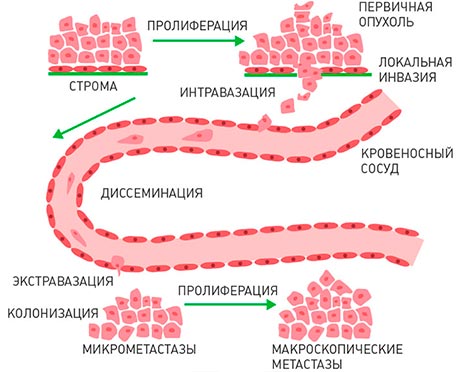
Важен другой факт: по мере увеличения числа клеток в метастазе, они начинают выделять особые вещества - факторы роста. Эти факторы роста стимулируют образование капиллярной сети, что обеспечивает клетки раковой опухоли всеми питательными веществами в ущерб остальным тканям организма.
Можно выделить несколько стадий распространения рака по организму:
- Проникновение опухолевых клеток в ближайший кровеносный или лимфатический сосуд;
- Распространение с током крови или лимфы по различным частям тела;
- Затем раковая клетка останавливается в одном из мелких сосудов и проникает через его стенку в ткани;
- Какое-то время она неактивна или размножается, но очень медленно;
- Бурный рост, разрастание капиллярной сети.
Многие опухолевые клетки погибают на одной из этих стадий. Те, которым удалось выжить, дают начало метастазам.
С какой вероятностью возникают метастазы?

От чего зависит скорость распространения метастазов по организму?
Время, необходимое для клинического проявления первых метастазов, во многом определяется видом опухоли и степенью дифференцировки её тканей.
- Высокодифференцированные опухоли, как правило, метастазируют гораздо реже и позднее, чем низкодифференцированные опухоли.
- В низкодифференцированных опухолях клетки практически утрачивают черты нормальной ткани. Такой рак ведет себя агрессивнее.
Вероятность метастазирования можно снизить при помощи разных методов лечения:
- Химиотерапия. Например, адъювантная химиотерапия проводится после операции и помогает уничтожить раковые клетки, которые, возможно, остались в организме.
- Лучевая терапия.
Существует такое заблуждение, что метастазы возникают из-за проведенных процедуры. Однако, удаление части опухоли или ее биопсия (взятие ткани опухоли на исследование) не повышают частоту развития метастазов.
Как метастазируют различные виды рака?
Наиболее часто метастазы обнаруживаются в лимфатических узлах, печени, легких, существенно реже — в мышце сердца, скелетных мышцах, коже, селезенке, поджелудочной железе. Промежуточное место по частоте обнаружения метастазов при различных видах рака занимают центральная нервная система, костная система, почки, надпочечники.
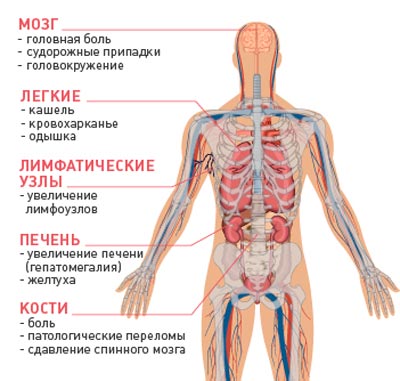
- Метастаз Крукенберга — в яичники;
- Метастаз сестры Марии Джозеф — в пупок;
- Метастаз Вирхова — в лимфоузлы над левой ключицей.
- Рак молочной железы: легкие, печень, кости.
- Рак яичников: брюшина, печень, легкие.
- Рак желудка: печень, брюшина, легкие.
- Рак кишечника (толстой кишки): печень, брюшина, легкие.
- Рак прямой кишки: печень, легкие, надпочечники.
- Рак предстательной железы: кости, легкие, печень.
- Рак матки: печень, легкие, брюшина.
- Рак почек: легкие, печень, кости.
- Рак легкого: надпочечники, печень, второе легкое.
- Меланома: легкие, кожа/мышечные ткани, печень.
- Рак поджелудочной железы: печень, легкие, брюшина.
- Рак щитовидной железы: легкие, печень, кости.
Метастазирование, как правило, происходит в случаях, когда исчерпаны резервы организма в борьбе с опухолью. Метастазы существенно нарушают функционирование всех жизненно важных органов и систем. В подавляющем большинстве смерть онкологических пациентов обусловлена именно метастазами.
Кроме того, метастазы существенно ухудшают общее состояние, нередко сопровождаясь нестерпимыми болями, требующими постоянного обезболивания.
Как проявляются метастазы?
Клиническая картина метастатического рака определяется местом расположения метастазов:
- Поражение брюшины (канцероматоз брюшины) приводит к возникновению асцита, что требует проведения лапароцентеза;
- Поражение плевры (канцероматоз плевры) вызывает развитие экссудативного плеврита, который требует выполнения торакоцентеза;
- Поражение костей и позвоночника ведет к болям в разных частях тела, переломам;
- Поражение легких проявляется в виде одышки;
- Метастазы головного мозга приводят к головным болям, головокружениям, судорогам, нарушению сознания;
- Поражение печени приводит к механической желтухе.
Кроме того, высвобождающиеся в ходе постоянной гибели опухолевых клеток токсины вызывают раковую интоксикацию организма.
Как диагностируются метастазы?
Обзорная рентгенография, ультразвуковое исследование, радиоизотопное исследование, компьютерная томография, магнитно - резонансная томография, позитронно - эмиссионная томография, — все эти методики имеют существенное значение в распознавании метастазов. Эти методики дают возможность уточнить величину, распространенность и характер роста метастазов, их распад, нагноение, прорастание в соседние органы и ткани. Кроме того, эти же методики диагностики позволяют контролировать эффективность лечения по степени регресса метастазов.
Условно можно выделить два этапа диагностики метастазов:
- Первичное обследование, когда только диагностирована основная опухоль;
- Наблюдение у онколога после пройденного лечения. Если изначально метастазы обнаружены не были, а лечение прошло успешно, в будущей все равно придется периодически проходить обследования - есть риск рецидива.
Можно ли вылечить метастазы, и что это дает?
Основной целью активной химиотерапии и лучевой терапии является профилактика возникновения метастазов рака на максимально ранней стадии. Лечение основано на общих принципах лечения опухолей, включая химиотерапию, лучевую терапию, оперативное лечение (при одиночных метастазах).
Лечение метастазов рака имеет определенные сложности. Поэтому в ряде случаев мы проводим лечение метастазов с целью облегчения симптомов и продления жизни. Мы используем системную терапию (химиотерапия, гормонотерапия, таргетная терапия), и местные виды лечения (хирургия, радиотерапия). Лечение тормозит рост опухоли, уменьшает ее размеры, замедляет процесс метастазирования. Это помогает подарить пациенту лишние месяцы, а иногда и годы.
Параллельно проводят поддерживающую терапию, которая помогает справиться с симптомами и побочными эффектами химиотерапии. При болях назначают сильные обезболивающие средства.
За рубежом при метастатических очагах в печени часто используют чрескожную чреспеченочную радиочастотную аблацию. Данная методика доступна нашим пациентам в Европейской клинике.
Как говорилось выше, лечение в таких случаях является средством облегчения состояния пациента. Вероятность достижения ремиссии очень мала.
Мы в Европейской клинике также используем такую методику как эмболизация артерий, питающих крупные метастазы в различных органах.
Узнайте о современных методах лечения метастазов рака в печени, которые применяют врачи Европейской клиники, а также о результатах лечения - историях пациентов Европейской клиники.
Где лучше лечить рак с метастазами — в Москве, в Израиле или в Германии?
Для того чтобы получить наиболее современное и эффективное лечение при раке с метастазами, российскому пациенту не обязательно ехать за границу. В Европейской клинике применяются те же препараты и технологии, что и в ведущих онкологических центрах мира.
Даже если вероятность ремиссии мала, лечение нужно продолжать. Врачи-онкологи Европейской клиники знают, как облегчить страдания пациента, продлить жизнь. Для этого мы используем наиболее современные методики и препараты. Если вы проходите курс лечения в другой клинике, у нас всегда можно получить второе врачебное мнение: иногда подходы разных врачей к лечению метастатического рака сильно различаются.
Выберите врача и запишитесь на приём:

Главный врач Европейской клиники, онколог, к.м.н.
- 25214
- 20,5
- 0
- 11
Метастазы в цельном мозге мыши, обработанном по специальной методике. Красный — MDA-231-D клетки, экспрессирующие mCherry; зеленый — сосуды, помеченные антителами к α-SMA, альфа-актинам гладких мышц [1].
![]()
Мария Рафаева
![]()
Светлана Ястребова![]()
Андрей Панов




Революция в понимании природы метастазирования
Усилия многих онкологов на протяжении последних десятилетий были направлены на установление деталей возникновения и развития рака — механизмов зарождения опухоли и регуляции ее активного роста, формирования благоприятного микроокружения из клеток стромы [2]. Эти знания несомненно привели к разработке новых подходов в терапии онкозаболеваний. Со временем стало понятно, что основная угроза рака заключена в способности к распространению по организму. Так, некоторые раковые клетки первичной опухоли (то есть развившейся изначально) отделяются от нее за счет эпителиально-мезенхимального перехода или других механизмов [3] и, попадая в кровоток или лимфоток, по маленьким капиллярам путешествуют в главные магистрали сосудистой системы. Они покидают ее за счет задержки в узких капиллярах органов, адгезии к их эндотелиальной стенке и выхода из просвета сосуда в строму органа (рис. 1). Лишь небольшой процент раковых клеток, покинувших первичную опухоль, преуспевает в этом процессе и выживает в новой среде. Эти клетки формируют будущие очаги роста опухоли в новых органах — метастазы.
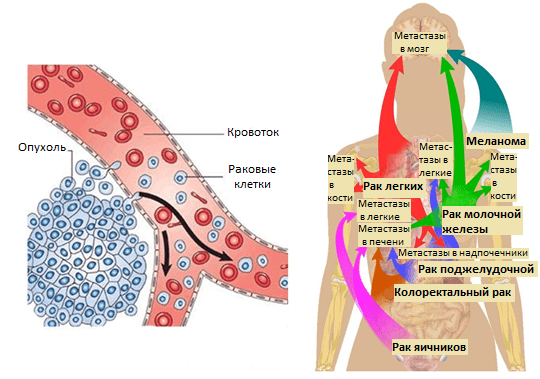
Рисунок 1. Метастазирование и пути рассеивания раковых клеток.
Рисунок 2. Основоположники учений о метастазировании: английский хирург Стивен Педжет (слева) и американский патолог Джеймс Юинг (справа).
Наконец в 1970-е годы в ходе нескольких экспериментов по инъекции радиоактивно меченных раковых клеток мышам Исаак Фидлер смог доказать, что результат метастазирования также зависит от природы раковых клеток. В этом случае клетки меланомы развивали метастазы только в легких, но не в печени, в сосудах которой они также задерживались, но позже не выживали [5].
Позднее было установлено еще больше фактов, подтверждающих, что раковые клетки разной природы метастазируют преимущественно в определенные органы и иногда даже в заданной последовательности. Например, клетки рака молочной железы — сначала в кости, печень, лимфатические узлы, легкие, а потом уже в мозг; клетки рака желудочно-кишечного тракта и яичников — в печень и легкие; рака простаты — в основном, в кости (рис. 1). Явление специфичного распределения метастазов по организму назвали органотропией метастазирования. Чаще всего метастазы встречаются в легких, печени и костях.
Несмотря на активные исследования, в онкологии все еще остается много вопросов без ответа. Отличаются ли метастазные раковые клетки от других клеток первичной опухоли? Что лежит в основе органотропии? Как метастазам удается выжить после удаления первичной опухоли и проведенной химиотерапии?
Генетическая и эпигенетическая гетерогенность при метастазировании
Генетическая информация лежит в основе программирования поведения клетки. Перерождение нормальных клеток организма в раковые (злокачественная трансформация) обусловлено мутациями в генах-драйверах, которые приводят к неконтролируемому клеточному делению. Помимо таких выгодных для опухолевых клеток мутаций, также происходят мутации в генах-пассажирах, то есть тех, что изначально не имеют влияния на рост опухоли. С каждым поколением, новым клоном внутри опухоли, накапливаются эти генетические изменения, и некоторые клоны преуспевают больше остальных, что стало основой для формирования представления об эволюции внутри опухоли. Одна из предложенных гипотез, почему некоторые клетки опухоли приобретают способность к метастазированию, основана на схожем со злокачественной трансформацией принципе. По всей видимости, у них тоже накапливаются мутации в генах-драйверах, которые запускают этот процесс. Однако экспериментального подтверждения она так и не нашла, ученые сходятся во мнении, что большинство клеток первичной опухоли способны метастазировать. А вот что происходит позже с геномами метастазных клеток?
В результате сравнения геномов клеток первичных опухолей молочных желез и их локальных (в ближайших лимфатических узлах) и отдаленных метастазов (в печени, легких, дальних лимфатических узлах) было установлено, что геномы метастазов продолжают эволюционировать в своих очагах роста независимо от первичной опухоли [6]. Интересно, что паттерн мутаций схож между метастазами в одном органе, но различен между метастазами в разных органах. Это означает, что раковые клетки на самом глубоком уровне адаптируются к новому микроокружению в зависимости от занятой ими ниши. Изучение генетических изменений при метастазировании рака поджелудочной железы выявило наличие разных субклонов (новых поколений клона), которые формируют метастазы. Однако различия между ними оказались не больше, чем между двумя случайно взятыми клетками одного организма [7].
Интересно, что обнаружили как минимум один ген, FBXW7, мутации в котором противодействуют метастазированию [8]. Происходит это за счет усиления провоспалительной реакции, пролиферации и активности T-лимфоцитов, которые стимулируют формирование адаптивного иммунитета к опухолевым клеткам. Таким образом, мутации в гене FBXW7 противодействуют опухолевой иммунносупрессии. Ее проявления, такие как уменьшение количества лимфатических сосудов и эффекторных T-лимфоцитов в первичной опухоли, связаны с лицензированием метастазирования [8].
Следующую ступень в регуляции экспрессии генов после непосредственных изменений в ДНК (мутаций, вариаций числа копий и т.д.) занимают эпигенетические изменения (метилирование гистонов, ДНК и др.) (рис. 3). По своей природе они более пластичны, более переменчивы по сравнению с генетическими изменениями и подвластны влиянию клеточной сигнализации, которая подстраивается под воздействие внешних факторов. Оказалось, что эпигенетический код значительно отличается в клетках метастазов по сравнению с первичной опухолью. При раке поджелудочной железы потеря большого количества меток неактивного хроматина (гетерохроматина) — метилирования гистонов (H3K9, H4K20) — и ослабление метилирования ДНК связаны с метастазированием. Эти модификации в раковых клетках переводят участки гетерохроматина в активное состояние, доступное для транскрипционных факторов, и в результате усиливают экспрессию генов онкогенеза, таких как регуляторы мезенхимального фенотипа, KRAS-сигнализации и метаболизма [9].
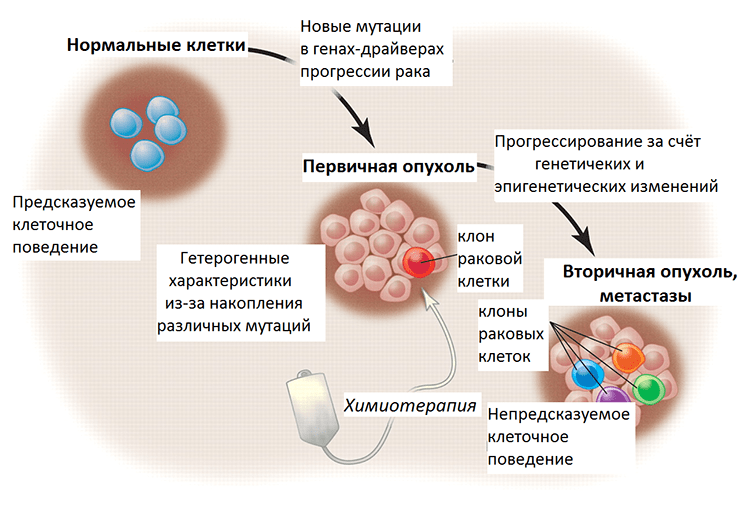
Рисунок 3. Злокачественная трансформация и прогрессирование рака в перспективе генетических и эпигенетических изменений. Нормальные клетки ткани имеют предсказуемое поведение — темпы пролиферации, срок жизни, характер взаимодействия с другими клетками. При злокачественной трансформации накапливаются мутации, и постепенно опухоль становится генетически гетерогенной (состоит из нескольких клонов, поколений раковых клеток). Химиотерапия уничтожает некоторые клоны, тогда как другие, с выгодными в новых условиях мутациями, выживают и создают новых клонов. Их поведение уже непредсказуемо, так как генетические и эпигенетические изменения этих раковых клеток привели к приобретению ими новых свойств.
Метаболическая пластичность при метастазировании
Эпигенетическая регуляция является одним из важнейших механизмов программирования клеточного метаболизма. С ростом опухоли внутри нее образуются области с недостаточным снабжением кислородом (гипоксией), так как до них не доходят кровеносные сосуды. Это вызывает в раковых клетках активацию гена фактора, индуцируемого гипоксией (HIF-1α). Происходит это за счет эпигенетического освобождения, деметилирования промотора гена, который становится доступным для транскрипционных факторов. Усиленное образование и активность белка HIF-1α, в свою очередь, регулирует экспрессию генов множества метаболических ферментов и транспортеров, что приводит к комплексным изменениям метаболизма раковых клеток и поддерживает их потребности.
Клеточный метаболизм разделен на процессы расщепления с выделением энергии (катаболизм) и образования соединений с использованием энергии (анаболизм). Энергетический обмен клетки протекает за счет этапов клеточного дыхания — гликолиза, цикла трикарбоновых кислот и окислительного фосфорилирования. Раковые клетки по-своему приспосабливаются к сохранению продуктивности энергетического обмена в условиях недостатка кислорода. В первичной опухоли они, в основном, используют анаэробный гликолиз, а не окислительное фосфорилирование, как в нормальных клетках. Это усиленное поглощение глюкозы с преобразованием до лактата, выделяемого раковыми клетками, названо эффектом Варбурга. Он позволяет им выжить при гипоксии и активно пролиферировать за счет использования промежуточных соединений для биосинтеза и выделения энергии [10].
Преимущественный способ генерирования энергии у метастазов, однако, до сих пор мало изучен. Используя клетки рака молочной железы, обладающие широкой или специфической органотропией при метастазировании, ученые обнаружили различия в метаболизме первичной опухоли и метастазов. Раковые клетки, колонизировавшие кости и легкие, активировали использование окислительного фосфорилирования, колонизировавшие печень — гликолиз. Когда раковые клетки колонизировали все вышеперечисленные очаги, они активировали сразу оба метаболических пути (рис. 4) [11]. Похоже, что такая пластичность помогает раковым клеткам освоить новые ниши для колонизации. Например, в печени гликолитический фенотип поддерживается при росте метастазов за счет активности упомянутого ранее фактора HIF-1α, а также повышенной экспрессии белка PDK1. Это фермент, который ингибирует формирование соединения ацетил-КоА. И так как его поток на развилке с гликолитическим путем в цикл трикарбоновых кислот уменьшается, усиливается образование конечного продукта гликолиза — лактата [12].
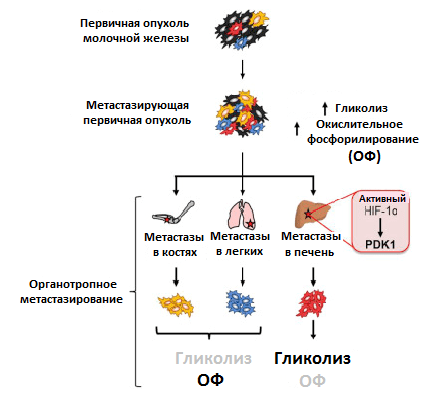
Рисунок 4. Различия в метаболизме первичной опухоли и метастазов в разных органах. Условные обозначения: ОФ — окислительное фосфорилирование; HIF-1α — индуцируемый гипоксией фактор 1; PDK1 — пируватдегидрогеназный комплекс 1.
Почему же для метастазов в одном органе выгоднее использовать преимущественно один вид метаболизма, чем другой? Ответ на этот вопрос и роль различных факторов в регуляции метаболической пластичности раковых клеток еще только предстоит узнать.
Понятие о преметастазных нишах
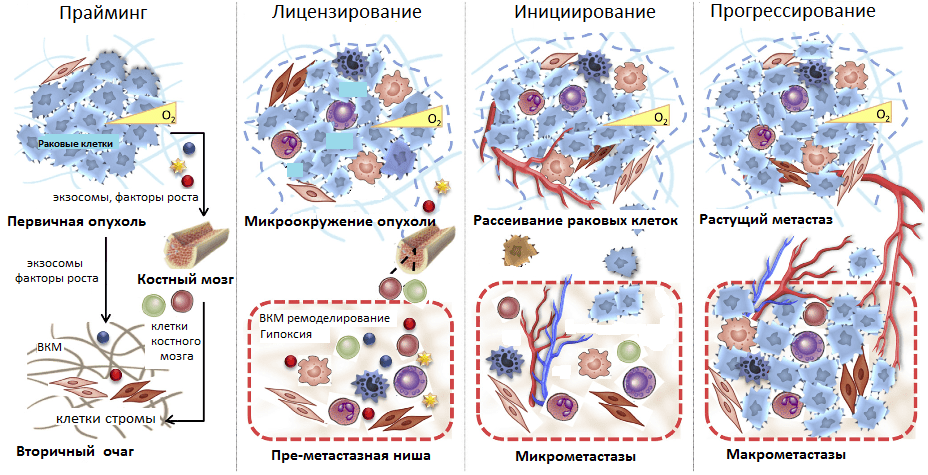
Рисунок 5. Стадии развития метастазов. Прайминг, или обучение, будущего вторичного очага роста первичной опухолью; лицензирование — иммуносупрессия первичной опухоли, создание благоприятного микроокружения в преметастазных нишах; инициирование — начало метастазирования и освоения преметастазной ниши; прогрессирование — рост метастазов во вторичном очаге.
Таким образом, в текущем представлении формирование метастазов происходит в несколько стадий. Начиная с раннего роста первичной опухоли происходит прайминг — обучение будущих ниш развития метастазов с помощью выделения различных факторов раковыми клетками, привлечения клеток из костного мозга. Затем клетки стромы первичной опухоли и преметастазных ниш (фибробласты, клетки миелоидного ряда, T-лимфоциты) формируют благоприятное микроокружение, лицензируя дальнейшее расселение метастазов. Фаза инициирования метастазирования заключается в росте сосудов, ангиогенезе, по которым метастазные клетки покидают первичную опухоль и приходят в преметастазные ниши. Прогрессирование — это финальный этап перехода микрометастазов в макрометастазы — вторичные сформированные опухоли. Он может занять от нескольких месяцев до нескольких лет (рис. 5).
Гетерогенность в механизмах формирования преметастазных ниш
При некоторых типах рака, таких как меланома, для успешного метастазирования в лимфатические узлы и органы необходимо формирование новых лимфатических сосудов в их преметастазной нише. Недавно ученые установили, что такой лимфангиогенез начинается на ранних стадиях роста первичной опухоли, и медиатором его запуска является фактор роста мидкин, секретируемый клетками меланомы в составе экзосом или в свободном виде [19].
Безусловно, механизмы формирования преметастазных ниш в комплексе позволяют лучше понять развитие рака и не перестают удивлять своей сложностью.
Причины органотропии
Описанные различия в специфичных механизмах формирования ниш могут служить одним из объяснений органотропному метастазированию, но как раковые клетки, которые могут метастазировать сразу в несколько органов, выбирают только один из них?
Именно они адресуют доставку экзосом в определенный орган, который преимущественно имеет этот специфический ВКМ-белок в составе стромы. Сливаясь с мембранами клеток стромы того или иного органа, экзосомы доставляют содержимое и запускают свою программу: в фибробластах легких — через экспрессию одних генов S100, в клетках Купфера в печени — через экспрессию других. Активность этих генов стимулирует клеточную сигнализацию и воспалительные реакции, которые занимаются обучением преметастазной ниши (рис. 6) [21].
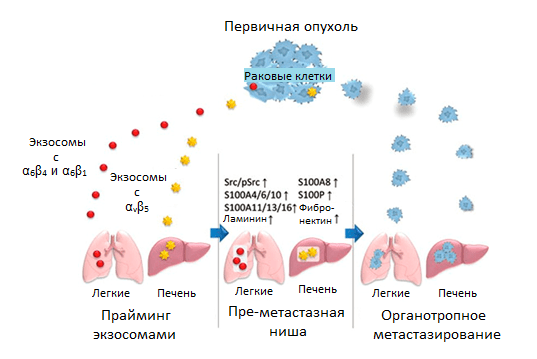
Рисунок 6. Регуляция органотропного метастазирования с помощью прайминга преметастазной ниши экзосомами со специфическими рецепторами интегринами. Условные обозначения: α6β4 и α6β1 — гетеродимеры интегринового рецептора; Src/pSrc — пропорция неактивной/активной форм киназы.
Перспективы в терапии метастазирования
Подведем итог: описанные здесь механизмы, очевидно, усложняют картину течения онкозаболеваний и развития тактик их лечения. Важно подчеркнуть, что гетерогенность первичной опухоли и метастазов по ряду рассмотренных здесь признаков (генетическая, метаболическая, нишевая) дает понимание того, что следует использовать комбинированное и таргетное лечение на разных стадиях течения болезни. Как подтверждение тому — результаты одного из последних исследований, проведенных на материалах пациента с рецидивами между курсами длительной иммунотерапии. Сравнение популяций T-лимфоцитов из микроокружения разных метастазов показало, что они гетерогенны [22] и, следовательно, первичная, вторичные и т.д. опухоли по-разному отвечали на лечение.
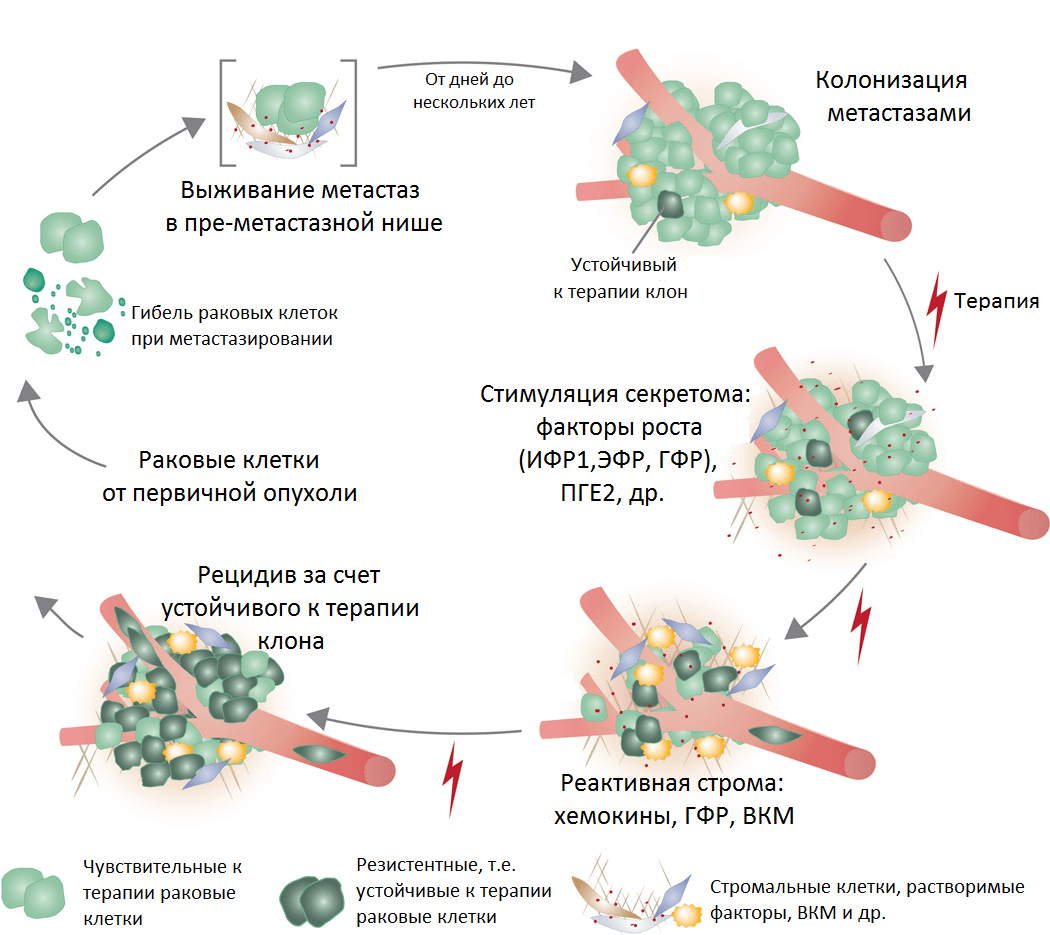
Рисунок 7. Реакция метастазов на терапию, образование резистентности и развитие рецидива. Условные обозначения: ИФР1 — инсулиноподобный фактор роста; ЭФР — эпидермальный фактор роста; ГФР — фактор роста гепатоцитов; ПГЕ2 — простагландин 2; ВКМ — внеклеточный матрикс.
Обнаружение преметастазных ниш и понимание их устройства предложили по-новому взглянуть на развитие подходов в терапии. Если бы стало возможным предотвратить формирование преметастазных ниш, то с большой вероятностью было бы остановлено метастазирование, а значит, и возможность ремиссии. Будем и дальше следить за прорывами в этой области.
Читайте также:




