Рабдоидная опухоль что это такое
Рабдоидная опухоль почки – одна из самых агрессивных и смертельных злокачественных опухолей в детской онкологии. Несмотря на то, что рабдоидные опухоли исторически относились к опухолям Вильмса, в настоящее время многие исследователи отделяют эту опухоль от опухоли Вильмса. В отличие от опухоли Вильмса, рабдоидные опухоли характеризуются локальными и отдаленными метастазами и устойчивостью к химиотерапии уже на ранних стадиях. И более того, в то время как общая выживаемость пациентов с опухолями Вильмса превышает 85%, выживаемость лиц с рабдоидными опухолями составляет всего 20-25%.
Рабдоидная опухоль почки. Причины
Мутации или делеции в генах SMARCB1, INI1 играют важную роль в развитии рабдоидной опухоли почки.
Рабдоидная опухоль почки. Симптомы и проявления
- Боль трудно оценить, поскольку средний возраст в котором диагностируется рабдоидная опухоль почки составляет всего около 11 месяцев. Тем не менее, суетливость наблюдается у большинства детей, это часто наталкивает врачей на мысль, что дети в таком раннем возрасте все-же чувствуют боль.
- Макрогематурия встречается примерно у 60% пациентов. В отличие от этого, только у 20% пациентов с опухоль Вильмса наблюдается макрогематурия.
- Лихорадка развивается у 50% пациентов, по сравнению с 25% пациентов с опухолью Вильмса.
- Целых 20% пациентов с рабдоидной опухолью почки имеют метастазы в ЦНС.
Рабдоидная опухоль почки. Диагностика
- Лабораторные анализы.
- КТ, МРТ.
- Окончательный диагноз ставится путем проведения гистологического анализа.
Рабдоидная опухоль почки. Лечение

Рабдоидная опухоль почки
Дети с рабдоидной опухолью должны быть направлены к детскому хирургу с опытом работы в онкологической хирургии. Если опухоль односторонняя, то хирурги (скорее всего) выполнят радикальную нефрэктомию с субтотальной уретерэктомией. Опухоль должна быть удалена целиком, чтобы можно было избежать утечки ее содержимого в брюшную полость. Если опухоль охватывает только верхний полюс почки, то хирурги удалят только надпочечник.
Близлежащие лимфатические узлы, кровеносные сосуды и другие ткани / структуры также должны быть удалены, даже если они выглядят нормально. Если опухоль двусторонняя или неоперабельная, онкологи могут инициировать предоперационную химиотерапию для уменьшения злокачественных масс в размере и для облегчения последующей резекции.
После того, как рабдоидная опухоль будет удалена хирургическим путем, онкологи приступят к химиотерапии. Исторически сложилось так, что рабдоидные опухоли лечат так-же как и опухоли Вильмса. Основные химиотерапевтические препараты, которые применяют в лечении этого рака, включают: винкристин, актиномицин, доксорубицин с или без циклофосфамида. С применение этих средств, по некоторым оценкам, выживаемость пациентов с рабдоидной опухолью составляет только 23%.
В попытке улучшить эти результаты, исследователи решили изменить схему лечения на карбоплатин-этопозид в чередовании с циклофосфамидом. Тем не менее и этой стратегией также не удалось улучшить результаты.
Так-же имеются отдельные данные, свидетельствующие о выгоде от использования лучевой терапии в рамках комплексного лечения рабдоидных опухолей почек. Суммарные дозы (в эспериментах) составляли от 1080 до 3500 сГр (сантигрей). Тем не менее, оптимальную дозу еще предстоит определить.
Рабдоидная опухоль почки. Осложнения
- Осложнения, связанные с опухолевой прогрессией: злокачественные опухоли могут быстро метастазировать в легкие, печень и головной мозг. Рабдоидные опухоли почек могут быть связаны с спонтанным кровоизлиянием и органной недостаточностью.
- Осложнения, связанные с лечением:
- Гематологические осложнения: основным осложнением химиотерапии является миелосуппрессия. Миелосуппрессия повышает риск развития серьезных инфекций. Такие пациенты требуют частых переливаний крови.
- Почечные осложнения: пациенты могут иметь дисфункцию почечных канальцев.
- Сердечные осложнения: некоторые химиотерапевтические препараты могут вызвать аритмию и сердечную недостаточность.
- Гонадные осложнения: ифосфамид и циклофосфамид связаны с риском развития бесплодия.
- Вторичный рак.
Рабдоидная опухоль почки. Прогноз
- Прогноз для детей плохой.
- Есть надежда, что новые мульти-институциональные клинические испытания помогут в выявлении новых методов лечения, которые улучшат результаты лечения больных с этими опухолями.
Кроме того, из-за большого количества редких заболеваний, информация по некоторым расстройствам и состояниям может быть изложена только в виде краткого введения. Для получения более подробной, конкретной и актуальной информации, пожалуйста, свяжитесь с вашим персональным врачом или с медицинским учреждением.
Рабдоидная опухоль печёночной паренхимы – самое редкое, имеющее наибольшую агрессивность новообразование смешанного типа. Саркомоидальный рак обычно диагностируют у малышей до двух лет, но в некоторых, исключительно редких, случаях рабдоидная опухоль может поразить секреторный орган более старших детей или молодых людей, не достигших тридцатилетнего возраста.
Опухолевые структуры такого типа могут поразить любую часть человеческого организма. В случае, когда новообразование развивается из клеток печени, его в клинической практике называют экстраренальная рабдоидная опухоль.
Рабдоидная опухоль печени у детей
Основными особенностями развития рабдоидной опухоли считается:
- стремительный темп роста и очень раннее метастазирование;
- низкая дифференциация клеток, обуславливающая высокую агрессивность;
- невосприимчивость мутировавших структур к таргетной терапии и высокая смертность.
Рабдоидная опухоль отличается от большинства злокачественных новообразований, поражающих печень, тем, что чаще всего возникает в период внутриутробного развития. Основная его особенность заключается в том, что предпосылкой для начала процесса малигнизации служат появившиеся при формировании эмбриональных тканей секреторного органа зародыша нарушения.
Стоит знать! По утверждению специалистов рабдоидная опухоль печени у детей развивается из остановившихся в своём развитии на эмбриональном уровне тканей. Практически все зародышевые тканевые структуры располагаются дистопично, то есть они пока не успели занять положенное им анатомическое место, чем и обуславливается их классификационное подразделение.
Классификация
Рабдоидная опухоль печени, как и любая злокачественная структура, для подбора наиболее оптимального курса терапии должна быть классифицирована. Её классификация имеет непосредственную зависимость от развития. В связи с тем, что эмбриональные ткани располагаются до определённого времени не на своих анатомических местах, опухоль, обнаруженная в печени, может быть зарождённой не только из печёночных клеток.
Именно поэтому рабдоидная опухоль подразделяется:
- Первичная патология развивается из тех зародышевых клеток, из которых в будущем будет состоять паренхима секреторного органа. Она в клинической практике встречается достаточно редко и исключительно у детишек младенческого возраста. Внешне первичное новообразование выглядит как бугристая структура, а из-за его быстрого роста происходит практически моментальная компрессия печёночной паренхимы и деформация органа.
- Вторичная злокачественная рабдоидная опухоль встречается чаще первичной. Она может быть диагностирована, как у маленьких детей, так и у молодых людей. Происхождение её обусловлено тем, что в печёночные ткани метастазировали раковые клетки эмбрионального происхождения из других органов. Злокачественные очаги при вторичном поражении бывают не только единичными, но и множественными. В последнем случае форма секреторного органа изменяется до неузнаваемости.
Причины возникновения рабдоидной опухоли печени
О том, что может спровоцировать генную мутацию зародышевых клеток, науке до сих пор не известно. Специалисты не дают точного ответа на вопрос, почему развивается недуг, но в настоящее время доказано, что рабдоидная опухоль печени у детей может возникнуть под воздействием некоторых факторов риска. Под их влиянием повышается вероятность появления в печени эмбрионального злокачественного новообразования.
Основными в клинической практике принято считать:
- ведение будущей матерью нездорового образа жизни, приводящего к появлению нарушений развития секреторного органа плода;
- длительный и бесконтрольный приём сильнодействующих лекарственных препаратов, в особенности антибиотиков;
- проживание в местности с плохой экологией или повышенным радиационным излучением;
- некоторые глистные инвазии, поражающие непосредственно печёночную паренхиму;
- генетический фактор – наличие в анамнезе родственников онкопатологий.
Помимо этого, причины возникновения рабдоидной опухоли печени могут крыться в преждевременной родовой деятельности. Если ребёнок рождается недоношенным, его печёночные ткани не успевают полностью сформироваться, что становится предпосылкой для появления в печени младенца злокачественного новообразования эмбрионального типа.
Рабдоидная опухоль печени: симптомы и проявление
Онкология любого органа очень коварна, так как развивается практически полностью незаметно. Опаснее всего такое её поведение при печёночных поражениях – на первых этапах, лучше всего поддающихся терапии, симптомы рабдоидной опухоли печени заметить сложно, поэтому практически у 80% маленьких пациентов заболевание выявляют слишком поздно. На III или IV стадии, после появления ярко выраженных клинических признаков, шансов на продление жизни малыша остаётся слишком мало.
Чтобы уберечь кроху от преждевременной смерти, онкологи настоятельно рекомендуют родителям обращать внимание на следующие проявления:
- значительное увеличение размеров животика и прощупываемое в нём уплотнение;
- отсутствие аппетита, сопровождающееся резкой потерей веса;
- желтушность кожи и постоянный плач ребёнка.
Важно! Такого варианта новообразования, как доброкачественная рабдоидная опухоль печени, не существует. Опухолевая структура этого типа всегда носит исключительно злокачественный характер с высокой агрессивностью, поэтому при появлении минимальной подозрительной симптоматики необходимо предпринимать экстренные меры. Любое, даже самое незначительное и неспецифическое проявление рабдоидной опухоли печени не должно быть проигнорировано. Длительность жизни при этом заболевании напрямую зависит от своевременности его обнаружения.
Стадии злокачественного процесса
Любая онкология развивается постепенно. До достижения конечной, неизлечимой стадии рабдоидной опухоли печени должно пройти несколько этапов, каждый из которых характеризуется своими клиническими и гистологическими проявлениями:
- 1 стадия. Онкоопухоль имеет чёткое ограничение от здоровых тканей и небольшие размеры. Инвазия во внутренние слои печёночной паренхимы и прорастание стенок кровеносных сосудов не наблюдается. Также отсутствуют метастазы и нет клинической симптоматики.
- 2 стадия. Новообразование увеличивается в размерах и начинает прорастать вглубь органа, но за его пределы не выходит. Границы опухолевой структуры становятся нечёткими. Отмечается начало разрушения стенок кровеносных и лимфатических сосудов, но близлежащие и отдалённые метастазы отсутствуют. Появляются первые незначительные симптомы.
- 3 стадия. Опухоль достаточно большого размера и начинает прорастать в брюшную полость, поражая близлежащие органы и ткани. Появляются одиночные метастазы в регионарных лимфатических узлах. Клинические признаки болезни становятся достаточно яркими.
- 4 стадия. Злокачественная структура становится гигантских размеров и зачастую занимает весь секреторный орган единым конгломератом. Метастазы через лимфо- и кровоток распространяются по всему организму ребёнка. Поражению ими подвергается даже костная система. Симптоматика патологического состояния становится невыносимо мучительной.
Диагностика заболевания
Лечение рабдоидной опухоли печени можно проводить только после того, как будут уточнены все нюансы протекания заболевания. Это связано с коварством онкоопухоли и изменением её гистологического состояния на каждом этапе развития. Чтобы наиболее точно определить классификацию и степень онкопроцесса, диагностика рабдоидной опухоли печени проводится с применением определённых методик. Основной диагностический тест – выявление наличия в плазме крови онкомаркера, которым при этом заболевании является эмбриональный альфа-фетопротеин.
Если его количество повышено, назначаются дополнительные инструментальные исследования, позволяющие уточнить характер опухоли и стадию её развития:
- УЗИ. С помощью ультразвука специалисты достаточно точно определяют интенсивность роста злокачественной опухолевой структуры.
- Компьютерная или магнитно-резонансная томография. Данные лучевые методы исследования применяют для уточнения стадии онкоопухоли и определения её характера. Также с помощью этих методик устанавливается наличие метастазов в брюшной полости и области малого таза.
- Диагностическая лапароскопия. Данная процедура позволяет специалистам взять биопсийный материал для дальнейшего гистологического исследования. Данное исследование считается основным, так как позволяет уточнить все характеристики новообразования.
- Рентгенография грудной клетки и сканирование скелета дают выяснить, присутствуют или отсутствуют метастазы в дыхательной и костной системах.
Лечение рабдоидной опухоли печени
Для избавления малышей от рабдоидной опухоли современная медицина применяет в онкологической клинической практике комплексную терапию, подобранную каждому маленькому пациенту в индивидуальном порядке. В случае своевременного обнаружения злокачественной структуры основой любого лечебного протокола становится хирургическое вмешательство.
Операция, с помощью которой удаляется рабдоидная опухоль печени у детей, подбирается в зависимости от места локализации онкоопухоли и степени её распространённости по паренхимальным тканям. Операционное лечение выполняется только в том случае, когда опухоль располагается в боковых частях секреторного органа. Если процесс малигнизации развивается в центре, частичная резекция противопоказана из-за нахождения в этой зоне крупных кровеносных сосудов. При такой локализации может быть проведена только трансплантация печени.
Дальнейшее лечение рабдоидной опухоли печени проводится с применением следующих терапевтических процедур:
- Химиотерапия. Медикаментозное противоопухолевое лечение считается наилучшим вспомогательным методом, позволяющим улучшить результативность хирургического вмешательства. Его проведение при поражениях секреторного органа имеет свои нюансы. Во-первых, все химиопрепараты вводятся через катетер в печёночную артерию, что позволяет оказывать воздействие непосредственно на злокачественную структуру, а во-вторых, одновременно с ними малышам вводят облегчающие и улучшающие самочувствие средства.
- Лучевая терапия. Облучение при опухолях печени стали применять только в последнее время, с появлением инновационных методик, позволяющих воздействовать только на очаг поражения, не задевая при этом здоровые ткани. Помимо этого, радиацию в обязательном порядке применяют на последних стадиях заболевания для облегчения состояния маленького пациента.
Стоит знать! Стандартного метода терапии при рабдоидной опухоли не существует, однако современные онкологические исследования, проводимые в этой области, позволяют надеяться, что в ближайшее время появится перспективная терапевтическая методика, позволяющая полностью избавить малыша от этого саркомоидального новообразования или достигнуть длительного реабилитационного периода, дающего шанс на выздоровление.
Метастазы и рецидив
Рабдоидная опухоль печени несёт высокую угрозу жизни маленьких пациентов. Она связана с ранним метастазированием. У большинства малышей опухоль в печени такого типа выявляется после того, как в большинстве внутренних органов появляются злокачественные очаги. Метастазы рабдоидной опухоли печени в 70% случаев обнаруживаются в лёгких. Помимо органов дыхания в клинической практике отмечались неоднократные случаи появления метастатических очагов в головном мозге. Их наличие делает терапевтические мероприятия, направленные на излечение ребёнка, нерентабельными, так как в короткие сроки после их проведения возникнет рецидив.
Сколько живут маленькие пациенты?
Рабдоидная опухоль – одна из самых жизнеугрожающих онкологических патологий, способных поразить печень. Только вовремя (до возникновения процесса метастазирования) проведённое лечение рабдоидной опухоли печени, позволяет надеяться на то, что рецидив заболевания не наступит. При своевременном выявлении патологического состояния, что случается очень редко в силу его скоротечности и грудного возраста пациентов, не способных рассказать о своих ощущениях, прожить более 5 лет могут 65-70% малышей.
а) Клиническая картина. Рабдоидная опухоль глазницы диагностировалась и у младенцев, и у взрослых (1-11). Обычно она манифестирует экзофтальмом и смещением глазного яблока. Описаны случаи, когда опухоль вызывала резко выраженный экзофтальм уже при рождении. После хирургического иссечения опухоль может рецидивировать и прорастать в придаточные пазухи носа и полость черепа. Описано развитие опухоли в глазнице после энуклеации и лучевой терапии по поводу ретинобластомы (8).
б) Диагностика. Рабдоидная опухоль глазницы не имеет специфических рентгенологических признаков. На ранних стадиях она представляет собой четко отграниченное новообразование, но быстро инфильтрирует окружающие ткани и прорастает кость (9).
У маленьких детей злокачественная рабдоидная опухоль может быть очень агрессивной, рецидивирует после лечения и распространяется в центральную нервную систему. Показан пример клинико-патологической корреляции.
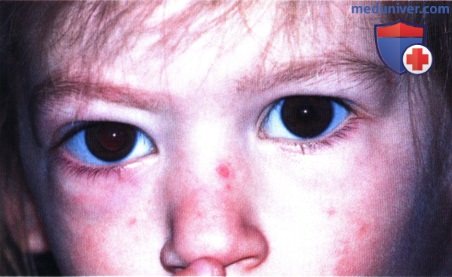
Правосторонний экзофтальм у 36-месячной девочки. Мидриаз, зрачковые реакции, в т.ч. на свет, отсутствуют. 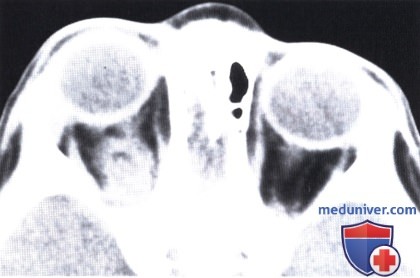
КТ, аксиальная проекция: новообразование в мышечном конусе. При биопсии выявлены признаки рабдоидной опухоли, новообразование было удалено, проведены химиотерапия (винкристин и актиномицин D) и лучевая терапия (5000 сГр). 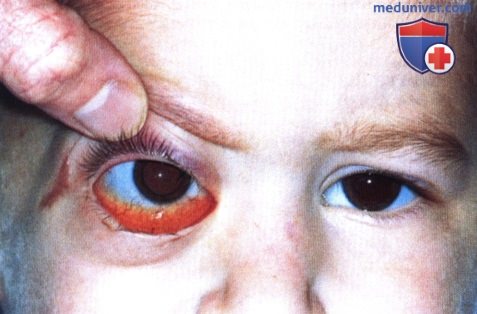
Приблизительно восемь месяцев спустя у ребенка рецидивировал экзофтальм и развился хемоз конъюнктивы. 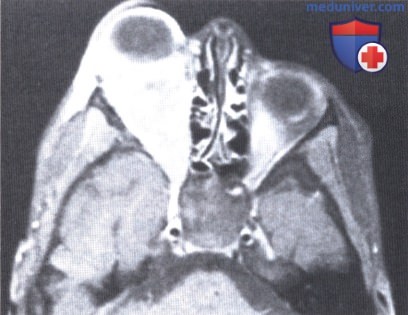
МРТ, режим Т1: массивная рецидивировавшая опухоль. Выполнена экзентерация глазницы с последующими лучевой и химиотерапией. Через несколько месяцев развился рецидив в глазнице, верхнечелюстной пазухе и головном мозге. 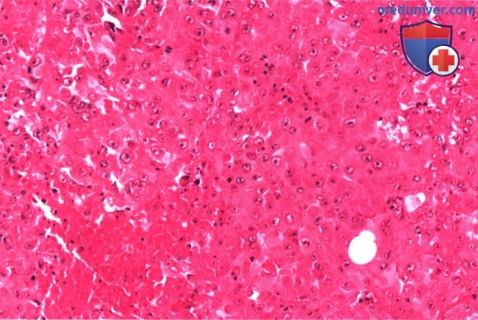
На микропрепарате видны пласты злокачественных опухолевых клеток (гематоксилин-эозин, х50). 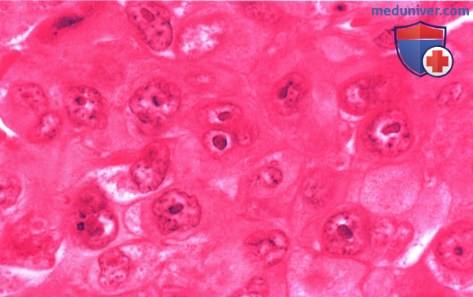
Микропрепарат: крупные анапластические эпителиоидные клетки (гематоксилин-эозин, х250). При иммуногистохимическом исследовании подтвержден диагноз экстраренальной рабдоидной опухоли.
в) Патологическая анатомия. При гистологическом исследовании выявляется низкодифференцированная опухоль, при поверхностном исследовании напоминающая рабдомиосаркому. Она образована плеоморфными эпителиальными клетками с хорошо выраженными ядрышками и многочисленными филаментными включениями. Обычно наблюдается положительная иммунологическая реакция при окраске на виметин, цитокератин и антиген эпителиальных мембран, и отрицательная иммунологическая реакция на миоглобин, мышцеспецифический антиген, десмин и НМВ-45.
г) Лечение. Выполняется хирургическое иссечение опухоли, лучевая и химиотерапия, так же, как и при лечении рабдомиосаркомы (4). Прогноз обычно считается очень неблагоприятным.
д) Список использованной литературы:
1. Shields JA, Shields CL, Scartozzi R. Survey of 1264 patients with orbital tumors and simulating lesions: The 2002 Montgomery Lecture, part 1. Ophthalmology 2004;111: 997-1008.
2. Shields JA, Bakewell B, Augsburger JJ, et al. Classification and incidence of space-occupying lesions of the orbit. A survey of 645 biopsies. Arch Ophthalmol 1984:102: 1606-1611.
3. Shields JA, Bakewell B, Augsburger JJ, et al. Space-occupying orbital masses in children: A review of 250 consecutive biopsies. Ophthalmology 1986;93:379-384.
4. Watanabe H, Watanabe T, Kaneko M, et al. Treatment of unresectable malignant rhabdoid tumor of the orbit with tandem high-dose chemotherapy and gamma-knife radiosurgery. Pediatr Blood Cancer 2006;47:846-850.
5. Rootman J, Damji KF, Dimmick JE. Malignant rhabdoid tumor of the orbit. Ophthalmologyl989;96:1650-1654.
6. Johnson LN, Sexton FM, Goldberg SH. Poorly differentiated primary orbital sarcoma (presumed malignant rhabdoid tumor). Arch Ophthalmol 1991;105:1275-1278.
7. Niffenegger JH, Jakobiec FA, Shore JW, et al. Adult extrarenal rhabdoid tumor of the lacrimal gland. Ophthalmology 1992;99:567-574.
8. Walford N, Defarrai R, Slater RM, et al. Intraorbital rhabdoid tumour following bilateral retinoblastoma. Histopathology 1992;20:170-173.
9. Gunduz K, Shields JA, Eagle RC Jr, et al. Malignant rhabdoid tumor of the orbit. Arch Ophthalmol 1998;116:243-246.
10. Stidham DB, Burgett RA, Davis MM, et al. Congenital malignant rhabdoid tumor of the orbit. J AAPOS1999;3:318-320.
11. Gottlieb C, Nijhawan N, Chorneyko K, et al. Congenital orbital and disseminated extrarenal malignant rhabdoid tumor. Ophthal Plast Reconstr Surg 2005;21:76-79.
Редактор: Искандер Милевски. Дата публикации: 24.5.2020
Отдаленные последствия лечения. Одним из главных факторов, позволяющих достоверно оценить эффективность лечения детей с раковыми опухолями, является возможность развития поздних отрицательных эффектов терапии. Известно, что в последнее время при использовании различных современных NWTS-протоколов лечения выживаемость при опухоли Вильмса превышает 85%. Одна из основных целей NWTS-3 и -4 исследований — свести к минимуму интенсивность и продолжительность терапии у детей, принадлежащих к прогностически благоприятным категориям.
Развитие второй злокачественной опухоли. Анализ историй болезни 487 детей с опухолью Вильмса, лечившихся в Dana-Farber Cancer Institute с 1927 по 1981 г., показал, что у 11 пациентов (2%) возникла вторая злокачественная опухоль через 7—34 года после лечения (в среднем через 17 лет). В 10 случаях из 11 это была злокачественная опухоль мягкотканного происхождения в зоне облучения. Анализ данных показывает, что вероятность развития второй злокачественной опухоли составляет 6% через 20 лет и 18% через 34 года. Подобные же результаты имеются в сообщениях как группы по изучению отдаленных результатов, так и NWTS.
Из 2438 пациентов, зарегистрированных в NWTS-протоколах с 1969 по 1982 г., у 15 развилась вторая злокачественная опухоль (SMN - second malignant neoplasm). Этот показатель частоты развития второй опухоли оказался в 8 раз выше, чем предполагалось.
Через 10 лет приблизительно у 1% выживших возникла SMN. Виды вторых опухолей разнообразны: в 6 случаях это были лейкоз или лимфома, в трех — гепатоцеллюлярная карцинома и в трех — мягкотканная саркома. Поэтому для своевременной диагностики SMN дети с опухолью Вильмса, выжившие после лечения и длительно живущие, требуют целенаправленного наблюдения, даже когда они стали уже взрослыми.
Репродуктивные проблемы. Из других отдаленных последствий лечения опухоли Вильмса, хорошо известных и документированных, следует назвать проблемы деторождения, беременности, рождения детей недоношенных или с низкой массой тела. В 1982 году был проведен обзор развития репродуктивных функций у 36 выживших пациентов с опухолью Вильмса (27 женщин и 9 мужчин). У их детей отмечено значительное увеличение, по сравнению с общей популяцией, перинатальной смертности (6,7%), связанной в основном с недоношенностью или низкой массой тела при рождении. Большинство проблем относительно беременности отмечались у женщин, которые в прошлом получали лучевую терапию на живот. Риск рождения маловесных детей в этой группе составил 30%.
Потомство мужчин, лечившихся в детстве по поводу опухоли Вильмса, не относилось к группе риска. Частота больших врожденных аномалий была не выше, чем в общей популяции. Ни у кого из детей в течение всего периода наблюдения не развивались ни опухоль Вильмса, ни другие злокачественные новообразования. Последующие исследования подтвердили эти данные.
В другом исследовании указывается, что из 114 беременных женщин, выживших после лечения опухоли Вильмса и подвергавшихся лучевой терапии, у 34 беременность протекала неблагоприятно, в том числе 17 детей погибли в перинатальном периоде и 17 родились с низкой массой тела. В отличие от этой группы, среди 77 беременных женщин, которые не получали лучевой терапии (или жен мужчин, которые не получали лучевой терапии), только в 2 случаях (3%) отмечались различные неблагоприятные последствия.
Все это говорит о снижении репродуктивной функции у женщин и мужчин, лечившихся в детстве по поводу опухоли Вильмса, а потому при возникновении беременности необходима пренатальная диагностика и всех беременных женщин следует относить к группе высокого риска, обследуя их по соответствующей программе.
Светлоклеточная саркома
Последующее изучение подтвердило наличие характерных морфологических и клинических особенностей СКС, в результате чего ее перестали считать вариантом нефробластомы, выделив как самостоятельную злокачественную опухоль почечного происхождения.
Из 1888 препаратов, представленных в NWTS с 1969 по 1983 год, в 75 случаях (4%) установлен диагноз СКС. Средний возраст, в котором появлялись клинические симптомы, равнялся 3 годам. У мальчиков эта опухоль встречалась намного чаще (мальчики : девочки=1,7 : 1). Макроскопически во время лапаротомии не было никаких определенных признаков, позволявших отдифференцировать СКС от опухоли Вильмса. На разрезе СКС имеет желтовато-коричневый цвет. Часто видны кистозные пространства, но кровоизлияния и некроз встречаются редко.
В большинстве случаев СКС имеет четкую гистологическую картину, которая заключается в наличии четко очерченных полигональных клеток со свет-ловодянистой цитоплазмой и везикулярным ядром, имеющим форму от овоидной до округлой, ядрышки в нем незаметны. Ультраструктуральное строение этих опухолей хорошо описано в деталях в других руководствах.
Что касается клинических особенностей, то здесь можно выделить ряд важных обстоятельств. Не существует сообщений о мультицентричных или двусторонних СКС. Частота метастазов СКС в кости у детей составляет 23%. Для сравнения — только у 0,3% всех детей, вошедших в NWTS-3, развилась опухолевая диссеминация в костные структуры. Стандартное рентгенологическое обследование было более информативным в определении поражения костей, чем радионуклидное сканирование, однако два этих метода должны использоваться вместе, поскольку они дополняют друг друга.
Пациенты с СКС обладают значительно более высоким риском развития метастазов в мозг (17%), что говорит о необходимости проведения не только стандартного рентгенологического обследования костей, но и сканирования головного мозга. Прогноз при костных метастазах у детей плохой — из 19 детей выжили 3 (16%).
Лечение детей с СКС отличается от лечения пациентов с опухолью Вильмса. Согласно последним современным рекомендациям, всем пациентам с СКС (стадии от I до IV) должна производиться нефрэкто-мия и лучевая терапия (1080 сГр) на область ложа опухоли. Применяется трехкомпонентная химиотерапия (актиномицин D, винкристин, доксорубицин). Прогноз при СКС существенно улучшился с тех пор, как к химиотерапевтическому протоколу был добавлен доксорубицин (см. табл. 63-2).
По данным NWTS-1 и -2, из 31 ребенка с СКС у 20 возник рецидив (65%) и 15 умерли (48%), в то время как из 55 детей с СКС, лечившихся в NWTS-3, рецидив развился в 31% случаев, а 2-летняя выживаемость составила 90%.м Поздние рецидивы представляют серьезную проблему у детей с СКС. Выживаемость через 4 года снижается до 72,6%. Все это убеждает в необходимости очень внимательного наблюдения в отдаленном периоде за пациентами, получавшими лечение по поводу СКС.
Рабдоидные опухоли
Рабдоидная опухоль обладает агрессивностью и появляется у детей очень рано. Средний возраст, в котором устанавливается диагноз — 1 год и 4,8 месяца. У мальчиков РОП встречаются чаще, чем у девочек (1,5: 1). В противоположность опухоли Вильмса, РОП редко ограничивается (ко времени ее выявления) пределами почки. Когда возникает клиническая симптоматика, то у 80% детей уже имеется III или IV стадия заболевания.
В противоположность СКС, результаты лечения РОП нельзя назвать сколько-нибудь успешными. Несмотря на трехкомпонентную химиотерапию (актиномицин D, винкристин, доксорубицин), улучшения в отношении отдаленных результатов не отмечено, а 3-летняя выживаемость меньше 20%. Из 57 пациентов с РОП, зарегистрированных в протоколах NWTS, у которых развился рецидив, 55 умерли в результате прогрессирования опухоли (96%).
Метастазы обычно возникают во многих местах, но наиболее часто — в легких (70%). Дети с РОП имеют также предрасположенность к развитию опухолей головного мозга. По данным одной из работ, среди пациентов с РОП и развившимися интракраниальными опухолями у 14% опухоли мозга гистологически отличались от первичной ренальной опухоли. Учитывая сказанное, всем детям с рабдоидными опухолями почек рекомендуется при первом же обследовании проводить сканирование головного мозга.
Врожденная мезобластная нефрома
Врожденная мезобластная нефрома (ВМН) была выделена как самостоятельная опухоль почки в 1967 году после описания ее характерной клиникогистологической картины. До этого сообщения ВМН расценивалась как вариант опухоли Вильмса и поэтому грудным детям с ВМН проводилась лучевая и химиотерапия. Последующий обзор 48 случаев вновь подтвердил доброкачественную природу ВМН, в результате чего было установлено, что методом выбора в лечении ВМН должна быть нефрэктомия, при этом нет необходимости ни в лучевой, ни в химиотерапии.
В 1982 году был проведен анализ наблюдений ВМН, зарегистрированных в протоколах NWTS. 51 случай ВМН составил 2,8% среди всех наблюдений NWTS. Диагноз устанавливался в возрасте (в среднем) 3,4 месяца. У мальчиков опухоль встречалась значительно чаще (1,8: 1). Наиболее характерным клиническим проявлением было обнаружение (пальпаторное) опухолевидного образования в животе (94%). У 9 детей (18%) отмечалась гематурия.
У 43 пациентов опухоль была удалена полностью, однако в 8 случаях она прорастала окружающие периренальные мягкие ткани, поэтому удалить ее полностью не удалось. Нередко (20%) отмечался интраоперационный разрыв опухоли. Несмотря на указанные трудности в лечении, исходы заболевания были благоприятными — выжили 50 пациентов. Только у одного ребенка отмечался рецидив интраабдоминальной опухоли. Умер из этих больных лишь один новорожденный ребенок, у которого развилась нейтропения и сепсис после химиотерапии. Результаты проведенного анализа говорят о том, что в большинстве случаев при лечении ВМН у детей единственным методом выбора является хирургическое удаление опухоли.
Предпринимались попытки установить какие-либо критерии, позволяющие распознавать потенциально агрессивные варианты ВМН, имеющие склонность к метастазированию и локальным рецидивам. К таким вариантам ВМН относятся атипичные или целлюлярные мезобластные нефромы. Они могут требовать адъювантной химиотерапии. При обзоре 38 случаев целлюлярных ВМН рецидив отмечен в 7 наблюдениях (18%).
Нет каких-либо специфических гистологических особенностей, которые позволяли бы предсказать возможность развития рецидива. Хотя у грудных детей более старшего возраста (не новорожденных) отмечается повышенный риск рецидивирования, тем не менее только возраст сам по себе не является показанием к адъювантной терапии.
Единственный прогностический фактор, позволяющий предсказать вероятность развития рецидива, — это невозможность полностью удалить опухоль. Поэтому, если целлюлярная ВМН удалена полностью, то адъювантная химиотерапия не требуется. Пациенты, у которых оставлены элементы опухоли по краям резецированного препарата или у которых произошел интраоперационный разрыв опухоли, являются кандидатами на химиотерапию, которая проводится комбинацией винкристина, доксорубицина и циклофосфамида.
Читайте также:

