Повышенные нейтрофилы при опухолях

7 миллионов нейтрофилов рождаются каждую минуту, чтобы максимально защитить организм от атаки вредоносных бактерий. Эти клетки обладают уникальными свойствами, и ценой своей жизни спасают человека от чужеродных микробов.
Повышенный уровень нейтрофилов (нейтрофилез)
Фагоцит поглощает бактерию
Основной функцией нейтрофилов является ограждение организма от всевозможных болезнетворных частиц. Они моментально реагируют на проникновение чужеродного микроорганизма, поглощают его и переваривают. Сами нейтрофилы после этого погибают, выделяя при этом большое количество специфичных веществ, которые разрушают оставшиеся бактерии.
Нейтрофилы — это самая многочисленная группа лейкоцитов, показатели их уровня обычно определяются при стандартном клиническом анализе крови. Если значения превышают норму, в организме происходит воспалительный процесс. Это состояние называется нейтрофилез. В зависимости от степени повышения, можно определить насколько обширным является воспаление.
Исследование количества нейтрофильных клеток включает в себя измерение их общего числа в единице крови, а также процентное соотношение к общему числу лейкоцитов.
Значения выше нормы для взрослых:
- в абсолютном количестве — > 6,5 * 10 9 /л;
- в процентном соотношении — > 75%.
Причины нейтрофилеза у взрослых
Нейтрофилез — верный спутник бактериальной инфекции
Рост иммунных клеток указывает на ответную реакцию организма по отношению к болезнетворным микробам. Обнаружение повышенного значения нейтрофилов указывает на следующие причины:
- заболевания, вызванные бактериями: пневмония, ангина, отит, гайморит, дизентерия, туберкулёз, дифтерия, лимфоретикулёз, остеомиелит, столбняк, сифилис, гонорея и другие;
- некроз тканей, образующийся в следствии гангрены, обширных ожогов, сердечно-сосудистых заболеваний;
- грибковые заболевания: микоз, кандидоз, лишай;
- онкологические заболевания различных органов;
- сахарный диабет;
- воспалительное поражение кожных покровов;
- анемия;
- патологии кровеносной системы;
- интоксикация, в том числе алкогольными напитками.
Сегментоядерные нейтрофилы повышены у взрослых
Нейтрофилы зарождаются в костном мозге и проходят стадии развития от миелобласта до палочкоядерной, а затем сегментоядерной клетки. Зрелые клетки содержат ядро, которое состоит из сегментов, связанных между собой нуклеопротеидными нитями. В кровяном русле взрослого человека составляют около 70% от числа всех лейкоцитов.
Сегментоядерные нейтрофилы живут около 14 суток, после чего разрушаются в печени и селёзенке. Если клетки сталкиваются с патогенными частицами, то в борьбе с ними погибают раньше. Ускоренная гибель клеток провоцирует активное зарождение новых нейтрофилов. Этот процесс продолжается до полного восстановления повреждённых микробами тканей. Поэтому повышенное количество указывает на воспалительный процесс в организме либо на его наличие в недавнем прошлом.
Обнаружив повышенные значения сегментоядерных нейтрофилов, врач назначит дополнительные обследования для выяснения причины. Факторами, вызвавшими рост зрелых клеток, могут быть воспалительные явления, инфекционные процессы, злокачественные образования, заболевания сердечно-сосудистой и дыхательной систем.
Показатель выше нормы для взрослых — > 72%.
Палочкоядерные нейтрофилы повышены у взрослых
Палочкоядерные нейтрофилы в мазке крови
Незрелый нейтрофил обладает ядром, напоминающим по внешнему виду палочку, откуда и пошло его название. Палочкоядерные клетки проходят стадию дозревания в костном мозге, поэтому в кровяном русле взрослого человека их количество невелико. В среднем они составляют от 3 до 5% от всех видов иммунных клеток.
В отличие от сегментоядерных, незрелые клетки не обладают всеми инструментами для борьбы с вредоносными микроорганизмами. Их основная задача — развиваться до следующего, зрелого уровня. Рост их количества в единице крови означает, что происходит активное производство новых нейтрофилов.
Повышение единиц незрелых клеток называется сдвигом лейкоцитарной формулы влево. Это характерный показатель, который означает в большинстве случаев ухудшение состояния пациента. Например, если на фоне гриппа обнаруживается рост палочкоядерных нейтрофилов, речь идёт о присоединении бактериальной инфекции.
Поэтому диагностика палочкоядерных клеток является обязательной при терапии, послеоперационном периоде, прекращении курса медицинских препаратов. Повышенный показатель укажет на возникновение осложнения.
Значение выше нормы для взрослых — > 6%.
Как выявить нейтрофилез?
Основа диагностики нейтрофилеза — клинический анализ крови
Уровень нейтрофилов диагностируется на основе развёрнутого клинического анализа крови. Перед анализом на уровень нейтрофилов необходимо отказаться от пищи за 8 часов до изъятия крови, исключить физическое перенапряжение, алкогольные напитки и медикаменты.
Значения выше нормы свидетельствуют о наличии нейтрофилеза. Данную патологию разделяют на 3 стадии, в зависимости от уровня превышения нормы.
- Абсолютное количество нейтрофилов составляет до 10 * 10 9 /л — воспаление умеренного характера, локализованное в одном очаге;
- Численность клеток диагностируется от 10 до 20 * 10 9 /л — выраженный нейтрофилёз при более сильном воспалительном процессе, распространившимся далее одного очага;
- Уровень нейтрофилов в единице крови определяется от 20 до 60 * 10 9 /л — тяжёлая стадия, свидетельствующая об обширном поражении организма в целом.
Если в бланке с результатами анализа указано только процентное соотношение, можно вычислить абсолютный показатель по формуле:
Относительный показатель * число лейкоцитов / 100.
Если показатель в процентах равен 68, а лейкоцитов всего 7 * 10 9 /л, то 68 * 7 / 100 = 4,76.
Что может повлиять на результаты исследования?
Прием пищи накануне теста может спровоцировать нейтрофилез
Умеренный нейтрофилёз указывает не только на патогенные процессы, но и отражает некоторые физиологические состояния. Небольшой рост клеток может быть спровоцирован:
- беременностью,
- повышенной физической нагрузкой,
- стрессом,
- обильным приёмом пищи.
Ряд лекарственных средств также вызывает рост числа нейтрофилов. Если приём медицинских препаратов невозможно отменить перед сдачей анализа, необходимо обязательно сообщить об этом врачу.
Лекарства, повышающие уровень нейтрофилов:
- Ацетилхолин-хлорид,
- Хлорпропамид,
- Гепарин,
- Гистамин,
- Норэпинефрин,
- все кортикостероидные лекарства,
Как понизить уровень нейтрофилов у взрослых?
Причину нейтрофилеза должен устанавливать специалист
Если число нейтрофилов возросло, значит иммунная система нуждается в таком количестве клеток для угнетения патологических процессов в организме. Поэтому специально снижать уровень нейтрофилов не нужно. Необходимо найти причину их повышения, исключить её, тогда число клеток иммунитета снова придёт в норму.
Наиболее частым фактором роста нейтрофилов является бактериальное инфицирование. В зависимости от заболевания, пациенту будет назначен курс антибиотиков узкого либо широкого спектра. Для лечения грибковых инфекций используются различные противогрибковые средства, в случае их повторения — антибиотики.
Опасность повышенного уровня нейтрофилов в крови
Нейтрофилез без внимания чреват осложнениями
Рост числа нейтрофилов не всегда сопровождается выраженными симптомами. Человек может считать себя абсолютно здоровым, а обнаружить отклонение от нормы только на бланке с результатами анализов. Это может означать, что в организме протекает скрытая инфекция. Если не предпринимать меры, то воспалительный процесс захватит более обширные участки.
Злокачественные и доброкачественные опухоли проявляются повышенным уровнем нейтрофилов. Если на протяжении длительного периода число клеток значительно превосходит норму, врач может заподозрить у пациента онкологическую природу патологии.
При беременности небольшой рост нейтрофилов относится к показателям нормы. Но слишком высокие значения могут привести к выкидышу, так как нейтрофилы воспринимают плод как чужеродный организм в теле женщины.
Профилактика
Профилактика нейтрофилеза — залог хорошего здоровья
Для того, чтобы нейтрофилам не пришлось усиленно бороться с болезнетворными бактериями, нужно помочь организму избежать проникновения болезнетворных микробов.
- Ягоды, фрукты, овощи употреблять только чистыми. Мясо, рыба, молоко должны быть обработаны термически правильно.
- Необходимо соблюдать личную гигиену: тщательно мыть руки, чистить зубы, следить за чистотой предметов обихода.
- Жилое помещение ежедневно должно проветриваться, влажную уборку нужно проводить регулярно.
- Необходимо избегать контакта с больными людьми.
- Раны, ссадины следует продезинфицировать и защитить от внешней среды при помощи бинта либо пластыря.
Диагностика раковых опухолей – комплексное обследование с использованием специфических инструментальных и лабораторных методов. Проводится она по показаниям, среди которых находятся и выявленные стандартным клиническим анализом крови нарушения.
Злокачественные новообразования растут очень интенсивно, потребляя при этом витамины и микроэлементы, а также выделяя в кровь продукты своей жизнедеятельности, приводят к значительной интоксикации организма. Питательные вещества берутся из крови, туда же попадают продукты их переработки, что и влияет на ее состав. Поэтому зачастую именно в ходе плановых осмотров и лабораторных исследований обнаруживаются признаки опасного заболевания.
- 1 Какие анализы крови показывают онкологию
- 1.1 Можно ли по общему анализу крови определить онкологию (рак)
- 1.2 Биохимическое исследование
- 1.3 Основной анализ
- 1.4 Может ли при раке быть хороший анализ крови
- 1.5 Какие показатели крови показывают онкологию у женщин
- 2 Когда необходим анализ на онкомаркеры?
- 3 Как подготовиться к сдаче анализа на онкомаркеры
Какие анализы крови показывают онкологию
Заподозрить рак можно по результатам стандартных и специальных исследований. При патологических процессах в организме изменения состава и свойств крови отражаются в:
- общем анализе крови;
- биохимическом исследовании;
- анализе на онкомаркеры.
Однако достоверно определить рак по анализу крови нельзя. Отклонения любых показателей могут вызываться заболеваниями, с онкологией никак не связанными. Даже специфический и наиболее информативный анализ на онкомаркеры не дает 100% гарантию наличия или отсутствия заболевания и нуждается в подтверждении.
Этот вид лабораторного исследования дает представление о количестве основных форменных элементов, которые отвечают за функции крови. Уменьшение или увеличение каких-либо показателей – сигнал о неблагополучии, в том числе и о наличии новообразований. Берется проба из пальца (иногда из вены) в первой половине дня, натощак. В таблице ниже представлены основные категории общего или клинического анализа крови и их нормальные значения.
При трактовке анализов необходимо учитывать, что в зависимости от пола и возраста показатели могут различаться, также существуют физиологические причины повышения или снижения значений.
Практически все эти показатели крови при онкологии изменяются в сторону уменьшения или увеличения. На что именно обращает внимание врач при изучении результатов анализа:
- СОЭ. Скорость оседания в плазме эритроцитов выше нормы. Физиологически это может объясняться менструацией у женщин, повышенной физической активностью, стрессами и т.д. Однако, если превышение значительное и сопровождается симптомами общей слабости и субфебрильной температурой, можно заподозрить рак.
- Нейтрофилы. Их количество увеличено. Особенно опасно появление новых, незрелых клеток (миелоцитов и метамиелоцитов) в периферической крови, характерное для нейробластом и других онкозаболеваний.
- Лимфоциты. Эти показатели ОАК при онкологии выше нормы, поскольку именно этот элемент крови отвечает за иммунитет и борется с раковыми клетками.
- Гемоглобин. Уменьшается, если имеются опухолевые процессы внутренних органов. Объясняется это тем, что продукты жизнедеятельности клеток опухоли повреждают эритроциты, снижая их количество.
- Лейкоциты. Численность белых кровяных телец, как показывают анализы при онкологии всегда снижается, если метастазами поражен костный мозг. Лейкоцитарная формула при этом сдвигается влево. Новообразования другой локализации приводят к повышению.
Следует учитывать, что снижение гемоглобина и количество эритроцитов характерно для обычной анемии, вызванной недостатком железа. Повышение СОЭ наблюдается при воспалительных процессах. Поэтому такие признаки онкологии по анализу крови считаются косвенными и нуждаются в подтверждении.
Назначение этого анализа, проводимого ежегодно – получение информации об обмене веществ, работе различных внутренних органов, балансе витаминов и микроэлементов. Биохимический анализ крови при онкологии тоже информативен, поскольку изменение определенных значений позволяет делать выводы о наличии раковых опухолей. Из таблицы можно узнать, какие показатели должны быть в норме.
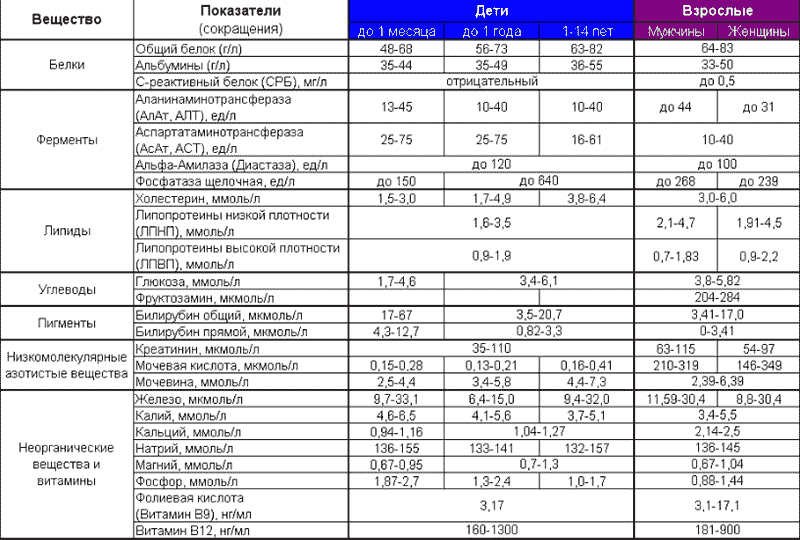
Заподозрить рак биохимический анализ крови возможно в том случае, когда следующие значения не соответствуют норме:
- Альбумин и общий белок. Они характеризуют общее количество протеинов в сыворотке крови и содержание основного из них. Развивающееся новообразование активно потребляет белок, поэтому данный показатель существенно снижается. Если поражена печень, то даже при полноценном питании наблюдается дефицит.
- Глюкоза. Рак репродуктивной (особенно женской) системы, печени, легких влияет на синтез инсулина, тормозя его. В результате появляются симптомы сахарного диабета, что и отражает биохимический анализ крови при раке (уровень сахара растет).
- Щелочная фосфатаза. Повышается, прежде всего, при опухолях костей или метастазах в них. Может также свидетельствовать об онкологии желчного пузыря, печени.
- Мочевина. Этот критерий позволяет оценить работу почек, и если он повышен – имеется патология органа либо идет интенсивный распад белка в организме. Последнее явление характерно для опухолевой интоксикации.
- Билирубин и аланинаминотрансфераза (АлАТ). Повышение количества этих соединений информирует о поражении печени, в том числе раковой опухолью.
Если есть подозрение на рак, биохимический анализ крови не может использоваться как подтверждение диагноза. Даже если наблюдаются совпадения по всем пунктам, потребуется сделать дополнительные лабораторные исследования. Что касается непосредственно сдачи крови, то берется она из вены с утра, а есть и пить (разрешено употреблять кипяченую воду) нельзя уже с предыдущего вечера.
Если биохимический и общий анализ крови при онкологии дают только общее представление о наличии патологического процесса, то исследование на онкомаркеры позволяет даже определить местоположение злокачественного новообразования. Именно так называется анализ крови на рак, при котором выявляются специфические соединения, вырабатываемые самой опухолью или организмом в ответ на ее присутствие.
Всего известно около 200 онкомаркеров, но для диагностики используется чуть больше двадцати. Некоторые из них являются специфичными, то есть свидетельствуют о поражении конкретного органа, а другие могут выявляться при разных видах рака. Например, альфа-фетопротеин – это общий онкомаркер на онкологию, он обнаруживается почти у 70% больных. То же относится и к РЭА (раково-эмбриональному антигену). Поэтому для определения разновидности опухоли кровь исследуется на комбинации общих и специфичных онкомаркеров:
- Белок S-100, НСЕ – мозг;
- СА-15-3, СА-72-4, РЭА – поражена молочная железа;
- SCC, альфа-фетопротеин – шейка матки;
- АФП, СА-125, ХГЧ – яичники;
- CYFRA 21–1, РЭА, НСЕ, SCC – легкие;
- АФП, СА 19-9, СА-125 – печень;
- СА 19-9, РЭА, СА 242 – желудок и поджелудочная;
- СА-72-4, РЭА – кишечник;
- PSA – предстательная железа;
- ХГЧ, АФП – яички;
- Белок S-100 – кожа.
Но при всей точности и информативности, диагностика онкологии по анализу крови на онкомаркеры носит предварительный характер. Наличие антигенов может быть признаком воспалительных процессов и других заболеваний, а РЭА всегда повышен у курильщиков. Поэтому без подтверждения инструментальными исследованиями диагноз не ставится.
Этот вопрос закономерен. Если плохие результаты не являются подтверждением онкологии, то может ли быть наоборот? Да, это возможно. На результат анализа может повлиять малый размер опухоли или прием лекарственных средств (учитывая, что для каждого онкомаркера существует специфический перечень препаратов, прием которых может привести к получению ложноположительных или ложноотрицательных результатов, лечащий врач и сотрудники лаборатории должны быть уведомлены о препаратах, принимаемых пациентом).
Даже если анализы крови хорошие и инструментальная диагностика результата не дала, но есть субъективные жалобы на боли, речь может идти о внеорганной опухоли. Например, ее забрюшинная разновидность выявляется уже на 4 стадии, до этого практически никак не давая знать о себе. Возрастной фактор тоже имеет значение, поскольку метаболизм с годами замедляется, и в кровь антигены поступают тоже медленно.
Опасность заболеть раком приблизительно одинакова у обоих полов, но у прекрасной половины человечества есть дополнительное уязвимое место. Женская репродуктивная система подвергается высокому риску онкозаболеваний, особенно молочные железы, что выводит рак груди на 2 место по частоте встречаемости, среди всех злокачественных новообразований. Эпителий шейки матки тоже склонен к злокачественному перерождению, поэтому женщины должны ответственно относиться к обследованиям и обращать внимание на следующие результаты анализов:
- ОАК при онкологии показывает снижение уровня эритроцитов и гемоглобина, а также повышении СОЭ.
- Биохимический анализ – здесь поводом для беспокойства является увеличение количества глюкозы. Такие симптомы сахарного диабета особенно опасны для женщин, поскольку нередко становятся предвестниками рака молочных желез и матки.
- При исследовании на онкомаркеры одновременное присутствие антигенов SCC и альфа-фетопротеина свидетельствует о риске поражения шейки матки. Гликопротеин СА 125 – угроза рака эндометрия, АФП, СА-125, ХГЧ – яичников, а комбинация СА-15-3, СА-72-4, РЭА говорит о том, что опухоль может быть локализована в молочных железах.
Если что-то настораживает в анализах и имеются характерные признаки онкологии в начальной стадии, визит к врачу откладывать нельзя. Кроме того, гинеколога посещать надо не реже раза в год, а грудь регулярно обследовать самостоятельно. Эти простые меры профилактики часто помогают выявить рак на ранних стадиях.
Когда необходим анализ на онкомаркеры?
Пройти обследование следует при продолжительном ухудшении самочувствия в виде слабости, постоянной невысокой температуры, утомляемости, потере веса, анемии неясного генеза, увеличении лимфатических узлов, появлении уплотнений в молочных железах, изменении цвета и размера родинок , нарушениях работы ЖКТ, сопровождающихся отхождением крови после дефекации, навязчивом кашле без признаков инфекции и т.д.
Дополнительным причинами являются:
- возраст за 40;
- онкология в семейном анамнезе;
- выход за пределы нормы показателей биохимического анализа и ОАК;
- боли или продолжительное нарушение функций каких-либо органов или систем даже в незначительной степени.
Анализ не занимает много времени, помогая при этом вовремя выявить угрожающее жизни заболевание и вылечить его наименее травматичными способами. Кроме того, такие обследования должны стать регулярными (не реже раза в год) для тех, кто имеет родственников с онкологией или перешагнул сорокалетний возрастной рубеж.
Как подготовиться к сдаче анализа на онкомаркеры
Кровь для исследований на антигены сдается из вены, утром. Результаты выдаются в течение 1-3 дней, а чтобы они получились достоверными, необходимо выполнить определенные рекомендации:
- не завтракать;
- не принимать накануне какие-либо медикаменты и витамины;
- за трое суток до того, как делать диагностику рака по анализу крови, исключить алкоголь;
- не принимать накануне жирную и жареную пищу;
- за сутки до исследования исключить тяжелые физические нагрузки;
- в день сдачи не курить с утра (курение повышает РЭА);
- чтобы сторонние факторы не исказили показатели, сначала вылечить все инфекции.
После получения результатов на руки не следует делать какие-либо самостоятельные выводы и ставить диагнозы. Стопроцентной достоверностью этот анализ крови при раке не обладает и требует инструментального подтверждения.
Подобно другим клеткам системы иммунитета нейтрофилы могут участвовать в стимуляции роста опухоли, однако исследований, посвященных этому вопросу, немного.
Соответствующие данные литературы показывают, что способность нейтрофилов стимулировать рост опухоли прежде всего обусловлена их большой возможностью индуцировать воспаление, что приводит к изменению микроокружения.
Известно, что в процессе воспаления нейтрофилы выделяют множество факторов, гетерогенных по своей природе, часть из которых идентифицирована и хорошо известна, а другие еще подлежат идентификации.
Нейтрофилы, подобно моноцитам, тучным клеткам, Тh1- и Тh2-лимфоцитам — активные участники ангиогенеза, прежде всего за счет продукции цитокинов, которые могут контролировать пролиферацию эндотелиальных клеток, их выживаемость, апоптоз, миграцию и активацию. В настоящее время очевидно, что ангиогенез — результат баланса между позитивными и негативными регуляторными влияниями.
Исследование способности нейтрофилов
Как важный фактор, изменяющий микроокружение, следует рассматривать и способность нейтрофилов повреждать эндотелий сосудов путем выделения гидрогенпероксидазы, что создает условия выхода жидкости из капилляров, утечки белка и электролитов. В этом случае развивается синдром органной дисфункции.
Этот механизм, который может развиваться при любой патологии, весьма существен и для развития опухолевого процесса. Перечень факторов, которые способствуют усилению роста опухоли с участием нейтрофилов, достаточно велик. К ним относятся VEGF, HGF, IL-8, известные как важные индукторы ангиогенеза. Подтверждением этого служат следующие данные.
Исследование способности нейтрофилов секретировать VEGF, уровень которого в сыворотке крови и супернатантах больных раком полости рта повышается, показало, что содержание VEGF в культуральной жидкости нейтрофилов было значительно больше, чем у здоровых, что сочеталось с плохим прогнозом, а также последующим уменьшением после операции.
Авторы заключают, что нейтрофилы, очевидно, необходимы для развития ангиогенеза и метастазов рака полости рта, а повышение уровня VEGF до операции и снижение его после нее может быть маркером прогноза при этих опухолях.
Сравнительное изучение высокоиммуногенных, метастазирующих и неиммуногенных, слабометастазирующих первичных клеток меланомы с учетом продукции VEGF и IL-8 дало возможность установить ряд интересных фактов.
Эти факты свидетельствуют о том, что продукция IL-8, VEGF и возможность усиления роста опухоли под влиянием этих цитокинов обусловлены ее биологическими особенностями: высокоиммуногенные, метастазирующие опухоли быстро растут и метастазируют в легкие при высоком уровне IL-8 и VEGF, в то время как продукция IL-8 существенно не влияет на рост первичных слабоиммуногенных опухолей. Эффект, аналогичный VEGF, способны индуцировать сериновые протеазы.
Одним из важных факторов влияния нейтрофилов на опухолевые клетки можно считать также их способность изменять миграцию и адгезию этих клеток. В частности, при культивировании нейтрофилов с клетками меланомы линии С8-161 нейтрофилы увеличивают продукцию IL-8 и экспрессию Мас-1, а клетки меланомы существенно усиливают миграцию; блокада ICAM на клетках меланомы или Mac-1 на нейтрофилах существенно ингибировала адгезию и миграцию через эндотелий.
В усилении ангиогенеза важную роль играет и HGF, который продуцируется нейтрофилами, а также фибробластами под влиянием опухолевых клеток. Появление этого фактора в комплексе с другими способствует усилению инвазии.
Свидетельством того, что характер роста опухолевых клеток в определенной степени может предопределить особенности развития воспаления и нарушение микроокружения, служат также данные, полученные при исследовании различных колоректальных карцином с целью выснения причин локальной прогрессии этих опухолей.
Было показано, что прогрессия колоректальных аденокарцином особенно выражена в участках истончения эпителия и образования своеобразных "пор" в опухоли. В этих участках скапливались муцин, нейтрофилы, другие клетки воспаления и некротические элементы, что, по мнению авторов, может служить показателем опухолевой прогрессии.
При исследовании опухолей, индуцированных ультрафиолетовым излучением, отмечено, что некоторые из них отличаются особенной агрессивностью. Оказалось, что рост таких клеток можно было стимулировать факторами, которые выделяют лейкоциты животных с опухолями.
Элиминация гранулоцитов in vivo у бестимусных мышей антителами против гранулоцитов ингибировала рост некоторых опухолей, для быстрого роста которых, по мнению авторов, необходимы гранулоциты.
Параллельно с выделением различных ростовых факторов нейтрофилы могут усиливать рост опухоли выделением продуктов метаболизма, связанного с кислородным стрессом этих клеток, что сопровождает многие заболевания, включая рак. Миелопероксидаза — фермент, который связан с метаболизмом кислорода и выделяется при кислородном стрессе.
Исследование миелопероксидазы у больных со злокачественными новообразованиями женских половых органов показало, что ее содержание в опухолевых тканях было значительно выше, чем в норме. Авторы полагают, что нейтрофилы, моноциты/макрофаги, а также естественные киллеры (ЕК) — клетки, содержащие миелопероксидазу, играют роль в усилении роста опухоли и ее прогрессии.
Весьма важными представляются сведения о том, что нейтрофилы могут быть причастны к формированию инвазивного и метастатического фенотипа.
Соответствующие данные получены при изучении клеток фибросаркомы мышей линии QR-32, которые характеризуются слабыми иммуногенностью и метастазированием.
Однако при определенных условиях эксперимента (введение клеток вместе с желатином) участки индуцированного воспаления инфильтрировались нейтрофилами, и их удаление не влияло на рост опухоли. В отличие от этого введение опухолевых клеток, полученных от мышей, которым вводили антитела против нейтрофилов, приводило к уменьшению количества метастазов, а у мышей, дефицитных по в2-интегрину, их было крайне мало.
Авторы полагают, что воспаление, индуцированное преимущественно нейтрофилами, инфильтрирующими ткань опухоли, очень важно для приобретения метастатического фенотипа.
К продуктам, которые выделяются нейтрофилами и могут влиять на усиление роста опухоли, относятся ММП и коллагеназа-2, играющие важную роль в опухолевой прогрессии. Наряду с этим отсутствие коллагеназы-2 в некоторых случаях, в частности при раке кожи, приводит к парадоксальному эффекту, так как у мышей, дефицитных по этому ферменту, чаще развивается именно рак кожи.

Рис. 66. Включение нейтрофилов в усиление роста опухоли
Появилась информация о том, что рост некоторых опухолей таким образом изменяет микроокружение, что оно способствует привлечению нейтрофилов. Подтверждающие это данные получены при исследовании различных опухолей.
Так, изучение роли нейтрофилов в развитии аденокарциномы легкого параллельно с такими факторами, как IL-8, GM-CSF, TNFa, G-CSF дало возможность выявить следующее.
Как известно, нейтрофилов практически нет в нормальной легочной ткани, однако при развитии бронхоальвеолярной аденокарциномы наблюдается инфильтрация нейтрофилами, которые начинают продуцировать указанные факторы.
Инфильтрацию ткани рака легкого нейтрофилами можно объяснить, опираясь на точку зрения, согласно которой при росте опухоли изменяется микроокружение, индуцирующее миграцию нейтрофилов из периферической крови.
Перечисленные факторы способствуют выделению нейтрофилами HGF, который выявляется в бронхоальвеолярном смыве и супернатантах культивируемых нейтрофилов практически всех больных.
По мнению авторов, именно выделение нейтрофилами биологически активной формы HGF, который взаимодействует с опухолевыми клетками, экспрессирующими соответствующие рецепторы, является причиной инвазии при бронхоальвеолярной аденокарциноме (субтип ADC) и способствует распространению процесса. Схематически процесс представлен на рис. 67.

Рис. 67. Прогрессирование процесса при инфильтрации бронхоальвеолярной карциномы нейтрофилами
Определяется еще один аспект негативного влияния нейтрофилов. Получены данные о том, что при определенных условиях они могут быть причастны к формированию лимфопролиферативных заболеваний. Как известно, при некоторых заболеваниях развивается нейтропения, которая предрасполагает к миелодисплазии и острой миелоидной лейкемии.
В этих случаях обнаружены мутации в гене, который кодирует эластазу нейтрофилов, включающуюся в протеолитическую регуляцию гематопоэза. Такой механизм рассматривается как новый путь индукции лейкемии.
Роль фагоцитирующих клеток в росте опухоли
На основании изложенного материала, свидетельствующего, что фагоцитирующие клетки способны усиливать рост опухоли, представляется возможным во многом объяснить разнонаправленность оценок инфильтрации различных опухолей моноцитами, макрофагами, нейтрофилами.
Одной из основных причин, приводящих к иммунологическому усилению роста опухоли этими фагоцитирующими клетками, является их способность к индукции воспаления, что особенно ярко проявляется при инфильтрации нейтрофилами, продукции факторов, усиливающих ангиогенез, и изменении микроокружения.
При стимуляции роста опухоли моноцитами, макрофагами, нейтрофилами достаточно четко прослеживается такая этапность событий: инфильтрация ткани опухоли указанными клетками, выделение биологически активных веществ, включая ростовые факторы, усиление ангиогенеза и нарушение микроокружения.
Появилась возможность говорить о том, что общий механизм стимуляции роста опухоли как макрофагами, так и нейтрофилами, вероятно, включает и возможность формирования определенного морфологического типа опухоли, а также метастатического фенотипа.
Очевидно, этому во многом способствует нарушение межклеточных взаимодействий в связи с изменениями микроокружения, когда на фоне деградации матрикса, усиления ангиогенеза реализуется такой тип взаимодействия, который не способствует осуществлению противоопухолевого ответа.
Перечисленными фактами не исчерпываются причины стимуляции роста опухоли, так как в условиях аномального микроокружения усиливается пролиферация опухолевых клеток, изменяется фенотип, в частности макрофагов, наблюдается апоптоз Т-лимфоцитов, создаются условия для различных супрессирующих влияний на клетки системы иммунитета, что, в частности, проявляется ослаблением цитотоксичности киллерных клеток и др.
Естественно, что особый интерес вызывает вопрос о четком определении фенотипа как макрофагов, так и нейтрофилов, которые усиливают рост опухоли. И если в отношении моноцитов/макрофагов наметились достаточно четкие подходы к характеристике этого фенотипа, то в отношении нейтрофилов этот вопрос находится лишь на ранних этапах изучения.
Все изложенное в комплексе с приведенными фактами позволяет говорить о том, что неблагоприятный прогноз течения заболевания, сопровождающийся инфильтрацией опухоли моноцитами, макрофагами, нейтрофилами происходит с участием клеток тех клонов, которые могут усиливать рост опухоли.
Поэтому противоречивые оценки, по сути, не являются противоречивыми, а служат доказательством того, что среди одной и той же популяции есть клоны клеток, функции которых реализуются по-разному. Противоречия могут быть исчерпаны при наличии полной информации о фенотипических особенностях клеток, инфильтрирующих опухоль.
Взаимодействие нейтрофилов и опухолевых клеток при определенных условиях может приводить к усилению миграции и адгезии последних, а также формированию метастатического фенотипа.
Бережная Н.М., Чехун В.Ф.
Как известно, учение о цитокинах (монокинах, лимфокинах, интерлейкинах, хемокинах, различных ростовых факторах) начало формироваться к концу 60-х годов прошлого столетия, непрерывно и очень активно развивалось на протяжении всех последующих десятилетий и в настоящее время представляет собой .
Еще P. Erlich отметил, что, во-первых, многие опухоли могут быть инфильтрированы эозинофилами, а во-вторых, в некоторых случаях такая инфильтрация сочетается с благоприятным прогнозом. В последующем было получено много примеров инфильтрации эозинофилами различных опухолей — ходжкинские и неходжкинск.
Исследования последних лет показывают, что наиболее активными антигенпрезентирующими клетками являются дендритные клетки, впервые выявленные в 1973 г. R. Steinman и Z. Colin. В дальнейшем было установлено и дендритное происхождение клеток Лангерганса, которые как "нервные" клетки были опис.
СD8+Т-лимфоциты — клетки, экспрессирующие антиген CD8, представлены основными двумя субпопуляциями — цитотоксическими Т-клетками и Т-лимфоцитами с супрессорной активностью. Со временем стало известно, что CD8 экспрессируют не только эти субпопуляции лимфоцитов, но и отдельные клоны других клеток.
Согласно условиям формирования иммунологического ответа на антигены различной природы его развитие, как отмечено выше, сопровождается обязательной экспрессией молекул ГКГ. Система ГКГ обеспечивает регуляцию всех форм иммунологического ответа, начиная от распознавания, и в конечном итоге — общий конт.
Основными антигенпрезентирующими клетками являются: В-лимфоциты, макрофаги и дендритные клетки. Особенности развития, дифференцировки, фенотипа, функций, участия в различных формах иммунологического ответа антигенпрезентирующих клеток — базисная область фундаментальной иммунологии, которая уже в теч.
Как отмечалось выше, CD40 и CD40L впервые были описаны соответственно как рецептор В-лимфоцитов и его лиганд на Т-лимфоцитах и с полным основанием определены как один из центральных механизмов взаимодействия указанных популяций лимфоцитов.
Читайте также:





