Проточная цитометрия для онкологии
Основные принципы метода проточной цитометрии. Регистрируемые параметры. Настройка прибора, пробоподготовка образцов. Основной метод анализа цитометрических данных. Сфера применения метода в медицине, его достоинства и недостатки, пути совершенствования.
| Рубрика | Медицина |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 29.09.2017 |
| Размер файла | 94,4 K |
- посмотреть текст работы
- скачать работу можно здесь
- полная информация о работе
- весь список подобных работ
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Проточная цитометрия
проточный цитометрия медицина
Первый патент на устройство, которое легло в основу проточной цитометрии, использующее принцип сопротивления Коултера было зарегистрировано в США в 1953 году, его автор Wallace H. Coulter. Адсорбционные методы на тот момент были распространены гораздо шире флуоресцентных.
Первый прибор, использующий флуоресценцию, был создан в 1968 году Wolfgang Gцhde из University of Mьnster и почти сразу получил коммерческое использование немецким разработчиком и изготовителем Партеком (Partec) в Геттингене. Новый метод быстро получил свое признание и развитие, и в период 70 х годов появилось несколько инструментов для проточной цитометрии включая Cytofluorograph (1971) от Bio/Physics Systems Inc., PAS 8000 (1973) от Partec, первые FACS оснащают датчиками от Becton Dickinson (1974), ICP 22 (1975) от Partec/Phywe и Epics от Коултера (1977/ 78). Изначально методику называли пульсовой цитофлоуметрией. Только 20 лет спустя в 1988, на Конференции американского Технического Фонда в Пенсаколе, штат Флорида, название было изменено на "проточную цитометрию", и именно этот термин быстро стал популярным.
1. ПРИНЦИП МЕТОДА
Основа метода заключается в:
1) использовании системы гидродинамической фокусировки либо микрокапилларной системы, которая обеспечивает прохождение клеток в потоке поодиночке;
2) облучении клетки лазерным излучением;
3) регистрации сигналов светорассеяния и флуоресценции от каждой клетки.
Кроме того, в ходе анализа учитывается уровень флуоресценции химических соединений, входящих в состав клетки (аутофлуоресценция) или внесённых в образец перед проведением проточной цитометрии.
За образцы берут кровь, костный мозг, ликвор, суставная жидкость, плевральная жидкость, асцитическая жидкость, суспензированные клетки тканей (например, опухолей).
Клеточная суспензия, предварительно меченная флюоресцирующими моноклональными антителами или флуоресцентными красителями (флуоресцеина изотиоцианат, фикоэритрин, аллофикоцианин и др.), попадает в поток жидкости, проходящий через проточную ячейку. Условия подобраны таким образом, что клетки выстраиваются друг за другом за счет т. н. гидродинамического фокусирования струи в струе. В итоге клетки одна за другой проходят через лазерный луч, а высокочувствительные детекторы, расположенные вокруг проточной ячейки регистрируют флюоресценцию и рассеянное лазерное излучение каждой клетки. Полученный сигнал передается в компьютер, обрабатывается, и полученные данные отображаются в виде различных графиков и гистограмм.
Рис 1. Схема оборудования для проведения проточной цитометрии.
2. РЕГИСТРИРУЕМЫЕ ПАРАМЕТРЫ
1. Прямое (малоугловое) светорассеяние.
Детектор прямого светорассеяния располагается по ходу лазерного луча за проточной ячейкой и регистрирует излучение лазера, которое рассеивается под углами 2-19 градусов. Интенсивность рассеянного под малым углом света пропорциональна размеру клетки. Более крупные клетки рассеивают свет сильнее мелких.
2. Боковое светорассеяние.
Внутреннее содержимое клеток оптически неоднородно. Луч лазера, проходя сквозь клетку, многократно преломляется и рассеивается во все стороны. Регистрация этого излучения позволяет судить о сложности внутреннего строения клетки (соотношение ядро-цитоплазма, наличие гранул, других внутриклеточных включений). Комбинация бокового и прямого светорассеяния позволяет судить о морфологии клетки в целом, выделять различные популяции клеток (лимфоциты, моноциты, гранулоциты) для дальнейшего анализа.
3. Регистрация флуоресценции.
Система для регистрации свечения флюоресцентных меток состоит из комплекса светофильтров и фотоумножителей, каждый из которых регистрирует излучение в диапазоне длин волн, соответствующих флюорохрому. Выбор типа и количества флуоресцентных красителей определяется поставленной задачей для данного исследования. Основными типами таких красителей являются моноклональные антитела, коньюгированные с флюоресцентной меткой (FITC, PE, APC, PerCP и др.) для определения мембранных и цитоплазматических антигенов клетки, красители, позволяющие оценить жизнеспособность клеток (7AAD, PI) флуорофоры, связывающиеся с нуклеиновыми кислотами (DAPI, Hoechst), pH-чувствительные флуорофоры (Fluo-3), ион-зависимые флуорофоры (Indo-1).
4. Сортировка клеток.
В проточном цитометре, оборудованном системой для сортировке клеток, проточная ячейка закреплена на пьезокристалле. При подаче на него напряжения кристалл вместе с ячейкой совершает колебания с заданной частотой, в результате чего струя жидкости с клетками разбивается на отдельные капли. Проходя сквозь заряжающее кольцо, капля может приобретать положительный или отрицательный заряд в зависимости от того, какая клетка содержится внутри капли. Пролетая мимо отклоняющих пластин капля с клеткой притягивается к ним, выходит из основного потока и попадает в пробирку.
3. ДРУГИЕ ФУНКЦИИ
Настройка прибора для исключения паразитного свечения флюорохрома в соседних каналах. Характеристики установленных на проточном цитометре светофильтров таковы, что их область пропускания соответствует максимуму спектра испускания флуорофора. Но за счет того, что спектр испускания флуорофора может быть достаточно широким, часть его излучения может проходить сквозь другие светофильтры, настроенные на регистрацию излучения дрогогофлуорофора. То есть к примеру некоторая доля излучения от красителя FITC будет регистрироваться в канале, предназначенном для фикоэритрина, искажая результаты измерения. Для исключения данного эффетка необходимо уменьшать сигнал с детектора пропорционально сигналу с соседнего детектора, компенсируя таким образом паразитное свечение соседних флуорохромов. Величина компенсации зависит от многих параметров: напряжения на фотоумножителе и как следствие его чувствительности, спектра используемых флуорохромов, производителя реактивов (меченые антитела от разных производителей имеют разное соотношение белок/флуорофора, соответственно одни и те же образцы окрашенные различными антителами будет давать сигналы разной интенсивности).
Дискриминатор
Функция, благодаря которой не регистрируются события, не удовлетворяющие какому-либо условию. Чаще всего данная функция используется для того чтобы не регистрировать объекты имеющие маленький размел, то есть исключить из анализа частицы разрушенных клеток, тромбоциты, другие мелкие посторонние объекты. Благодаря использованию дискриминатора уменьшается нагрузка на компьютер прибора, повышается его быстродействие, уменьшается размер записываемых файлов, что облегчает последующий анализ данных. Дискриминатор должен быт настроен таким образом, чтобы отсекать большую часть дебриса, но при этом не захватывать область, содержащую интересующие исследователя события.
Пробоподготовка образцов
В качестве образцов для исследования на проточном цитометре могут использоваться различные суспензии клеток и биологические жидкости. Для проведения исследования на проточномцитометре необходимо минимизировать количество частиц в исследуемой суспензии, которые могут затруднить анализ. Чаще всего такими частицами являются эритроциты в образцах крови или костного мозга, тогда как объектом исследования выступают лейкоциты. Получение лейкоцитарной суспензии возможно несколькими способами. Во-первых можно лизировать эритроциты каким-либо химическим агентом, разрушающим мембрану эритроцита (наиболее распространенным является 0,9% раствор хлорида аммония). Вторым распространённым способом получения лейкоцирарной суспензии является центрифурирование в градиенте плотности (например выделение мононуклеарной фракции из крови при помощи центрифугирования на фиколе).
Неспецифическое связывание антител
На точечной диаграмме неспецифическое связывание выглядит в виде “хвоста”, тянущегося от двойной негативной популяции под углом 45 градусов в верхний правый угол. Неспецифической связывание характерно для образцов с большим содержанием погибших клеток, а также для клеток, имеющих на поверхности Fc-рецептор (в основном, клетки, способные к фагоцитозу). Для борьбы с данным феноменом следует перед окрашиванием антителами обрабатывать клетки специальными реагентами для блокировки Fc-рецептора, проводить подготовку образцов таким образом, чтобы минимизировать гибель и разрушение клеток в процессе пробоподготовки. Также при анализе полученных данных нужно стараться чтобы в регион анализа попадало как можно меньше погибших клеток и дебриса.
Логическое гейтирование
Основной метод анализа цитометрических данных заключается в выделении какой-либо популяции клеток, и дальнейшего анализа событий, относящихся только к интересующей популяции. Гейтирование может производиться по любым регистрируемым параметрам и с использованием любых логических операторов и их комбинаций (И, ИЛИ, НЕ). На представленном примере сперва производится гейтирование по CD45 позитивным событиям выделение лейкоцитарной популяции и отсев дебриса. Следующим шагом идет выделение лимфоцитарной популяции по параметрам прямого и бокового светорассеяния. И уже после двойного гейтирования по CD45 и лимфоцитарному региону происходит заключительный этап анализа - определение процентного содержания субпопуляций лимфоцитов.
4. ПРИМЕНЕНИЕ МЕТОДА
Иммунология
- иммунофенотипирование клеток периферической крови.
- определение фагоцитарной активности (захват меченных флюорохромами бактерий или дрожжей).
- определение внутриклеточных цитокинов (спонтанная продукция и под действием различных специфических или неспецифических активаторов, таких как ФМА + иономицин, ЛПС, ФНО-альфа).
- определение внутриклеточных белков, например транскрипционных факторов GATA-3, T-bet, FoxP3 для дискриминации CD4 Т-лимфоцитов.
- определение пролиферативной активности (выявление инкорпорированого бромдезоксиуридина).
- исследование клеточного цикла.
- оценка клеточной цитотоксичности.
- количественный анализ внутриклеточных компонентов (ДНК).
- анализ стадий клеточного цикла.
- выявление анеуплоидного клона.
- определение пролиферативной активности анеуплоидного клона.
- определение специфических маркеров.
- позволяет проводить наблюдение пациентов, входящих в группу риска.
- оценка состояния иммунной системы:
· оценка клеточного звена иммунитета (определение субпопуляций лимфоцитов).
· оценка функциональной состоятельности иммунокомпетентных клеток (NK тест, фагоцитарный тест и т. п.).
- определение цитоморфологической принадлежности клетки размер, соотношение ядро/цитоплазма, степень асимметричности и гранулярности клеток.
- оценка активности внутриклеточных ферментов с помощью флюорогенных субстратов.
- определение экспрессии поверхностных антигенов.
- анализ стадий клеточного цикла.
- измерение физиологических параметров клетки (внутриклеточный pH, концентрация свободных ионов Ca 2+ , потенциал наружной клеточной мембраны).
Гематология
- анализ субпопуляционного состава клеток периферической крови.
- подсчет ретикулоцитов, анализ тромбоцитов по специфическим маркерам.
- дифференциальная диагностика лимфопролиферативных заболеваний и реактивных лимфоцитозов.
- диагностика лимфопролиферативных заболеваний.
- диагностика острых лейкозов.
- оценка минимальной резидуальной болезни.
Фармакология
- измерение экспрессии маркеров.
- измерение активности внутриклеточных ферментов.
- определений стадий клеточного цикла в рамках изучения механизмов воздействия различных биологически активных веществ на клеточном уровне.
В настоящее время проточная цитометрия применяется также и в инфектологии для выявления определённых клеток в исследуемых образцах (как бактериальных так и грибковых), определения чувствительности микроорганизмов к антибактериальным препаратам, а также мониторирования состояния вирусного процесса у ВИЧ-инфицированных пациентов.
Рис 2. Проточный цитофлюориметр СYTOMICS FC 500.
Рис 3. Проточный цитофлюориметр CyAn ADP.
5. ПРЕИМУЩЕСТВА И НЕДОСТАТКИ
- короткое время анализа за счет высокой скорости (до 100 000 событий в секунду).
- анализ большого количества клеток (до 108 клеток в мл).
- определение субпопуляций клеток.
- измерение параметров редко встречающихся клеток.
- объективное измерение интенсивности флуоресценции.
Преимуществами сортировки клеток на проточном цитометре является высокая чистота получаемой популяции клеток (до 99.9% позитивных клеток в отсортированной фракции), возможность сортировать клетки по любым комбинациям детектируемых параметров. Данный метод позволяет отсортировывать любое количество клеток, вплоть до единичных клеток, что является незаменимым в технологиях связанных с клонированием.
Недостатки: Проходя через системы прибора клетки подвергаются некоторым неблагоприятным воздействиям (лазерное излучение, перепады давления) что несколько снижает процент жизнеспособных клеток на выходе по сравнению с исходным материалом. Также, при сортировке на проточном цитометре бывает затруднительным соблюдение абсолютной стерильности, что ограничивает применение данного метода в клинической практике.
ЗАКЛЮЧЕНИЕ
Таким образом, можно сделать вывод о том, что метод проточной цитометрии является перспективным направлением, имеет множество преимуществ, функций и обладает высокой чувствительностью и скоростью анализа. Разнонаправленность метода позволяет использовать его в различных современных и значимых клинических направлениях и научных исследованиях. В настоящее время создаются всё более универсальные и многофункциональные цитометры, разрабатываются более мощные системы управления, делая данный метод рациональнее и актуальнее в современном мире, и в частности в медицине.
СПИСОК ЛИТЕРАТУРЫ
2. Клиническая иммунология и аллергология / Под ред. Лолора-младшего Г., Фишера Т., Адельмана Д. Пер. с англ. - М.: Практика, 2000. - 806 с.
4. Хаитов Р.М., Пинегин Б.В., Ярилин А.А. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы / Руководство для врачей. - М: ГОЭТАР-Медиа, 2009, - 352 с.
5. Хайдуков С.В., Зурочка А.В. Проточная цитометрия как современный метод анализа в биологии и медицине, М. 2007.
6. Л.В. Ковальчук, Г.А. Игнатьева, Л.В. Ганковская "Иммунология. Практикум".
7. Исаев В.Л., Пинчук В.Г., Исаева Л.М. Современные методы автоматизированных цитологических исследований. - Киев: Наук. думка, 1988. - 218 с.
8. Полетаев А.И. Проточная цитометрия и сортировка в цитологии, молекулярной биологии, биотехнологии и медицине. М., ВИНИТИ, 1989, 87с.
Размещено на Allbest.ru
Основные блоки проточного цитометра. Принципиальная схема устройства. Принцип работы проточного цитофлуориметра. Сравнительная характеристика приборов для проточной цитометрии. Особенности работы диагностических наборов для проточной цитометрии.
реферат [272,3 K], добавлен 18.01.2015
Историческая справка о развитии рентгенодиагностики, назначение традиционной флюорографии как ее метода. Основные преимущества и недостатки применения флюорографии. Опасность использования метода при беременности. Особенности цифровой флюорографии.
реферат [148,6 K], добавлен 25.03.2017
История криоцервации и витрификации, физическое обоснование данных процессов, их основные этапы и значение. История формирования и развития принципов проведения криоцервации и витрификации, обоснование и условия их применения в современной медицине.
контрольная работа [35,4 K], добавлен 12.12.2014
Общая характеристика ЗАО "Биосвязь", рассмотрение основных видов деятельности. Знакомство с особенностями применения метода биологической обратной связи в ряде медицинских учреждений. Анализ стабилографического метода биологической обратной связи.
реферат [43,2 K], добавлен 14.02.2014
Сущность и принципы метода полимеразной цепной реакции, его достоинства и недостатки. Метод молекулярных колоний. Онкомаркеры в клинической диагностике. Муциноподобный ассоциированный антиген в сыворотке. Алгоритм и методика исследования на онкомаркеры.
курсовая работа [59,6 K], добавлен 19.11.2014
История открытия метода полимеразной цепной реакции (ПЦР), его особенности и этапы. Методика проведения анализа в режиме реального времени. Преимущества применения метода ПЦР в диагностике инфекционных заболеваний, его ограничения и сферы использования.
реферат [685,7 K], добавлен 03.05.2013
Характеристика свойств нанокомпозитов как многокомпонентного твердого материала. Виды полимерных нанокомпозитных материалов. Особенности их строения и сфера применения. Эффективность данных материалов в области стоматологического протезирования.
презентация [398,2 K], добавлен 25.12.2014
Понятие потенциометрии как электрохимического метода анализа, ее применение. Ионометр, pH-метр: принципы работы, области и методы применения. Прямая потенциометрия (ионометрия) и потенциометрическое титрование. Преимущества потенциометрических методов.
презентация [1,5 M], добавлен 04.03.2016
Значение эпидемиологических исследований в процессе оценки факторов риска разного уровня обобщения. Принципы и этапы проведения социально-гигиенического мониторинга здоровья населения. Основные достоинства метода случай-контроль и когортного испытания.
презентация [824,4 K], добавлен 04.10.2017
Исследование и изучение научной литературы, посвященной методам плацебо. Рассмотрение основных понятий, формулировки, сферы применения эффектов внушения в медицине, их непосредственного влияния на физическое и психическое состояние современного человека.
курсовая работа [296,2 K], добавлен 31.03.2015

- главная
- рубрики
- по алфавиту
- вернуться в начало страницы
- вернуться к началу текста
- вернуться к подобным работам
- Рубрики
- По алфавиту
- Закачать файл
- Заказать работу
- Вебмастеру
- Продать
- весь список подобных работ
- скачать работу можно здесь
- сколько стоит заказать работу?
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Проточная цитофлуориметрия – это цитологический метод исследований, применяющийся для углубленного анализа клеток. Его преимуществом является то, что он позволяет изучить каждую клетку в отдельности. Данный вид анализа помогает произвести оценку нескольких параметров у сотен клеток за считанные секунды. Благодаря этому цитофлуориметрия считается одним из наиболее быстрых и точных способов анализа, которые доступны ученым и клиницистам в настоящее время.
Принцип
Принцип метода проточной цитофлуориметрии основан на измерении рассеивания света и свечения (флуоресценции) клеток. Клеточную суспензию пропускают в виде потока с большой скоростью через ячейку цитометра, где происходит ее облучение лазером. Там же производится, так называемая гидродинамическая фокусировка. Ее механизм заключается в том, что поток из ячейки с изучаемыми частицами на выходе вливается во внешнюю струю, которая обладает большей скоростью. В результате происходит выстраивание частиц в упорядоченную цепочку.
Предварительно клетки метят специальными флуоресцирующими красителями (флуорохромами). Благодаря им лазерный луч возбуждает вторичное свечение. Полученные световые сигналы регистрируются детекторами. В последующем информация обрабатывается при помощи программных алгоритмов, которые позволяют подсчитать отдельные популяции клеток, различающиеся по каким-либо критериям.
Исследование с помощью традиционной микроскопии часто не позволяет отличить разные клетки, так как они одинаково выглядят. Цитофлуориметрия может предоставить и другие данные (целостность структуры ДНК), провести анализ экспрессии белков, выживаемости клеток.
Так как для возбуждения флуорохромов нужны световые лучи с разной длиной волны, а также разные типы детекторов, то современные установки оснащены несколькими каналами детекции (от 4 до 30). Количество лазерных излучателей может быть от 1 до 7. Более сложные по составу устройства позволяют осуществлять многопараметрические исследования сразу нескольких свойств частиц.
Преимущества и недостатки

К преимуществам проточной цитофлуориметрии относятся следующие:
- высокая скорость обработки (регистрация до 30 тысяч событий за 1 секунду);
- возможность исследования большого числа клеток (до 100 млн. в образце);
- количественная оценка интенсивности флуоресцентного излучения;
- анализ каждой из клеток;
- одновременное исследование разнородных процессов;
- автоматическое разделение данных по популяциям клеток;
- качественная визуализация результатов.
Еще одной особенностью этой технологии является то, что анализируемую частицу допускается окрашивать несколькими флуоресцентными растворами. Благодаря этому происходит многопараметрическое исследование.
К недостаткам можно отнести сложность технического оборудования и необходимость специальной подготовки пробы.
Цитометры
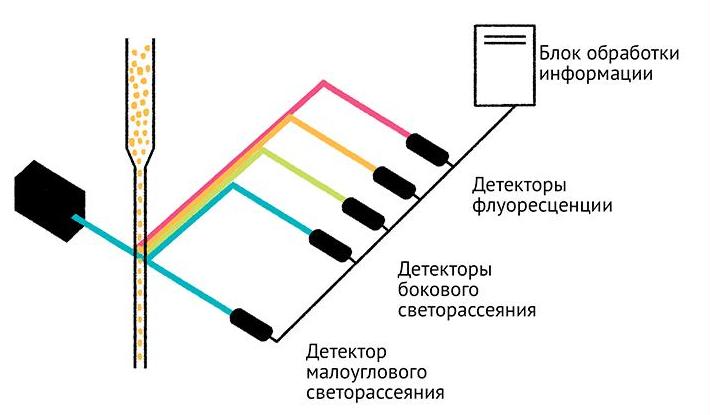
Первые устройства такого типа появились уже в 1968 году в Германии, но широкое распространение они получили гораздо позднее. В настоящее время все приборы, работающие по методу проточной цитофлуориметрии, можно разделить на 2 типа:
- устройства, что измеряют флуоресцентное излучение (две и более длины волны), рассеяние света под углом 10 и 90° (детектор малоуглового и бокового рассеяния);
- аппараты, которые, помимо измерения нескольких клеточных параметров, автоматически производят сортировку на группы в соответствии с этими критериями.
Детектор прямого светорассеяния предназначен для определения размеров клетки, а устройство для регистрации бокового светорассеяния позволяет получить информацию о наличии внутриклеточных гранул, объемного соотношения цитоплазмы и ядра.
Классические цитометры, в отличие от световых микроскопов, не позволяют получить изображение клетки. Однако в последние годы разработаны комбинированные устройства, которые способны совмещать возможности микроскопа и цитофлуориметра. Речь о них пойдет ниже.
Визуализирующие цитометры

Для приборов, использующихся в классической проточной цитофлуориметрии, характерна одна особенность: если в популяции анализируемых клеток зарегистрированы редкие события, то нет возможности оценить, какова их суть. Эти частицы могут оказаться как останками умерших клеток, так и их редкой группой. В обычных аппаратах такие данные исключаются из общего потока событий, однако именно они могут представлять особую ценность для научного и клинического анализа.
Визуализирующие проточные цитометры нового поколения позволяют зафиксировать изображение каждой клетки, проходящей в потоке через зону детектора. Его легко увидеть, нажав на соответствующую область диаграммы, которая выводится на монитор компьютера.
Сферы применения
Проточная цитофлуориметрия – универсальный метод, который применяется во многих областях медицины и науки:
- иммунология;
- онкология;
- трансплантология (трансплантация красного костного мозга, стволовых клеток);
- гематология;
- токсикология;
- биохимия (измерение кислотности внутри клетки, исследование других параметров);
- фармакология (создание новых лекарств);
- микробиология;
- паразитология и вирусология;
- океанология (изучение фитопланктона для оценки состояния водоемов и другие задачи);
- нанотехнологии и анализ микрочастиц.
Иммунология
Иммунная система человека состоит из большого количества разнообразных клеток. Проточная цитофлуориметрия в иммунологии позволяет оценить их структуру и функции, то есть провести морфофункциональный анализ.
Такие исследования помогают изучить сложную природу иммунитета. Фенотипы клеток меняются в результате активации антигенами, развития патологий и других факторов. Цитофлуориметрия может разделить субпопуляции иммунных клеток в сложной смеси и оценить все их изменения в динамике.
Онкология
Одной из важнейших задач в онкологии является дифференцирование клеток по их типу. Принцип анализа по методу проточной цитофлуориметрии в онкогематологии основан на следующем явлении: при обработке пробы специальным флуоресцентным красителем происходит его связывание с белками цитоплазмы. После деления в активно пролиферирующих клетках происходит снижение его содержания в два раза. Соответственно, двукратно уменьшается и интенсивность свечения клеток.
Существуют и другие способы выявления пролиферирующих клеток:
- использование ДНК-связывающих красителей (йодид пропидия);
- применение меченого урацила;
- регистрирование повышенного уровня экспресии белков циклинов, которые участвуют в регуляции клеточного цикла.
Комплекс методов проточной цитометрии позволяет измерять физические и химические параметры отдельных клеток или частиц. Он основан на регистрации флуоресценции и светорассеяния от отдельных клеток или частиц, проходящих через лазерный луч в струе жидкости. Методы проточной цитометрии чаще всего применяется при исследовании периферической крови человека, в частности лейкоцитов. Также можно исследовать диссоциированные клетки любых тканей, дрожжевые клетки, бактериальные клетки, микропланктон, флуоресцентные микросферы с зондами.
Комплекс методов проточной цитометрии включает:
- 1. Анализ клеток и частиц:
- - идентификация отдельных классов, подклассов, популяций, субпопуляций путем измерения их поверхностных и/или внутриклеточных маркеров;
- - оценка функционального состояния клеток (митохондриальный потенциал, внутриклеточный кальций, pH) с использованием специальных ратиометрических красителей (FDA, DiOC1, JC -1 и др.);
- - оценка функционального состояния клеток с помощью специфических антител к фосфорилированным и не-фосфорилированным формам изучаемых белков;
- - многопараметрический (многоцветный) анализ проб;
- - анализ параметров клеточного цикла и содержания ДНК в живых и фиксированных клетках;
- - изучение кинетических параметров клеточных процессов (повреждение клеточных мембран, ферментативная активность);
- - исследование механизмов и стадий апоптоза с использованием разнообразных маркеров и зондов;
- - изучение фагоцитоза, в том числе в нейтрофилах крови и макрофагах;
- - исследование чувствительности клеток к цитостатикам путем определения уровня экспрессии белков (P-gp и др.);
- - молекулярно-генетические исследования (изучение отдельных хромосом и экспрессии генов);
- - проточное кариотипирование хромосом с использованием флуоресцентных зондов.
- 2. Сортировку клеток и частиц:
- - сортировка до 4 фракций в соответствии с проведенным гейтированием;
- - сортировка единичных клеток в культуральные и/или ПЦР-планшеты.
Цитометрический анализ клеточного цикла
Используемое оборудование РЦ:
- проточный цитофлуориметр-сортировщик клеток BD FACSAriaIII;
- рутинное оборудование.
Описание метода:
Анализ клеточного цикла – один из методов изучения пролиферативной активности клеток. С помощью метода исследуются фазы клеточного цикла: оценивается распределение клеток по G1/G0-, S- и G2/M-фазам клеточного цикла путем определения относительного содержания ДНК в клетках при помощи ДНК-связывающих флуоресцентных красителей, таких как PI (йодистый пропидий), 7-AAD (7-аминоактиномицин), DAPI (4’6’-diamidino-2-phenylindole (DAPI)), Hoechst, SybrGreen и др. С помощью данного метода можно анализировать только клеточные суспензии, что является одним из ограничительных факторов метода.
Метод используется как в научных, так и в клинических исследованиях, например,:
- - выявление высоко пролиферирующих популяций клеток;
- - выявление анеуплоидных популяций клеток;
- - анализ эффектов лекарственных препаратов.
Вариации метода:
- использование различных красителей ДНК:
- 1). Красители, проникающие через плазматическую мембрану и мембрану ядра, предназначенные для окрашивания живых клекток.
- 2). Красители, не проникающие через мембраны ядра, требующие предварительной обработки клетки: фиксации и/или пермеабилизации;
- в случае необходимости фиксации и/или пермеабилизации использование разных агентов:
- 1). Использование спиртов (этанола) – одновременно и фиксирующего, и пермеабилизирующего агента. Использование спиртов обеспечивает легкий доступ красителя в ядро, а также хорошие характеристики анализируемого сигнала – низкий коэффициэнт вариации (CV). Однако, часто использование спиртов несовместимо с использованием флуоресцентных красителей. Фиксированные спиртом клетки стабильны в течение нескольких недель при температуре 4°C.
- 2). Использование альдегидов (параформальдегида) – фиксирующего агента. Использование альдегидов позволяет одновременную (синхронную) детекцию различных флуорохромов и мембран-связанных протеинов. Однако, использование альдегидов приводит к ухудшению характеристик анализируемых сигналов (высокий коэффициент вариации), а также в большинстве случаев альдегиды только фиксируют, но не пермеабилизируют мембраны, что приходит к необходимости применять дополнительные пермеабилизирующие агенты, такие как Triton X-100 (0.1%) и др. Фиксированные альдегидом клетки стабильны в течение двух-трех дней при температуре 4°C.
Протокол анализа клеточного цикла с помощью проточной цитометрии путем окрашивания ДНК йодистым пропидием (PI)
- 70% этонол,
- йодистый пропидий (исходный раствор 50 мкг/мл),
- рибонуклеаза I (исходных раствор 100 мг/мл).
- 1). Собрать клетки в пробирку и отмыть несколько раз в PBS.
- 2). Провести фиксацию клеток в холодном 70% этаноле: Осадить клетки; удалить буфер; перемешивая клетки на вортекте, медленно добавлять этанол. Таким образом происходит фиксация всех клеток и предотвращается образование слипшихся масс. Оставить фиксироваться клетки в этаноле на 30 мин при 4°C.
- 3). Отмыть клетки от этанола в PBS (2 раза): отцентрифугировать клетки на скорости 850 g, осторожно слить супернатант, избегая потери клеток, особенно после первой отмывки от этанола. Оставить часть клеток в качестве отрицательного контроля (неокрашенные клетки).
- 4). Обработать клетки рибонуклеазой I: добавить 50 мкл исходного раствора рибонуклеазы I (100 мг/мл). Это обеспечит связывание только ДНК с красителем, но не РНК.
- 5). Добавить 200 млк исходного раствора PI (100 мг/мл).
- Анализ образца на проточной цитрфлуориметре:
- 1) Настроить прибор с помощью неокрашенных клеток.
- 2) Найти и гейтировать исследуемый образец на гистограмме FSC-A (прямое светорассеяние) против SSC-A (боковое светорассеяния).
- 3) Отделить синглеты на гистограмме SSC-H (высота сигнала бокового светорассеяния) против SSC-W (ширина сигнала бокового светорассеяния).
- 4) Провести анализ фаз клеточного цикла на гистограммах FSC-A против PI; PI-W (ширина сигнала флуоресценции PI) против PI-A (площадь) сигнала флуоресценции PI); PI против количества клеток.
- M.G. Ormerod, B. Tribukait, Walter Giaretti. Consensus report of the task force on standardisation of DNA flow cytometry in clinical pathology// Analytical Cellular Pathology. (Hindawi Publishing Corporation) 1998, v.17, № 2, p.103-110.
- Кудрявцев И.В., Хайдуков С.В., Зурочка А.В., Черешнев В.А. Проточная цитометрия в экспериментальной биологии. Екатеринбург: РИО УрО РАН, 2012, 192 с.
Цитометрический анализ апоптотической (программируемой) клеточной гибели: AnnexinV-FITC/PI
Используемое оборудование РЦ:
- проточный цитофлуориметр-сортировщик клеток BD FACSAriaIII;
- рутинное оборудование.
Описание метода:
Цитометрический анализ апоптотической (программируемой) клеточной гибели с помощью AnnexinV-FITC/PI – один из комплекса методов исследования апоптоза с помощью проточной цитометрии. AnnexinV-FITC/PI – самый распространенный и легко воспроизводимый тест для исследования апоптоза клетки, который, однако, не заменяет другие тесты, и для получения полноценных данных применяется в комплексе с ними.
Апоптотическая гибель клетки состоит из 4 основных стадий: 1) Начальная стадия – индукция (внешний или внутрений пути) – обратимая стадия. 2) Первые видимые события: митохондриальная "катастрофа" – пермеабилизация наружной мембраны и сброс потенциала; нарушение калий-натриевого баланса и съеживание клетки. 3) Промежуточные события: активация каспаз и экстернализация фосфатидилсерина; нарушение проницаемости плазматической мембраны. 4) Поздние события: деградация ДНК, конденсация и затем фрагментация ядра, полная пермеабилизация плазматической мембраны; распад клетки. С помощью описываемого метода (AnnexinV-FITC/PI) можно разделить клетки на живые клетки (влючает живые клетки и клетки на первой и второй стадиях апоптоза), апоптотичесчкие клетки (третья и частично четвертая стадии апоптоза) и вторичные некротические клетки. Метод основан на:
- - регистрации изменений архитектуры наружной плазматической мембраны клетки на третьей стадии апоптоза. В нормальных живых клетках фосфолипид фосфатидилсерин находится во внутреннем слое мембраны клетки, в то время как в наружном слое мембраны он представлен в минимальных количествах. На третьей стадии апоптоза фосфатидилсерин экстернализуется из внутреннего слоя мембраны в наружный. В присутствии ионов Ca 2+ AnnexinV специфично связывается с фосфатидилсероном, находящемся в наружном слое мембраны, и конъюгированный с флуоресцентной меткой (FITC) он позволяет определить начало 3 стадии апоптоза;
- - неспособности PI входить в живые клетки, а также в клетки с нетронутой наружной плазматической мембраной. PI начинает входить в клетки только в конце третьей стадии апоптоза после того, как целостность наружной мембраны нарушается. Таким образом, используя конъюгат AnnexinV-FITC в комбинации с ДНК красителем PI, можно разделить исследуемый образец на 4 популяции:
- популяция условно живых клеток: негативный сигнал от обоих красителей (FITC-/PI-);
- популяция клеток на ранней/ средней стадии апоптоза: позитивный сигнал FITC и негативный сигнал PI (FITC+/PI-);
- популяция клеток на поздней стадии апоптоза / условно некротические клетки: позитивный сигнал FITC и позитивный сигнал PI (FITC+/PI+);
- некротические клетки / остатки клеток: негативный сигнал FITC и позитивный сигнал PI (FITC-/PI+).
Ограничения анализа апоптотической (программируемой) клеточной гибели с помощью AnnexinV-FITC/PI: исследование апоптоза только на живых (нефиксированных) клетках в суспензии.
Протокол цитофлуориметрического анализа апоптоза клеток с помощью AnnexinV-FITC/PI метода:
- связывающий буфер (10 mM HEPES/NaОН pH7.4, 140 mM NaCl, 2.5 mM CaCl2),
- FITC-Annexin V,
- PI (исходный водный раствор 400 мг/мл йодистого пропидия, 4°C).
- 1). Приготовить суспензию клеток с концентрацией 10 6 /мл, отмыть в PBS 2 раза.
- 2). Осадить клетки центрифугированием, удалить буфер, ресуспензировать клетки в связывающем буфере.
- 3). Добавить конъюгат AnnexinV-FITC в конечной концентрации 1мг/мл клеточной суспенции. Инкубировать 10 мин. в темноте при комнатной температуре.
- 4). Добавить PI в конечной концентрации 2 мг/мл клеточной суспенции. Продолжить инкубацию еще 5 мин.
Для корректного анализа также необходимо приготовить контроли:
- - отрицательный контроль для настройки прибора (неокрашенные клетки);
- - клетки, окрашенные только конъюгатом AnnexinV-FITC, и клетки, окрашенные только PI, для настройки компенсации;
- - в качестве положительного контроля можно провести окраску клеток без использования Ca 2+ -содержащего буфера.
- Анализ окрашенных клеток на проточной цитрфлуориметре:
1). Настроить прибор с помощью неокрашенных клеток, а также остальных контролей.
2). Найти и гейтировать исследуемый образец на гистограмме FSC-A (прямое светорассеяние) против SSC-A (боковое светорассеяния).
3). Отделить синглеты на гистограмме SSC-H (высота сигнала бокового светорассеяния) против SSC-W (ширина сигнала бокового светорассеяния).
4). На гистограмме FITC-A (площадь сигнала флуоресценции FITC) против PI-A (площадь сигнала флуоресценции PI) разделить клетки на 4 популяции и провести дальней анализ выделенных популяций (определить процентное содержание каждой популяции). При этом необходимо помнить, что в процессе пробоподготовки исследуемые клетки могут также уходить в апоптоз, индуцированный сторонними воздействиями. Поэтому после первичной (экспериментальной) индукции апоптоза необходимо как можно скорее провести анализ клеток на проточном цитофлуориметре. Также необходимо учитывать, что начальные стадии апоптоза – обратимые, поэтому цитофлуориметрический анализ апоптоза клеток с помощью AnnexinV-FITC/PI метода необходимо повторять несколько раз для получения достоверных воспроизводимых результатов.
- I. Vermes, C. Haanen, C. Reutelingsperger. Flow cytometry of apoptotic cell death// Journal of Immunological Methods. V. 243, Issues 1-2, 2000, p. 167-190.
- I. Vermes, C. Haanen, H. Steffens-Nakken, C. Reutelingsperger. A novel assay for apoptosis. Flow cytometic detection of phosphatidylserine expression on early apoptotic cells using fluorescein labeled Annexin V// J. Immunol. Methods, 184 (1995), p. 39.
- Кудрявцев И.В., Хайдуков С.В., Зурочка А.В., Черешнев В.А. Проточная цитометрия в экспериментальной биологии. Екатеринбург: РИО УрО РАН, 2012, 192 с.
Иммунофенотипирование методом проточной цитометрии
Используемое оборудование РЦ:
- проточный цитофлуориметр-сортировщик клеток BD FACSAriaIII;
- рутинное оборудование.
Описание метода:
Иммунофенотипирование – анализ гетерогенной популяции клеток с целью выявления наличия и соотношения популяций интереса путем анализа поверхностных и внутриклеточных антигенов (маркеров), экспрессируемых клетками. Выявление и анализ антигенов производится с помощью конъюгированных с флуорохромами антител путем детекции флуоресцентного сигнала проточным цитофлуориметром. В качестве антигенов чаще всего используются функциональные протеины мембран, вовлеченные в клеточную коммуникацию, адгезию и метаболизм.
В научных и клинических исследованиях применяется, прежде всего, фенотипирование клеток крови и костного мозга с помощью мультипараметрического (многоцветного) анализа поверхностных CD маркеров. Данный метод позволяет разделить клетки на популяции клеток с различными фенотипами (как известными в литературе, так и новыми, еще неисследованными ранее), анализируя интенсивность сигналов исследуемых флуоресцентных маркеров. Проточный цитофлуориметр с тремя лазерами в конфигурации 3-6-3 полосных фильтра позволяет одновременно регистрировать до 11 флуоресцентных маркеров.
- - анализ поверхностных и/или внутриклеточных маркеров;
- - анализ живых / фиксированных клеток;
- - использование разных протоколов окрашивания (с помощью конъюгатов первичных антител / с помощью конъюгатов вторичных антител).
Общий протокол для иммунофенотипирования с использованием конъюгатов первичных антител
- 1). Собрать, отмыть клетки и развести их в концентрации 1-5x10 6 клеток/мл в холодном буфере PBS (с добавлением 10% FCS, 1% азида натрия).
- Рекомендуется работать с клетками при температуре 4°C, используя охлажденные реактивы и в присутствии азида натрия для предотвращения модуляции и интернализации поверхностных антигенов.
- 2). Добавить 0.1-10 мг/мл первичных антител, конъюгированных с флуорохромами. При необходимости разводить антитела можно в 3% растворе BSA/PBS. Также можно добавить йодид пропидия для исключения мертвых клеток.
- 3). Инкубировать антитела как минимум 30 мин при комнатной температуре или при температуре 4°C (в зависимости от используемых антител).
- 4). Отмыть клетки 3 раза с помощью центрифугирования на 400 g 5 мин. и развести их в 500-1000 мкл холодного PBS (с добавлением 10% FCS, 1% азида натрия). Держать клетки необходимо в темноте на льду. Провести анализ клеток на проточной цитометре рекомендуется как можно быстрее после завершения окраски. Если требуется время между окрашиванием и анализом рекомендуется произвести фиксацию клеток после пункта 3.
Для корректного анализа образца необходимо приготовить также контроли: отрицательный контроль (неокрашенные клетки), изотипический контроль (клетки, окрашенные каждым флуорохромом отдельно (при окраске образца более чем одним красителем), для настройки компенсации).
- Анализ окрашенных клеток на проточной цитрфлуориметре:
- 1). Настроить прибор, используя неокрашенные клетки и необходимые контроли.
- 2). Найти и гейтировать исследуемый образец на гистограмме FSC-A (прямое светорассеяние) против SSC-A (боковое светорассеяния).
- 3). Отделить синглеты на гистограмме SSC-H (высота сигнала бокового светорассеяния) против SSC-W (ширина сигнала бокового светорассеяния).
- 4). Разделить клетки интереса на отдельные популяции и проанализировать их в соответствии с интенсивностью флуоресценции исследуемых маркеров на соответствующих гистограммах FL1/FL2 и т.д.
- 1. Stewart CC, Nicholson JKA, editors. Immunophenotyping. New York: Wiley-Liss; 2000.
- 2. Robinson JP, Darzynkiewicz Z, Hyun W, Orfao A, Rabinovitch P, editors. Current protocols in cytometry. New York: John Wiley & Sons; 2004.
- 3. Gutensohn K, Sonneborn HH, Kuhnl P, editors. Aspects of the flow cytometric analysis of red blood cells. Heidelberg: Clin Lab Publications; 1997.
Сортировка единичных клеток (single cell sorting)
Используемое оборудование РЦ:
- проточный цитофлуориметр-сортировщик клеток BD FACSAriaIII;
- рутинное оборудование.
Описание метода
Данный метод предоставляет возможность рассортировать клетки по 1 шт. в каждую лунку культуральных и ПЦР-планшетов в соответствии в проведенным гейтированием по исследуемым клеточным маркерам. Сортировка единичных клеток применяется, прежде всего, для последующего культивирования (получения чистых клеточных линий от одной клетки) или для последующего генетического анализа (проведения ПЦР одной клетки). Сортировка единичных клеток отличается от стандартной сортировки особой настройкой проточного цитофлуориметра-сортировщика клеток таким образом.
- Необходимо сортировать в оптимальных биологических условиях:
Читайте также:

