Простое вещество образованное химическим элементом х реагирует с хлором

Сера является не только важным компонентом множества химических соединений, но и непосредственно экзамена ОГЭ.
Она часто встречается в заданиях разного типа и уровня, и все возможные задания, в которых рассматриваются особенности серы, мы и пройдем в рамках этого урока.
Задание 1:
Выберите два высказывания, в которых говорится о сере как о простом веществе:
1) При горении серы на воздухе образуется сернистый газ;
2) Сера в природных водах встречается в основном в виде сульфат - иона;
3) Сера входит в состав некоторых аминокислот;
4) В состав ядра атома серы входит 16 протонов;
5) Серный цвет - это мелкий порошок серы, применяющийся в качестве средства защиты растений.
Решение:
Для начала, нужно понять само определение "простое вещество".
Простое вещество - это вещество, которое состоит из атомов одного химического элемента. В противовес простому веществу обычно указывают понятие "химический элемент".
Химический элемент - это определенный вид атомов.
Соответственно, для решения этого задания необходимо выбрать те варианты ответа, где указаны физические и химические свойства серы.
1) При горении серы на воздухе образуется SO2 (сернистый газ) - подходит, так как здесь сера обладает химическими свойствами и показана как простое вещество. Кстати, вот эта реакция:
2) Сера в природных водах встречается в виде сульфат - ионов - не подходит, так как ионы не обладают свойствами простых веществ;
3) Сера входит в состав некоторых аминокислот - не подходит, почему? Дело в том, что в данном варианте ответа сера не обладает самостоятельными свойствами, а только входит в состав аминокислот в виде иона;
4) В состав ядра серы входит 16 протонов - не подходит, здесь речь идет о химическом элементе серы;
5) Серный цвет - это мелкий порошок серы, применяющийся в качестве средства защиты растений - подходит, в этом варианте ответа сера представлена как простое вещество.
Задание 2:
Степень окисления серы в высшем оксиде равна степени окисления серы в веществе:
Решение:
Сера расположена в 6А группе, поэтому имеет высшую степень окисления равной номеру своей группы, ее высший оксид - SO3 , в котором она проявляет степень окисления +6.
Поэтому, для решения этого задания необходимо выбрать вещество со степенью окисления +6.
1) H2SO3 (сернистая кислота) - здесь у серы +4, не подходит;
2) (NH4)2SO4 (сульфат аммония) - когда ты видишь в формуле сложного вещества остаток SO4 (это кислотный остаток - сульфат), то запомни, что в сульфат - ионе степень окисления серы равна +6, подходит;
3) K2S - это вещество называется сульфид калия, нужно помнить, что у калия в классической химии нет отрицательной степени окисления, а так как в молекуле сложного вещества должно быть равное количество катионов и анионов, значит, отрицательную степень будет проявлять сера, в данном случае, -2, ответ не подходит;
4) SCl2 (дихлорид серы) - сера и хлор это два неметалла, причем оба достаточно активные, однако, хлор сильнее проявляет электроотрицательность,поэтому в бескислородных солях у хлора степень окисления равна -1, значит, у серы будет +2; не подходит.
Задание 3:
Железо при обычных условиях реагирует с
2) оксидом углерода (4);
3) сульфатом меди (2);
Решение:
Как понять, при каких условиях элемент реагирует с различными веществами? На самом деле, не так и сложно.
Например, в данном задании у нас железо, мы знаем, как выглядит этот элемент в природе, он не так активен, как калий или литий, из -за пленки с кислородом при окислении на воздухе.
Однако, и железо при обычных условиях может взаимодействовать с теми веществами, с которыми возможна реакция замещения.
А этот тип реакций возможен
Иными словами, смотрим на ряд активности:
K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Cu Hg Ag Pt Au
Итак, анализируем каждый вариант ответа:
1) с водой - если кинуть железную арматуру в воду, ничего не произойдет, только постепенно железо начнет покрываться ржавчиной.
P.S. Ржавчина не имеет четкой химической формулы, это смесь оксидов и гидроксидов железа.
Поэтому, данный вариант ответа нам не подходит.
2) с углекислым газом (CO2) - этот газ всегда присутствует в воздухе, так как является его непосредственным компонентом.
Углекислый газ выделяют большинство органических существ в реакциях энергетического обмена.
- Но, с железом реакции нет, ответ не подходит.
3) с сульфатом меди (2) - это как раз тот случай, когда нам нужно воспользоваться рядом активности металлов (РАМ) (смотри выше).
- Медь находится в РАМ после железа, поэтому Fe с легкостью вытеснит его из сульфата, причем, без нагревания; ответ подходит.
4) с серой - железо взаимодействует с S, но определенно не при обычных условиях; ответ не подходит.
Итак, верный ответ в этом вопросе - 3.
Задание 4:
Какие два утверждения верны для характеристики как углерода, так и серы?
1) на внешнем слое находится шесть электронов;
2) соответствующее простое вещество существует в твердом агрегатном состоянии;
- 3) химический элемент образует простое вещество - металл;
4) значение электроотрицательности меньше, чем у фосфора;
5) химический элемент образует оксид с общей формулой ЭО2.
Решение:
В этом вопросе нужно найти общие черты углерода и серы; хотя эти два элемента совершено разные по своим химическим свойствам и другим критериям, все же, они имеют схожие данные.
- Смотрим на первый вариант ответа: на внешнем слое находится шесть электронов - количество электронов на внешнем подуровне численно равно номеру группы, в которой находится элемент (это правило касается элементов главных подгрупп !)
В ПСЭ сера находится в 6А группе, у нее шесть электронов на внешнем подуровне, а углерод - в 4А, и у него четыре электрона, значит, этот вариант ответа не подходит.
- Второй вариант: соответствующее простое вещество существует в твердом агрегатном состоянии - да, это именно так.
И сера, и углерод в природе являются твердыми веществами (несмотря на то, что оба образуют газообразные оксиды при взаимодействии с кислородом) - ответ подходит.
- В третьем варианте ответа - химический элемент образует простое вещество - металл, ты наверняка понимаешь, что это неверное утверждение.
Сера и углерод - это типичные Неметаллы, ответ не подходит.
Значение электроотрицательности меньше, чем у фосфора - четвертый ответ требует наличия ряда электроотрицательности неметаллов (РЭН):
H As I Si P Se C S Br Cl N O F
Здесь хорошо видно, что и углерод, и сера стоят после фосфора (P), значит, их показатели электроотрицательности выше, чем у элемента, входящего в состав АТФ. Ответ не подходит.
- Пятый пункт: химический элемент образует оксид с общей формулой ЭО2 - для этого необходимо вспомнить степени окисления углерода и серы, а также оксиды, которые они образуют.
Углерод в имеет много степеней окисления (особенно в органической химии), но оксиды образует только в двух вариациях - CO и CO2.
Сера также как углерод имеет не одну степень окисления, и ее оксиды - SO2 и SO3.
Этот вариант нам подходит, так как и сера, и углерод образуют оксиды с общей формулой ЭО2 .
Хлор в чистом виде впервые выделил шведский ученый Карл Шееле в 1774 году. Своё нынешнее название элемент получил в 1811 году, когда Г.Дэви предложил название "хлорин", которое вскоре было сокращено до "хлор" с легкой руки Ж. Гей-Люссака. Немецкий ученый Иоганн Швейгер предложил для хлора название "галоген", но этим термином было решено назвать всю группу элементов, в которую входит и хлор.
Хлор является самым распространенным галогеном в земной коре - на долю хлора приходится 0,025% всей массы атомов земной коры. По причине своей высокой активности хлор не встречается в природе в свободном виде, а только в составе соединений, при этом хлору "по барабану" с каким элементом вступать в реакцию, современной науке известны соединения хлора практически со всей таблицей Менделеева.
Основная масса хлора на Земле содержится в соленой воде Мирового океана (содержание 19 г/л). Из минералов больше всего хлора содержится в галите, сильвине, сильвините, бишофите, карналлите, каините.
Хлор играет важную роль в деятельности нервных клеток, а также в регуляции осмотических процессов, происходящих в организме человека и животных. Также хлор входит в состав зеленого вещества растений - хлорофилла.
Природный хлор состоит из смеси двух изотопов:
- 35 Cl - 75,5%
- 37 Cl - 24,5%
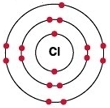
Рис. Строение атома хлора.
Электронная конфигурация атома хлора - 1s 2 2s 2 2p 6 3s 2 3p 5 (см. Электронная структура атомов). В образовании химических связей с другими элементами могут участвовать 5 электронов, находящихся на внешнем 3p-уровне + 2 электрона 3s уровня (всего 7 электронов), поэтому в соединениях хлор может принимать степени окисления от +7 до -1. Как уже было сказано выше, хлор является химически активным галогеном.
Физические свойства хлора:
- при н.у. хлор является ядовитым газом желто-зеленого цвета с резким запахом;
- хлор в 2,5 раза тяжелее воздуха;
- при н.у. в 1 л воды растворяется 2,5 объема хлора - этот раствор называется хлорная вода.
Химические свойства хлора
Взаимодействие хлора с простыми веществами (Cl выступает в роли сильного окислителя):
- с водородом (реакция протекает только при наличии света):
- с металлами с образованием хлоридов:
- с неметаллами, менее электроотрицательными, чем хлор:
- с азотом и кислородом хлор не реагирует непосредственно.
Взаимодействие хлора со сложными веществами:
Одной из самых известных реакций хлора со сложными веществами есть взаимодействие хлора с водой - кто живет в большом городе, наверняка, периодически сталкивается с ситуацией, когда, открыв кран с водой, ощущает стойкий запах хлора, после чего многие сетуют, дескать, опять воду хлорировали. Хлорирование воды является одним из основных способов ее обеззараживания от нежелательных микроорганизмов, небезопасных для здоровья человека. Почему так происходит? Разберем реакцию хлора с водой, которая протекает в два этапа:
- На первом этапе происходит образование двух кислот: соляной и хлорноватистой:
- На втором этапе хлорноватистая кислота разлагается с выделением атомарного кислорода, который окисляет воду (убивая микроорганизмы) + подвергает отбеливающему действию ткани, окрашенные органическими красителями, если их опустить в хлорную воду:
С кислотами хлор не взаимодействует.
Взаимодействие хлора с основаниями:
- на холоде:
- при нагревании:
- с бромидами металлов:
- с йодидами металлов:
- с фторидами металлов хлор не реагирует, по причине их более высокой окислительной способности, нежели у хлора.
Хлор "охотно" вступает в реакции с органическими веществами:
В результате первой реакции с метаном, которая протекает на свету, образуется хлористый метил и соляная кислота. В результате второй реакции с бензолом, которая протекает в присутствии катализатора (AlCl3), образуется хлорбензол и соляная кислота.
Получение и применение хлора
Промышленным способом хлор получают электролизом водного раствора (хлор выделяется на аноде; на катоде - водород) или расплава хлорида натрия (хлор выделяется на аноде; на катоде - натрий):
В лаборатории хлор получают действием концентрированной HCl на различные окислители при нагревании. В роли окислителей могут выступать оксид марганца, перманганат калия, бертолетова соль:
Применение хлора:
- отбеливание тканей и бумаги;
- обеззараживание воды;
- производство пластмасс;
- производство хлорной извести, хлороформа, ядохимикатов, моющих средств, каучуков;
- синтез хлороводорода в производстве соляной кислоты.
Если вам понравился сайт, будем благодарны за его популяризацию :) Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Ответы и задания для 7, 8, 9, 10 класса олимпиады по химии пригласительный школьный этап всероссийской школьной олимпиады ВОШ (Сириус), официальная дата проведения олимпиады в режиме онлайн: 27.04.2020 (27 апреля 2020 год).
Ссылка для скачивания заданий для 7 класса: скачать
Ссылка для скачивания заданий для 8 класса: скачать
Ссылка для скачивания заданий для 9 класса: скачать
Ссылка для скачивания заданий для 10 класса: скачать
Ссылка для скачивания всех ответов (на все задания) для 7-10 класса: скачать
1)При испарении какой воды не остаётся твёрдого остатка? Ответ: дождевой
2)Для засолки огурцов одну столовую ложку поваренной соли растворяют в одном литре воды. Какова массовая доля поваренной соли в этом растворе, если столовая ложка вмещает 16 г соли? Ответ: 1,57%
3)Какое вещество является простым и не имеет цветной окраски? Ответ: алмаз
4)Какой элемент 2-го периода образует больше всего оксидов? В ответе укажите его химический символ. Ответ: N
5)Лунный грунт содержит в среднем 46% кислорода и 20% кремния по массе. Сколько атомов кислорода приходится на один атом кремния на поверхности Луны? Ответ округлите до ближайшего целого числа. Ответ: 4
7)Каких элементов нет в Периодической системе? Укажите все правильные ответы
- кюрий
- менделевий
- ньютоний
- флеровий
- московий
- нильсборий
8)Какие из перечисленных веществ являются индивидуальными? Укажите все правильные ответы.
- столовый уксус
- сода
- нашатырный спирт
- соляная кислота
- серная кислота
- гремучий газ
- O2
- N2
- CO2
- Ar
- H2O
- CO
11)Атом элемента A (масса – 28 усл. ед.) может соединяться ровно с тремя другими атомами, а атом элемента B (масса – 2 усл. ед.) – только с одним. Сколько весит (в усл. ед.) самая лёгкая шестиатомная частица, составленная из этих элементов? В ответе приведите число.
12)Четыре одинаковые пробирки заполнили следующими газами: азот, аммиак, водород и угарный газ. Пробирки пронумерованы цифрами. Их попарно помещали на рычажные весы, как это показано на рисунках, и сравнивали массы. Все измерения проводились при одинаковой температуре и одинаковом давлении. Известно, что газ, находящийся в пробирке 4, является основным в составе земной атмосферы. Установите, в пробирке с каким номером находится каждый из указанных газов.
1)Какой из перечисленных неметаллов образует наибольшее число водородных соединений? Ответ: C
2)Частица, состоящая из атомов серебра, в 144 раза тяжелее атома углерода. Сколько атомов входит в состав частицы? Ответ: 16
3)В соединении, состоящем из двух элементов, число атомов X в 4 раза больше числа атомов Y, при этом на 19 массовых частей X приходится 3 массовые части Y. Определите формулу соединения и запишите её в ответ (например, CaCl2).Ответ: CF4
4)Одно и то же количество вещества металла реагирует с 1,68 г кислорода и 26,67 г галогена. Определите галоген, если известно, что валентность металла в оксиде и галогениде одна и та же. В ответе запишите химический символ галогена.Ответ: I
5)В реакциях с какими из перечисленных веществ разбавленная серная кислота играет роль окислителя?Ответ: Zn, NaH
6)При действии соляной кислоты на твёрдую соль выделился газ. Какие анионы могли входить в состав соли? Приведите все правильные ответы.Ответ: SO32–, HCO3–, MnO4–
7)В атоме элемента 3-го периода число электронов на внешнем уровне в 3 раза меньше общего числа электронов. Определите элемент. В ответе укажите его химический символ. Ответ: P
8)Медную проволоку сильно нагрели и внесли в колбу с газом X1, в результате реакции получили кристаллическое вещество, которое растворили в воде. Раствор принял синюю окраску. К этому раствору добавили раствор вещества X2, выпавший осадок отфильтровали. Фильтрат выпарили и прокалили, в результате образовалось вещество X3 чёрного цвета. Над нагретым порошком X3 пропустили газ X4, одним из продуктов реакции является металлическая медь. В таблице приведены формулы различных веществ.
9)Железные опилки смешали с веществом X1 жёлтого цвета и сильно нагрели, в результате реакции получили вещество X2. Его обработали соляной кислотой, при этом выделился газ X3, имеющий резкий, неприятный запах. Газ X3 пропустили в раствор сульфата меди(II), в результате образовалось вещество X4 чёрного цвета. В таблице приведены формулы различных веществ. Установите вещества X1–X4. В ответе приведите их номера из таблицы.
10)В три пробирки с растворами хлоридов магния, кальция, бария добавили избыток насыщенного раствора сульфата натрия. В пробирку, где осадка не образовалось, добавили раствор карбоната натрия. Состав образовавшегося осадка:
- BaCO3
- CaCO3
- Mg(HCO3)2
- (MgOH)2CO3
- Mg(OH)2
- Ca(OH)
11)22,1 г оксида металла, известного человечеству с древности, полностью восстановили до простого вещества, используя 3,36 л (н. у.) водорода. Определите металл, в ответе запишите его порядковый номер.
12)Серу массой 9,6 г сожгли в атмосфере кислорода. Образовавшийся газ пропустили через 360 г 10,0 %-го раствора гидроксида натрия. Определите массовую долю соли (в %) в образовавшемся растворе. В ответе запишите число, округлив его до целых, знак % записывать не нужно.
2)При добавлении к раствору соли неизвестного металла некоторого количества раствора щелочи выпал осадок белого цвета. К осадку прилили раствор сульфида натрия, осадок принял чёрный цвет. При последующем добавлении раствора пероксида водорода осадок вновь приобрёл белую окраску. Исходный раствор соли содержал ионы. Ответ: свинца(II)
3)Молярная теплота сгорания алканов линейно зависит от числа атомов углерода в молекуле и описывается уравнением Qсгор(n)=100+700n (кДж/моль), где n – число атомов углерода в молекуле. Определите количество теплоты (в кДж), которое выделится при полном сгорании 0,4 моль декана C10H22. В ответе запишите целое число без единиц измерения. Ответ: 2840
4)Среди перечисленных выберите все молекулы, в которых хотя бы один из элементов имеет валентность III. Ответ: N2, PH3
5)Кислотный оксид, в котором элемент проявляет высшую степень окисления, при лёгком нагревании разлагается со взрывом. Одним из продуктов разложения является твёрдый оксид, взаимодействующий с концентрированной соляной кислотой с выделением хлора. Формула кислотного оксида: Ответ: Mn2O7
6)Из приведённого перечня реакций выберите те, при протекании которых единственным видимым признаком реакции является изменение окраски раствора. В ответе укажите все правильные варианты. Ответ: K2Cr2O7 + KOH → …,KNO2 + KMnO4 + H2SO4 → …,Br2(водн.) + SO2 + H2O → …
7)Алюминиевые стружки разделили на две части. Первую часть поместили в раствор вещества А, а вторую – в раствор, содержащий смесь веществ А и Б. Реакционные смеси сильно разогрелись. Из первой смеси выделился газ без цвета и запаха В. Из второй выделился газ Г, тоже без цвета, но с очень резким запахом. Известно, что газ Г очень хорошо растворяется в воде. В таблице приведены формулы различных веществ. Установите вещества А–Г. В ответе укажите их номера из таблицы.
- H2
- O2
- NH3
- Cl2
- N2
- HCl
- NaOH
- NaNO3
8)Тонкую проволоку, изготовленную из вещества А, нагрели и внесли в колбу с газообразным веществом Б. Реакция протекала с выделением большого количества теплоты. Из колбы выделялся дым, состоящий из кристалликов вещества В бурого цвета. Вещество В растворили в воде, раствор имел бурую окраску. Через него пропустили бесцветный газ Г, при этом бурая окраска раствора исчезла, но осадок не выпал. Если через полученный раствор пропустить газ Б, то раствор снова приобретёт бурую окраску. В таблице приведены формулы различных веществ.
- HCl
- FeCl3
- Fe
- NH3
- FeCl2
- Cl2
- Cu
- SO2
9)Гептагидрат сульфата двухвалентного металла массой 83,4 г растворили в воде. К образовавшемуся раствору добавили избыток сульфида натрия, выпавший осадок отфильтровали и сожгли в избытке кислорода. Твёрдый остаток смешали с алюминиевой пудрой и подожгли, в результате получили 16,8 г металла. Определите металл. В ответе запишите его порядковый номер.
10)При разложении вещества, которое прошло со 100 %-м выходом, образовалась только смесь двух газов в объёмном отношении 2 : 1, которая в 1,5 раза легче воздуха. Какое вещество подвергли разложению?
- NH4NO3
- NH4NO2
- NH4Cl
- CH4
- C4H10
- C2H5Cl
11)Насыщенный раствор хлорида меди(II), содержащий соляную кислоту, имеет одинаковую окраску с раствором хлорида никеля(II). С помощью каких веществ можно различить эти растворы? Укажите все правильные варианты.
- NaCl
- H2O
- Fe
- Na2SO4
- NaOH
12)Смесь аммиака, этана и этилена, имеющую общий объём 22,4 л (н. у.), пропустили последовательно через разбавленную серную кислоту и бромную воду, которые были взяты в избытке. При этом масса сосуда с кислотой изменилась на 7,14 г, а масса сосуда с бромной водой – на 14,28 г. Определите состав исходной смеси. В таблице под формулой вещества укажите его количество вещества (в молях) с точностью до сотых (например, 0,22).
- NH3
- C2H6
- C2H4
1)Выберите вещества, которые при определённых условиях могут прореагировать с метилпропеном. Ответ: водород, вода, бензол, кислород
2)Кумол (изопропилбензол) окислили перманганатом калия, подкисленным серной кислотой. В уравнении реакции перед формулой кумола стоит коэффициент 5. Какое число находится перед формулой перманганата калия? Ответ: 18
3)Какие полимеры не могут быть получены полимеризацией соответствующего мономера? Укажите все правильные ответы. Ответ: поливиниловый спирт, полиэтилентерефталат, полигексаметиленадипинамид
4)Органическое вещество А сплавили с гидроксидом натрия и получили два вещества – Б и В. Определите вещества А, Б, В, если известно, что вещества Б и В – неорганические. В ответе запишите сумму относительных молекулярных масс веществ А, Б и В с точностью до целых. Ответ: 176
5)Сколько существует изомерных фенолов состава C8H10O? В ответе приведите число. Ответ: 9
6)Сколько существует производных этилена, в которых все атомы водорода замещены на галогены, причём все галогены разные (астат не учитываем)? В ответе приведите число. Ответ: 6
7)Как соотносятся объём газа (V1), выделившегося при обработке бромэтана натрием (взятым в избытке в инертном растворителе), и объём газа (V2) , образовавшегося при обработке того же количества бромэтана спиртовым раствором щёлочи? Объёмы газов измерены в одинаковых условиях. Выберите все правильные варианты. Ответ: V1 12
11)Какие из перечисленных молекул неполярны, т. е. имеют нулевой дипольный момент? Укажите все правильные ответы.
- CF4
- O3
- C2H4
- C6H6
- NH3
- HNO3
12)Бензол ввели в следующие превращения:1) ангидрид янтарной кислоты, AlCl3, t; 2) цинк, HCl (конц.); 3) SOCl2; 4) AlCl3, t; 5) гидразин, КОН, t. В ответе приведите относительную молекулярную массу конечного продукта синтеза, округлённую до целых. (Пример: 264.)
Галогены (греч. hals - соль + genes - рождающий) - химические элементы VIIa группы: F, Cl, Br, I, At. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.

От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 5 :
- F - 2s 2 2p 5
- Cl - 3s 2 3p 5
- Br - 4s 2 4p 5
- I - 5s 2 5p 5
- At - 6s 2 6p 5
Для галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.

- NaCl - галит (каменная соль)
- CaF2 - флюорит, плавиковый шпат
- NaCl*KCl - сильвинит
- 3Ca3(PO4)2*CaF2 - фторапатит
- MgCl2*6H2O - бишофит
- KCl*MgCl2*6H2O - карналлит

Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте - HF - был впервые получен фтор.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.

В лабораторных условиях галогены могут быть получены следующими реакциями.
-
Реакции с металлами
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Реакции с неметаллами
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.

F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность ;)
Br2 + F2 → BrF (фтор более электроотрицателен, чем бром - F - )
Br2 + I2 → IBr3 (бром более электроотрицателен, чем йод - Br - )
Реакции с водой
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Хлор реагирует с водой обратимо, образуя хлорную воду - смесь хлорноватистой и соляной кислоты. Бром вступает в те же реакции, что и хлор.

Замечу, что активность йода существенно ниже, чем у остальных галогенов. С неметаллами йод почти не реагирует, а с металлами - только при нагревании.
Реакции с щелочами
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Соединения, образованные из галогенов и водорода. К галогеноводородам относятся следующие вещества:
- HF - фтороводород (газ), фтороводородная (плавиковая) кислота (жидкость)
- HCl - хлороводород (газ), соляная кислота (жидкость)
- HBr - бромоводород, бромоводородная кислота
- HI - йодоводород, йодоводородная кислота
- HAt - астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI - газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
HF - является слабой кислотой, HCl, HBr, HI - сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.

Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)

Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.

В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:

