Саркома из интердигитирующих клеток
Основная цель этого исследования — расширить клинико-патологический спектр и повысить узнаваемость саркомы фолликулярной дендритной клетки (FDCS) путем анализа клинических и патологических особенностей 50 случаев.
Были проанализированы клинико-патологические особенности всех 50 случаев FDCS, включая обзор 44 случаев, о которых сообщалось в китайской литературе до октября 2009 года, и шесть оригинальных случаев из файлов патологии, проведенных авторами.
Самым младшим пациентом, которого наблюдали в этом исследовании, было всего семь лет. Включая случаи, внесенные авторами, наш литературный обзор показал, что мужчины доминировали над опухолевыми заболеваниями (M: F = 3: 2). 28 случаев (56%) присутствуют с этим заболеванием в экстранодальных участках. Опухолевые клетки продемонстрировали положительное окрашивание маркеров фолликулярных дендритных клеток CD21 (47/49), CD35 (43/45), CD23 (20/23) и CD68 (23/25). Гибридизацию in situ для РНК вируса Эпштейна-Барра проводили в 10 случаях. Тем не менее, во всех этих случаях экспрессия EBV отсутствовала. Последующий анализ всех случаев показывает, что 26 (81,2%) пациентов были живы и свободны от болезней; 6 (18,8%) пациентов были живы с рецидивирующим заболеванием или метастазами; и никто не умер от этой болезни во время последнего наблюдения.
Диагноз FDCS основан на результатах морфологии и иммуногистохимии. FDCS в Китае следует рассматривать и рассматривать как низкосортную саркому, а роль EBV в патогенезе этой опухоли все еще остается неопределенной. Существует вероятность того, что опухоль может быть расовым или географическим, поскольку большинство случаев было сообщено из района Восточной Азии; это особенно относится к опухоли печени или селезенки.
Классифицированные как вспомогательные клетки иммунной системы, фолликулярные дендритные клетки (FDC), также известные как дендритные клетки ретикулума, необходимы для функции представления антигена и регуляции реакции зародышевого центра. Фолликулярная саркома дендритных клеток (FDCS) является необычной опухолью, которая обычно возникает в лимфатических узлах, особенно в шейном, средостении и подмышечных областях, но также и в экстранодальных участках. Существование первичного новообразования фолликулярной дендритной клетки впервые было признано в 1986 году Мондой и др. [1]; с тех пор в литературе сообщается о разрозненных случаях. До сих пор в английской литературе сообщалось о 150 случаях. Дефицит может быть частично вызван недооценкой этого лица. В последние годы наблюдается повышенный интерес к этому специфическому типу новообразований из-за появляющейся доступности специфических антител, которые могут подтвердить линию FDC.
Чтобы добавить к существующей литературе по FDCS, чтобы углубить понимание заболевания, мы проанализировали клинические характеристики, патологические особенности, иммунофенотипический профиль, лечение и результат 50 случаев, включая наши 6 случаев и 44 случая из обзора китайских литератур на FDCS.
Настоящее исследование включало в себя в общей сложности 50 пациентов с FDCS. Не сообщалось ранее, первые 6 случаев были получены из патологических файлов Департамента патологии, больницы Xiangya в Центральном Южном университете в период с 2004 по 2009 год. Другие случаи были получены через основную базу данных с индексацией литературы CNKI (Китайская национальная инфраструктура знаний ) между 1994 и 2009 годами путем поиска ключевых слов, таких как дендритная клетка, фолликулярная дендритная клетка и саркома. Клинические характеристики всех случаев FDCS были обобщены в дополнительном файле 1.
Рутинные гистопатологические и иммуногистохимические анализы проводили из фиксированных формалином образцов, содержащих парафин. Панель антител в основном включала CD21, CD35, CD23, CD68, CD20, EMA, Vimentin, S-100, Clusterin и LMP-1. Все антитела были продуктами DAKO, а окрашивание проводили с помощью набора DAKO En Vision Kit. Секции были разработаны с 3,3′-диаминобензидином тетрагидрохлоридом и контрастировали с гематоксилином.
Гибридизацию in situ для РНК Эпштейна-Барра (EBV) -кодированной РНК (EBER) проводили на парафиновых срезах с использованием набора для гибридизации и обнаружения на месте EBER (DAKO), и процедура окрашивания была точно выполнена в соответствии с рекомендациями производителя. EBV-ассоциированная носоглоточная карцинома служила положительным контролем.
Настоящее исследование содержит 30 мужчин и 20 женщин. Средний возраст пациентов составлял 44 года, от 7 до 75 лет. 7-летний пациент был самым молодым, которого наблюдали до сих пор. Конкретные симптомы, включая низкосортную лихорадку, потерю веса, эпигастралгию, абдоминальную полноту, легкую анемию и т. Д., Были неспецифичны у пациентов с FDCS. Пациенты часто представлены с медленно растущей, хорошо очерченной, безболезненной массой. Один случай осложнялся болезнью Каслмана, которая была обнаружена в грудной клетке. Из всех случаев, обобщенных в этом обзоре, наиболее распространенным участком поражения опухоли был лимфатический узел, в 22 случаях (44%). Другие (28, 56%) были расположены в экстранодальных участках, включая печень (5), желудочно-кишечный тракт (5), носовую глотку (5), селезенку (4), околоушную железу (2), больший сальник (2), кавиту таз и брюшную полость (2), миндалину (1), надпочечник (1) и грудную стенку (1).
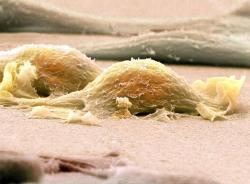
Валовые измерения этой опухоли варьировались от случая к случаю в пределах от 0,6 до 21 см. Макроскопически опухоль была характерно хорошо описана или даже имела капсулу. Он был мягким и слегка твердым и мог содержать участки некроза и кровоизлияния. Микроскопически опухоль была составлена из овальных клеток веретена, независимо от мест поражения, расположенных в виде сториформного, вихревого и фасцикларного рисунков (рис. 1). Отдельные клетки обладали характерными особенностями, в том числе слегка эозинофильной, фибриллярной цитоплазмой, тонкой ядерной мембраной, везикулярными ядрами, небольшими, но четкими ядрышками и нечеткими границами клеток с иногда многоядерными формами (рис. 2). Общей и весьма характерной особенностью было разбрызгивание всей опухоли мелких лимфоцитов, изредка приводящее к ошибочному диагнозу лимфомы. Иногда лимфоциты также показывали мантию вокруг кровеносных сосудов. Иногда отмечались гигантские клетки и митотические фигуры (рис. 3). В некоторых случаях наблюдались нерегулярные кровоизлияния и коагулятивный некроз.
Случай 1 FDCS миндалины, шпиндельные клетки располагаются в виде складообразных и перекрученных узоров. (Пятно H & E).
Случай 1 FDCS миндалины, отдельные клетки обладают характерными чертами, включая тонкую ядерную мембрану, везикулярные ядра, небольшие, но отчетливые ядрышки и нечеткие границы клеток. (Пятно H & E).
Случай 3 FDCS печени, гигантские клетки и митотические фигуры идентифицируются время от времени. (Пятно H & E).
Три из девяти случаев, связанных с печенью и селезенкой, отличались тем, что у них часто были гистологические особенности, похожие на воспалительные псевдотуморы 4. В этих случаях шпиндельные клетки диспергировались в распределении, разбросанные известным лимфоплазматическим инфильтратом (рис. 4).
Случай 4 FDCS лимфатического узла, шпиндельные клетки рассеиваются в распределении, рассеиваются заметным лимфоплазматическим инфильтратом (пятно H & E).
Иммуногистохимически FDCS проявлял уникальные гистологические иммунофенотипические признаки (фиг. 5 и 6). Опухолевые клетки продемонстрировали положительное окрашивание маркеров фолликулярных дендритных клеток CD21 (49/49), CD35 (43/45), CD23 (20/23), CD68 (23/25), Виментина (22/28) и 18 случаев иммуноокрашивание для белка S-100. Положительное окрашивание для EMA наблюдалось в 16 случаях. Белок EBV-латентной мембраны (LMP-1) показал только положительное окрашивание в 1 из 7 случаев [5]. Другие положительные, но необычные иммуногистохимические маркеры включали HLA-DR, SMA, Clusterin, NSE и LCA.
Случай 1 FDCS миндалины, опухолевые клетки иммунореактивны с CD21 сильно и диффузно.
Случай 4 FDCS лимфатического узла, опухолевые клетки были положительными для CD35 сильно и диффузно.
Электронно-микроскопическое исследование было доступно в 4 случаях в опубликованной литературе 7. Опухолевые клетки, смешанные с многочисленными воспалительными клетками, демонстрировали удлиненные ядра и часто с мелкодисперсным хроматином. В некоторых клетках отмечались рассеянные лизосомы и хорошо развитые глоги. Однако наиболее отличительной особенностью было множество длинных, тонких цитоплазматических процессов, соединенных зрелыми десмосомами.
В 10 случаях была выполнена гибридизация in situ для РНК вируса Эпштейна-Барра (EBV). Тем не менее, во всех этих случаях экспрессия EBV отсутствовала [2,9,10].
Несмотря на то, что были использованы различные методы лечения, включая хирургию, химиотерапию, лучевую терапию и комбинации этих методов, полная хирургическая резекция по-прежнему является основой лечения первичных FDCS для большинства пациентов. Во всех 50 случаях, изученных в этой статье, все пациенты лечились хирургическим удалением, а адъювантная лучевая терапия или химиотерапия была дополнена в 13 случаях. Последующая информация была доступна у 32 пациентов с временным интервалом от 1 месяца до 5 лет. Двадцать шесть (81,2%) пациентов были живы и без болезней после лечения, у 6 (18,8%) пациентов были живые рецидивирующие заболевания или метастазы, и никто не умер от этого заболевания во время последнего наблюдения.
FDCS является чрезвычайно редкой опухолью и признается все чаще. Большинство данных о FDCS основаны на отчетах о случаях или небольших сериях дел с момента первого отчета в 1986 году. В последние годы FDCS уделяет все большее внимание из-за наличия более чувствительных маркеров для подтверждения линии FDC. Интересно, что существует вероятность того, что опухоль имеет расовую или географическую корреляцию, потому что 17 случаев были из Японии среди 50 случаев заболевания, рассмотренных в нашем исследовании, несмотря на то, что точная информация об этнической и живой среде пациентов не была имеется [11]. Предполагалось, что опухоль в основном поражает лимфатические узлы, причем наиболее распространенными участками являются шейные и подмышечные области. Однако более половины зарегистрированных случаев в нашем обзоре были расположены в экстранодальных участках, включая неба, глотку, миндалину, щитовидную железу, средостение, селезенку, желудочно-кишечный тракт, печень [2-10,12-32]. Поэтому FDCS, представленный на экстранодальных сайтах, заслуживает большего внимания, чем когда-либо.
В настоящее время для большинства случаев FDCS нет определенной этиологии. Цитогенетические аномалии были описаны в одном случае FDCS в селезенке [33], демонстрируя множественные клональные несбалансированные хромосомные транслокации, включая потерю Xp. Было предложено, что это открытие может быть ранним свидетельством роли Xp в развитии этой опухоли. Интересно отметить, что болезнь Кастманна была обнаружена в связи с FDCS для меньшего числа случаев [26,34], что свидетельствует о том, что она может представлять собой повреждение предшественника. Распространение FDC и диспластические изменения, происходящие в болезни Каслмана, могут стать фоном, из которого развивается FDCS. Возможно, опухоль возникает через последовательность гиперплазии-дисплазии-неоплазии. Однако, когда только один пациент представил FDCS, осложненную болезнью Каслмана в нашем исследовании [26], потребуются дополнительные исследования, чтобы решить, существует ли связь между болезнью Каслмана и FDCS. Также была предложена возможная роль p53 в процессе трансформации [35], с избыточной экспрессией белка p53, отмеченной в FDCS, а также с увеличением числа слабо p53-позитивных клеток веретена в образце болезни гиалинового сосуда Castleman.
EBV был задокументирован как положительный в небольшом проценте случаев FDCS [36]. Неудивительно, что FDCS показывает связь с этим вирусом, поскольку FDCS выражает CD21 (рецептор EBV) и может быть экспериментально инфицирован EBV. Однако в 6 случаях, проведенных нашей собственной командой, мы не обнаружили признаков вируса путем гибридизации in situ для EBER-1 гена. Хотя ассоциация опухолей FDCs с EBV, по-видимому, изменяется в разных органах, FDCS печени, по-видимому, сильно проявляется особым образом. Эти отличительные особенности были отмечены также в опухолях селезеночных фолликулярных дендритных клеток [37]. Таким образом, роль EBV остается неясной в патогенезе опухолей FDCS. Для лучшего определения характеристик этой специфической опухоли необходимо более длительное наблюдение за больными. Латентный мембранный белок-1 (LMP-1) является интегральным мембранным белком и кодируется геном LMP-1 EBV. LMP-1 считается вирусным онкогеном из-за его способности трансформировать фибробласты грызунов in vitro и сделать их опухолегенными у голых мышей [38]. Однако только один случай в нашей литературе показывает положительное окрашивание для LMP-1. Поэтому клинико-патологическая значимость гена LMP-1 в опухолях FDCS требует дальнейшего изучения из-за того, что до сих пор было зарегистрировано лишь небольшое количество клинико-патологических данных.
Патологические характеристики и иммунофенотипический профиль FDCS в нашей серии аналогичны тем, что описаны в литературе. Наиболее распространенной гистологической особенностью является наличие овальных клеток веретена с удлиненными ядрами, нежным, диспергированным хроматином и бледно-эозинофильной цитоплазмой. Лимфоциты могут собираться вокруг кровеносных сосудов, создавая узор для манжеты. Концентрический завиток также является характерным шаблоном роста. Также могут присутствовать рассеянные многоядерные опухолевые клетки. Все эти различные морфологические признаки должны учитываться при дифференцированном диагнозе FDCS.
Чтобы обобщить литературу, CD21 и CD35 являются наиболее широко используемыми маркерами. Другими полезными маркерами являются виментин, CD23, CD68, S-100 белок, фасцин, Ki-M4p и Ki-FDC1p; однако они неспецифичны. FDCS, как правило, не имеет экспрессии CD1a, desmin и CD45, что позволяет их дифференциальную диагностику с интердигитационными опухолями дендритных клеток, опухолями клеток Лангерхана, гистиоцитарными и лимфоидными неоплазиями. Таким образом, выражение нестандартных маркеров FDCS должно учитываться при дифференциальной диагностике с другими новообразованиями.
Диагноз опухоли FDC устанавливается на основании результатов морфологии и иммуногистохимии. Ультраструктурные исследования могут быть полезны, но не обязательно для точной диагностики. Все новообразования в дифференциальном диагнозе не имеют дифференцировки фолликулярной дендритной клетки и легко исключаются, если рассматривается FDCS и применяется иммуногистохимическое окрашивание маркерами FDC.
Оптимальное лечение для FDCS еще не найдено из-за ограниченного опыта. Существующий наилучший доступный подход заключается в применении терапевтических рекомендаций, аналогичных тем, которые используются для саркомы мягких тканей высокого класса. Однако наше исследование показывает некоторые тенденции. И анализ аналитической литературы, и случаи, проведенные нами самим, показывают, что FDCS можно эффективно лечить хирургическим путем, а также не проводить лучевую терапию или химиотерапию после радикального удаления.
Лимфатические узлы, легкие и печень являются наиболее распространенными сайтами для метастазов. В случае исследований, проведенных нашими членами нашей команды, клинический ход саркомы фолликулярных дендритных клеток сродни с опухолями низкосортных опухолей. Эти цифры, вероятно, недооцениваются, поскольку во многих случаях в литературе были короткие периоды наблюдения.
В заключение, FDCS — чрезвычайно редкая опухоль лимфатических узлов и экстранодальных тканей. Из-за нехватки выявленных случаев это, вероятно, признано, особенно когда это происходит на экстранодальных сайтах. В последнее время точность диагностики значительно улучшилась благодаря анализу IHC и двум наиболее надежным маркерам FDC CD21 и CD35. Как только FDCS подозревается гистологически, иммуногистохимические пятна для дифференцировки фолликулярной дендритной клетки должны выполняться во избежание риска неправильного диагноза. Как отмечалось ранее, FDCS, происходящий в печени или селезенке, может представлять собой вариант подмножества, который отличается от FDCS в других местах, создавая гистологическую картину, подобную воспалительному псевдомутону (IPT). Вероятно, у них разные характеристики и причины. Поэтому важно учитывать возможность опухоли FDC, подобной IPT, при постановке диагноза печеночного / селезеночного поражения, подобного IPT.
FDCS обладает небольшим рецидивирующим и метастатическим потенциалом, и его следует рассматривать как низкосортную злокачественность. Литература показывает, что терапевтические модальности в этом заболевании широко варьировались, хотя часто включалась полная хирургическая резекция. Кроме того, могут использоваться адъювантная химиотерапия и лучевая терапия; но ценность этих адъювантных методов лечения для эффективного повышения выживаемости не была убедительно доказана.
Большинство данных о FDCS основаны на отчетах по отдельным случаям или сериях небольших групп, необходимы дальнейшие исследования для решения следующих вопросов: (1) необходимы более систематические данные, чтобы понять роль EBV в патогенезе этой опухоли , (2) Дальнейшие подробные цитогенетические исследования FDCS могут выявить специфический хромосомный профиль этих опухолей, что, в свою очередь, даст новое представление о биологии FDCS и предоставит патологоанатому независимые генетические маркеры. (3) дополнительные исследования должны были решить, будут ли азиаты восприимчивы к этому заболеванию.
Авторы заявляют, что у них нет конкурирующих интересов.
WHW проводила гибридизацию in situ, проводила обзор литературы, приобретала микрофотографии и составляла рукопись. LBA задумал и разработал исследование. LBA и SZS провели и проанализировали окончательный гистопатологический диагноз. HZL проводили и оценивали иммуногистохимические окраски. WJF пересмотрел рукопись для важного интеллектуального контента. Все авторы прочитали и утвердили окончательную рукопись.
Клинические характеристики 50 случаев FDCS. Клинические характеристики всех случаев FDCS были обобщены в дополнительном файле 1.
Нажмите здесь для файла
Мы хотели бы поблагодарить следующих авторов за цитирование их опубликованных случаев FDCS на китайском языке: Tu XY, Sheng WQ, Lu HF, Wang J, Wang HM, Zhao JM, Li YW, Zhang JH, An XJ, Zhang ZX, Ma HH , Zhou Z, Zheng LY, Wang JD, Liu Q, Shi QL, Zhou XJ, Ma J, Wang QP, Zhou Y, Li J, Yao XH, Zhang L, Zhong GP, Sun WY, Gan MF, Yuan MC, Dong YC, Wu B, Liu Z, Zhou XJ, Liu J, Zhang ZT, Li JS, Wang Y, Li F, Yu YH, Yao LQ, Li XQ, Du GY, Fan YJ, Lu LJ, Hu JZ, Li YL, Liu HM, He J, Qiao LK, Zhang K, Wang CJ, Xu RJ, Xu ZY, Xiang JJ, Mei JH, Wan HP, Chen RS, Su Q, Wang SF, Shang FX, Wang YC, Zhang XH, Li J , Kong FJ, Xu WS, Xu KJ, Li HZ, Shi J, Liu YH, Chen N, Liu WP, Zhou Q, Li GD, Jiang Y, Yao M, Liu Q, Cheng YQ, Bao YY, Guan NF, Gu WX, Lu HF, Wang J, Peng WJ, Yao LQ, Chang ZP, Liao SL, Jin Y, Duan LJ, Lu CH, Hong M, Luo YD, Xu L, Zhang ZX, Cheng J, Zhang RX, Xiao Y, Zhou P, Zhu ZL, Liu YH, Wang XH, Lu LM, Xu YQ, Dai CL, Jia CJ, Zhao L.
Это исследование было поддержано Отделом патологии, Xiangya Basic Medical School, Центральным южным университетом
Фолликулярных дендритных клеток саркомы (ФСКН) является чрезвычайно редким новообразование . В то время как наличие опухолей FDC было предсказано Lennert в 1978 году, опухоль не была полностью не признана в качестве своего собственного рака до 1986 года после того, как характеристики по Монда и соавт. На его долю приходится лишь 0,4% от мягких тканей саркомы , но имеет значительные периодические и метастатический потенциал и считается промежуточной степени злокачественности. Главное препятствие в лечении FDCS было ошибочным диагнозом. Это вновь характеризуется рак, и из - за его сходства в презентации и маркеры для лимфомы , как Ходжкина и неходжкинской подтипы, диагностика FDCS может быть затруднено. С последними достижениями в области биологии рака лучше диагностические анализы и химиотерапевтические средства были сделаны , чтобы более точно диагностировать и лечить ФКИ.
содержание
- 1 Симптомы
- 2 Диагностика
- 2,1 Окрашивание
- 2.2 Клеточные мутации
- 3 Лечение
- 3.1 ЧОП
- 3.2 (ПЭГ) -liposomal доксорубицин
- 3.3 Таксотер и гемцитабин
- 4 события будущего ФСКН
- 5 Ссылки
- 6 Внешние ссылки
симптомы
Фолликулярные дендритные клетки локализованы в зародышевых центрах лимфоидных фолликулов и имеют важную роль в регуляции зародышевого центра реакции и присутствующих антигенов В - клеток. В большинстве случаев FDCS развиваются в лимфатических узлах, но около 30% развиваются в экстранодальных сайтах. В 1998 году крупное исследование по болезни был ретроспективный обзор с пятьюдесятью один пациентов. Из этих пятидесяти один пациентов, не убедительны образец был найден в отношении возраста, пола, расы или презентации. Средний возраст пациентов составил 41 (диапазон 14-76), и в то время в большинстве случаев представлены шейных и подмышечных лимфоузлов , 17 представлены в экстранодальных сайтов , включая печени, селезенки, кишечника и pancrease. При таком диапазоне историй пациентов нет окончательной причины не была связана с FDCS. Там, однако, были некоторые доказательства того, что предыдущее воздействие на вирус Эпштейна - Барр (EBV) или диагностики заболевания Кастельмана может увеличить риск развития ФДК-медицинской литературы в 2000 году сообщили , примерно 12% всех случаев опухолей FDC связаны с EBV с дисперсией в различных органах, но роль EBV остается неясным , в опухолевой патогенезе FDC; и EBV не играет существенную роль в процессе трансформации заболевания Кастельмана к FDC саркоме , потому что во всех случаях отчет ассоциирован с болезнью Кастельмана были EBV отрицательной.
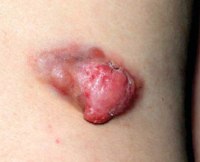
Симптомы FDCS различаются, и в значительной степени зависит от части тела опухоли развивается. Наиболее распространенным симптомом является безболезненное набухание в лимфатических узлах. Этот симптом в одиночку, однако, является nonconclusive, как это связанно со многими другими заболеваниями, включая насморк. Другие симптомы включают кашель, боль в горле, затруднение глотания, потеря веса и усталость. В тех случаях, которые представляют в экстранодальных местах за пределами головы и области шеи, органов наблюдаются специфические симптомы.
диагностика
Пролиферация клеток FDC характерно для многих неопластических заболеваний , включая фолликулярной гиперплазии , фолликулярной лимфомы , шаровидным лимфоцитов преобладают болезнь Ходжкина и ангиоиммунобластомной Т-клеточной лимфомы . Несмотря на наконец - то признается в качестве своей собственной болезни в 1986 году, диагноз FDCS еще трудно. FDC клетки являются большими, содержат два ядра, и образуют кластеры с лимфоцитами что делает их трудно различить в окрашивании. Эти клетки лучше всего визуализируются с иммунным использованием FDC маркеров CD21, CD35, R4 / 23, кластерин и KiM4p. Анализ Маркера также привела к дискуссии по поводу происхождения этого типа клеток; это coexpresses CD45, общий антиген лейкоцитов, и CD15, общий антиген моноцитов. Из-за споров и трудностей окрашивания, патологический диагноз часто требует морфологического, цитохимических и анализ электронного микроскопа , а также.
Биологические мутации опухоли ФСКН эксплуатировались в диагностических целях. Характерно FDCS имеет mircotubuloreticular структуры (ССО) и повышенные уровни внутриклеточного кластерина . МТР способствует микротрубочкам формированию многих структур , включая митотическое веретено во время клеточного деления. Это способствует многие из признаков рака , включая пролиферативные сигнализации, активации роста и репликативное бессмертие. Кластерин представляет собой гетеродимерный белок , который помогает в оформлении клеточных остатков и участвует с апоптозом. Clusterin может быть окрашен , чтобы помочь отличить ФКИ и участвует во многих важных признаках рака , включая устойчивость к гибели клеток и уклоняющимся супрессоры роста.
лечение
Во время фолликулярной дендритных информации обнаружения клеточной саркомы о влиянии химиотерапии и радиации на нем не существовало. Лучшие врачи могли бы сделать , это попытаться существующие химиотерапевтические агенты. При отсутствии доказательств клинической эффективности химиотерапии, многие из первых случаев лечились только с полной резекцией и / или лучевой терапией. Тем не менее, 12 из 31 пациентов, перенесших операцию в одиночку , как рецидив первичной обработки. Из пациентов, получивших хирургическое вмешательство и излучение 2 из 8 рецидива. Стало очевидным , что лучшие варианты лечения были необходимы. Будучи очень похожи на лимфом, врачи начали использовать общий лейкоза и неходжкинской лимфомой режим химиотерапии на пациентов: ФСКН CHOP .

Режим СНОР состоит из циклофосфамида , доксорубицина , онковином и преднизон (СНОР). Они используют различные пути , распространенные в раковых клетках. Циклофосфамид замедляет или останавливает клетку роста клеток. Он нацелен на клетки, которые быстро делящиеся , которые включают раковые клетки , которые являются самодостаточными в сигналах роста и нечувствительным к antigrowth сигналов. Что еще более важно, биологические действия циклофосфана зависит от дозы. При высоких дозах он очень цитотоксический; его метаболит phosphoromide добавляет алкильную группу в положении N7 на гуанин , что приводит к арестованному роста и гибели клеток. Метаболит образуется только в клетках с низким уровнем цитоплазматической альдегиддегидрогеназы (ALDH) , что приводит к относительно низкой токсичности химиотерапии в других не-раковых клеток , таких как костный мозг. Это также иммунодепрессант и уменьшает воспалительную реакцию. При низких дозах, в то время как он менее цитотоксический, он показывает некоторые антиангиогенные свойства. Механизм до конца не изучен , но считается , что это мешает факторов роста VEGF , производимых внутри и вокруг опухоли микроокружения.
Доксорубицин препятствует росту клеток и репликации путем интеркаляции в ДНК. Это останавливает топоизомеразы II от расслабления нитей ДНК и ингибировать транскрипцию. Недавние исследования также показали, что доксорубицин может быть вовлечен в пути Akt. Важным отличительным признаком рака, Akt является частью путей выживания клеток путем ингибирования апоптоза. Существует также доказательство того, что Akt участвует в ангиогенезе и сосудистом созревании. Активация PI3-киназа / Akt опосредует производство VEGF в клетках. Таким образом, доксорубицин имеет двойную роль в лечении рака: он ингибирует выживаемость клеток (вызывает апоптоз), и уменьшает ангиогенез.
Онковин, более известный как винкристины, является ингибитором митоза. Он связывается с димеров тубулина, ингибируя сборку микротрубочек структур, как цитоскелета и митотического веретена. Хотя этот препарат до сих пор не может строго целевой раковые клетки, раковые клетки имеют более высокий средний оборот микротрубочек, делая их более чувствительными к цитотоксичности онковином. Преднизон, последний препарат в комбинированной терапии СНОР является кортикостероид, который действует как воспаление иммунодепрессанта уменьшается.
Одним из таких событий в доставке доксорубицина. Несмотря на то, что является эффективным индуктором апоптоза, доксорубицин быстро отфильтрованы из тела. Загрузив ПЭГ-липосом с доксорубицином время циркуляции и локализации опухолей в значительной степени возрастает. Раковые опухоли характерно имеют обширный ангиогенез и вытекающую vasculatures, что приводит к ПЭГ-липосомам, естественно накапливаться в опухоли. Это также позволяет пациентам получать более низкие и меньше дозы препарата и испытывают меньше побочных эффектов. Это также попытка с наночастицами, но не было протестировано на FDCS. В 2008 году КС плюс (PEG) -liposomal доксорубицин пошел в клиническое испытание для пациента ФСКН заменить схему СНОР, и через 5 лет пациент остается в ЧР.
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Саркомы – это группа различных по клиническим и морфологическим признакам злокачественных новообразований, которые происходят из любых неэпителиальных тканей. В этом заключено основное отличие саркомы от рака, ростком которого являются эпителиальные клетки.
Риск возникновения данного заболевания повышается при некоторых генетических патологиях:
- синдром базальноклеточных невусов;
- синдром Вернера;
- синдром Гарднера;
- туберозный склероз;
- кишечный полипоз т.д.
А болезнь Реклингхаузена, или нейрофиброматоз 1 типа, является наиболее распространенным наследственным заболеванием, которое осложняется опухолевыми процессами. При этой патологии нейрофибросаркомы возникают примерно в 15% случаев. Описаны также случаи возникновения саркомы в зоне воздействия ионизированного излучения, как патологического, так и с лечебными целями.
Гистоморфологическая классификация сарком
Зачастую точно определить, из какой именно ткани возникла конкретная опухоль, довольно сложно. Кроме того, выделяется большая группа опухолей, которые имеют неясный гистогенез.
Наиболее часто диагностируются фибросаркомы, липосаркомы и рабдомиосаркомы. Вторыми по частоте встречаемости следует злокачественная гистиоцитарная саркома мягких тканей и саркомы неясного генеза. Ангиосаркомы, синовиальные саркомы, злокачественные шванномы, лейомиосаркомы и прочие типы наблюдаются редко.
Опухоли жировых тканей
Промежуточные (местно-агрессивные) формы:
- атипичный липоматоз;
- высокодифференцированные липосаркомы.
Злокачественные формы:
- недифференцированные липосаркомы;
- миксоидные липосаркомы;
- круглоклеточные липосаркомы;
- полиморфная липосаркома;
- липосаркомы смешанного типа;
- липосаркомы без признаков дифференцировки.
Миофибропластические и фибробластические опухоли
Промежуточные, или местно-агрессивные, формы:
- поверхностные подошвенные или ладонные фиброматозы;
- фиброматозы десмоидного типа;
- липофиброматозы.
Редко метастазирующие формы:
- солитарные фиброзные опухоли;
- гемангиоперицитомы, включая липоматозные гемангиоперицитомы;
- воспалительные миофибропластические опухоли;
- миофибропластические саркомы низкой степени дифференцировки;
- миксоидные фибропластические саркомы;
- инфантильные фибросаркомы.
Злокачественные формы:
- зрелые фибросаркомы;
- миксофибросаркомы;
- медленнорастущие фибромиксоидные саркомы;
- гиалинизирующие веретеноклеточные саркомы;
- склерозирующие эпителиоидные фибросаркомы.
Фиброгистиоцитарные опухоли
Промежуточные, или местно-агрессивные формы:
- плеоморфные фиброгистиоцитарные опухоли;
- гигантоклеточные саркомы мягких тканей.
Злокачественные формы:
- недифференцированные плеоморфные саркомы;
- недифференцированные плеоморфные саркомы с гигантскими клетками;
- недифференцированные плеоморфные саркомы с преобладанием воспаления.
Саркома мышечной ткани
Опухоли скелетных мышц:
- эмбриональные веретеноклеточные и анапластические рабдомиосаркомы;
- альвеолярные солидные и анапластические рабдомиосаркомы;
- плеоморфные рабдомиосаркомы.
Саркома гладких мышц: лейомиосаркома, включая и кожные формы.
Периваскулярные опухоли
- Злокачественные гломусные опухоли;
- миоперицитомы.
Сосудистые опухоли
Промежуточные, или местно-агрессивные формы: гемангиоэндотелиомы типа Капоши.
Редко метастазирующие формы:
- ретиформные гемангиоэндотелиомы;
- папиллярные внутрилимфатические ангиоэндотелиомы;
- смешанные гемангиоэндотелиомы;
- саркомы Капоши.
Злокачественные формы:
- эпителиоидные гемангиоэндотелиомы;
- гемангиосаркома мягких тканей.
Костно-хрящевые опухоли
Опухоль костной ткани, или остеогенная саркома:
- обыкновенные: хондробластические, фибробластические, остеобластические;
- телеангиоэктатические;
- мелкоклеточные;
- центральные, имеющие низкую злокачественность;
- вторичные;
- параоссальные;
- периоссальные;
- поверхностные, имеющие высокую злокачественность.
Опухоли хрящевой ткани (хондросаркомы):
- центральные, первичные и вторичные;
- периферические;
- дедифференцированные;
- мезенхимальные;
- светлоклеточные.
Опухоли неясного происхождения
Редко метастазирующие формы:
- ангиоматоидные фиброзные гистиоцитомы;
- оссифицирующие фибромиксоидные опухоли;
- миоэпителиомы;
- парахондромы.
Злокачественные формы:
- синовиальная саркома;
- эпителиоидные саркомы;
- альвеолярная мягкотканная саркома;
- светлоклеточная саркома мягких тканей;
- внескелетные миксоидные хондросаркомы хордоидного типа;
- примитивные нейроэктодермальные опухоли (PNET);
- внескелетные саркомы Юинга;
- десмопластические мелко- и круглоклеточные опухоли;
- внепочечные рабдоидные опухоли;
- злокачественные мезенхимомы;
- миелоидная саркома;
- новообразования, имеющие периваскулярную эпителиоидно-клеточную дифференцировку (PEComa);
- светлоклеточные миомеланоцитарные опухоли;
- интимальные саркомы.
Каждый из названных гистологических типов отличается не только своими морфологическими признаками и гистогенезом, но также имеет определенное клиническое течение. Конечно, подобное многообразие морфологических форм сарком вызывает значительную трудность в их диагностике.
Еще больше гистологическое типирование сарком осложняется в детском возрасте. Обусловлено это тем, что у детей большая часть опухолей происходит из примитивных эмбриональных клеток (эмбриональная саркома) или клеток, которые еще не завершили свое гистогенетическое становление. Такие опухоли, имея большое разнообразие морфологических форм, зачастую не имеют четких признаков гистотиповой дифференцировки, характеризуются резкой анаплазией и вариабельностью клеточного состава. Вместе с тем часто наблюдается и обратная картина: новообразования различного происхождения часто имеют сходные признаки строения. Все это делает типирование опухолей значимой проблемой.
Распределение основных типов сарком по преобладанию в их составе
клеток определенной формы
Рутинная оценка сарком начинается с оценки общего строения опухоли, которая базируется, прежде всего, на ее "узнаваемости" при микроскопии. Описывается общая картина преобладания клеток определенной формы.
Опухоли, состоящие из округлых клеток:
- нейробластома;
- саркома Юинга/PNET;
- мезенхимальная хондросаркома;
- эмбриональная и альвеолярная рабдомиосаркома;
- десмопластичная круглоклеточная саркома;
- круглоклеточная липосаркома;
- малигнизированная рабдоидная опухоль.
Опухоли, состоящие из веретенообразных клеток:
- фибросаркома;
- веретеноклеточная рабдомиосаркома;
- лейомиосаркома;
- злокачественные опухоли периферических нервных стволов;
- веретеноклеточная ангиосаркома;
- монофазная веретеноклеточная синовиальная саркома.
Опухоли, состоящие из эпителиоидных клеток:
- эпителиоидноклеточная синовиальная саркома;
- эпителиоидноклеточная ангиосаркома;
- эпителиоидноклеточные злокачественные опухоли нервного ствола;
- склерозирующая эпителиоидноклеточная фибросаркома;
- злокачественная фиброзная гистиоцитома;
- эпителиоидноклеточная лейомиосаркома.
Остальные гистоморфологические типы сарком, входящие в классификацию, имеют преимущественно смешанную форму клеток. Кроме того, иногда форма злокачественно перерожденных клеток не поддается описанию и определению. В таких случаях опухоль классифицируется как плеоморфная саркома.
Типирование сарком по степени дифференцировки клеток
После определения гистологического типа саркомы оценивается степень ее дифференцировки (G). При этом учитываются такие критерии, как клеточный полиморфизм, митотическая активность и др.
Степени дифференцировки сарком:
- GX – степень дифференцировки клеток определить невозможно;
- G1 – саркома высокодифференцирована;
- G2 – саркома дифференцирована умеренно;
- G3 – саркома низкодифференцирована;
- G4 – недифференцированая саркома.
Дифференциация клеток определяется возможностью установить, к какому именно виду ткани относится конкретная клетка. Чем ниже степень дифференциации клеток, составляющих опухоль, тем более выраженную злокачественность имеет данная саркома. Это напрямую связано с шансами раннего метастазирования в другие органы и ткани. Кроме этого, чем выше злокачественность саркомы, тем быстрее она увеличивается в размерах, тем большую инфильтративность имеет ее рост и тем стремительнее прогрессирует заболевание.
Иммуногистохимическое (ИГХ) типирование сарком
Иммуногистохимическое исследование позволяет:
- провести гистогенетическое типирование опухоли и определить нозологический вариант новообразования;
- определить органопринадлежность первичной опухоли при метастазах неизвестного происхождения;
- определить степень злокачественной трансформации клеток опухоли;
- прогнозировать течение опухолевого заболевания;
- прогнозировать чувствительность и резистентность опухолевых клеток к химиотерапевтическим препаратам и лучевой терапии;
- определить возможность проведения узконаправленной терапии.
Сегодня при верификации сарком используется несколько десятков основных ИГХ-маркеров. Поскольку практически нет ИГХ-маркеров, которые были бы специфичными только для какого-то конкретного типа опухоли, для типирования новообразования должен использоваться набор из нескольких антител.
1. В группу опухолей, состоящих из мелких округлых клеток, относятся новообразования, наиболее часто встречающихся в детском возрасте. Они обычно имеют низкую дифференцировку и высокую степень злокачественности.
- Бластная нейрогенная саркома. Все ее разновидности экспрессируют нейрональные маркеры, такие как нейронспецифическая энолаза (NSE), синаптофизин, хромогранины (CgA), СD56, СD57.
- Рабдомиосаркома. Все ее виды экспрессируют виментин, десмин и мышечный специфический актин (MA), а также СD99. Основными же ее специфическими маркерами является миогенные ядерные регуляторные протеины – миогенин и МуоD1.
- Основными диагностическими маркерами для саркомы Юинга и примитивной нейроэктодермальной опухоли являются СD99 (продукт гена MIC2) и Fli-1. Также клетки этих опухолей экспрессируют виментин, сравнительно часто - синаптофизин, в редких случаях - цитокератины (CK), CD57.
- Клетки мезенхимальной хондросаркомы экспрессируют виментин, S-100 протеин и, реже, СD57.
- Мелкоклеточная остеосаркома характеризуется экспрессией виментина, остеокальцина, может наблюдаться экспрессия СD57 и СD99.
- Мелкоклеточная низкодиференцированная синовиальная саркома мягких тканей, как и другие типы синовиальных сарком (монофазная веретеноклеточная синовиальная саркома, эпителиоидная синовиальная саркома, дедиференцированная полиморфноклеточная саркома), экспрессируют CK, эпителиальный мембранный антиген (EMA), виментин, коллаген IV типа.
- Десмопластическая мелкокруглоклеточная опухоль - очень редкий вид чрезвычайно агрессивного новообразования. Обычно клетки этой опухоли экспрессируют эпителиальные (СК и ЕМА), мезенхимальные (виментин), миогенные (десмин) и нейральные (СD56, NSE) маркеры.
2. К опухолям, состоящим из веретенообразных клеток, прежде всего относятся новообразования, развивающиеся из производных мезенхимы.
- Фибросаркома и инфантильная фибросаркома не имеют специфического иммунопрофиля, но всегда положительны к виментину, а иногда – и к SMA.
- Клетки лейомиосаркомы, как правило, экспрессируют виментин, десмин, МА, SMA, кальдесмон.
- Злокачественная опухоль оболочки периферического нервного ствола экспрессирует виментин, коллаген IV типа и СD57.
- Сосудистая эпителиоидно- и веретеноклеточная саркома, а также саркома Капоши экспрессируют Fli-1, CD31, CD34 и фактор фон Виллебранта (фактор VIII связывающий протеин).
- Гемангиоперицитома и солитарная фиброзная мягкотканая саркома относятся к новообразованиям, пограничным по своему потенциалу злокачественности. Их клетки обычно экспрессируют CD34, CD99, а также bcl-2.
3. Опухоли, состоящие из эпителиоидных клеток, характеризуются признаками, присущими специализированным клеточным элементам соединительной ткани (миофибробластам, эпителиоидным клеткам сосудов, миоэпителиальным клеткам).
- Злокачественная воспалительная миофибробластическая опухоль (воспалительная фибросаркома) демонстрирует иммунореактивность с кальпонином, SMA и десмином.
- Злокачественная фиброзная гистиоцитарная саркома характеризуется коэкспрессией виментина, EMA и CD68, в некоторых случаях наблюдается экспрессия MA, однако не экспрессируются миогенин и МиоD1.
- Периваскулярные эпителиоидноклеточные опухоли (PEC-омы) – это группа опухолей, к которым относятся: ангиомиолипома почек (и других локализаций), светлоклеточная саркома легких ("сахарная" опухоль), лимфангиолейомиоматоз и др. Клетки этих опухолей демонстрируют меланоцитарный иммунофенотип (положительны к: Мелан-А, НМВ45, тирозиназе) с коэкспрессией SMA.
- Эпителиоидная саркома коэкспрессирует виментин и СК.
Помимо гистогенетического типирования опухолей, принципиально важной задачей ИГХ является определение степени злокачественности опухоли и выявление прогностических маркеров. Это позволяет намного более обоснованно и достоверно прогнозировать течение болезни, а также чувствительность опухоли к лечебным средствам.
Читайте также:

