Прогностические факторы в онкологии
В первом исследовании GOG (Creasman et al., Boronow et al., DiSaia et al.), охватившем 222 больных с I стадией РЭ, установленной хирургическим методом, была выявлена взаимосвязь между различными прогностическими факторами. В следующем исследовании GOG 621 пациентке с раком эндометрия (РЭ) I стадии провели хирургическое лечение в объеме абдоминальной гистерэктомии с двусторонней аднексэктомией, а также селективной лимфаденэктомией тазовых и парааортальных лимфоузлов.
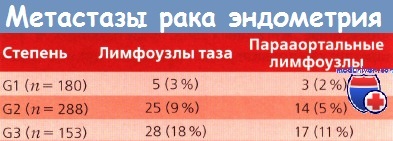
Во время операции обязательно брали смывы из брюшной полости для цитологического теста. Анализировали размер матки, гистологические типы опухолей, степень дифференцировки и глубину инвазии в миометрий — все то, что изучали в предварительных и последующих работах. Из всех больных только у 25% диагностирован низкодифференцированный рак; у 22 % наблюдалась глубокая инвазия в миометрий; метастазы в лимфоузлах таза выявлены у 58 (9%) больных, а в парааортальных — у 34 (6%).
Размер опухоли, степень ее дифференцировки и глубина инвазии хорошо коррелировали с возникновением метастазов в лимфоузлах. Метастазы в придатках обнаружены у 35 (5%), до лапарото-мии их не распознали. С увеличением глубины инвазии в миометрий и при поражении истмической части или шейки матки возрастает частота метастазов в придатках матки и лимфоузлах.
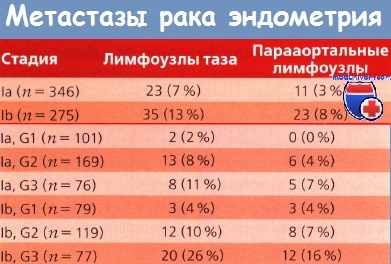
При цитологическом исследовании смывов из брюшной полости клетки злокачественной опухоли обнаружены у 76 (12 %) больных. У одной и той же больной могли встречаться как благоприятные, так и неблагоприятные прогностические факторы. При оценке возникновения метастазов в лимфоузлах в соответствии с 6 подстадиями I клинической стадии РЭ оказалось, что вероятность их метастатического поражения возрастает при менее дифференцированных опухолях и увеличении размера матки.
В одном из первых исследований GOG больных раком эндометрия (РЭ) после хирургического лечения наблюдали от 37 до 72 мес. Поскольку рецидивирование заболевания, как правило, происходит на протяжении первых 2 лет после лечения, можно предположить, что в течение указанного срока наблюдения было диагностировано большинство рецидивов.
Только хирургическое лечение было проведено 68 (31 %) пациенткам; еще 97 (44%) получили комбинированную терапию — предоперационную брахитерапию с последующей операцией па протяжении одной госпитализации. По крайней мере в одном из участвующих в исследовании учреждений в начале клинического испытания предоперационную брахитерапию выполняли всем больным, затем ее назначали реже и к моменту завершения исследования прекратили применять вообще. У пациенток, которым проведено только хирургическое лечение, рецидивы возникли в 9% случаев, в группе брахитерапия + операция — в 8%.
При индивидуальном рассмотрении каждого случая было решено, что только 25% больных с высоким риском показана ДЛТ. Среди пациенток, получивших этот вид облучения, рецидивы развились в 35% (20 из 57) случаев. Поскольку ЛТ назначали при высоком риске прогрессирования заболевания, возникла необходимость четкого разграничения больных па группы высокого и низкого риска на основании данных о возникновении рецидивов. В исследовании только 25% больных были отнесены к группе высокого риска, диктующего необходимость проведения ДЛТ. С другой стороны, предполагалось, что 75% пациенток не нуждаются в ЛТ, что указывает на заметное изменение протокола, утвержденного во многих учреждениях.
По данным анализа локализации рецидивов заболевания, только у 2(1 %) пациенток был выявлен изолированный рецидив в области культи влагалища; одна из них перенесла только хирургическое лечение, а другая — операцию + брахитерапию. Из результатов данного исследования следует, что культя влагалища не есть локализация, характеризующаяся высоким риском возникновения рецидивов, поэтому роль бра-хитерапии при РЭ должна быть пересмотрена. Кроме того, у 5 больных рецидивы диагностированы в области таза. Из 37 рецидивов 27 (73 %) были представлены метастазами в зонах за пределами лечебных воздействий. Проведенная терапия обеспечивала отличный местный контроль над РЭ, но усилия научной и практической онкогинекологии должны быть направлены на профилактику возникновения отдаленных метастазов.

Частота рецидивов строго коррелировала с другими прогностическими факторами: степенью дифференцировки и глубиной инвазии опухоли, местом ее локализации в матке, поражением придатков, данными цитологического исследования смывов из брюшной полости, а также метастазированием в лимфоузлы. В зависимости от распространенности опухоли эндометрия на момент постановки диагноза — в матке или за ее пределами (метастазы в придатках, лимфоузлах или в пределах брюшной полости, положительный результат цитологического исследования смывов) — установлено, что в первом случае рецидивы после лечения возникли только у 7 % больных, во втором — у 43 %.
Эксперты GOG исследовали факторы риска у 895 больных с клинически установленными I (789 женщин) и II (136 женщин) стадиями рака эндометрия (РЭ). У некоторых пациенток не все прогностические факторы были доступны для анализа. По данным многофакторного анализа, у пациенток с заболеванием, ограниченным пределами матки, риск рецидива был более высоким при глубокой инвазии в миометрий, проникновении опухолевых клеток в просвет сосудов или положительном результате цитологического исследования смывов из брюшной полости.
На рисунке ниже авторы разграничили факторы риска на отдельные группы для определения прогноза заболевания и принятия решения о назначении адъювантной терапии. Несмотря на некоторую условность границ между этими категориями, они согласуются с большинством клинических ситуаций.

Какие факторы влияют на прогноз при раке?
Чем отличается общая и относительная выживаемость?
Обсудим терминологию и наиболее частые вопросы пациентов.
Прогноз — это оценка вероятного течения и исхода заболевания.
Прогноз пациента с диагнозом рак часто рассматривается как вероятность того, что заболевание будет успешно вылечено и человек восстановится.
Какие факторы влияют на прогноз при раке?
На течение заболевания влияют многочисленные внутренние и внешние факторы.
К числу наиболее важных факторов прогноза относят:
• Тип и локализацию злокачественной опухоли
• Стадия заболевания (степень распространения рака в организме)
• Степень злокачественности (насколько аномально выглядят раковые клетки под микроскопом — показатель скорости роста и распространения новообразования)
• Общее состояние здоровья пациента
• Возраст на момент диагноза
Другие факторы, влияющие на прогноз, включают биологические свойства опухолевых клеток (эти свойства отражают биомаркеры, которые можно определить с помощью специальных лабораторных анализов), а также ответ пациента на предпринятое ранее лечение.
Что означает выживаемость при раке?
При составлении прогноза врачи учитывают характеристики заболевания, доступные варианты лечения и любые проблемы со здоровьем, которые могут возникнуть у пациента, повлиять на течение заболевания и возможность успешного продолжения терапии.
В основе прогноза при раке лежит статистика — информация, которую исследователи со всего мира кропотливо собирали в течение многих лет о сотнях или даже тысячах людей с одним и тем же типом заболевания.
Когда возможно, врачи используют статистику, основанную на группах людей, чьи ситуации наиболее похожи на ситуацию конкретного пациента. В остальных случаях они руководствуются обобщенными данными.
Одним из ключевых индикаторов в исследованиях рака является выживаемость, и с этим термином не все просто, как может показаться на первый взгляд. Выживаемость бывает разной.
Наиболее часто употребляемые виды выживаемости при раке перечислены ниже:
• Специфическая выживаемость (опухоль-специфическая, канцер-специфическая): показатель отражает процент пациентов с определенным типом и стадией рака, которые не умерли от своего заболевания в течение определенного периода времени (1 год, 2 года, 5 лет) после диагноза. Опухоль-специфическая выживаемость в большинстве случаев определяется исследователями на основании записей о причине смерти в медкартах, поэтому данные могут быть неточными.
• Относительная выживаемость: этот показатель сравнивает выживаемость пациентов с диагнозом рак (например, рак молочной железы) с выживаемостью людей из общей популяции того же возраста, расы и пола, у которых данный диагноз отсутствует. Фактически, это процент больных раком, которые выжили в течение определенного периода времени, по сравнению с людьми без рака.
• Общая выживаемость: это процент пациентов с определенным типом и стадией рака, которые еще живы, то есть не умерли от любых причин, в течение определенного периода времени после диагноза.
• Безрецидивная выживаемость: процент пациентов, у которых нет признаков рака в течение определенного периода времени после лечения. Аналогичным термином, который применяют исследователи, является выживаемость без прогрессирования заболевания.
Статистика часто приводится с точки зрения 5-летней выживаемости по отношению к общей популяции.
Например, согласно данным Национальных институтов рака США, 5-летняя относительная выживаемость для всех женщин с диагнозом рак молочной железы за 2001-2007 год составляла 89%, а 5-летняя относительная выживаемость для всех пациентов с диагнозом рак легкого за тот же период — 16%. Наглядно и просто.
Поскольку статистика выживаемости при раке основана на больших группах людей, ее некорректно использовать для точного прогнозирования того, что произойдет с конкретным пациентом.
Нет двух одинаковых пациентов, их лечение и ответы на терапию могут сильно различаться.
Кроме того, обычно требуются годы, чтобы увидеть влияние новых методов лечения и диагностических тестов. Статистика, которую использует онколог для составления прогноза, может не отражать нынешних реалий.
Тем не менее, врач может говорить о благоприятном прогнозе, если исследования на больших группах людей предполагают хороший ответ на терапию. Прогноз будет неблагоприятным, если рак трудно контролировать. Врачи не могут быть абсолютно уверены в результате для отдельно взятого пациента.
Важно помнить, что прогноз — это только оценка.
Полезно ли знать прогноз при раке?
Больные раком и их близкие сталкиваются со многими неизвестными, которые давят на них.
Понимание болезни и реалистичные ожидания может помочь принимать правильные решения о лечении, поддерживающей и паллиативной помощи, реабилитации и личных вопросах, таких как финансы.
Поиск информации о прогнозе — это сугубо личное решение больного.

Многие больные раком хотят знать свой прогноз. Им легче справиться, когда они знают вероятное течение заболевания и могут лучше контролировать свою жизнь на основании этих сведений. Можно спросить своего врача о статистике выживаемости или найти эту информацию самостоятельно.
Другие больные не без оснований считают статистическую информацию запутывающей и пугающей. Они называют цифры слишком безличными и обобщенными, а потому не представляющими ценности для них.
Поскольку ситуация у всех разная, на этот вопрос бывает сложно ответить. Кроме того, устаревшие или проведенные в заморских странах исследования могут искажать истинную ситуацию здесь и сейчас.
В чем разница между выздоровлением и ремиссией?
Выздоровление означает, что лечение успешно уничтожило все следы рака, и заболевание никогда не повторится (рецидив рака). Однако излечение не означает, что у человека больше никогда не заболеет. Вполне возможно, что в будущем в организме возникнет другая опухоль, в том числе такого же типа. Следует понимать, что некоторые методы лечения рака (лучевая терапия) делают такой сценарий вполне реальным.
Ремиссия рака означает, что признаки уменьшаются, но болезнь не исчезает.
Ремиссия может быть частичной (неполной) или полной. При полной ремиссии все признаки заболевания исчезают, но опухолевые клетки продолжают скрываться в организме, ожидая своего часа.
Если пациент остается в полной ремиссии на протяжении 5 лет и более, некоторые онкологи берут смелость утверждать, что больной излечился. Тем не менее, раковые клетки могут жить незамеченными в организме в течение многих лет или даже десятилетий после явно успешного курса лечения. Эти клетки могут в конечном итоге вызвать рецидив заболевания.
Хотя большинство видов рака, как правило, рецидивируют в течение первых 5 лет после прохождения терапии, более поздние рецидивы всегда никогда не исключены. Прогноз при раке — вещь ненадежная, поэтому врач не сможет с уверенностью сказать, что человеку больше ничего не угрожает. Максимум, что в настоящее время нет признаков рака.
Из-за возможности рецидива, врачи продолжают наблюдать за пациентами в течение многих лет и выполняют периодические обследования, чтобы вовремя обнаружить признаки рецидива рака и назначить лечение.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
4 февраля во всем мире отмечается День борьбы против рака. Как выглядит ситуация с заболеваемостью, диагностикой и лечением этой болезни в нашей стране, рассказал главный онколог Минздрава России, руководитель Национального медицинского исследовательского центра (НМИЦ) радиологии академик РАН Андрей Каприн.
ЦИФРЫ И ФАКТЫ
По последним данным (за 2019 год):
57,9% онкозаболеваний выявляется в России на ранней стадии. Именно на ранних стадиях наиболее высоки шансы успешного лечения болезни.
55% онкопациентов состоят на учете 5 и более лет. Как правило, это означает, что болезнь успешно лечится и взята под контроль.
21,3% больных погибают в течение 1-го года после постановки диагноза (в большинстве случаев - когда рак обнаруживается на поздней стадии).
Показатель 5-летней выживаемости очень важен еще и потому, что у пациента повышается шанс дожить до еще более эффективного лечения, новых передовых технологий, подчеркнул академик Каприн.
Также главный онколог сообщил, что показатель заболеваемости раком на 100 тысяч населения в России вырос. Так, в 2015 году это было 402,57 на 100 тысяч, в 2017-м - 420,3, а в 2018 (последние данные) - 425,46. Пугаться не стоит, на самом деле это говорит об улучшении охвата и качества диагностики, подчеркнул Андрей Каприн. А чем лучше диагностика, тем больше шансов на эффективное лечение.
ФАКТОРЫ РИСКА, КОТОРЫЕ СОЗДАЕМ МЫ САМИ
На сегодня дефицит врачей-онкологов в нашей стране составляет 1 987 человек, сообщил глава НМИЦ радиологии. В то же время не все зависит от медицины. Есть факторы, которые доказанно повышают риск развития и прогрессирования рака. И при этом зависят исключительно от нас самих. Академик Каприн перечислил четыре основных и самых распространенных фактора:
1. Курение. Однозначно доказано, что у курильщиков риск развития разных видов рака, включая рак легкого, мочевого пузыря и др . возрастает в среднем в 30 (!!) раз.
2. Ожирение. Исследования показали, что избыточный вес связан с хроническим воспалением. А оно, в свою очередь, служит благоприятной почвой для появления опасных мутаций.
3. Злоупотребление алкоголем. С этим пагубным пристрастием связано развитие не только рака печени. Доказано, что частое и неумеренное употребления алкоголя повышает риск развития рака молочной железы, поджелудочной железы. А также других видов онкологических заболеваний.
СЕМЬ ВАЖНЫХ ОБСЛЕДОВАНИЙ
Также главный онколог напомнил, что на сегодня в рамки бесплатной диспансеризации входят 7 видов онкоскрининга. То есть обследований, позволяющих обнаружить на ранней стадии наиболее распространенные виды онкологических заболеваний. Это:
- ПАП-тест (исследование мазка с поверхности шейки матки). Проводится женщинам с 18 до 64 лет раз в три года.
- Маммография. Проводится женщинам 40 - 75 лет раз в два года.
- Определение простат-специфического антигена (ПСА) в крови. Проводится мужчинам в 45, 50, 55, 60 лет и в 64 года.
- Анализ кала на скрытую кровь. Проводится мужчинам и женщинам 40 - 64 лет - раз в два года; 65 - 75 лет - раз в год.
- Эзофагогастродуоденоскопия (для диагностики рака пищевода, желудка, двенадцатиперстной кишки). Проводится в 45 лет всем, сроки проведения в другом возрасте определяются врачом по медпоказаниям.
- Рентген легких или компьютерная томография легких (для выявления рака легкого). Назначается врачом по медпоказаниям.
- Колоноскопия. Назначается врачом по медпоказаниям.
О.Б.Кармановская
Обычно определяя тактику лечения больной раком молочной железы, врач-онколог задает себе следующие вопросы: каков у данной пациентки риск рецидива и смерти? Какого результата можно ожидать от лечения в данном конкретном случае? Он должен изучить биологические характеристики опухоли и в зависимости от совокупности прогностических и предсказывающих факторов определить план лечения. С развитием молекулярных, иммуногистохимических и биохимических методов диагностики наши знания о прогностических и предсказывающих факторах расширяются. Важным для клинициста является умение применять их в клинических ситуациях, выделять важные и второстепенные прогностические факторы.
Прогностические и предсказывающие факторы
Как известно, прогностические факторы оценивают риск рецидива или смерти, в то время как предсказывающие факторы предсказывают эффективность какого либо вида терапии. Некоторые прогностические факторы могут быть и предсказывающими (рецепторы эстрогенов в ткани опухоли свидетельствуют о более благоприятном прогнозе заболевания и чувствительности к гормональному лечению). Предсказывающие факторы освещают связь между биологией опухоли и эффективностью лечения. В таблице 1 показаны различия между двумя типами факторов.
Таблица 1.
Предсказывающие и прогностические факторы
| Прогностические факторы | Предсказывающие факторы |
|---|---|
| Базируются на биологии опухоли | Отражают взаимосвязь между биологией опухоли и лечением |
| Коррелируют с продолжительностью жизни больных независимо от вида лечения | Коррелируют с частотой объективного ответа независимо от прогноза |
| Разделяют больных по степени риска рецидива или смерти | Разделяют больных по чувствительности к различным видам лечения |
| Большое количество | Малое количество |
| Примеры: статус регионарных лимфоузлов, размер опухоли, степень дифференцировки, рецепторы эстрогенов, HER2 | Примеры: Рецепторы эстрогенов и гормональная терапия, HER2 и Герцептин |
В данном сообщении будут представлены некоторые новые сведения о прогностических и предсказывающих факторах на основе материалов 23 конференции по раку молочной железы, прошедшей в Сан-Антонио в декабре 2000г.
Через 30 лет после идентификации рецепторов эстрогенов выяснилось, что существует 2 различных вида рецепторов эстрогенов (ER) — ER-alpha и ER-beta. Функция и прогностическое значение ER-beta в настоящее время продолжает изучаться во многих исследовательских центрах. Так Fuqua и коллеги изучали экспрессию ER-beta в архивном материале с помощью моноклональных антител к белку ER-beta [1]. Оказалось, что совместная экспрессия двух видов рецепторов определяется в большинстве опухолей, однако только повышенная экспрессия ER-alpha коррелировала с повышенной экспрессией рецепторов прогестерона и другими маркерами лучшего прогноза (диплоидия, меньший размер опухоли, меньшее количество клеток в S-фракции). Напротив, повышенная экспрессия ER-beta коррелировала только с анеуплоидией. Данное исследование подтвердило различную биологическую роль двух видов рецепторов эстрогенов и показало необходимость дальнейших исследований в этом направлении.
Индекс митотической активности (MAI)
Микрометастазы в лимфатических узлах.
Доктор Norikazu М. И коллеги в своем исследовании показали прогностическое значение микрометастазов в регионарных лимфоузлах у больных раком молочной железы [5]. Микрометастазы, определяемые с помощью RT-PCR (полимеразная цепная реакция), были выявлены у 40 из 129 (31%) больных без вовлечения в процесс лимфоузлов по данным рутинного гистологического исследования. При мультивариантном анализе оказалось, что наличие микрометастазов в подмышечных лимфоузлах прогнозировало большую вероятность возникновения рецидива заболевания. У больных с микрометастазами в подмышечных лимфоузлах значительно меньшими оказались показатели как безрецидивной (87,6% и 66,1%), так и общей продолжительности жизни (93,7% и 67,8%).
Инсулин и диабет Значение ожирения и сахарного диабета в клиническом течении рака молочной железы изучалось доктором Song EY и коллегами в Karmanos Cancer Institute in Detroit, Michigan [6]. В исследование включено 1126 больных раком молочной железы I-III стадий, 153 из которых страдали также сахарным диабетом, 362 — ожирением. Средний период наблюдения составил 45 месяцев. Оказалось, что больные сахарным диабетом имели больший риск рецидивирования и меньшую продолжительность безрецидивного периода, для страдающих ожирением такой корреляции не было получено.
Протеолитические ферменты урокиназный активатор плазминогена (uPA) и его ингибитор 1 типа (PAI-1) играют важную роль в процессе опухолевой инвазии и метастазирования. Прогностическое значение этих двух ферментов изучалось Lisboa BA и коллегами [7]. Оказалось, что у 126 больных операбельным раком молочной железы без метастазов в подмышечные лимфоузлы uPA является независимым прогностическим фактором, характеризующим безрецидивную выживаемость.
Еще одно продолжающееся клиническое исследование оценивает возможность использования параметры uPA и PAI-1 для отбора больных, нуждающихся в адъювантной химиотерапии [8]. За период с июня 1993 по декабрь 1998 в исследование включено 674 больных раком молочной железы (No). Больные с низким уровнем uPA и PAI-1 после радикального оперативного вмешательства составили контрольную группу. Больные из группы высокого риска с повышенным уровнем uPA и PAI-1 были рандомизированы на 2 группы: в первой группе больные получали адъювантную химиотерапию CMF (6 курсов), во второй группе наблюдались. Больные с низким уровнем uPA и PAI-1 (n=208) имели преимущества по безрецидивной выживаемости перед больными с высоким уровнем uPA и (или) PAI-1 (n=166). Хотя небольшой период наблюдения не позволяет делать окончательных выводов, больные из группы высокого риска, получавшие адъювантную терапию CMF имели более длительный безрецидивный промежуток.
Как известно способность злокачественной опухоли к инвазивному росту и метастазированию в огромной степени зависит от процесса формирования новых кровеносных сосудов — ангиогенеза. Доктор Kato и коллеги из токийского университета изучали плотность микрососудов в опухолях (MVD) у 377 больных раком молочной железы и подтвердили прогностическое значение этого показателя [9]. Средний период наблюдения в этом исследовании составил 10 лет. Оказалось, что у больных с высокими значениями MVD были хуже показатели безрецидивной и общей продолжительности жизни.
Топоизомераза-2-альфа и антрациклины
Ген топоизомераза II локализуется на хромосоме 17q12, очень близко к гену HER2. Известно, что in vitro гиперэкспрессия топоизомеразы коррелирует с повышенной чувствительностью к антрациклинам. Два исследования, представленных на конференции в Сан-Антонио, изучали значение экспрессии топоизомеразы II и HER2 при лечении антрациклинами больных диссеминированным раком молочной железы. Доктор Isola J.J. представила данные о лечении эпирубицином 303 больных метастатическим раком молочной железы [10]. Гиперэкспрессия HER2, определенная методом FISH (иммунофлюоресценция in citu), наблюдалась у 17 из 303 больных. Из них 43% имели амплификацию топоизомеразы II, у 41% ген топоизомераза II отсутствовал и только 16% больных имели нормальную экспрессию топоизомеразы II. Напротив, среди 124 HER2-отрицательных опухолей (FISH) только у 3 наблюдалась делеция гена топоизомераза II и ни у одного не было отмечено амплификации. Результаты данного исследовании приведены в таблице 5.
Таблица 5.
Экспрессия HER2 и топоизомеразы II и эффективность эпирубицина
| Статус HER2 | Статус топоизомеразы II | Частота объективного эффекта |
|---|---|---|
| FISH — | Все больные | 53% |
| FISH + | Все больные | 46% |
| FISH + | Амплифицирован | 79% |
| FISH + | Не изменен | 35% |
| FISH + | Делеция | 17% |
Эти данные демонстрируют, что экспрессия гена топоизомераза II является потенциальным предсказывающим эффективность химиотерапии антрациклинами фактором у женщин с HER2-положительными опухолями. Кроме того, исследование показало, что высокая экспрессия топоизомеразы II коррелирует с большей частотой объективного эффекта, более длительными безрецидивным промежутком и общей продолжительностью жизни.
Похожее исследование предпринято исследователями в Rush University в Чикаго [11]. Двадцать больных местнораспространенным раком молочной железы получили лечение доксорубицином и таксотером. Ампфлификация гена топоизомеразы II была определена в опухолях у трех больных, у всех троих была достигнута полная регрессия заболевания после индукционной химиотерапии с включением доксорубицина, в то время как больных без ампфлификации этого гена в опухоли только у 3 из 17 была достигнута полная регрессия опухоли. Полная регрессия опухоли среди больных с HER2-положительной опухолью молочной железы достигнута у 4 из 5 больных, в то время как у больных без гиперэкспрессии HER2 подобный результат был отмечен только у 2 из 15 больных.
Летрозол и erbB1/erbB2
Доктор Ellis MJ и коллеги изучали экспрессию erbB1/erbB2 в биптатах опухоли больных раком молочной железы [12]. В исследование включено 337 больных в постменопаузе, которым до оперативного лечения назначался тамоксифен или летрозол в течение 4 месяцев. Повышенная экспрессия erbB1/erbB2 была обнаружена у 14% больных и коррелировала с резистентностью к тамоксифену (частота объективного эффекта 17% и 40%), но не коррелировала с чувствительностью к летрозолу (69% и 53%).
1. Fuqua SAW, Schiff R, Parra I, et al. Expression of estrogen receptor beta protein in human breast cancer: correlation with clinical parameters. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 123. Breast Cancer Res Treat. 2000; 64:41.
2. Van Diest PJ, Baak JPA, and other MMCP collaborators of Pathology. Selection of high risk lymph node negative breast cancer patients for chemotherapy can done with the mitotic activity index (MAI). Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 4. Breast Cancer Res Treat. 2000; 64:26.
3. Braun S, Schindlbeck C, Schaffer P, et al. Identification of occult metastatic cells in bone marrow predicts poor prognosis better han HER-2/neu status and angiogenesis in breast carcinomas. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 3. Breast Cancer Res Treat. 2000; 64:26.
4. Janni WJ, Rjosk D, Hepp F, et al. The fate of occult metastatic cells in follow-yp bone aspirations of patients with primary breast cancer. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 403. Breast Cancer Res Treat. 2000; 64:96.
5. Norikazu M, Yasuhiro T, Isao S, et al. Micrometastases in axilary lymph nodes detected by RT-PCR as a valuable prognostic factor in node-negative breast cancer patients. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 145. Breast Cancer Res Treat. 2000; 64:47.
6. Song EY, Banerjee M, Du W, Hryniuk WM. Diabetes but not obesity is a prognostic factor for disease-free survival in women with stage I,II, or III breast carcinoma receiving tamoxifen. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 120. Breast Cancer Res Treat. 2000; 64:40.
7. Lisboa BW, Friedrichs K, Riethdorf L, et al. Urokinass plasminogen activator (uPA) and its type-1 inhibitor (PAI-1) are superior to the Nottingham Prognostic Index NPI in predicting relapse in node-negative breast cancer patients. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 119. Breast Cancer Res Treat. 2000; 64:40.
8. Prechtl A, Thomssen C, Harbeck N, et al. Tumor biological factor uPA and PAI-1 as stratification criteria for risk-adapted adjuvant chemotherapy: second interim analysis of a randomized multicenter trial in node-negative breast cancer Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 231. Breast Cancer Res Treat. 2000;64: 63.
9. Kato T., Kameoka S. Kimura T et.al. Prognostic significance of angiogenesis associated with long-term survival in 377 Japanese patients with breast cancer. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 568. Breast Cancer Res Treat. 2000; 64:132.
10. Isola JJ, Tanner M, Holli K, et al. Amplification of topoisomerase II alpha is a strong predictor of response to epirubicin-based chemotheropy in HER-2/neu positive metastatic breast cancer. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 21. Breast Cancer Res Treat.2000; 64:31.
11. Coon JC, Marcus E, Gupta-Burt S, et al. Amplification of topoisomerase IIa or c- erbB-2 predicts response to doxorubicin and docetaxel in locally advnced breast cancer. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9, 2000; San Antonio, Texas. Abstract 309. Breast Cancer Res Treat.2000; 64:78.
12. Ellis MJ, Jaenicke F., Llombart-cassac A. Et al.. A randomized double-blind multicenter study of preoperative tamoxifen versus Femara (letrozole) for postmenopausal women with ER and/or PgR positive breast cancer ineligible for breast-cincerving surgery. Correlation of clinical responce with tumor gene expression and proliferation. Program and abstracts of the 23rd Annual San Antonio Breast Cancer Symposium; December 6-9,2000; San Antonio, Texas. Abstract 14. Breast Cancer Res Treat. 2000; 64:29.
Читайте также:

