Продукт взаимодействия железа с хлором
Реакция взаимодействия железа с хлором.










Уравнение реакции взаимодействия железа с хлором:
Железо взаимодействует с хлором. Реакция взаимодействия железа с хлором представляет собой сгорание железа в атмосфере хлора.
2Fe + 3Cl2 → 2FeCl3 (t = 200-300 °C).
Реакция железа с хлором протекает при условии: при предварительном нагревании железа до температуры 200-300 °C.
В результате реакции происходит образование хлорида железа (III).
В ходе реакции железа с хлором при стандартных условиях выделяется тепловая энергия (теплота) 798,8 кДж .
Термохимическое уравнение этой реакции имеет следующий вид:
2Fe + 3Cl2 = 2FeCl3 + 798,8 кДж; ΔH = -399,4 кДж/моль.
Таким образом, реакция железа с хлором носит экзотермический характер.










- ← Реакция цинка с серой
- Реакция цинка с водой →
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (105 893)
- Экономика Второй индустриализации России (101 448)
- Программа искусственного интеллекта ЭЛИС (22 642)
- Метан, получение, свойства, химические реакции (15 899)
- Мотор-колесо Дуюнова (15 113)
- Гидротаран – самодействующий энергонезависимый водяной насос (14 468)
- Природный газ, свойства, химический состав, добыча и применение (13 936)
- Крахмал, свойства, получение и применение (13 512)
- Прямоугольный треугольник, свойства, признаки и формулы (13 061)
- Целлюлоза, свойства, получение и применение (11 912)
- Пропилен (пропен), получение, свойства, химические реакции (11 652)
- Этилен (этен), получение, свойства, химические реакции (11 171)
- Бутан, получение, свойства, химические реакции (9 847)
- Оксид алюминия, свойства, получение, химические реакции (9 364)
- Оксид железа (III), свойства, получение, химические реакции (9 140)
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Взаимодействие хлора с железом приводит к образованию средней соли – хлорида железа (III). Какая масса данной соли образуется, если в реакцию вступили 7 г железа и 15 л хлора?
Хлор — чрезвычайно химически активный элемент. Он вступает во взаимодействие почти со всеми простыми веществами. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения хлора с металлами. Во всех этих случаях металлы отдают электроны, т.е. окисляются, а атом хлора присоединяет электроны, т.е. восстанавливается. Эта способность присоединять электроны, резко выраженная у атома хлора, является его характерным химическим свойством. Следовательно, хлор – очень сильный окислитель.
Взаимодействие хлора с железом протекает согласно следующему уравнению:

(
).
Рассчитаем количество моль хлора и железа, вступивших в реакцию взаимодействия:
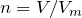
; 
; 
.
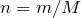
; 
; 
.
Определим, какое из исходных веществ находится в избытке и дальнейшие расчеты будем производить по тому соединению, которое в недостатке:

0,125" title="Rendered by QuickLaTeX.com" height="17" width="97" style="vertical-align: -4px;"/>, значит 
n(Fe)" title="Rendered by QuickLaTeX.com" height="18" width="128" style="vertical-align: -4px;"/>;
Определим мольное соотношение железа и хлорида железа (III) для того, чтобы вычислить количество вещества соли:

,
т.е. 
.
Тогда, масса образующегося хлорида железа (III) будет равна:

; 
.
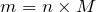
; 
; 
.
Химические свойства меди
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400 о С образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400 о С образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 о С может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d 10 4s 2 . Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900 o C (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Химические свойства хрома
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Раскаленный до температуры более 600 o С порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 o C соответственно):
С бромом же хром реагирует при температуре красного каления (850-900 o C):
С азотом металлический хром взаимодействует при температурах более 1000 o С:
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
С водородом хром не реагирует.
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Либо же при избытке серы дисульфид железа:
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =t o => 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =t o => 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =t o => 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
На влажном воздухе железо весьма быстро подвергается ржавлению:
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 о С). т.е.:
Задание №1
Осадок, полученный при взаимодействии растворов хлорида железа (III) и нитрата серебра, отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением тепла и света. Составьте уравнения четырех описанных реакций.
при взаимодействии как солей соляной кислоты, так и самой кислоты с нитратом серебра образуется АgCl – нерастворимое в воде и кислотах творожистое вещество белого цвета (уравнение 1); эта реакция является качественной на хлорид-ион.
Фильтрат-раствор, прошедший через фильтр, который задерживает нерастворимые вещества. Взаимодействие растворимых солей с растворами щелочей-способ получения нерастворимых оснований (уравнение 2)
Fe(OH)3 – нерастворимое вещество бурого цвета, амфотерный гидроксид, разлагается при нагревании на оксид металла и воду (уравнение 3).
Восстановление металлов из их оксидов с помощью алюминияпромышленный способ получения многих металлов (алюмотермия); реакция экзотермическая, сопровождается выделением тепла, света и плавлением реакционной массы (уравнение 4)
Продукты разложения хлорида аммония последовательно пропустили через нагретую трубку, содержащую оксид меди(II), а затем через склянку с оксидом фосфора(V). Составьте уравнения четырёх описанных реакций.
Соли аммония и кислот, для которых нехарактерны окислительные свойства (NH4Cl, (NH4)2CO3), при нагревании разлагаются на аммиак NH3 и кислоту (уравнение 1)
Оксид меди (II) – основный оксид, кислоты реагируют с основными оксидами с образованием солей (уравнение2)
Аммиак, в котором азот находится в низшей степени окисления N –3 , проявляет восстановительные свойства и восстанавливает среднеактивные и малоактивные металлы из их оксидов (уравнение 3)
При взаимодействии P2O5 с водой, в зависимости от соотношения реагентов и температуры, могут образовываться фосфорные кислоты (H4P2O7, HPO3, H3PO4) (уравнение 4); азот с P2O5 не реагирует
Газ, выделившийся при взаимодействии хлороводородной кислоты с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой.
Составьте уравнения четырёх описанных реакций.
Взаимодействие соляной кислоты с перманганатом калия является способом получения хлора (уравнение 1)
Железо взаимодействует с сильными окислителями с образованием соединений железа в степени окисления +3 (уравнение 2)
Железо в степени окисления +3 проявляет свойства окислителя, поэтому может взаимодействовать с восстановителем (сульфид натрия восстановитель, так как содержит серу в степени окисления S –2 ), образуя соединения двухвалентного железа (уравнение 3)
Горячая азотная кислота окисляет серу до высшей степени окисления +6 (до H2SO4), азот при этом восстанавливается до N +4 (до NO2) (уравнение 4)
При сжигании на воздухе простого вещества жёлтого цвета образуется газ с резким запахом. Этот газ выделяется также при обжиге некоторого минерала, содержащего железо, на воздухе. При действии разбавленной серной кислоты на вещество, состоящее из этих же элементов, что и минерал, но в другом соотношении, выделяется газ с запахом тухлых яиц. При взаимодействии выделившихся газов друг с другом образуется исходное простое вещество. Составьте уравнения четырёх описанных реакций.
Простое вещество желтого цвета, горящее на воздухе с выделением газа с резким запахом, – сера (уравнение 1)
Вещества, содержащие железо и серу: минерал пирит FeS2 и сульфид железа (II) (уравнения 2 и 3)
При взаимодействии оксида серы (IV) и сероводорода первый проявляет свойства окислителя, второй-восстановителя) и образуется простое вещество-сера (уравнение4)
После кратковременного нагревания неизвестного порошкообразного вещества оранжевого цвета начинается самопроизвольная реакция, которая сопровождается изменением цвета на зелёный, выделением газа и искр. Твердый остаток смешали с едким калии нагрели, полученное вещество внесли в разбавленный раствор соляной кислоты, при этом образовался осадок зелёного цвета, который растворяется в избытке кислоты. Составьте уравнения четырёх описанных реакций.
Решение:
Вещество оранжевого цвета, которое разлагается с изменением цвета на зелёный, – бихромат аммония (NH4)2Cr2O7 (уравнение 1)
Cr2O3 – вещество зелёного цвета, – амфотерный оксид и будет реагировать с безводной щелочью с образованием соли (уравнение 2)
В воде, в присутствии небольшого количества кислоты, KCrO2 будет гидролизоваться с образованием нерастворимого амфотерного гидроксида хрома(III) (уравнеие 3)
Амфотерный гидроксид хрома (III) растворяется в избытке кислоты с образованием Cr +3 , имеющий зелёный цвет (уравнение 4).
Через горячий раствор гидроксида калия пропустили хлор. Раствор охладили, выделившиеся кристаллы бертолетовой соли отфильтровали и внесли в раствор соляной кислоты. Газообразный пр…
Фосфор нагрели с избытком йода. Продукт реакции обработали небольшим количеством воды при нагревании, при этом выделился бесцветный газ с резким запахом, который взаимодействует с …
Оксид хрома(III) сплавили с сульфитом калия и к продукту реакции добавили воду. Выпавший осадок перенесли в раствор едкого натра, добавили бром и нагрели; в результате образовался …
Йод обработали хлорноватой кислотой; взаимодействие сопровождалось выделением газа. Раствор, содержащий второй продукт реакции, осторожно нагрели. Образующийся оксид реагирует с уг…
Карбонат кальция обработали раствором азотной кислоты, при этом выделился газ. Газ пропустили над раскалённым углём. Продукт реакции смешали с хлором. Образовавшееся вещество пропу…
При прокаливании нитрата меди(II) получили смесь газов. Эту смесь газов поглотили водой, при этом образовалась кислота. Фосфид кальция обработали водой, при этом выделился газ. Это…
Оксид железа(III) сплавили с поташом. Полученный продукт добавили в воду. Образовавшийся осадок отделили и растворили в йодоводородной кислоте. Выделившееся простое вещество реагир…
Некоторое количество сульфида алюминия разделили на две части. Одну из них обработали разбавленной соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выдели…
Кремний сожгли в атмосфере хлора. Продукт реакции обработали водой. Выделившийся осадок отделили, прокалили и обработали плавиковой кислотой. Напишите уравнения четырёх описанных р…
Серебро растворили в концентрированной азотной кислоте. Выделившийся газ пропустили над нагретым порошком цинка. Образовавшееся твёрдое вещество добавили к раствору гидроксида кали…
Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора едкого натра. Выпавший осадок отделили и прокалили. Образовавшееся …
При нагревании смеси нитрата аммония и гидроксида бария выделился газ. Этот газ пропустили через водный раствор сульфата хрома(III), в результате образовался осадок. Осадок отфильт…
Железо сожгли в броме. Полученную соль добавили к раствору гидрокарбоната натрия, при этом выпал бурый осадок, который отфильтровали и прокалили. Полученное вещество растворили в й…
Малахит растворили в азотной кислоте. Выделившийся газ пропустили над раскалённым углём. Продукт реакции смешали с хлором и нагрели. Образовавшееся вещество пропустили через раство…
Карбонат кальция обработали раствором азотной кислоты, при этом выделился газ. Газ пропустили над раскалённым углём. Продукт реакции смешали с хлором. Образовавшееся вещество пропу…
Йод обработали хлорноватой кислотой; взаимодействие сопровождалось выделением газа. Раствор, содержащий второй продукт реакции, осторожно нагрели. Образующийся оксид реагирует с уг…
Оксид железа(III) сплавили с поташом. Полученный продукт внесли в воду. Образовавшийся осадок отделили и растворили в йодоводородной кислоте. Выделившееся простое вещество реагируе…
Оксид хрома(III) сплавили с сульфитом калия и продукт реакции внесли в воду. Выпавший осадок перенесли в раствор едкого натра, добавили бром и нагрели; в результате образовался рас…
При прокаливании нитрата меди(II) получили смесь газов. Эту смесь газов поглотили водой, при этом образовалась кислота. Фосфид кальция обработали водой, при этом выделился газ. Это…
Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора едкого натра. Выпавший осадок отделили и прокалили. Образовавшееся …
Читайте также:

