Применение лекарственных средств при остром лейкозе
Лечение острого лейкоза должно быть комплексным, включающим кортикостероидные гормоны, 6-меркаптопурин, гемотрансфузии и антибиотики. Кортикостероиды обладают "дезаллергизирующим" действием, уменьшают проницаемость, сосудистой стенки, но главное - подавляют митотические процессы преимущественно в родоначальных клетках. Обычно применяют их в максимальных дозах (преднизолон - от 60 до 100 мг в сутки) до наступления клинической и гематологической ремиссии с последующим переходом на поддерживающие-дозы (15-20 мг) в течение нескольких месяцев и даже лет. В таких случаях целесообразно периодически менять препараты (преднизолон, триамцинолон, дексаметазон), сочетая их с гормонами анаболического действия (дианабол, неробол, метандростенолон и др.).
Широко при остром лейкозе применяются антиметаболиты, в частности 6-меркаптопурин, который тормозит размножение недифференцированных клеток, нарушая в них синтез нуклеиновых кислот. Его назначают из расчета 2,5-3 мг на 1 кг массы тела больного (взрослому в день 3-4 таблетки по 50 мг) до наступления ремиссии. Если через 2-3 недели от начала лечения улучшения не наблюдается, суточная доза может быть увеличена до 4-5 мг на 1 кг массы тела. В стадии ремиссии рекомендуется поддерживающая терапия в амбулаторных условиях (по 50 мг в сутки), поскольку с отменой препарата уже по истечении полутора-двух недель в костном мозгу и периферической крови появляются недифференцированные клетки. При этом на курс лечения рекомендуется давать не более 5-7 г препарата.
Меркаптопурин показан и при лейкопенической форме лейкоза, так как ориентиром в решении вопроса о его назначении служит не периферическая кровь, а состояние костномозгового кроветворения. Противопоказанием к нему являются лишь резко выраженная лейкопения (ниже 2000 в 1 мкл) и тромбоци-топения с геморрагическими проявлениями, а также нарушение функций печени и почек.
В последние годы в клиническую практику вошли новые цитостатические средства (метотрексат, винкристин, или винбластин, циклофосфан и др.), а также практикуется одновременное применение нескольких противолейкозных препаратов, учитывая различный механизм их цитостатического действия, например, сочетание винкристина, аминоптерина (метотрексата), 6-меркаптопурина и преднизолона (именуемое схемой ВАМП) или циклофосфана, аминоптерина, 6-меркаптопурина и преднизолона (схема ЦАМП). Метод комбинированной терапии более эффективен, так как с помощью его повышается частота и сроки ремиссии, а следовательно, продолжительность жизни больных.
Из гемотерапевтических средств заслуживают предпочтения систематические капельные переливания эритроцитной массы по 125-250 мл с интервалом от 2 до 10 дней в зависимости от степени анемии. Противопоказанием к гемотерапии являются острый инфаркт селезенки, кровоизлияние в мозг и тяжелое поражение печени.
В последнее время для лечения острого лейкоза предложена трансплантация костного мозга, однако сложность самого метода, требующего иммунологической совместимости, и незначительный симптоматический эффект служат серьезным препятствием для широкого внедрения миелотерапии в клинике.
Немаловажное лечебное значение при остром лейкозе приобретают средства симптоматической терапии, направленные на купирование кровоточивости и на ликвидацию вторичной инфекции. В первом случае наиболее эффективно переливание плазмы и тромбоцитной массы. При наличии инфекционно-септических осложнений показаны антибиотики, в первую очередь пенициллин в больших дозах (по 200000 ЕД 3- 4 раза в сутки). При неэффективности назначают антибиотики широкого спектра действия в сочетании с нистатином с целью профилактики кандидамикоза. При развитии некрозов в полости рта и зева проводят орошение пенициллином и полоскание раствором грамицидина (1:50) или фурацилина (1:5000).
Таким образом, основной принцип в лечении острого лейкоза сводится к непрерывной комплексной терапии, благодаря которой удается достигнуть клинической и даже гематологической ремиссии длительностью от 6 месяцев до 1,5, а в редких случаях даже до 2-3 лет.
Проф. Г.И. Бурчинский

Общие сведения
Лейкоз (другие названия — рак крови, лейкемия, белокровие) – это группа болезней клеток крови, которые являются злокачественными.
Изначально лейкоз проявляется у человека в костном мозге. Именно этот орган отвечает за выработку лейкоцитов (белых кровяных клеток), эритроцитов (красных кровяных телец) и тромбоцитов. Лейкоз возникает в том случае, если одна из клеток в костном мозге мутирует. Так, в процессе развития эта клетка становится не зрелым лейкоцитом, а раковой клеткой.
После образования белая кровяная клетка уже не выполняет свои обычные функции, но при этом происходит очень быстрый и бесконтрольный процесс ее деления. В итоге вследствие образования большого количества аномальных раковых клеток они вытесняют нормальные клетки крови. Результатом такого процесса становится анемия, инфекции, проявление кровотечений. Далее лейкемические клетки попадают в лимфоузлы и другие органы, провоцируют проявление патологических изменений.
Наиболее часто лейкоз поражает людей старшего возраста и детей. Лейкоз возникает с частотой около 5 случаев на 100 000 детей. Именно лейкоз у детей диагностируется чаще других раковых болезней. Наиболее часто это заболевание возникает у детей в возрасте 2-4 года.
До сегодняшнего дня не существует точно определенных причин, которые провоцируют развитие лейкоза. Однако есть точные сведения о факторах риска, которые способствуют возникновению рака крови. Таковыми является облучение радиацией, влияние канцерогенных химических веществ, курение, фактор наследственности. Однако многие люди, которые болеют лейкозом, не сталкивались прежде ни с одним из указанных факторов риска.
Виды лейкоза
Лейкоз крови принято разделять на несколько разных видов. Если принять во внимание характер течения недуга, то выделяют острый лейкоз и хронический лейкоз. Если в случае острого лейкоза симптомы болезни проявляются у пациента резко и стремительно, то при хроническом лейкозе болезнь прогрессирует постепенно, на протяжении нескольких лет. При остром лейкозе у больного происходит быстрый неконтролируемый рост незрелых кровяных клеток. У пациентов с хроническим лейкозом быстро растет количество клеток, которые являются более зрелыми. Симптомы лейкоза острого типа гораздо более тяжелые, поэтому данная форма болезни требует немедленной правильно подобранной терапии.
Если рассматривать виды лейкоза с точки зрения поражения типа клеток, то различают ряд форм лейкоза: лимфолейкоз (форма болезни, при которой наблюдается дефект лимфоцитов); миелолейкоз (процесс, при котором нарушается нормальное созревание гранулоцитарных лейкоцитов). В свою очередь, эти виды лейкоза подразделяют на определенные подвиды, которые различают по разнообразным свойствам, а также по подбору типа лечения. Следовательно, очень важно точно установить расширенный диагноз.
Симптомы лейкоза
Прежде всего, нужно учитывать, что симптомы лейкоза напрямую зависят от того, какая именно форма болезни имеет место у человека. Основными общими симптомами лейкоза являются головные боли, повышенная температура, проявление выраженной склонности к возникновению синяков и кровоизлияний. У больного также проявляются болезненные ощущения в суставах и костях, увеличение селезенки, печени, опухание лимфоузлов, проявления ощущения слабости, склонность к инфекциям, потеря аппетита и, как следствие, веса.
Важно, чтобы человек вовремя обратил внимание на проявление подобных симптомов и определил появление изменений в самочувствии. Также к развитию лейкоза могут присоединяться осложнения инфекционного характера: некротическая ангина, стоматит.
При хроническом лейкозе симптомы проявляются постепенно. Больной быстро утомляется, ощущает слабость, у него пропадает желание есть и работать.
При поздних стадиях лейкоза у пациента проявляется также выраженная склонность к тромбозам.
Если у больного лейкозом крови начинается процесс метастазирования, то лейкозные инфильтраты проявляются в различных органах. Они часто возникают в лимфоузлах, печени, селезенке. Ввиду обтурации сосудов опухолевыми клетками в органах также могут проявляться инфаркты, осложнения язвенно-некротического характера.
Причины лейкоза
Существует ряд моментов, которые определяются как возможные причины возникновения мутаций в хромосомах обычных клеток. Причиной лейкоза является воздействие ионизирующего излучения на человека. Данная особенность была доказана после атомных взрывов, произошедших в Японии. Через некоторое время после них количество больных острым лейкозом возросло в несколько раз. Напрямую влияет на развитие лейкоза и действие канцерогенов. Это некоторые лекарственные средства (левомицитин, бутадион, цитостатики) и химические вещества (бензол, пестициды, продукты переработки нефти). Фактор наследственности в данном случае относится в первую очередь к хронической форме заболевания. Но в тех семьях, члены которых болели острой формой лейкоза, риск возникновения заболевания также повышался в несколько раз. Принято считать, что по наследству переходит склонность к мутации нормальных клеток.
Существует также теория о том, что причиной развития лейкоза у человека могут стать особые вирусы, которые могут встраиваться в ДНК человека и впоследствии провоцировать трансформацию обычных клеток в злокачественные. В некоторой степени проявление лейкозов зависит от того, в какой географической зоне проживет человек, и представителем какой расы он является.
Диагностика лейкоза

Диагностику болезни проводит специалист-онколог, проводящий предварительный осмотр больного. Для постановки диагноза в первую очередь проводится общий анализ крови и биохимические исследования крови. Для обеспечения точности диагностики проводят также исследование костного мозга.
Для исследования образец костного мозга у пациента берут из грудины или подвздошной кости. Если у пациента развивается острый лейкоз, то в процессе исследования выявляется замена нормальных клеток незрелыми опухолевыми клетками (их называют бластами). Также в процессе диагностики может проводится иммунофенотипирование (обследование иммунологического характера). Для этого используется метод проточной цитометрии. Это исследование позволяет получить информацию о том, какой именно подвид рака крови имеет место у больного. Эти данные позволяют подобрать максимально эффективную методику лечения.
В процессе диагностики проводят также цитогенетическое и молекулярно-генетическое исследование. В первом исследовании можно обнаружить специфические хромосомные повреждения. Это позволяет специалистам выяснить, какой именно подвид лейкоза наблюдается у больного, и понять, насколько агрессивно течение болезни. Наличие генетических нарушений на молекулярном уровне выявляется в процессе молекулярно-генетической диагностики.
При подозрении на некоторые формы болезни может проводится изучение спинномозговой жидкости на предмет наличия в ней опухолевых клеток. Полученные данные также помогают подобрать правильную программу терапии болезни.
В процессе постановки диагноза особо важна дифференциальная диагностика. Так, лейкоз у детей и взрослых имеет ряд симптомов, характерных для ВИЧ-инфекции, а также другие признаки (увеличение органов, панцитопения, лейкемоидные реакции), которые могут свидетельствовать и о других заболеваниях.



Лечение лейкоза
Лечения лейкоза острой формы заключается в применении сразу нескольких препаратов с противоопухолевым действием. Их комбинируют с относительно большими дозами глюкокортикоидных гормонов. После тщательного обследования больных врачи определяют, есть ли смысл проведения больному операции по пересадке костного мозга. В процессе терапии очень большое значение имеет проведение поддерживающих мероприятий. Так, больному проводят переливание компонентов крови, а также принимают меры по оперативному лечению присоединившейся инфекции.
В процессе лечения хронического лейкоза на сегодняшний день активно применяются антиметаболиты — препараты, подавляющие развитие злокачественных клеток. Также применяется лечение с использованием лучевой терапии, а также введение пациенту радиоактивных веществ.
Специалист определяет методику лечения лейкоза, руководствуясь тем, какая форма заболевания развивается у пациента. В процессе проведения лечения обеспечивается контроль за состоянием больного с помощью регулярного проведения анализов крови и исследования костного мозга.
Лечение лейкоза проводится регулярно, на протяжении всей жизни. Важно учесть, что без лечения возможен быстрый летальный исход.
Острый лейкоз
Наиболее важным моментом, который следует учитывать тем, у кого диагностирован острый лейкоз, является то, что лечение лейкоза данной формы следует начинать немедленно. Без надлежащего лечения болезнь прогрессирует необычайно быстро.
Различают три стадии острого лейкоза. На первой стадии происходит дебют заболевания: начальные клинические проявления. Период заканчивается получением эффекта от предпринятых мер по лечению лейкоза. Вторая стадия болезни – ее ремиссия. Принято различать ремиссию полную и неполную. Если имеет место полная клинико-гематологическая ремиссия, которая длится не меньше одного месяца, то клинические проявления отсутствуют, в миелограмме определяется не больше 5% бластных клеток и не больше 30% лимфоцитов. При неполной клинико-гематологической ремиссии клинические показатели приходят в норму, в пунктате красного костного мозга в наличии не больше 20% бластных клеток. На третьей стадии болезни происходит ее рецидив. Процесс может начаться с возникновения экстрамедуллярных очагов лейкозной инфильтрации в разных органах, при этом показатели гемопоэза будут в норме. Больной может не высказывать жалоб, однако при исследовании красного костного мозга выявляют признаки рецидива.
Лечить острый лейкоз у детей и взрослых следует только в специализированном учреждении гематологического профиля. В процессе терапии основным методом является химиотерапия, цель которой – уничтожить все лейкозные клетки в организме человека. Проводятся также вспомогательные действия, которые назначают, руководствуясь общим состояние пациента. Так, может проводиться переливание компонентов крови, мероприятия, направленные на снижение уровня интоксикации и профилактику инфекций.
Лечение острого лейкоза состоит из двух важных этапов. Во-первых, проводится индукционная терапия. Это химиотерапия, при которой уничтожаются злокачественные клетки, и ставиться цель достичь полной ремиссии. Во-вторых, проведение химиотерапия уже после достижения ремиссии. Данный метод направлен на то, чтобы предупредить рецидив болезни. В этом случае подход к лечению определяется уже в индивидуальном порядке. Возможно проведение химиотерапии с использованием подхода консолидации. При этом после ремиссии используется программа химиотерапии, аналогичная той, которую применяли ранее. Подход интенсификации заключается в использовании более активной химиотерапии, чем в процессе лечения. Применение поддерживающей терапии заключается в использовании меньших доз препаратов. Однако сам процесс химиотерапии более длительный.
Также возможно лечение с помощью иных методов. Так, лейкоз крови можно лечить путем высокодозной химиотерапии, после которой больному производится трансплантация стволовых кроветворных клеток. Для лечения острого лейкоза применяются новые лекарственные средства, среди которых можно выделить нуклеозидные аналоги, моноклональные антитела, дифференцирующие средства.
Профилактика лейкоза
В качестве профилактики лейкозов очень важно регулярно проходить профилактические осмотры у специалистов, а также проводить все необходимые профилактические лабораторные анализы. При наличии симптомов, описанных выше, следует незамедлительно обращаться к специалисту. На данный момент не разработаны четкие меры по первичной профилактике острого лейкоза. Больным после достижения стадии ремиссии очень важно проводить качественную поддерживающую и противорецидивную терапию. Необходим постоянный контроль и наблюдение у онкогематолога и педиатра (в случае лейкоза у детей). Важен постоянный тщательный контроль над показателями крови пациента. После лечения лейкоза пациентам не рекомендуется переезжать в другие климатические условия, а также подвергать больного физиотерапевтическим процедурам. Детям, которые болели лейкозом, проводят профилактические прививки согласно индивидуально разработанному календарю прививок.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Общая стратегия лечения острого миелобластного лейкоза
В современной гематологии терапию лейкозов, в том числе и острого миелобластного, необходимо проводить в специализированных стационарах по строгим программам. Программа (протокол) включает перечень необходимых для диагностики исследований и жёсткий график их проведения. После завершения диагностического этапа пациент получает лечение, предусмотренное этим протоколом, с жёстким соблюдением сроков и порядка элементов терапии. В настоящее время в мире существуют несколько ведущих исследовательских групп, анализирующих диагностику и лечение острого миелобластного лейкоза у детей в мультицентровых исследованиях. Это американские исследовательские группы CCG (Children's Cancer Group) и POG (Pediatric Oncology Group), английская группа MRC (Medical Research Council), немецкая группа BFM (Berlin-Frankfurt-Miinster), японская CCLG (Children's Cancer and Leukemia Study Group), французская LAME (Leucamie Aique Mycloi'de Enfant), итальянская AIEOP (Associazione Italiana Ematologia ed Oncologia Pediatric) и др. Результаты их исследований - основные источники современных знаний о диагностике, прогнозе и лечении острого миелобластного лейкоза у детей.
Основная цель лечения - эрадикация лейкемического клона с последующим восстановлением нормального гемопоэза.
Первый этап - индукция ремиссии. Для прогноза важна оценка чувствительности к терапии после проведения индукционного курса. Окончательную оценку, согласно большинству протоколов, проводят после двух курсов лечения.
Постремиссионная терапия должна состоять не менее чем из трёх блоков. Это может быть только химиотерапия или химиотерапия с последующей аутологичной или аллогенной трансплантацией гемопоэтических стволовых клеток. Некоторые терапевтические режимы включают поддерживающую терапию. Важный элемент - профилактика и лечение поражений ЦНС путём интратекального введения цитостатических препаратов, системной высокодознои терапии, а иногда и краниального облучения. Основной препарат для интратекальной терапии при остром миелобластном лейкозе - цитозин-арабинозид, в некоторых протоколах дополнительно используют преднизолон и метотрексат.
Современная терапия острою миелобластного лейкоза должна быть дифференцированной, т.е. различной по интенсивности (а значит, и по токсичности) в зависимости от группы риска. Кроме того, лечение должно быть настолько специфичным, насколько это возможно.
Терапия индукции
Цитотоксическая терапия острого миелобластного лейкоза вызывает транзиторную, но тяжёлую миелосупрессию с высоким риском инфекций и геморрагических осложнений. Спектр цитостатических препаратов, эффективных в отношении острого миелобластного лейкоза, достаточно невелик. Базовые препараты - цитозин-арабинозид, антрациклины (даунорубицин, митоксантрон, идарубицин), этопозид, тиогуанин.
В 1989-1993 годах группа CCG провела исследование 589 детей с острым миелобластным лейкозом. Исследование показало преимущество индукции в режиме интенсивного тайминга. Суть этого режима в том, что больные получают индукционную терапию, состоящую из двух одинаковых 4-дневных курсов с интервалом 6 дней. Каждый курс лечения включает цитозин-арабинозид, даунорубицин, этопозид и тиогуанин. Необходимость повторения курса лечения строго через фиксированный интервал, независимо от показателей гемопоэза, обусловлена тем, что леикемические клетки, которые находились во время первого курса вне митотической фазы, войдут в неё ко времени начала второго курса и подвергнутся цитотоксическому воздействию химиопрепаратов. Преимущество интенсивного тайминга в достоверном увеличении EFSc 27% у больных, получавших ту же терапию в стандартном режиме, до 42%. В настоящее время группа CCG опубликовала данные о пилотном исследовании индукции интенсивного тайминга с использованием идарубицина, показаны преимущества этого препарата в терапии индукции у детей.
Группа MRC в исследовании AML-9 (1986 год) показала преимущества продлённой терапии индукции (5-дневную индукцию с применением даунорубицина, цитозин-арабинозида и тиогуанина сравнивали с 10-дневной). Несмотря на более высокий уровень смертности от токсичности (21 против 16%), уровень достижения ремиссии был выше в группе продлённой терапии. Следующее исследование этой группы - AML-10 - включало 341 ребёнка. Индукционная терапия в AML-10 была основана на стандартных дозах цитозин-арабинозида и даунорубицина с добавлением трегьего препарата - этопозида или тиогуанина, в зависимости от группы рандомизации. Индукция в AML-12 (в исследование включены 529 детей) состояла из схемы ADE (цитозин-арабинозид + даунорубицин + этопозид), в другой группе рандомизации - из схемы АМЕ (цитозин-арабинозид + митоксантрон + этопозид). Ремиссия в обоих исследованиях составила 92%, смерть в индукции и резистентные острые миелобластные лейкозы - по 4%. Уровень ремиссии в обеих ветвях протокола AML-12 (ADE и АМЕ) был практически одинаковым - 90 и 92%. В начале 1990-х годов DFS при остром миелобластном лейкозе увеличилась с 30 до 50%; с 1995 года (протокол AML-12) значение данного показателя составляет 66%.
Индукция по протоколу исследовательской группы LAME состоит из стандартных доз цитозин-арабинозида и митоксантрона (суммарная доза 60 мг/м 2 ), ремиссия достигнута у 90% больных.
В России наиболее хорошо известны протоколы группы BFM. До 1993 года индукционная терапия состояла из курса ADE (цитозин-арабинозид + даунорубицин + этопозид). Согласно протоколу AML-BFM-93 (исследование включает 471 ребёнка), индукционная терапия в одной группе рандомизации была прежней - ADE, в другой группе - состояла из цитозин-арабинозида, этопозида и идарубицина. Уровень достижения ремиссии среди всех пациентов составил 82,2%. Показано, что введение идарубицина достоверно увеличило редукцию бластов у пациентов к 15-му дню от начала индукционной терапии, однако это не повлияло на частоту досгижения ремиссии и DFS, которая в этих группах была сходной.
Постиндукционная терапия
Большинство протоколов в качестве постремиссионной терапии предполагает два или более курса цитостатиков. Как правило, не менее одного курса полихимиотерапии основано на высоких дозах цитозин-арабинозида (1-3 г/м 2 в одно введение). Дополнительные препараты - этопозид и/или антрациклины (идарубицин или митоксантрон).
Наиболее успешны протоколы, предусматривающие три постремиссионных блока химиотерапии, часть которых проводят в режиме интенсивного тайминга и/или с использованием высоких доз цитозин-арабинозида.
Трансплантация гемопоэтических стволовых клеток
Современная терапия острого миелобластного лейкоза предусматривает для определённых категорий пациентов трансплантацию гемопоэтических стволовых клеток (ТГСК). Существуют два принципиально различных вида трансплантации - аллогенная и аутологичная.
По сравнению с аллогенной, роль аутологичной трансплантации в профилактике рецидива не столь очевидна.
Терапия острого промиелоцитарного лейкоза
Вариант М, по ЕАВ - особый вид острого миелолейкоза. Его регистрируют во всех регионах мира, но в некоторых он существенно преобладает. Среди всех случаев острого миелобластного лейкоза в США и Европе на острый промиелоцитарный лейкоз приходится 10-15%, в то время как в Китае - около трети, а среди латиноамериканской популяции - до 46%. Основное звено патогенеза и диагностический признак острого промиелоцитарного лейкоза - транслокация t(15;17)(q22;ql2) с образованием химерного гена PML-RARa. В клинической картине лидирует коагулопатия (в равной степени вероятны ДВС и гиперфибринолиз), которая может усугубляться на фоне химиотерапии, формируя высокий уровень смертности от геморрагического синдрома в начале лечения (20%). Неблагоприятные в отношении прогноза факторы - инициальный лейкоцитоз (количество лейкоцитов превышает 10х10 9 /л) и экспрессия CD56 на лейкемических промиелоцитах.
Большинству пациентов для достижения ремиссии достаточно применения ATRA в качестве монотерапии, однако без дополнительной терапии заболевание практически всегда рецидивирует в течение первого полугодия. Наилучшая стратегия - комбинирование ATRA с индукционной химиотерапией. Показано, что индукция с использованием all-трансретиноевой кислоты в комбинации с антрациклинами, несколько курсов основанной на антрациклинах консолидации и поддерживающая низкодозная терапия с или без ATRA обеспечивает 75-85% EFS в течение 5 лет у взрослых. Применение ATRA в индукции одновременно с химиотерапией даёт более высокую безрецидивную выживаемость, чем последовательное использование препаратов. Применение поддерживающей терапии также уменьшает вероятность рецидива, а увеличение дозы антрациклинов в индукционной терапии и ATRA в консолидации может улучшить результаты лечения больных группы риска.
Результаты исследований эффективности лечения острого промиелоцитарного лейкоза у детей до настоящего времени не опубликованы, однако природа заболевания и принципы терапии одинаковы во всех возрастных группах.
Какой прогноз имеет острый миелобластный лейкоз?
Современная стратегия химиотерапии острого лейкоза, разработанная 20—25 лет назад и претерпевшая за это время определенные изменения в плане интенсификации, к сожалению, уже не может принципиально изменить результаты лечения: ни частоты достижения ремиссий, ни долгосрочной выживаемости.
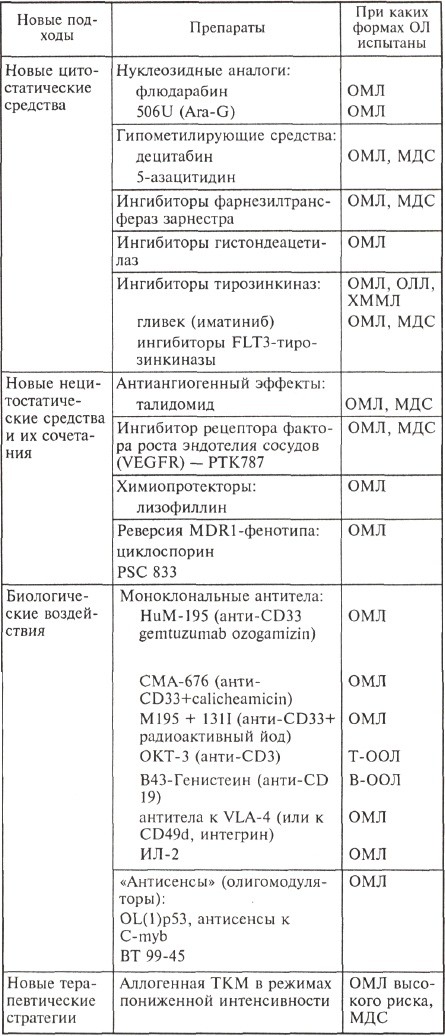
Эффективность стандартной химиотерапии, по-видимому, еще может быть повышена, но в основном благодаря усовершенствованию тактики выхаживания пациентов после цитостатического воздействия. Собственно антилейкемический потенциал самой стратегии химиотерапии уже исчерпан, поэтому все современные исследования в лейкозологии направлены на поиск и внедрение новых, порой не связанных с цитостатическими эффектами способов воздействия на лейкемические клетки. Основные направления этой работы отражены в таблице.
Данные, представленные в таблице, отражают лишь те новые подходы, которые были испытаны в клинических исследованиях I—II и даже III фаз. Безусловно, не перечислены еще многие исследовательские работы, в основном те, которые не вышли из рамок поисковых. К ним относится, например, так называемая вакцинация:
1) введение в организм больного собственных лейкемических клеток (аутологичная клеточная вакцина), в которые с помощью ретровирусов были введены гены определенных молекул (например, В7-1), являющихся мощными костимуляторами Т-клеточного ответа;
2) коммитирование и культивирование, а затем введение в организм больного собственных дендритных (антигенпрезентирующих) клеток, полученных из лейкемических, с целью усиления иммунного ответа на опухолевые антигены.
Традиционным направлением многих исследований является разработка новых противоопухолевых препаратов. Особого внимания заслуживают ингибиторы тирозинкиназ, в частности c-ABL-тирозинкиназа (Гливек). Этот препарат полностью изменил терапевтические подходы в лечении ХМЛ. В программах терапии острого лейкоза его используют в случае обнаружения химерного транскрипта BCR-ABL или t(9;22).
У 30 % больных острым миелоидным лейкозом выявляют мутации гена FLT3, продуктом которого является FLT3-тирозинкиназа. Проведены первые клинические испытания II фазы по применению ингибиторов FLT3 тирозинкиназы.
При использовании молекулы РКС412 были зафиксированы выраженные эффекты у больных с рефрактерным острым миелоидным лейкозом. Так, из 20 больных у одного достигнута полная ремиссия, у 6 отмечено значительное (более чем в 100 раз) уменьшение числа властных клеток в крови, у 7 больных оно составило на 50 % от исходного. Аналогичные эффекты наблюдались и при использовании другого ингибитора FLT3-тирозинкиназы - СЕР-701.
Ингибиторы гистондеацетилаз — это препараты, которые влияют на процесс транскрипции. Создано несколько молекул различных классов: производные бутировой кислоты — ВА (пивалоилоксиметил бутират, бутироилоксиалкиловые эфиры глутаровой и никотиновой кислот, бутироилоксиметиловые эфиры); диэтиловый эфир фосфорной кислоты; субероиланилидгидроксаминовая кислота (SAHA); циннамил гидроксамат LAQ824 и др.
Большинство из этих молекул демонстрирует высокую активность в лабораторных условиях на клеточных линиях острого лейкоза. Клинические исследования проводят лишь с единичными препаратами. Так, применение SAHA у больных с периферическими Т-клеточными лимфомами позволило у 5 из них получить частичную ремиссию, у 5 — стабилизацию. У 25 больных рефрактерным острым миелоидным лейкозом исследование I фазы по применению ингибитора гистондеацитилаз МС-275 было не столь эффективным — получены лишь незначительные гематологические эффекты.
Создается впечатление, что в скором времени из огромного числа синтезируемых ингибиторов гистондеацетилаз будут отобраны наиболее эффективные препараты.
В настоящее время проходят клинические испытания препараты из новой группы лекарственных средств — ингибиторы фарнезилтрансферазы. Основой для разработки использования этих препаратов стали исследования, свидетельствующие об увеличении частоты мутаций онкогена RAS у больных острым миелоидным лейкозом. RAS-протеины являются важным звеном в цепи передачи сигналов внутри клетки и становятся функционально активными после присоединения фарнезильтных остатков с помощью фарнезилтрансферазы.
Результаты первых клинических испытаний препарата типифарниба (R115 777, Зарнестра) свидетельствуют об его определенной активности: общий гематологический эффект отмечен у 37 % больных острым миелоидным лейкозом старше 60 лет.
Нуклеозидные аналоги завоевывают место в программах лечения не только острый миелоидный лейкоз и хронических лимфопролиферативных заболеваний, определенный оптимизм внушает эффективность некоторых из них при остром лимфобластном лейкозе. Так, арабинозилметоксигуанин (Ara-G или 506U), вводимый в дозе 40—50 мг/кг внутривенно 1 раз в день в течение 5 дней, позволил добиться полной ремиссии у 44 % и частичной ремиссии у 32 % больных с рецидивами Т-клеточного острого лимфобластного лейкоза.
Анализ работ по применению гипометилирующих агентов — 5-азацитидина и 5-аза-деоксицитидина (децитабина) — позволяет сделать заключение о более высокой эффективности децитабина. Его применение в дозе 50—75 мг/м2 в виде постоянной инфузии в 1—3-й день позволяет получить полную ремиссию у 30—37 % больных ОМЛ или МДС из группы высокого риска. При использовании децитабина в сочетании с антрациклинами или амсакрином полный ответ отмечен у 35 % больных ОМЛ из группы высокого риска. Следует подчеркнуть, что клинических исследований по изучению этих препаратов еще очень мало, и требуется время, чтобы реально оценить эффективность каждого из них.
Бесспорным является лишь тот факт, что эти средства обладают уникальным механизмом действия: помимо гипометилирующих эффектов (а гиперметилирование ДНК является признаком опухолевой устойчивости и прогрессии), они вызывают клеточную дифференцировку, активируют супрессорные гены и могут in vitro ингибировать пролиферацию клоногенных лейкемических клеток.
Очень интересным направлением в разработке новых противоопухолевых препаратов является создание средств, влияющих на ангиогенез. Талидомид как антиангиогенный препарат давно занял прочное место в лечении множественной миеломы, однако его эффективность при ОЛ и миелодисплазиях незначительна. К новым средствам относятся молекулы, ингибирующие рецепторы ростового фактора эндотелия сосудов (VEGFR). Показано, что ОЛ, при которых бластные клетки экспрессируют VEGFR в больших количествах, отличаются неблагоприятным прогнозом. В испытаниях I фазы исследователи отметили незначительную эффективность ингибитора VEGFR — PTK787 при минимальной токсичности.
Читайте также:

