Препараты второй линии при раке

Современная медицина владеет широким арсеналом препаратов для борьбы с раком.

Выбор препаратов при онкологическом заболевании зависит в том числе от стадии болезни.


Цены на некоторые препараты в дисконт-аптеках, как правило, ниже, чем в городских.

Спецпредложения, акции и скидки — отличный шанс приобрести необходимые препараты на выгодных условиях.

При оформлении предзаказа препарата через интернет (с возможностью самовывоза) главное — выбрать надежную аптеку, чтобы быть уверенным в подлинности и качестве приобретенного товара.
Процесс лечения онкологических заболеваний очень долгий и сложный. Единого лекарства против рака пока не существует, но комбинация различных препаратов при онкологии позволяет добиться торможения роста опухоли, снятия болевого синдрома и общего улучшения состояния пациента.
Роль лекарственных препаратов в терапии онкозаболеваний
Современные препараты при лечении рака решают несколько задач, потому и назначаются они чаще всего комплексно. Одни лекарства от рака разрушают пораженные клетки, другие останавливают их рост и предотвращают возникновение новых раковых клеток. На поздних стадиях активно применяются обезболивающие препараты, а также средства, которые сами по себе никак не влияют на рост опухоли, но улучшают общее состояние человека, снимая неприятную симптоматику.
Химиотерапия — высокотехнологичный и эффективный способ лечения онкологических заболеваний, пусть и не лишенный недостатков. Препараты для химиотерапии подавляют рост раковых клеток или уничтожают их, однако многие их них воздействуют также и на здоровые клетки. Из-за этого химиотерапия переносится тяжело, а пациенты после каждого курса нуждаются в реабилитации. Побочными эффектами препаратов для химиотерапии являются рвота и тошнота, выпадение волос, снижение массы тела, ухудшение иммунитета, постоянное чувство усталости, нарушение свертываемости крови.
Специалисты различают цитостатическую и цитотоксическую химиотерапию. Они различаются по механизму воздействия на клетки. Цитостатические препараты замедляют размножение клеток опухоли. Цитотоксические убивают пораженные клетки, вследствие чего начинается некроз опухоли.
К препаратам для химиотерапии относятся следующие группы средств:
- Алкилирующие агенты. Эти лекарства против рака разрушают белки, ответственные за формирование ДНК раковых клеток. Самые распространенные препараты этой группы — средства на основе действующего вещества циклофосфамид.
- Препараты платины. Этот благородный металл токсичен. Препараты платины обладают тем же действием, что и алкилирующие агенты, а именно — разрушают ДНК раковых клеток. Цитостатические средства алкилирующего типа действия широко используются для лечения рака.
- Антиметаболиты. Они воздействуют на генетический аппарат клетки, убивая ее при делении. Наиболее известными антиметаболитами являются препараты на основе гемцитабина.
- Антрациклины. Эти препараты образуют свободные радикалы, повреждающие ДНК больных клеток. Самые известные представители группы антрациклинов — средства с действующим веществом даунорубицин.
- Таксаны нарушают процесс деления раковых клеток. Препараты на основе паклитаксела — самые распространенные в этой группе.
- Винкалкалоиды разрушают цитоскелет раковых клеток, что приводит к их гибели. Относятся к мягким средствам химиотерапии, так как раковые клетки гораздо более чувствительны к воздействию этого препарата, чем здоровые. В этой группе выделяют средства с действующими веществами винбластин и винкристин.
При лечении многих видов опухолей хорошие результаты дает применение гормональных препаратов. Они наиболее эффективны при лечении гормонозависимых опухолей — рака молочной железы, матки, простаты, а также при опухолях поджелудочной железы, почек, при меланомах.
Эстрогенсодержащие препараты назначаются для подавления андрогенов (например, при раке простаты), а андрогенсодержащие, наоборот, подавляют выделение эстрогенов. Препараты последней группы назначают при таких видах онкологии, как рак молочной железы и т.д.
Несмотря на эффективность, у гормональных препаратов много минусов — они способны ослаблять действие химиотерапевтических препаратов, при долгом лечении у многих больных вырабатывается резистентность к подобным средствам.
Некоторые виды рака развиваются вследствие деятельности вирусов (например, вируса папилломы человека). Кроме того, организм, ослабленный агрессивной химиотерапией, подчас не может самостоятельно защитить себя от вирусных инфекций. Именно поэтому в комплексной терапии рака используются и противовирусные лекарства, в частности — препараты на основе тилорона и их аналоги.
К ферментам относятся активные белковые соединения, которые способны разрушать аминокислоты, необходимые для роста клеток опухоли. Для лечения опухолей применяют аргиназу, аспаргиназу и некоторые другие ферменты. Эффективность такой терапии под вопросом, так как резистентность вырабатывается очень быстро: человеческая иммунная система начинает вырабатывать антитела к ним. Однако исследования показывают, что ферментотерапия значительно смягчает последствия химиотерапии.
При лечении рака большое внимание уделяется не только воздействию на саму опухоль, но и улучшению качества жизни пациента, в частности — борьбе с болью. Чаще всего боль вызывается ростом опухоли, но иногда болевой синдром — побочный эффект некоторых лекарств от рака.
Выбор обезболивающих препаратов зависит от стадии болезни. ВОЗ разработала трехступенчатую схему, которая предполагает переход ненаркотических анальгетиков к слабым опиатам, а затем — к сильным опиатам. Эта схема позволяет добиться заметного улучшения состояния у 9 из 10 пациентов.
- Адъювантные средства. Эти лекарства не являются обезболивающими в строгом смысле слова, однако они уменьшают побочные эффекты сильных опиоидов и усиливают их болеутоляющее действие (к примеру, клонидин). Определенный эффект дают и антидепрессанты.
- Ненарктотические анальгетики. Это первый шаг в снятии болевого синдрома при онкологических заболеваниях. Для этих целей применяются препараты на основе парацетамола, а также нестероидные противовоспалительные препараты (ибупрофен).
- Слабые опиаты. К этим средствам относятся кодеин, трамадол и некоторые другие. Это сильнодействующие препараты, которые тем не менее отличаются хорошей переносимостью. Они дают особенно заметный эффект в сочетании с ненаркотическими анальгетиками.
- Сильные опиаты. В случаях, когда боль становится слишком сильной и иные средства не помогают, врач назначает сильные опиаты на основе морфина, фентанила и т.д. Они воздействуют напрямую на ЦНС, подавляя нервные импульсы.
Онкологические заболевания распространены очень широко, количество больных раком увеличивается с каждым годом, причем врачи отмечают, что рак молодеет — все чаще этот диагноз ставится людям, не достигшим и 40 лет. Все это делает исследования в области разработки новых препаратов от рака приоритетом для международного фармацевтического сообщества. Исследования проводятся постоянно, и уже есть определенные результаты.
Возможно, уже через несколько лет подобные вакцины станут доступными, а таргетная терапия разовьется достаточно, чтобы полностью заменить химиотерапию. Однако пока эти направления являются экспериментальными.
Лицензия № ЛО-77-02-009978 от 17 января 2019 г. выдана Департаментом здравоохранения города Москвы.
Злокачественные эпителиальные опухоли яичников — солидные новообразования, чрезвычайно чувствительные к химиотерапии (ХТ) первой линии (70—80 %) с высокой частотой полных ответов. Однако у большинства больных раком яичников (РЯ) возникает рецидив, и в конечном итоге они умирают при явлениях резистентности к химиотерапии (ХТ).
Даже при применении препаратов платины 5-летняя выживаемость больных с первоначально выявленной поздней стадией заболевания составляет менее 25 %. До настоящего времени результаты химиотерапии (ХТ) второй линии при всех морфологических вариантах рака яичника (РЯ) остаются неутешительными.
При наличии эффекта от полихимиотерапии (ПХТ) первой линии после развития лекарственной резистентности практически нет шансов на существенный успех второго, третьего препаратов или их сочетаний. Иногда имеют место частичные ответы и исчезают опухолевые выпоты, но это длится недолго. Тем не менее большинство онкогинекологов применяюттерапию второй линии активными препаратами, не использовавшимися в первой схеме лечения.
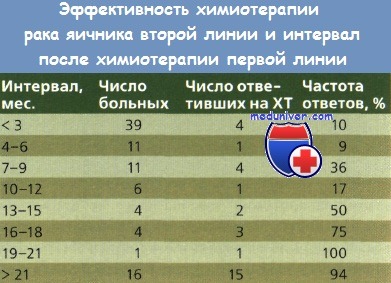
Чувствительность к производным платины (устойчивая реакция на терапию первой линии на основе препаратов платины) — прогностический показатель ответа на терапию второй линии, содержащую цитостатик с этим элементом. Ответ на первичное лечение и безрецидивный промежуток более 6 мес. — показатель чувствительности к препаратам платины.
При прогрессировании или стабилизации заболевания, а также при возникновении рецидива в течение 6 мес. после начала первичной XT на основе препаратов платины опухоли расценивают как платинорезистентные. Эффективность терапии в этих двух группах пациенток различна. Blackledge и соавт. проанализировали данные обследования 92 пациенток, получавших пять разных режимов терапии второй линии, и установили, что перерыв в лечении препаратами платины был устойчивым фактором прогноза эффективности лечения.
Это наблюдение было одинаково верным для схем второй линии как на основе препаратов платины, так и без них. У пациенток с перерывом в лечении менее 6 мес. частота противоопухолевого ответа составила менее 10 %, с ростом этого промежутка до более 21 мес. этот показатель увеличился до 90 %.
Seltzer и соавт. сообщили, что у 11 пациенток с полным ответом на химиотерапию (XT) первой линии на основе платины эффективность терапии второй линии составила 72 %, включая 36 % полных ответов. Согласно данным Markman и соавт., у больных, не получавших химиотерапию (XT) более 24 мес, частота ответа на цисплатин равняется 77 %, а при перерыве влечении втечение 5—12 мес. — 27 %.

Eisenhauer и соавт. сообщили о частоте объективного ответа на карбоплатин 43 % у пациенток, не получавших химиотерапию (XT) более 2 мес, а при перерыве в лечении до 2 мес. — 10 %. Эти данные указывают на необходимость тщательного отбора пациенток для проведения химиотерапии (XT) второй линии. Для II фазы исследования требуется достаточная выборка пациенток с чувствительностью и резистентностью к препаратам платины.
Кроме того, нужно стратифицировать больных в зависимости от протяженности интервала между химиотерапией (XT) первой и второй линий. В целом для II фазы исследования ожидаемая эффективность активных средств химиотерапии (XT) в группе пациенток, чувствительных к препаратам платины, составляет более 25—30 %, а в платинорезистентной — более 10 — 15 %.
Эффективность карбоплатина в качестве второй линии терапии рака яичника (РЯ) составила 14—38 % с частотой полных ответов 25—50 %. У пациенток с рефрактерностью к цисплатину и алкилирующим препаратам частота ответов равнялась 6—13 %, в случаях предшествующей эффективной терапии цисплатином — 31 %, у нелеченных больных (неудачная ЛТ) — 45 %. Если болезнь прогрессирует во время лечения цисплатином, то объективный ответ на карбоплатин не наблюдается.
Стандартная доза паклитаксела эффективна у 22—23 % пациенток с платинорезистентной опухолью. Kohn и соавт. изучали эффективность высоких доз паклитаксела, требующих поддержки гемопоэза, у пациенток с платинорезистентным заболеванием: частота ответов отмечалась в 48 % случаев. Но, как и при применении других препаратов, длительность их была короткой. Тем не менее паклитаксел — основной препарат терапии второй линии при платинорезистентном раке яичника (РЯ).
Значимость интенсивности дозы анализируют в рандомизированных исследованиях во всем мире; полученные результаты позволят точно определить дозировку паклитаксела для комбинированных режимов лечения первой и второй линий.
В последние 10 лет для лечения рецидивного рака яичника (РЯ) наибольший интерес представляют три препарата: гемцитабин, пегилированный липосомный доксорубицин и топотекан. Поскольку эти препараты оказались эффективными, их также включили в клинические исследования терапии первой линии.
GOG сообщила о положительных результатах II фазы исследования эффективности лечения топотеканом (5 дней по 1,5 мг/м 2 с интервалом 21 день): частота ответов составила 33 %, медиана выживаемости — 11,2 мес. Основными побочными эффектами были недомогание, анемия и тромбоцитопения. Сейчас большинство онкологов используют недельный режим применения топотекана, назначая 3,5—4 мг/м2 в 1, 8 и 15-й дни 28-дневного цикла.
Gordon и соавт. сообщили о III фазе исследования эффективности пегилированного липосомного доксорубицина (Доксил) по 50 мг/м 2 каждые 28 дней и топотекана по 1,5 мг/м2 в сутки в течение 5 дней каждые 21 день при лечении рефрактерного РЯ. В группе пациенток с резистентностью к препаратам платины различий в выживаемости не отметили. При лечении пегилированнным липосомным доксорубицином больных, чувствительных к препаратам платины, риск смерти снизился на 30 %; медиана выживаемости равнялась 108 и 70 нед. соответственно.
Эффективность монотерапии рефрактерных опухолей гемцитабином невелика, при комбинации с препаратом платины, обычно цисплатином, она возрастает. Nagourney и соавт. сообщили о результатах лечения цисплатином (30 мг/м 2 ) и гемцитабином (600—750 мг/м 2 ) в 1-й и 8-й дни каждые 21 день: частота полных ответов составила 26 %, частичных — 44 % (общая частота ответов 70 %), медиана времени до возникновения прогрессирования у больных, ответивших на лечение, — 7,9 мес. (диапазон 2,1 — 13,2 мес). Токсичность проявлялась в виде нейтропении, анемии, тромбоцитопении, тошноты, рвоты и периферической нейропатии. Имеются данные о способности гемцитабина устранять резистентность к цисплатину.
В настоящее время главная проблема лечения рефрактерного рака яичника (РЯ) заключается в выборе режима лечения: последовательная монотерапия или ПХТ. По данным двух европейских отчетов, ПХТ предпочтительнее. В одном исследовании (ICON4/AGO-OVAR 2,2) участвовало более 800 пациенток. Вся группа была с высокой платиночувствительностью, более чем у 75 % больных перерыв в лечении превышал 12 мес. При медиане наблюдения 42 мес. анализ показал, что 2-летняя выживаемость при ПХТ составила 57 %, при лечении только препаратом платины — 50 %, медиана общей выживаемости — 29 и 24 мес. соответственно.
Это исследование, представляющее множество параллельных клинических испытаний, проведенных разными группами в 119 клиниках 5 стран, подвергли критике. В качестве препарата платины использовали цисплатин или карбоплатин; лечение проводили ежемесячно. Немало больных раньше не получали таксаны. Исход заболевания, как оказалось, не зависел от того, получали они таксаны во время химиотерапии (XT) первой линии или нет.
В США большинство больных раком яичника (РЯ) получают первичное лечение таксанами и карбоплатином, поэтому перенос результатов и опыта этого исследования на женщин США сомнителен. По данным других, менее крупных исследований, в т. ч. испанского (GEICO), ПХТ рефрактерного рака яичника (РЯ) может улучшить результат. Тем не менее пациенткам с безрецидивным промежутком более 12 мес. предпочитают назначать химиотерапию (XT) второй линии с комбинацией таксанов и препаратов платины.
Другая стратегия удлинения перерыва в применении препаратов платины состоит в лечении рецидивов другими препаратами, например пегилированный липосомным доксорубицином и топотеканом. Сейчас широко применяется повторное лечение производным платины, часто в комбинации с гемцитабином, либо таксанами в сочетании с таргетным средством.
Другие препараты (гексаметилмеламин, 5-фторурацил, этопозид) редко вызывают умеренные кратковременные ответы на терапию.
Е.И. Загрекова, Л.Г. Жукова
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
К наиболее эффективным препаратам для лечения рака молочной железы относятся антрациклины, индуцирующие в монотерапии до 40% ответа у ранее не леченых пациентов. Многоцентровое исследование NSABP B18 показало, что комбинация доксорубицина с циклофосфаном является оптимальной для проведения НАТ рака молочной железы, с общей эффективностью (полная + частичная регрессия опухоли) около 80%. Тем не менее, продолжаются поиски более эффективных режимов НАТ за счет введения в схемы химиотерапии наиболее эффективных препаратов, как правило, применяемых во второй линии лечения рака молочной железы. Наиболее популярными являются препараты платины, навельбин, и, особенно в последние годы, таксаны.
Smith и Talbot (Br. J. Cancer, 65, 1992) приводят обзор работ по применению цисплатина в различных комбинациях при первой линии лечения рака молочной железы. Общий эффект составил от 49% до 91%.
Один из наиболее эффективных режимов НАТ включает постоянную инфузию 5-фторурацила 200 мг/м2 в день ежедневно длительно, эпирубицин 50 мг/м2 и цисплатин 60 мг/м2 каждые 3 недели в течение 6 месяцев. Лечение получили 50 больных с опухолью 3-12 см (в среднем 6 см). Полная ремиссия была достигнута у 66% больных, частичная ремиссия — у 32%. Общая частота эффекта составила 94%. Всем больным были выполнены сохранные операции (Smith, J. Clin. Oncol., 13, 2, 1995).
L.E. Morrell с соавт. (Саncer, 82, 3, 1998) проводили НАТ 55 больным III стадией рака молочной железы в режиме: метотрексат 30 мг/м2 в/в (день 1), винбластин 3 мг/м2 в/в, доксорубицин 30 мг/м2 в/в, цисплатин 70 мг/м2 в/в (день 2), метотрексат 30 мг/м2 в/в и винбластин 3 мг/м2 в/в дни 15 и 22, интервал между курсами 28 дней. Общий ответ получен у 82% больных, полная ремиссия — у 29%, общая и безрецидивная 5-летняя выживаемость составили 63% и 51% соответственно.
Высокоэффективный режим с включением метотрексата 30 мг/м2 (дни 1,15,22), винбластина 3 мг/м2 (дни 2,15,22), доксорубицина 30 мг/м2 и цисплатина 70 мг/м2 (день 2), фолиниевой кислоты 10 мг каждые 6 часов, 6 доз, начиная через 24 часа после метотрексата, был изучен у 36 больных (Т3-4). Лечебный эффект составил 100% (полная ремиссия — 39%), полная морфологическая ремиссия — у 24% больных (Flores M. et al, Proc. ASCO, 12, 1993).
Хорошие результаты также получены при НАТ с включением навельбина в комбинации с другими препаратами, чаще всего, с антрациклинами. 89 больных (стадия II-III, размер опухоли >3 cм) получили НАТ навельбином 25 мг/м2, эпирубицином 35 мг/м2, метотрексатом 20 мг/м2 в дни 1 и 8 (28-дневные циклы), 6 курсов. Полная ремиссия достигнута у 21 (24%) больного, частичная ремиссия — у 44 (50%) больных. В результате эффективной химиотерапии удалось выполнить сохранную операцию у 77 (87%) больных. Полная морфологическая ремиссия зафиксирована у 14% больных (Van Praagh I. et al, Proc. Ann. Meet. ASCO, 14, 1995).
R.M. Gaafar с соавт. (Eur. J. Cancer, 35, suppl.4, 1999) провели НАТ навельбином 25 мг/м2 в 1 и 5 дни и эпирубицином 40 мг/м2 в 1 и 5 дни 53 больным. Полная регрессия опухоли достигнута у 5,5% больных, частичная — у 85%.
46 пациентов с местно-распространенным раком молочной железы получили НАТ по схеме: доксорубицин 50 мг/м2 день 1, навельбин 25 мг/м2 дни 1 и 8, интервалы между курсами 21 день. Получены результаты: полная регрессия — 15%, частичная — 50% (5th Int. Congress on anti-cancer chemotherapy, 1995, Paris).
В исследовании Ezzat с соавт. у 28 пациентов с местно-распространенным раком молочной железы провели химиотерапию навельбином и эпирубицином в сходном режиме. Объективный ответ составил 50% (Ann. Oncol., 7, suppl. 5, 1996).
Другой режим НАТ включал навельбин 40 мг/м2 каждые 3 недели и митомицин С каждые 6 недель, а также Г-КСФ 5 мкг/кг дни 2-7 после введения каждого препарата. После проведения 6 курсов у 55 больных лечебный эффект был получен у 73% больных (полная ремиссия — 22%, частичная ремиссия — 51%) (Koznek G. et al, Br. J. Cancer, 74, 1996).
В нашем отделении в 1995-97 гг. изучались 3 новых режима НАТ. Первая схема включала цисплатин 60 мг/м2 в/в кап. со стандартной водной нагрузкой 1 раз в 3 недели, эпирубицин 50 мг/м2 в/в 1 раз в 3 недели и фторафур 1200 мг/сут. в 3 приема ежедневно. Лечение получили 13 больных местно-распространенным раком молочной железы, общий эффект составил 73%. Вторая схема вместо эпирубицина включала новантрон 10 мг/м2 1 раз в 3 недели. Пролечено 28 больных, общий эффект отмечен у 69%. Третий режим включал навельбин 20 мг/м2 в/в в 1 и 8 дни и новантрон 10 мг/м2 в/в в 1 день, интервал 3 недели. Лечение получили 14 больных, общий эффект — 60%. Проанализирована общая и безрецидивная выживаемость. Анализ проводился с использованием метода Kaplan-Meier, кривые сравнивались с использованием Log-rank-теста. Медиана прослеженности составила 45 месяцев. Общая 5-летняя выживаемость составляла 52%, безрецидивная — 39%. В целом 3 предложенных режима показали высокую, сравнимую со стандартными режимами, эффективность, и приемлемую токсичность.
В последнее время при проведении НАТ все чаще используются комбинации, содержащие таксаны (таксол или таксотер). Монотерапия таксанами не имела существенных преимуществ перед стандартными антрациклин-содержащими режимами. При сравнении монотерапии таксолом и ПХТ с включением 5-фторурацила, доксорубицина и циклофосфана в рандомизированном исследовании Buzdar с соавт. (Proc. ASCO, 16, 1997) получена сходная эффективность в обеих группах. При применении высоких доз таксола (175 мг/м2, 6 еженедельных введений с 2-недельным интервалом между курсами) объективный ответ был получен у 86% больных (Sikov с соавт., Br. Cancer Res. Treat., 57, 1, 1999).
Высокую эффективность показала комбинация таксанов и антрациклинов. Полная патоморфологическая регрессия при стандартных схемах, включающих антрациклины, по данным различных авторов, не превышает 10-15%. При использовании схем, включающих таксаны и антрациклины, получен не только хороший клинический эффект, но, что особенно важно, более высокие цифры полной регрессии опухоли при гистологическом исследовании.
Penault-Llorca с соавт. (Br. Cancer Res. Treat., 57, 1, 1999) проводили рандомизированное исследование, сравнивающее эффективность НАТ комбинациями доксорубицина с таксолом (АТ) и циклофосфаном (АС). При гистологическом исследовании после 4 курсов НАТ полный или почти полный гистологический эффект в режимах АТ и АС отмечен в 23% и 9% соответственно, уменьшение опухоли >50% — в 19% и 10% соответственно.
Fumoleau с соавт. (Eur. J. Cancer, 35, suppl.4, 1999) при сравнении режимов АС и АТ получили полную патологическую регрессию опухоли у 5% из 40 больных, получавших НАТ в режиме АС, и у 16% из 180 больных, получавших комбинацию АТ. Общий клинический эффект в режиме АТ составил 83%.
Marcus с соавт. (Br. Cancer Res. Treat., 57, 1, 1999) оценивали эффективность комбинации таксотера 75 мг/м2 и доксорубицина 50 мг/м2 в/в день 1, интервал 3 недели, у 16 пациентов с IIB-IIIВ стадиями рака молочной железы. При гистологическом исследовании полный эффект отмечен у 13% больных, минимальная резидуальная болезнь — у 27%.
Knocker с соавт. (Br. Cancer Res. Treat., 57, 1, 1999) получили полную регрессию опухоли при гистологическом исследовании у 23% из 33 больных, получавших НАТ доксорубицином 60 мг/м2 и таксолом 200 мг/м2 1 раз в 3 недели.
Wenzel с соавт. (Eur. J. Cancer, 35, suppl.4, 1999) проводили НАТ эпирубицином 75 мг/м2 и таксотером 75 мг/м2 1 раз в 3 недели с поддержкой Г-КСФ. Из 40 оцененных больных полная морфологическая ремиссия отмечена у 12,5%, общий клинический ответ получен у 85% больных.
Из 15 пациентов, получивших НАТ доксорубицином и таксотером, Lara с соавт. (Proc. ASCO, 19, 2000) не обнаружили опухоли при гистологическом исследовании у 20%, общий клинический эффект составил 87%.
Основываясь на обнадеживающих результатах, полученных при многочисленных подобных работах, проводится исследование NSABP по применению комбинаций таксанов в неоадъювантной и адъювантной химиотерапии рака молочной железы. Ответ на НАТ может быть значительно увеличен при интенсификации лечения.
Интенсификация НАТ достигается при:
укорочении интервалов между курсами химиотерапии за счет использования КСФ;
введении полных или повышенных доз с планируемыми интервалами за счет использования КСФ;
применении стволовых гемопоэтических клеток с использованием высоких доз цитостатических препаратов.
Возможность улучшения отдаленных результатов лечения рака молочной железы при высокодозной полихимиотерапии остается до конца не выясненной. Исследования, проводившиеся при IV стадии и плохом прогнозе течения заболевания, показали незначительное увеличение медианы выживаемости, но значительно более выраженное увеличение длительной выживаемости на срок более 2 лет у 15-25% пациентов. При применении высокодозной химиотерапии у пациентов II стадии с плохим прогнозом выявлен больший процент безрецидивной выживаемости в сроки 2-3 года (Cancer, Suppl. 74, 3, 1994).
Fornasiero с соавт. (5th Int. Congress on anti-cancer chemotherapy, 1995, Paris) сообщают о хороших результатах, полученных при лечении 30 больных с местно-распространенным раком молочной железы. Больным проводилась НАТ эпирубицином 100 мг/м2 и циклофосфаном 400 мг/м2 (ЕС) с поддержкой Г-КСФ с 14-дневным интервалом. Объективный ответ получен в 96,5% случаев (4 полных и 25 частичных ремиссий).
Интенсивный режим получили 36 больных (T2>3,5см, T3No) с использованием эпирубицина 65 мг/м2, циклофосфана 600 мг/м2 и 5-фторурацила 600 мг/м2 в день 1, при поддержке Г-КСФ 5 мкг/кг, дни с 7 по 12. Интервалы между курсами составляли 14 дней. После трех курсов клинический эффект получен в 100% случаев; 80,5% больным выполнена сохранная операция (Bernardo et al, Proc. ASCO, 14, 1995).
Honkoop с соавт. (Oncologist, 4, 2, 1999) у 42 больных раком молочной железы IIIA и IIIB стадии проводили НАТ доксорубицином 90 мг/м2 и циклофосфаном 1000 мг/м2 при поддержке Г-КСФ с 3-недельным интервалом. Общий клинический эффект составил 98%, полная клиническая регрессия — 50%, полная гистологическая регрессия — 14%.
У 40 пациентов, получавших НАТ 5-фторурацилом 750 мг/м2 (дни 1-4), эпирубицином 35 мг/м2 (дни 2-4), циклофосфаном 400 мг/м2 (дни 2-4) с интервалом 3 недели, с поддержкой Г-КСФ, клиническая полная регрессия составила 37,5%, частичная — 45%, полная гистологическая ремиссия отмечена у 15% больных (Darut-Jouve et al, Bull-Cancer, 86, 2, 1999).
Massidda с соавт. (5th Int. Congress on anti-cancer chemotherapy, 1995, Paris) включили в рандомизированное исследование 67 женщин с местно-распространенным невоспалительным раком молочной железы. Больные получали НАТ по 4 линиям: 1) стандартный режим эпирубицин + фторурацил + циклофосфан (FEC) каждые 3 недели; 2) эпирубицин 120 мг/м2 каждые 3 недели; 3) интенсивный режим (FEC) с Г-КСФ каждые 14 дней; 4) МММ (митомицин, метотрексат, митоксантрон) с Г-КСФ каждые 14 дней. Эффективность обоих интенсивных режимов оказалась примерно одинаковой и выше, чем при стандартном режиме FEC; полная морфологическая ремиссия составила 23,2%, в то время как при стандартном режиме — 9%.
Dhingra с соавт. у 97 больных сравнили стандартный режим (доксорубицин 50 мг/м2 + фторурацил 1000 мг/м2 + циклофосфан 500 мг/м2, день 1, каждые 21 день) и интенсивный режим (доксорубицин 60 мг/м2 + фторурацил 1200 мг/м2 + циклофосфан 1000 мг/м2, день 1, Г-КСФ 5 мкг/кг, дни 4-17, интервалы 18 дней). Интенсификация лечения улучшила результат. Полная + частичная ремиссия — 98% и 76%, уменьшение распространенности болезни — 77% и 53%, соответственно. Не получено различий в частоте полной морфологической ремиссии. При интенсификации была выше частота фебрильной нейтропении — 28% против 11% (Proc. ASCO, 14, 1995).
Roche с соавт. (Proc. ASCO, 16, 1997) сравнивают стандартный и интенсивный режимы 5-фторурацил + эпирубицин + циклофосфан при НАТ у 98 больных местно-распространенным раком молочной железы, воспалительной формой. При медиане наблюдения 40 мес. 3-летняя общая выживаемость составила в стандартном и интенсивном режимах 60,6% и 72,5% соответственно, а безрецидивная выживаемость — 47,6% и 58,1%. Отмечена тенденция к большей эффективности интенсивного режима, однако разница не была статистически достоверной.
Совершенствуются методы высокодозной химиотерапии с введением стволовых гемопоэтических клеток + Г-КСФ. Их используют у больных раком молочной железы с плохим прогнозом, чаще всего при воспалительной форме рака молочной железы (T4d стадии) или в качестве адъювантного лечения, если при гистологическом исследовании выявлено вовлечение >10 аксиллярных лимфоузлов. Наилучший результат достигается в тех случаях, когда индукционная химиотерапия антрациклин-содержащими комбинациями оказалась эффективной.
Gravis с соавт. у 23 больных с воспалительной формой рака молочной железы проводили индукционную химиотерапию антрациклин-содержащими режимами с последующей высокодозной химиотерапией циклофосфаном 120 мг/м2, мелфаланом 140 мг/м2 и митоксантроном 36 мг/м2. 4 из 12 оперированных больных имели полную патоморфологическую ремиссию. Выживаемость при 36-месячном наблюдении составила: общая — 59%, безрецидивная — 45% (Ann. Oncol., 7, suppl. 5, 1996).
Viens с соавт. (Bone-Marrow-Transplant., 21, 3, 1998) провели 17 больным с воспалительной формой рака молочной железы НАТ митоксантроном 36 мг/м2, циклофосфаном 120 мг/м2, мелфаланом 140 мг/м2 с последующей трансплантацией периферических стволовых клеток. Макро- и микроскопическая полная морфологическая ремиссия составили соответственно 56% и 39%. 3-летняя безрецидивная выживаемость составила 59%.
Arun с соавт. (Сancer, 85, 1999) проводили высокодозную химиотерапию с включением карбоплатина 1,2-1,8 г/м2 и циклофосфана 4,8-6,0 г/м2 с последующей аутологичной трансплантацией костного мозга или периферических стволовых клеток 24 больным с воспалительной формой рака молочной железы. Двухлетняя безрецидивная и общая выживаемость составили 71 и 73% соответственно.
Stemmer с соавт. (Ann. Oncol., 7, suppl. 5, 1996) включили в исследование 69 больных раком молочной железы II-III стадии с плохим прогнозом, ответивших на индукционную химиотерапию антрациклин-содержащими режимами. На следующем этапе вводили циклофосфан 6000 мг/м2, карбоплатин 800 мг/м2 и тиотепа 500 мг/м2 с аутологичной трансплантацией периферических стволовых клеток. При среднем периоде наблюдения 12 месяцев отмечен рецидив болезни у 5 (7,2%) больных (2 — стадия II, 3 — стадия III).
Garcia-Conde с соавт. (Ann. Oncol., 7, suppl. 5, 1996) включили в исследование 62 больных с II-III-IV стадией рака молочной железы (с плохими прогностическими факторами), имевших ответ на первичную химиотерапию антрациклин-содержащими режимами. Режим кондиционирования проводился по схеме циклофосфан + TSPA + карбоплатин или циклофосфан + этопозид + L-PAM с последующей аутотрансплантацией периферических стволовых клеток. У всех больных с воспалительным раком молочной железы получен объективный ответ. 40-месячная безрецидивная выживаемость при II-III стадиях и воспалительном раке молочной железы составила соответственно 81% и 60%, а в группе исторического контроля — 35%.
Несмотря на обнадеживающие результаты приведенных исследований, ряд авторов считают, что повышение безрецидивной и общей выживаемости при проведении высокодозной химиотерапии обусловлено не эффективностью лечения, а отбором больных. Garcia-Carbonero с соавт. (J. Clin. Oncol., 15, 1997) сравнили общую и безрецидивную выживаемость у 128 больных, отвечавших критериям отбора для проведения высокодозной химиотерапии и получавших лечение в стандартных дозах, и 39 больных, отвечавших тем же критериям и получившим химиотерапию в высоких дозах. В обеих группах не получено значимых различий. Rahman с соавт. (J. Clin. Oncol., 15, 1997) разделили 1581 больных диссеминированным раком молочной железы, получивших стандартное лечение, на отвечающих критериям для проведения высокодозной химиотерапии и не отвечающих таковым. Во второй группе медиана общей и безрецидивной выживаемости оказалась значительно ниже, чем в первой.
В 1993-96 гг. группой EORTC, Национальным институтом онкологии Канады (NCIC CTG) и швейцарской группой клинических исследований по онкологии (SAKK) проводилось рандомизированное исследование III фазы, включавшее 448 пациенток с местно-распространенным раком молочной железы. Рандомизация проводилась по 2 направлениям: (1) FEC: 5-фторурацил 500 мг/м2, эпирубицин 60 мг/м2 в/в дни 1 и 8, циклофосфан 75 мг/м2 внутрь с 1 по 14 дни, интервал между курсами 28 дней; (2) EC + Г-КСФ: эпирубицин 120 мг/м2 в/в и циклофосфан 830 мг/м2 в/в день 1, с поддержкой Г-КСФ, интервал между курсами 2 недели, всего проводилось 6 курсов НАТ. При анализе результатов существенных различий в 3-летней общей и безрецидивной выживаемости, частоте полных морфологических регрессий не выявлено (Pritchard, Prоgrams and abstracts from ECCO 10, 1999, Vienna).
Таким образом, стандартным режимом для проведения НАТ рака молочной железы остается комбинация доксорубицина и циклофосфана в стандартных дозах. Однако, возможно, после получения новых результатов исследований, особенно c использованием комбинаций таксанов с антрациклинами и интенсивных режимов, появятся новые рекомендации по стандартам НАТ.
Читайте также:

