Предельные углеводороды с хлором
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:

Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:

| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан: |
Бромирование протекает более медленно и избирательно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:

Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:

Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:

1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, п ри дегидрировании этана образуются этилен или ацетилен:  |
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:

Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:

Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:

Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:


Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:

2.2. Пиролиз (дегидрирование) метана .
При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ:

Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:

- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:

- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.

4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Простейшим представителем класса предельных углеводородов является метан СН4. Это бесцветный легкий горючий газ, не имеющий запаха и почти нерастворимый в воде. Точка кипения метана —161,5°, точка замерзания —184°.
Метан довольно часто встречается в природе. Так называемые природные газы, в большом количестве выделяющиеся в некоторых местах из земли, состоят главным образом из метана.
Этот газ выделяется со дна болот, прудов и стоячих вод, где он образуется при разложении растительных остатков без доступа воздуха, почему он и получил также название болотного газа. Наконец, метан постоянно скапливается в каменноугольных шахтах, где его называют рудничным газом. Образуя с воздухом взрывчатую смесь, метан не раз являлся причиной катастроф в рудниках.
Метан является одной из главных составных частей коксового газа, который образуется при нагревании каменного угля без доступа воздуха и содержит около 30% СН4.
Молекула метана характеризуется сравнительно большой прочностью. При обычных условиях метан реагирует только с хлором и особенно активно с фтором. Реакция ускоряется под действием света и идет с последовательным замещением атомов водорода атомами хлора:

Эта реакция получила название металепсии (замещения).
Существует очень много углеводородов, сходных по своим свойствам с метаном. К ним относятся: этан С2Н6, пропан С3Н8, бутан С4Н10 и др. В молекулах этих соединений все связи между атомами углерода простые:
Если написать формулы рассматриваемых углеводородов в порядке возрастающего числа атомов углерода в их молекулах, то получим следующий ряд:
метая этан пропан бутан пентан гексан
Сравнивая эти формулы, мы видим, что каждый следующий член ряда содержит в молекуле на один атом углерода и два атома водорода больше, чем предыдущий. Такой ряд органических соединений, все члены которого обладают сходными химическими свойствами и сходным строением, причем каждый следующий член отличается от предыдущего на группу атомов СН2, называется гомологическим рядом, а отдельные члены его — гомологами. Приведенные выше углеводороды образуют гомологический ряд предельных (насыщенных) углеводородов, называемых также парафинами (от латинского parum affinis — имеющие мало сродства) ввиду их малой активности. В подобные гомологические ряды группируются и другие органические вещества.
В гомологических рядах особенно ярко проявляется всеобщий закон природы — закон перехода количества в качество. Изменение состава молекулы на один атом углерода и два атома водорода приводит к образованию совершенно другого вещества, которое, хотя и имеет много общего с соседними членами ряда, но вместе с тем качественно от них отличается. Качественное различие гомологов проявляется совершенно ясно в их физических свойствах. Низшие члены ряда предельных углеводородов (от СН4 до С4Н10) являются газами, температуры кипения которых тем выше, чем больше их молекулярный вес; средние члены ряда (от С5Н12 до С16Н34) при температуре до 20° С — жидкости, остальные — твердые вещества.
Основная заслуга исследования гомологического ряда парафинов принадлежит немецкому ученому Карлу Шорлеммеру (1834—1892).
Предельные углеводороды входят в состав нефти и нефтяных продуктов.Соляровое масло и другие тяжелые масла, используемые в качестве дизельного топлива, представляют собой смеси углеводородов; некоторые из них содержат до двадцати атомов углерода в молекуле. Еще более тяжелые углеводороды содержатся в смазочных маслах, вазелине и парафине.
С увеличением числа атомов в молекулах предельных углеводородов возникает еще одна качественная особенность — появление все большего числа изомеров.
Метан СН4, этан C2H6 и пропан С3Н8 не имеют изомеров. Бутан С4Н10 образует два изомера:
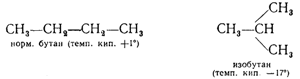
Пентан С5Н12 имеет три изомера, число изомерных гептанов C7H16 равно девяти, а формулу C1 4H 30 могут иметь уже 1818 различных углеводородов и т. д.
Изомерия в ряду предельных углеводородов была предсказана Бутлеровым. Им же были синтезированы первые изомеры с разветвленной цепью атомов углерода.
Как отдельные гомологи, так и изомеры отличаются друг от друга не только своими физическими, но и химическими свойствами. Различие в химических свойствах, в частности, сказывается на склонности некоторых углеводородов, входящих в состав моторного топлива, к детонации.
Детонация моторного топлива представляет собой чрезвычайно быстрое разложение (взрыв) углеводородов, которое происходит внезапно при сжатии горючей смеси в цилиндре двигателя. Детонация не дает возможности достигнуть высокой степени сжатия горючей смеси , ведет к излишнему расходу топлива и быстрому износу мотора. Детонационные свойства топлива сильно зависят от строения углеродных цепей в молекулах углеводородов, входящих в его состав. Изомеры с разветвленной цепью детонируют гораздо труднее, чем изомеры с неразветвлен-ной цепью.
Антидетонационные свойства моторного топлива характеризуются так называемым октановым числом. В качестве стандартных образцов для определения октанового числа берут углеводород гептан C7H16 с неразветвленной цепью атомов, весьма легко детонирующий, и один из изомеров октана с разветвленной цепью атомов, мало склонный к детонации. Строение этих углеводородов выражается следующими формулами:

Октановое число гептана принимается равным нулю, а изо-октану приписывают число 100. Если октановое число топлива равно 80, то это значит, что данный вид топлива детонирует в смеси с воздухом (при той же степени сжатия) как смесь, состоящая на 80% из изооктана и на 20% из гептана.
Повышение октанового числа топлива достигается увеличением содержания в нем углеводородов с разветвленной цепью атомов, а также прибавлением тетраэгилевинца (ТЭС), небольшое количество которого значительно снижает детонацию.
Тетраэтилсвинец (ТЭС) представляет собой тяжелую ядовитую жидкость, строение молекул которой выражается следующей формулой:

Соединения, в которых углеводородные радикалы непосредственно соединены с каким-либо металлом, как, например, в тетраэтилсвинце, называются металлоорганическими. Они имеют огромное, год от года возрастающее значение. К металло-органическим соединениям относится, например, один из наиболее эффективных препаратов для борьбы с вредителями и болезнями растений — гранозан, или этилртутьхлорид C2H5-Hg-Cl.
Вы читаете, статья на тему Предельные углеводороды
Мы приступаем к новому разделу - органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp 3
- Валентный угол (между химическими связями) составляет 109°28'

Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

В промышленности алканы получают путем:
-
Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
Гидрогенизацией угля (торфа, сланца)
Гидрированием оксида углерода II
В лабораторных условиях алканы получают следующими способами:
-
Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Алканы - насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
-
Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.

Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
6. Галогенирование углеводородов
Среди процессов галогенирования широкое распространение получили процессы хлорирования углеводородов. Их ценные свойства и доступность элементарного хлора, необходимого для их получения, способствовали развитию производства хлорорганических соединений-
Хлор в углеводородах может замещать водородные атомы или присоединяться по месту ненасыщенных связей между атомами углерода:
Для хлорирования могут использоваться не только хлор, но и хлорсодержащие соединения: хлористый сульфурил SO 2 Cl 2 , фосген COCI 2 , четыреххлористый углерод CCl 4 и др.
Большой практический интерес представляет процесс хлорирования углеводородов хлористым водородом, так называемое гидрохлорирование, например
или окислительным хлорированием, например
Хлорирование углеводородов проводится в паровой и в жидкой фазах различными способами: при нагревании (термическое хлорирование). в присутствии катализаторов (каталитическое хлорирование), при специальном освещении реагирующих компонентов (фотохимическое хлорирование).
Термическое хлорирование обычно применяется для получения хлоридов низших углеводородов. Например, метан реагирует с хлором трудно, поэтому его хлорируют при высокой температуре. Гомологи метана хлорируются легче, чем метан, и при более низких температурах. Каталитическое хлорирование углеводородов проводится чаще всего в жидкой фазе, причем газообразные углеводороды предварительно растворяют в хлорорганических растворителях. Поскольку катализатор снижает энергию активации, в его присутствии хлорирование протекает при более низких температурах, чем при термическом хлорировании. Например, в присутствии катализатора четырех хлористой углерод образуется при 250-300° С ; без катализатора в процессе термического хлорирования - при 460° С. Катализаторами служат хлориды металлов (Сu, Sb, Sn, Si ) и металлоидов ( I, S ), нанесенные на высокопористые материалы (пемзу, активированный уголь, силикагель), а также органические соединения - перекись бензоила и некоторые нитрилы. Наиболее активным катализатором является хлорид меди С u С1 2 , нанесенный на пористый носитель (пемзу, силикагель, активированный уголь).
Фотохимическое хлорирование - процесс хлорирования, ускоряемый действием света. Элементарный механизм этого процесса заключается в активации молекул реагирующих веществ при поглощении фотонов. Под действием лучистой энергии хлор диссоциирует на атомы:
которые затем взаимодействуют с углеводородом ( RH ). При этом образуется свободный углеводородный радикал R - и отщепляется хлористый водород:
Углеводородный радикал реагирует с другой молекулой хлора и образует хлорпроизводные углеводорода и один атом хлора и т. д.
Таким образом, хлорирование углеводородов принадлежит к цепным реакциям.
Хлорпроизводные углеводороды: четыреххлористый углерод СО 4 , метиленхлорид CH 2 Cl 2 , трихлорэтилен CHCl=CCl 2 , дихлорэтан CH 2 Cl -СН 2 С l и др. применяются в качестве растворителей.
При переработке ряда хлорпроизводных получают спирты (аллиловый, амиловые), каучукоподобные материалы (тиокол, полихлоропрен), синтетические полимеры (поливинилхлорид, энант), антидетонаторы (тетраэтилсвинец) и др.
В промышленных масштабах производятся хлорфтор- и фторпроизводные углеводородов, используемые в качестве хладагентов, высокотемпературных теплоносителей, смазочных и трансформаторных масел.
Перфторуглероды - производные углеводородов, у которых все атомы водорода замещены фтором: С n F 2n , С n F 2n+2 и др. - химически стойкие вещества, применяемые в качестве инертных растворителей, неокисляющихся высокотемпературных смазок, теплоносителей, диэлектриков для токов высокой и сверхвысокой частоты и исходных веществ в производстве химически и термически стойких полимеров - фторопластов.
Хлорирование парафиновых углеводородов заключается в замещении атома водорода хлором с образованием хлористого водорода. При этом получаются моно-, ди-, три- и полихлориды. Практически в процессе хлорирования образуется смесь хлоридов:
В зависимости от условий процесса в смеси преобладает какой-либо один из хлоридов.
При хлорировании олефинов может происходить замещение атомов водорода, как в случае хлорирования парафиновых углеводородов, а также присоединение атомов хлора по двойной связи с образованием насыщенных соединений, например
Скорость хлорирования возрастает с увеличением молекулярного веса олефина, повышением температуры и введением избытка галогена.
Гидрохлорирование олефинов - взаимодействие олефинов с хлористым водородом протекает с образованием монохлорпроизводных, например
По правилу В. В. Марковникова, атом галогена присоединяется к наименее гидрогенизированному атому углерода, поэтому при гидрогалогенировании олефинов образуются только вторичные и третичные галогенпроизводные. Одновременное присоединение галогенов и замещение атомов водорода галогенами приводят к образованию полигалогенных соединений.
Производство хлористого винила. Хлористый винил получается при гидрохлорировании ацетилена:
или при дегидрохлорировании дихлорэтана:
В промышленности гидрохлорирование ацетилена проводится в жидкой или газовой фазе. Последний способ более перспективен, так как для его осуществления требуется аппаратура меньшего объема и процесс может быть легко автоматизирован.
Гидрохлорирование ацетилена в газовой фазе производится при 170° С. Смесь хлористого водорода и ацетилена из смесителя 1 поступает в трубчатый контактный аппарат 2 (рис. 8), трубки которого заполнены катализатором хлорной ртутью, нанесенной на активированный уголь (10% HgCI 2 от массы угля). Тепло реакции отводится холодным минеральным маслом, циркулирующим в межтрубном пространстве реактора. Контактные газы, содержащие 93% хлористого винила и 5% хлористого водорода, поступают в скрубберы 3, где они сначала промываются водой для удаления хлористого водорода, а затем нейтрализуются щелочью. В аппарате 4 хлористый винил осушается твердой щелочью. Далее винил-хлорид конденсируется в конденсаторе 5, охлаждаемом рассолом, после чего направляется на ректификацию для отделения примесей: ацетальдегида, 1,1-дихлорэтана и др. После ректификации из хлористого винила производится отгонка ацетилена.
Винилхлорид - важнейшее сырье для получения полимеров, необходимых в производстве пластических масс и синтетических волокон.
При хлорировании полимера винилхлорида - поливинилхлорида - получается перхлорвнниловая смола, содержащая 64-65% хлора (поливинилхлорид содержит 55-56% хлора). Хлорирование поливинилхлорида проводится в хлорорганическом растворителе (хлорбензоле, дихлорэтане и др.) при 110-115° С. При употреблении низкокипящего растворителя процесс проводится под давлением. Перхлорвиниловая смола применяется в производстве лаков, эмалей и синтетического волокна - хлорина.
Хлорирование ароматических углеводородов может протекать несколькими путями. В зависимости от условий процесса атомы хлора могут присоединяться или замещать атомы водорода в ядре и в боковой цепи.
При фотохимическом хлорировании в отсутствии катализатора происходит присоединение хлора и образуются хлорпроизводные циклических углеводородов, например при хлорировании бензола образуется гексахлорциклогексан:
Водород бензольного ядра замещается на атомы хлора при сравнительно невысоких температурах в присутствии катализаторов железа или его солей. Сначала образуется монохлорбензол, затем дихлорбензол, трихлорбензол и т. п. Хлор замещает атомы водорода в боковой цепи ароматических углеводородов при более высоких температурах в отсутствии катализатора.
Получение хлорбензола. Процесс осуществляется по реакции
в присутствии катализатора хлорного железа .
Бензол и хлор непрерывно поступают в нижнюю часть реактора, в котором происходит образование хлорбензола и небольших количеств полихлоридов. Выделяющееся реакционное тепло отводится охлаждающей водой или расходуется на испарение избытка бензола, вводимого в хлоратор, и частичное испарение образующегося хлорбензола.
Парогазовая смесь, содержащая выделяющийся при хлорировании хлористый водород, пары бензола, остатки влаги и некоторые газообразные примеси, выводится в верхней части хлоратора, охлаждается в графитовом холодильнике до -2° С, где конденсируются пары бензола. Жидкие продукты реакции, выводимые из средней части хлоратора: хлорбензол, полихлориды и непрореагировавший бензол, поступают на ректификацию для выделения из них хлорбензола.
Хлорбензол применяется как полупродукт в производстве синтетических красителей, фенола, инсектицида ДДТ, он является хорошим растворителем некоторых эфиров целлюлозы и других полимеров.
Фторхлорзамещенные углеводородов предельного и непредельного ряда используются для получения пластических масс - фторопластов.
При взаимодействии хлороформа с фтористым водородом образуется дифторхлорметан:
При пиролизе дифторхлорметана при 650° С в отсутствии катализатора образуется тетрафторэтилен - мономер, при полимеризации которого получается фторопласт-4 (тефлон):
При полимеризации трифторхлорэтилена CF 2 =CFCl получается фторопласт-3.
Важнейший фреон - дихлордифторметан (фреон-12) получается при взаимодействии фтористого водорода с четыреххлористым углеродом в присутствии катализатора небольших количеств пятихлористой сурьмы:
Читайте также:

