Полный морфологический ответ опухоли на химиотерапию
IV РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ПРЕДОПЕРАЦИОННАЯ (ИНДУКЦИОННАЯ) ХИМИОТЕРАПИЯ МЕСТНО-РАСПРОСТРАНЕННОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ.
М.В. Шомова
Рязанский областной клинический онкологический диспансер
Понятие "местно-распространенный рак молочной железы" (МРРМЖ) включает в себя новообразования с различными клиническими и биологическими характеристиками. Все больные III стадии заболевания относятся к этой группе. Предоперационная химиотерапия впервые была использована для лечения МРРМЖ c целью перевода процесса в операбельное состояние и увеличения продолжительности жизни пациенток. Первые публикации по применению системной химиотерапии на предоперационном этапе появились в 60-70-х годах.
Предоперационная химиотерапия дает возможность не только выполнить операцию у больных МРРМЖ, но и уменьшить в ряде случаев объем вмешательств до органосохраняющих, воздействовать уже на первом этапе лечения на отдаленные микрометастазы, не определяемые обычными методами исследований, уменьшить вероятность метастазирования во время проведения операции. Клиническая регрессия опухоли после предоперационной химиотерапии и степень терапевтического патоморфоза отражают чувствительность опухоли к проводимому лечению. Это позволяет в резистентных случаях определить оптимальный подход к терапии, проводимой в послеоперационном периоде.
К недостаткам индукционной химиотерапии относится то, что локальное лечение бывает отсрочено у больных МРРМЖ, не прореагировавших на химиотерапию, стадирование процесса проводится только клинически, и риск хирургических и лучевых осложнений может увеличиться.
Наиболее важными факторами прогноза как по общей, так и по безрецидивной выживаемости после предоперационной химиотерапии считаются степень терапевтического патоморфоза в опухоли (морфологической регрессии опухоли) и число пораженных лимфатических узлов. Пациентки с полной морфологической регрессией опухоли имеют лучшую выживаемость, чем остальные больные, хотя не все авторы подтверждают этот факт. Количество полных регрессий зависит в определенной степени от схемы проводимой химиотерапии, числа курсов и биологических особенностей опухоли.
Проблему составляет выбор рациональной схемы химиотерапии, которая смогла бы обеспечить высокие показатели выживаемости при сохранении качества жизни больных. Среди схем предоперационной химиотерапии, которые применяют при лечении МРРМЖ, называют как комбинации, не содержащие антрациклины, так и антрациклин-содержащие схемы. Из комбинаций, не содержащих антрациклины, используют обычно CMFVP, CMF, TMF. Однако более часто при лечении больных III стадии заболевания применяются антрациклин-содержащие комбинации. Вопрос об их преимуществах не решен, а имеющиеся в литературе данные противоречивы. Среди схем индукционной химиотерапии, содержащих антрациклины, наиболее часто используют сочетания FAC, AC, MVAC, CMFAV, CAP. Процент полной морфологической регрессии при использовании данных комбинаций составляет 10-15 %.
Оптимальное количество курсов предоперационной химиотерапии при МРРМЖ не установлено, обычно проводятся 2-4 курса в предоперационном периоде. Ответ опухоли на лечение у разных больных различный: у некоторых пациенток максимальное уменьшение опухоли отмечается после первого курса химиотерапии, в то время как в других случаях требуется длительное лечение, чтобы достичь желаемого результата. Хотя индивидуализация продолжительности индукционной химиотерапии, вероятно, увеличивает количество полных регрессий, выживаемость при этом значительно не улучшается. В то же время, есть данные о том, что увеличение числа курсов неоадъювантной химиотерапии при МРРМЖ приводит к улучшению показателей общей и безрецидивной выживаемости (1).
В последние годы в схемы предоперационной химиотерапии при местно-распространенном раке молочной железы включаются препараты, показавшие значительную эффективность в лечении метастатического рака молочной железы - таксаны и винорельбин. Окончательные выводы по сравнительной эффективности схем химиотерапии, содержащих эти препараты со стандартными лечебными комбинациями, используемыми при лечении больных МРРМЖ, можно будет сделать после изучения отдаленных результатов лечения.
Использование таксанов в монорежиме не показало их высокой эффективности для достижения полной морфологической регрессии у больных III стадии заболевания (2, 3). Это побудило многих авторов к проведению исследований по использованию комбинации препаратов данной группы с другими химиопрепаратами при проведении индукционной химиотерапии у больных МРРМЖ. Предварительные результаты позволяют отметить активность этих схем для получения объективной регрессии опухоли как клинической, так и морфологической. По данным литературы, применение комбинации доксорубицина и доцетаксела позволило увеличить процент полной морфологической регрессии опухоли у больных МРРМЖ III и IV стадии до 20% (4). По результатам другого исследования, при применении 3-х курсов предоперационной химиотерапии по схеме паклитаксел+доксорубицин у 16% больных получена полная морфологическая регрессия (5).
Отмечена высокая частота полных морфологических регрессий (33%) при применении на предоперационном этапе 4-6 курсов NEC: винорельбин, циклофосфан и эпирубицин (6).
Во многих исследованиях авторы проводят предоперационную химиотерапию при МРРМЖ одновременно с лучевой терапией. Обоснованием одновременного применения химиотерапии и лучевого лечения послужили данные о радиосенсибилизирующем действии некоторых химиотерапевтических препаратов. Так, использование паклитаксела и доцетаксела позволяет остановить опухолевые клетки в G2/M фазах клеточного цикла, наиболее чувствительных к лучевой терапии (7).
В настоящее время нет определенных данных о том, является ли индукционная химиотерапия более эффективной, чем послеоперационная, в плане отдаленных результатов лечения. Рандомизированные исследования показывают, что результаты, полученные при использовании предоперационной химиотерапии, по крайней мере, равноценны наблюдаемым при проведении послеоперационной химиотерапии (10). Кроме того, целесообразность данного подхода определяется, прежде всего, тем, что 80-90% больных с неоперабельными новообразованиями могут быть переведены в операбельное состояние, а у ряда больных могут быть выполнены органосохраняющие операции после проведения индукционной химиотерапии. Вопрос, на который действительно следует ответить при проведении перспективных рандомизированных исследований, заключается в том, как эффективно комбинировать первичные и адъювантные режимы лечения для того, чтобы максимально увеличить гибель опухолевых клеток и продолжительность жизни больных.
Одним из важных аспектов индукционной химиотерапии является возможность клиницистов оценить эффективность проведенного лечения. Возросший интерес к использованию химиотерапии на предоперационном этапе требует того, чтобы были найдены адекватные прогностические факторы химиочувствительности. Известно, что цитотоксические препараты действуют в основном на пролиферирующие клетки, что отражает отмеченная в некоторых работах взаимосвязь между регрессией опухоли после проведенного лечения и пролиферативной активностью опухоли до лечения. Среди других факторов прогноза регрессии опухоли после индукционной химиотерапии называют рецепторный статус опухоли, а также экспрессию некоторых генов (p53, HER2/neu).
Таким образом, предоперационная химиотерапия является перспективным направлением в лечении больных МРРМЖ. Ее дальнейшее развитие основано на применении новых терапевтических комбинаций с учетом чувствительности опухоли к различным видам воздействия. Это позволит увеличить процент полных морфологических регрессий опухоли и продолжительность жизни больных.
Список литературы:
1. Honkoop A.H., Luykx-de Bakker SA, Hoekman K, et al. Prolonged neoadjuvant chemotherapy with GM-CSF in locally advanced breast cancer // Oncologist, 1999, 4(2):106-11.
2. Gradishar W.J. Docetaxel as neoajuvant chemotherapy in patients with stage III breast cancer // Oncology (Huntingt), 1997, 11 (8 Suppl 8): 15-8.
3. Lara F.U., Casta Castaneda N., Ramirez M.T. et al. Neoadjuvant (NA) Taxol (T) in stage III breast cancer (BC). // Proc Am Soc Clin Oncol, 1997, Abstr 626.
4. Lara F., De la Garza J., Ramirez T., et al. High pathological complete response (PCR) after neoadjuvant chemotherapy with doxorubicin and docetaxel in locally advanced breast cancer. // Proc Am Soc Clin Oncol, 2000, Abstr 492.
5. Anelli A., Gadelha A.P., Albuquerque A.A., et al. High response rate of paclitaxel (PTX) and doxorubicin (DOX) as neoadjuvant chemotherapy (NCT) in locally advanced breast cancer (IIIB) is associated with p53 status. // Proc Am Soc Clin Oncol, 1999, Abstr 302.
6. Braud A., Levy E., Kirova Y., et al. Primary chemotherapy combining vinorelbine, cyclophosphamide and epirubicin (NEC) in locally advanced breast cancer (LABC): final results of a phase II study. // Proc Am Soc Clin Oncol, 2000, Abstr 565.
7. Choy H. Taxanes in combined-modality therapy for solid tumors. // Oncology (Huntingt), 1999, 13 (10 Suppl 5):23-38.
8. Летягин В.П. Актуальные вопросы лечения первичного рака молочной железы. // Маммология, 1992, 1, стр. 52-56.
9. Шомова М.В. Местно-распространенный рак молочной железы (лечение и факторы прогноза).// Дисс. . доктора мед. наук, М., 1999.- 293 с.
10. Cunningham J.D., Weiss S.E., Ahmed S., et al. The efficacy of neoadjuvant chemotherapy compared to postoperative therapy in the treatment of locally advanced breast cancer // Cancer Invest, 1998, 16(2): 80-6.
Тактика лечения первичных новообразований скелета зависит от нескольких факторов. Во-первых, это их гистологическая форма. В лечении доброкачественных опухолей ведущим является хирургический метод. Злокачественные опухоли костей представляют собой разнородную группу нозологических форм, отличающихся по клиническим проявлениями, способностью к метастазированию, рецидивированию, чувствительностью к химиотерапии и лучевым методам воздействия. Так, например, хондросаркомы низкой степени злокачественности не чувствительны к химиолучевой терапии, и для них единственным методом лечения является радикальная операция. В то же время остеосаркомы, ЗФГ, саркомы Юинга/ПНЭО, низкодифференцированные хондросаркомы склонны к ранней гематогенной диссеминации, поэтому их лечение должно предусматривать воздействие на субклинические метастазы с помощью химиотерапии.
Вторым определяющим фактором при выборе тактики лечения является стадия заболевания. При наличии явных отдаленных метастазов, на первый план выходят лекарственные методы. В дальнейшем, в зависимости от характера ответа на проводимую терапию, в лечебную программу вносятся необходимые коррективы. При выраженном ответе возможно хирургическое удаление первичной опухоли, а также отдаленных метастазов.
Важнейшим моментом является определение объема хирургического вмешательства. Главным условием операции при саркомах костей является радикальность удаления опухоли, которая должна гарантировать отсутствие местного рецидива. Радикальным считается удаление в пределах слоя здоровых мышечных тканей, отсутствие опухолевых клеток по линии костного спила, исключение вскрытия псевдокапсулы.
В зависимости от возраста больного, гистологической формы опухоли, степени ее местной распространенности, вовлечения сосудисто-нервных образований, характера ответа на предоперационное лечение определяется вид операции. Хирургические вмешательства при саркомах костей могут быть калечащими (ампутации, экзартикуляции) и сохраняющими конечность. Калечащие операции показаны при местно-распространенных саркомах, вовлекающих магистральные сосуды и нервы, мышцы, кожу, а также при угрозе распада опухоли. В остальных случаях, в первую очередь следует рассматривать возможность выполнения сохранной операции. Применяемая в последние годы предоперационная химиотерапия, может уменьшить размеры опухоли, способствовать ее отграничению псевдокапсулой и перевести в резектабельное состояние. Образовавшиеся после сегментарных резекций дефекты замещают с помощью металлических эндопротезов или костными трансплантатами. Существенно улучшаются исходы костной пластики при пересадке васкуляризированных трансплантантов с применением микрохирургической техники и внеочаговой фиксации аппаратом Илизарова.
Лучевая терапия используется только в сочетании с химиотерапией или в качестве предоперационной подготовки при ряде радиочувствительных сарком. Методика облучения, доза и источник зависят от возраста больного, локализации и размеров опухоли и характера планируемой операции.
Лекарственное лечение сарком костей высокой степени злокачественности стало применяться тогда, когда стало ясным, что эти опухоли склонны к ранней гематогенной диссеминации, что обусловливает их системный характер уже в момент установления диагноза.
ОСТЕОСАРКОМА
До 70-х годов прошлого столетия хирургический метод являлся основным в лечении данной опухоли. Несмотря на выполнение радикальных, чаще всего калечащих операций или проведение лучевой терапии, прогноз оставался крайне неблагоприятным. Более 90% больных с клинически локализованной опухолью погибали в течении ближайших двух лет от прогрессирования легочных метастазов. Стало очевидным, что дальнейший прогресс в лечении может быть достигнуть только путем системного воздействия на опухолевый процесс.
В первой половине 70-х годов прошлого столетия впервые была показана эффективность лекарственной терапии при метастатической остеосаркоме. Наиболее активными оказались доксорубицин, комбинация доксорубицин — цисплатин и метотрексат в высоких дозах. Использование этих цитостатиков после радикального удаления опухоли увеличило безметастатическую выживаемость с 7—20% в группах исторического контроля до 40—65%. В тот период органосохраняющие операции выполнялись не более чем у 40% больных, и главным образом в высокоспециализированных центрах.
Ключевую роль в развитии органосохраняющей хирургии сыграло внедрение в конце 70-х начале 80-х годов прошлого столетия предоперационной или, как ее называют в последние годы, индукционной химиотерапии. С учетом биологических особенностей остеосаркомы ее использование обосновывалось необходимостью раннего воздействия на субклинические метастазы, стремлением уменьшить размеры первичной опухоли, и улучшить тем самым условия для выполнения операции, уменьшением риска появления химиорезистентных клонов. Гистологический ответ в удаленной опухоли учитывается при планировании режима адьювантной химиотерапии. Эта стратегия была названа неоадьювантной и стала стандартом лечения остеосаркомы в большинстве клиник мира.
Арсенал активных в отношении остеосаркомы противоопухолевых препаратов относительно невелик. Это метотрексат в высоких дозах, антрациклиновые антибиотики (доксорубицин), производные платины (цисплатин) и ифосфамид.
Отдельно хотелось бы остановиться на регионарной химиотерапии, у истоков которой в начале 60-х годов прошлого столетия стоял академик Н. Н. Трапезников. Эта методика позволяет получить более высокую концентрацию препарата в зоне опухоли, при этом концентрация на системном уровне аналогична той, что достигается при внутривенном введении, т. е. достаточна для воздействия на микрометастазы.
Цисплатин является наиболее подходящим для артериального введения цитостатиком, так как частота осложнений не превышает 4%. Доксорубицин в артерию практически не вводится из-за выраженной локальной токсичности. При совместном регионарном введении цисплатина и доксорубицина частота экстравазаций и некрозов кожи может достигать 23%.
Доксорубицин в комбинации с артериальным введением цисплатина более эффективны, чем системное введение этих препаратов. По данным РОНЦ им. Н.Н. Блохина при артериальном введении цисплатина патоморфоз III—IV степени встречался более чем в 1,5, а полный некроз в 3 раза чаще. При внутривенном лечении риск рецидивирования был в 3, а после органосохраняющих операций в 5,5 раз выше, чем при регионарной химиотерапии.
Ответ опухоли на индукционную химиотерапию может быть оценен с помощью клинических, инструментальных, лабораторных и морфологических методов.
характеризуется уменьшением или исчезновением болевого синдрома, что обусловлено в первые дни и недели от начала химиотерапии в большей степени анальгезирующим эффектом цитостатиков, нежели регрессией опухоли. За счет регрессии внекостного компонента значительно снижается давление на внескелетные структуры, что приводит к улучшению или полному восстановлению функции конечности (рис. 7).
Онкология — одна из самых сложных сфер медицины. В настоящее время многие злокачественные опухоли хорошо изучены, о них имеется много данных. Но зачастую эти данные сложны для понимания. Человеку без медицинского образования очень непросто увязать их в общую стройную картину.
Все это бывает очень сложно объяснить пациентам. А там, где человек не до конца понимает ситуацию, возникает масса сомнений и вопросов. Действительно ли медицина может помочь? Врач понимает, что со мной происходит, и как меня лечить? Работает ли курс химиотерапии, который мне назначили?
В этой статье мы постараемся ответить — максимально подробно и понятно.
- В первую очередь нужно понимать цель лечения
- На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
- Что такое ремиссия?
- Как контролируют эффективность химиотерапии в процессе лечения?
- Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь нужно понимать цель лечения
В большинстве случаев единственный радикальный метод лечения, который помогает избавиться от рака — хирургическое вмешательство. Противоопухолевые препараты применяют как дополнение к операции, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива.
Если основным методом лечения является химиотерапия, а не хирургия, это, как правило, говорит о том, что опухоль успела сильно распространиться в организме. Она неоперабельна, имеются отдаленные метастазы. Прогноз в плане полного излечения от рака в данном случае неблагоприятен. Скорее всего, врачи не смогут полностью ликвидировать опухолевый процесс.
Но это еще не приговор. Таким пациентам можно помочь. Химиотерапия может преследовать другие цели:
- Затормозить или полностью остановить рост опухоли.
- Уменьшить размеры опухоли.
- Продлить жизнь больного.
- Избавить от мучительных симптомов.
- Улучшить общее состояние.
Для пациента с самого начала важно понимать: для чего врач назначил химиопрепараты, какого результата он ожидает? Обязательно побеседуйте с доктором на эту тему. Не бойтесь задавать вопросы. Это поможет избежать недопонимания и ненужных сомнений в будущем. Если у вас нет медицинского образования, в некоторых моментах вам будет сложно разобраться сразу. Не стесняйтесь, попросите доктора еще раз объяснить более понятным языком.
На основании чего врач приходит к выводу о том, что именно данная комбинация препаратов поможет конкретному пациенту?
В настоящее время существует огромное количество разновидностей химиопрепаратов и других противоопухолевых средств: таргетных препаратов, иммунопрепаратов, гормональных препаратов. Как понять, какие именно и в каких комбинациях помогут в вашем случае? Ни один онколог не сможет на 100% правильно ответить на этот вопрос, руководствуясь лишь собственным опытом. Но этого и не требуется.
Каждый лицензированный химиопрепарат хорошо изучен. Проведены многочисленные клинические исследования с участием тысяч пациентов. Это очень серьезный, сложный и дорогостоящий процесс.

Например, для того чтобы создать и протестировать новый препарат, современным фармкомпаниям в среднем нужно потратить 12 лет и миллиард евро.
Если какой-либо препарат помог или не помог одному пациенту, это еще ни о чем не говорит. Не существует двух людей с полностью одинаковыми организмами, как и двух совершенно одинаковых по своим свойствам злокачественных опухолей. Но когда лекарство проверено на тысячах людей, ученые получают результаты, которым можно доверять, и на которые можно ориентироваться.
На основании проведенных исследований составлены протоколы химиотерапии. Ориентируясь на них, онколог может назначить лечение, которое с очень высокой вероятностью поможет. Конечно же, предварительно нужно провести тщательное обследование, разобраться во всех характеристиках конкретной злокачественной опухоли.
Что такое ремиссия?
Для того чтобы вовремя выявить возможный рецидив, после наступления ремиссии пациент должен периодически проходить обследования.

В зависимости от того, как пациент отвечает на химиотерапию, онкологи описывают результат лечения разными терминами:
- Полный ответ (полная ремиссия): опухоль исчезла и больше не обнаруживается.
- Частичный ответ (частичная ремиссия): опухоль осталась, но уменьшилась на определенный процент.
- Стабильное состояние: опухоль не уменьшается, но и не растет, не увеличивается количество очагов, не вовлекаются новые органы.
- Прогрессирование: опухоль растет, несмотря на лечение.
Опухолевые клетки коварны. Со временем в них происходят новые мутации. Начинается самый настоящий естественный отбор, как в теории эволюции: слабейшие быстро погибают под действием химиопрепарата, но сильнейшие выживают и обзаводятся новыми механизмами защиты. Поэтому все противоопухолевые средства помогают лишь в течение некоторого времени. Потом развивается резистентность (устойчивость), и вновь начинается прогрессирование. В таком случае врач назначит новые комбинации препаратов.
Как контролируют эффективность химиотерапии в процессе лечения?
- Инструментальные исследования: КТ, УЗИ, МРТ и др.
- Анализы крови на онкомаркеры.
- Исследование функции пораженных органов.
- Осмотр врача, беседа. Доктор оценивает состояние пациента, спрашивает о симптомах, общем самочувствии.
Если рак отвечает на химиотерапию, лечение продолжают в прежнем режиме. Если начинается прогрессирование, нужно менять тактику.
Одновременно контролируют побочные эффекты. При их возникновении назначают поддерживающую терапию, меняют состав и дозировки химиопрепаратов. В Европейской клинике этому моменту уделяется особое внимание. Мы считаем, что пациенты должны переносить курсы химиотерапии максимально комфортно и без лишних рисков.
Что делать, если вы сомневаетесь в эффективности лечения?
В первую очередь стоит поговорить с лечащим врачом, спросить, как он оценивает эффективность лечения, нельзя ли сделать что-то еще.
Но в онкологии нередко встречаются сложные ситуации, когда сам врач не до конца уверен в диагнозе, правильности назначений. По объективным причинам встречаются ошибки. Поэтому во всем цивилизованном мире давно стала нормой практика получения второго врачебного мнения. Не стесняйтесь проконсультироваться с другим специалистом.
Врачи в Европейской клинике всегда воспринимают позитивно возможность услышать мнение опытных коллег. У нас даже существует специальная система контроля качества. Ведь в конечном счете это идет на пользу пациенту, жизнь и здоровье которого — главные ценности для нас.

Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
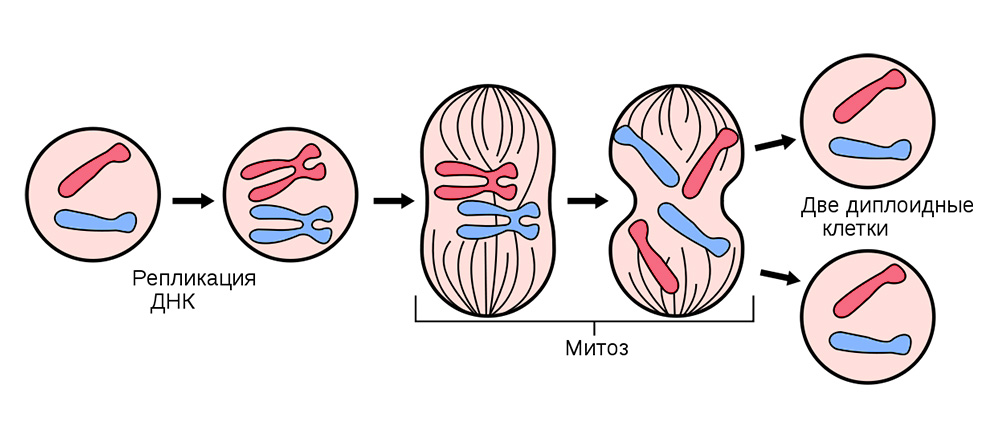
Деление соматических клеток происходит во всех органах и тканях
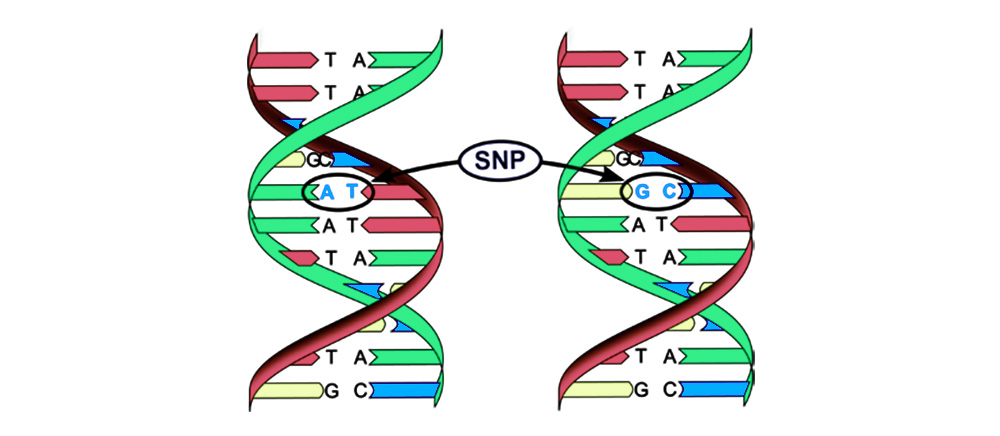
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
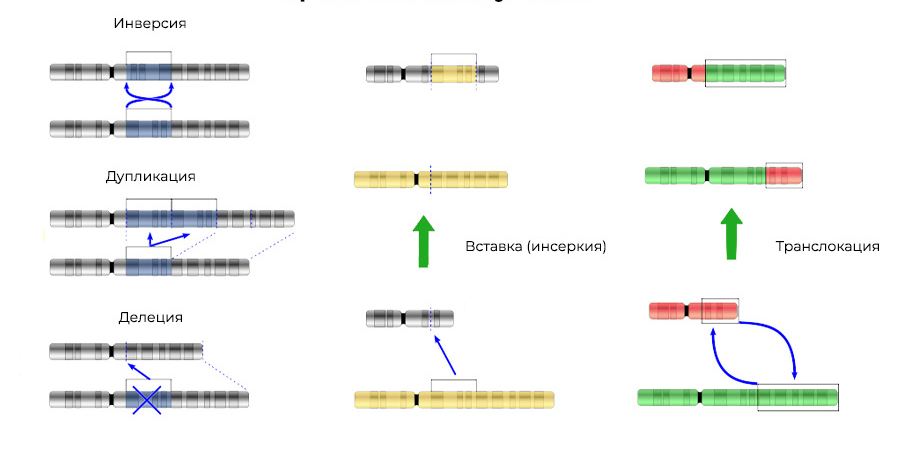
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
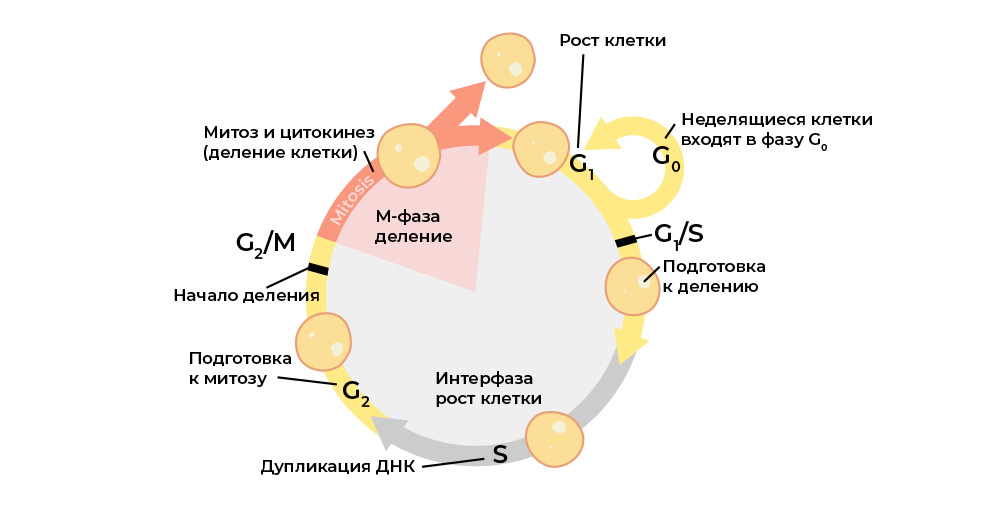
Каждый этап клеточного цикла контролируется белками-регуляторами
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
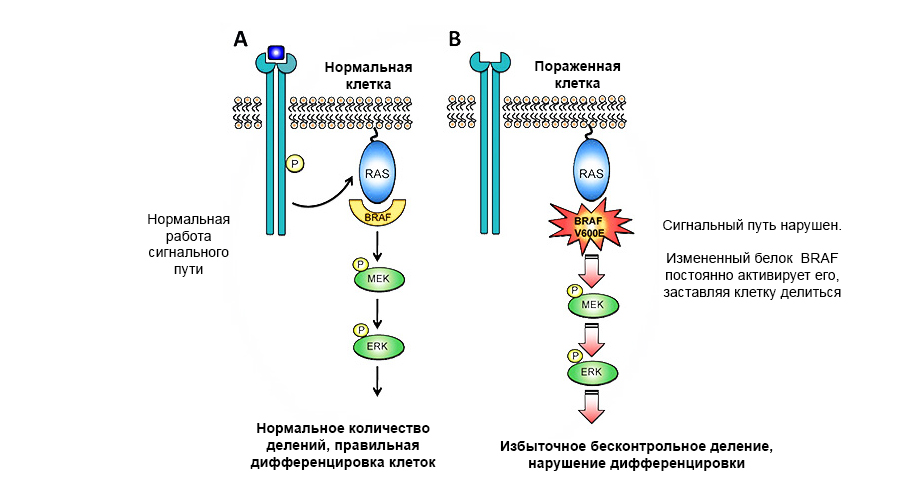
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
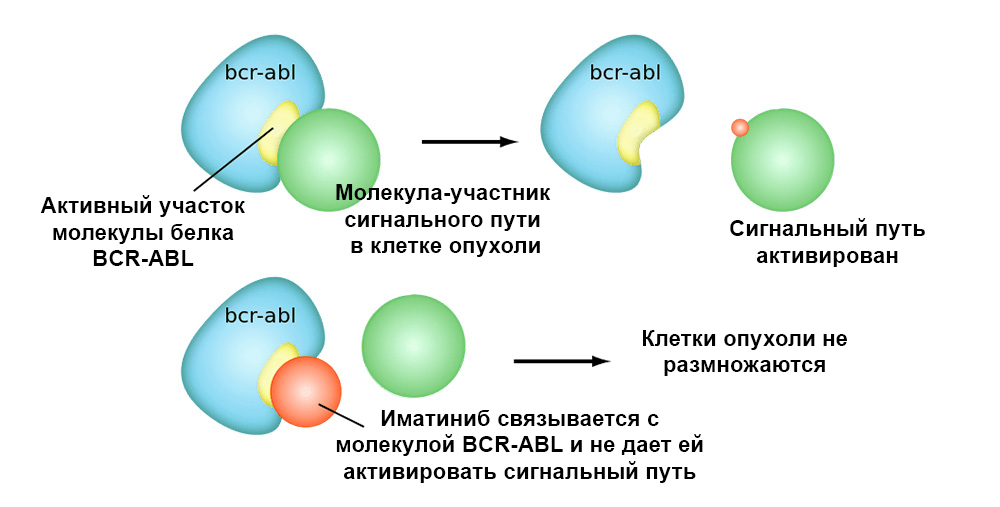
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
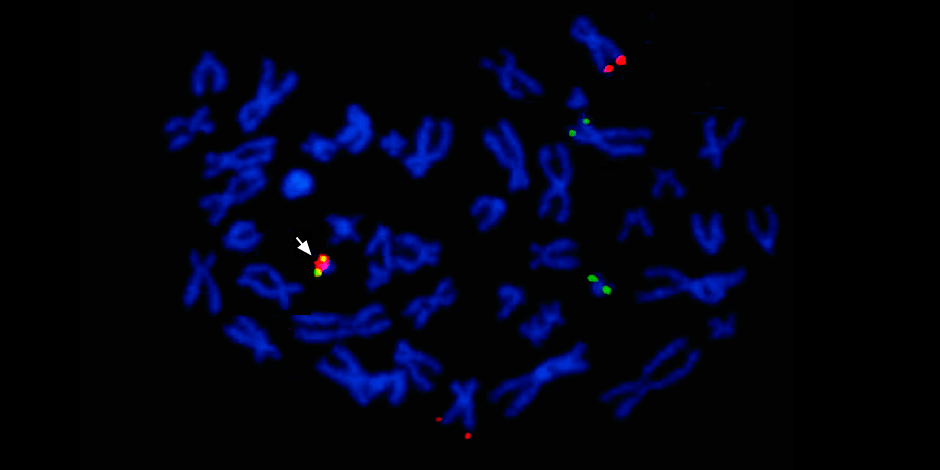
Под стрелкой слева – слияние красного и зеленого сигнала – свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Читайте также:

