Персонализированная медицина в онкологии
Именно эта новость заставила авторов незамедлительно взяться за перо, чтобы познакомить читателей с проблемами и методами персонализации терапевтического лечения рака – одной из самых пугающих и распространенных болезней современности.
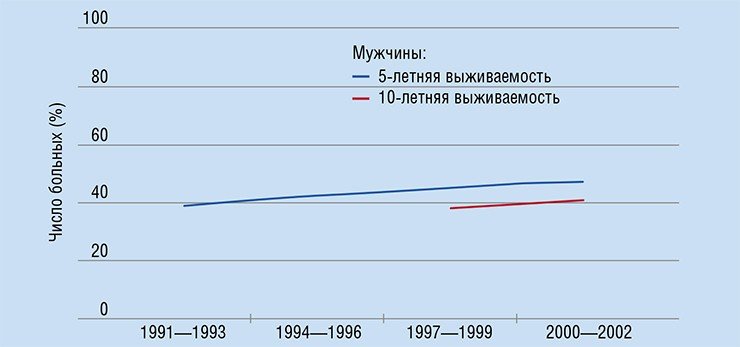
По прогнозам экспертов, на тот момент в странах Евросоюза ожидалось появление более трех миллионов новых случаев заболевания раком в год, причем эта цифра с течением времени должна только увеличиваться. По оценкам участников проекта, около двух миллионов человек в Евросоюзе умирают в год от рака или его последствий. Причем в Европе, численность населения которой составляет не более одной восьмой от численности мировой популяции, регистрируется около четверти всех случаев онкологических заболеваний.
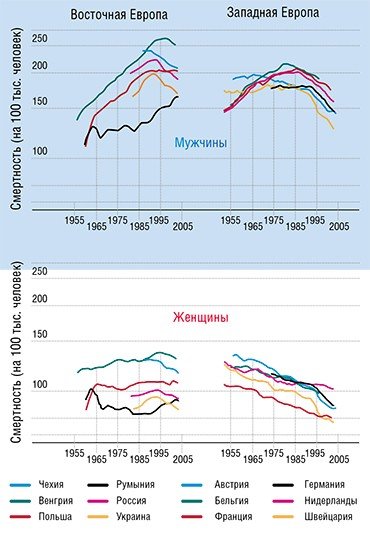
Впрочем, деньги здесь помогают мало. Например, Швейцария тратит на медицину в пересчете на каждого жителя примерно в десять раз больше, чем Польша. Однако соответствующая разница в числе онкологических больных, проживших 5 и более лет с момента диагностики, составляет всего 15—20 %.
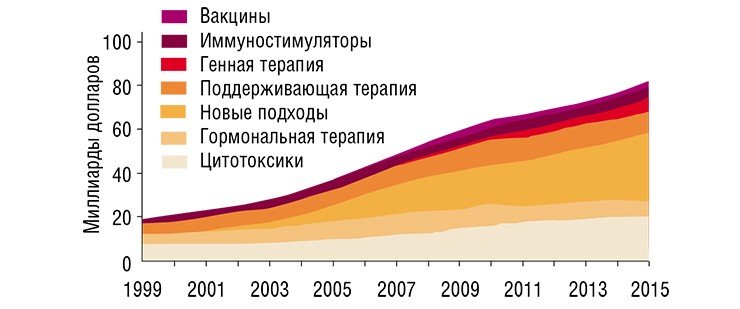
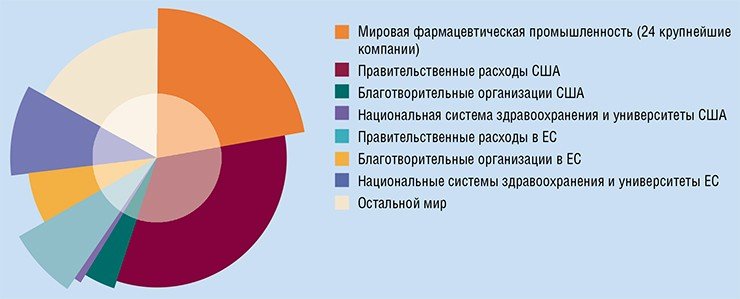
Разумеется, есть и успехи. Однако, согласно упомянутым исследованиям, почти все они связаны с превентивными мерами и мерами, направленными на раннюю диагностику (в частности, речь идет о широких программах скрининга населения), а вовсе не с прогрессом в лекарственной терапии. Вместе с тем, число новых методик лечения рака и новых противораковых препаратов растет взрывным образом. Уже в 2007 г. мировые расходы на противораковые препараты оценивались в 31 млрд долл. (почти 60 % из них составили расходы США). Если современные тенденции роста сохранятся, к 2027 г. эти расходы увеличатся в десять раз.
Дьявол сидит в деталях
Среди используемых сегодня химических веществ доминируют препараты химиотерапии – так называемые цитотоксики, вызывающие необратимые повреждения и смерть клеток. Но имеется множество препаратов и с другими способами воздействия. Что касается радиотерапии, то наиболее распространено лечение радиационным излучением. Наряду с этим набирает силу терапия с использованием радионуклидных препаратов, содержащих радиоактивные изотопы.
Итак, лекарство работает на группе схожих медицинских случаев, его и применяем – в чем проблема? Дьявол, как известно, сидит в деталях.
Одно для всех, или уникальное – каждому
Допустим, что в некотором царстве, в некотором государстве одна отдельно взятая компания решила наладить производство туфель для местного женского населения. Причем туфель универсальных, а именно таких, которые бы смогло надеть большинство.
Сказано – сделано. Выпустили опытную партию туфель 40-го размера – и давай проверять. Взяли группу из сотни дам всех возрастов (хотели 200 для надежности статистики, но сошлись на 100, чтобы сэкономить средства). В результате примерки оказалось, что туфли смогли надеть аж 75 дам! Статистически – результат блестящий. Правда, некоторым туфли слегка жали, а у многих на ноге болтались. А кому-то и вовсе не повезло – туфли на ногу не налезли. Но ничего, для них в следующий раз другая компания что-нибудь выпустит!
Итак, многие специалисты пришли к выводу, что статистический подход к лекарственной терапии опухолей нужно менять на персонализированный. Здесь есть три возможных решения, которые обсуждались выше: персонализировать лекарства (то есть изготавливать его индивидуально для каждого случая), персонализировать схемы применения уже существующих лекарств, или то и другое вместе.
С другой стороны, известны многочисленные случаи, когда прогресс в состоянии онкологических пациентов был достигнут с помощью траволечения, гипноза или других немедикаментозных средств. Правда, эти случаи часто не поддаются традиционной научной аргументации.
Basso A. M., Depiante-Depaoli M., and Molina V. A., Chronic variable stress facilitates tumoral growth: reversal by imipramine administration // Life Sciences. 1992 . V. 50. P. 1789—1796.
Coleman M. P., Alexe D.-M., Albreht T., and Mckee M. Responding to the Challenge of Cancer in Europe // Institute of Public Health of the Republic of Slovenia. Ljubljana. 2008.
J rgensen J. T. Are we approaching the post-blockbuster era? – Pharmacodiagnostics and rational drug development // Expert Review of Molecular Diagnostics. 2008. V. 8. P. 689—695.
Rothwell P. M., Fowkes F. G. R., Belch J. F. F., et al. Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials // The Lancet, Early Online Publication, 2010. 7 December.
The European Journal of Cancer. 2009. V. 45. Iss. 6.
Когда мы читаем о персонализированной или, как её в последнее время стали называть, точной медицине, то чаще всего встречаем примеры из области практической онкологии.
Сегодня персонализированный подход в онкологии развивается в двух ключевых направлениях:
- Современные методы молекулярно-генетической диагностики используются, чтобы спрогнозировать вероятность развития рака и предложить пациентам с высоким риском онкологии ранние скрининговые исследования.
Результаты диагностики важны ещё и тогда, когда пациента всё же настигла болезнь и нужно принять решение, какую тактику лечения выбрать. - И второе направление — молекулярно-генетические особенности опухоли и пациента помогают понять, будет ли выбранное лечение эффективным и переносимым.
Таргетная терапия
Учёные определили геном человека и изучили его соматические мутации — как геном меняется в опухолевых клетках. Это помогло выявить гены, мутации в которых приводят к раку.
В последние три десятилетия таргетная терапия развивается семимильными шагами. На рынке появляются лекарственные препараты для лечения различных типов опухолей. Цель терапии — достичь максимального лечебного эффекта при минимальном воздействии лекарства на здоровые клетки организма.
Наверное, наиболее показателен эффект таргетных препаратов в лечении рака лёгкого. Это одно из самых распространённых онкологических заболеваний в мире — ежегодно диагностируется 1,8 млн. новых случаев болезни. По количеству летальных случаев рак лёгкого на первом месте среди остальных — ежегодно от него умирает больше больных, чем от рака простаты, молочной железы и толстой кишки вместе взятых.
Есть два основных типа рака лёгкого: мелкоклеточный (МЛР) и немелкоклеточный (НМЛР). Последний наиболее распространённый и встречается в 85% случаев.
В зависимости от структуры опухолевых клеток и характера их роста, немелкоклеточный рак лёгкого разделяют на несколько подтипов: аденокарциному, плоскоклеточный и крупноклеточный раки. Различные подтипы требуют разного лечения.
До 2003 года единственной доступной системной терапией для пациентов с прогрессирующим НМРЛ была паллиативная химиотерапия. Знаний биологический различий между аденокарциномой и плоскоклеточным раком было недостаточно, поэтому все подтипы НМЛР лечили одинаково — комбинированными схемами препаратов на основе платины.
Если сравнить с поддерживающим лечением, качество жизни пациентов было выше. Но средняя выживаемость всё равно оставалась скромной — 8-10 месяцев.
Сейчас стратегия лечения рака лёгких существенно отличается, особенно для пациентов с аденокарциномой. Молекулярно-генетическое тестирование позволяет определить индивидуальные особенности опухоли и подобрать максимально эффективный препарат.
Самым важным молекулярным тестом для НМЛР является выявление активирующих мутаций в гене рецептора эпидермального фактора роста (EGFR). Мутации стимулируют постоянную активность белка в клетке, которая выражается в неконтролируемой стимуляции клеточного деления — основной черты опухолевых клеток. Активирующие мутации в гене EGFR — показание к применению Гефитиниба, Эрлотиниба и Афатиниба. Эти эффективные лекарственные препараты обладают лучшим профилем безопасности и, в отличие от стандартной химиотерапии, практически не действуют на нормальные ткани.
Молекулярно-генетическое тестирование позволяет определить несколько молекулярных маркеров — мутации генов EGFR и BRAF, перестройки генов ALK, ROS1, RET, NTRK. Это примерно треть пациентов с прогрессирующим НМЛР, которые получают таргетные лекарственные препараты. У них выше выживаемость, быстрее наступает регрессия, что принципиально важно при симптомном течении заболевания и при большой распространённости опухолевого процесса.
На таргетной терапии продолжительность жизни пациентов выросла в 4 раза, и это не предел.
Эффективные таргетные препараты существенно изменили ландшафт лекарственного лечения и молекулярно-генетического тестирования при ряде и других онкологических заболеваний, включая меланому, рак толстой кишки, рак яичников и другие.
Профилактика рака
Персонализированная медицина даёт нам ключ к пониманию, как предотвратить рак.
Геномные технологии развиваются, мы лучше понимаем суть связей между определёнными генетическими изменениями и развитием рака, а значит, можем более точно оценить риск онкозаболевания и найти действенные методы профилактики. Например, у женщин, которые несут мутации в генах BRCA1 или BRCA2, риск рака молочной железы к возрасту 70 лет составляет приблизительно 65% и 45% соответственно.
Профилактика рака молочной железы у таких пациентов — в основном, регулярная диагностика и хирургическое вмешательство: двусторонняя мастэктомия и двусторонняя сальпингоофорэктомия (BSO). Клинически доказано, что эти процедуры значительно снижают риск рака молочной железы. Тем не менее, во многих странах, включая Россию, использование высокоэффективных профилактических стратегий ограничено… Поэтому нужно искать дополнительные нехирургические альтернативы для профилактики рака молочной железы пациентам с мутациями BRCA1 и BRCA2, с учётом персонального анамнеза и особенностей генотипа.
Персональное тестирование чувствительности опухолевых клеток к лекарствам
Другое развивающееся направление персонализации в лечении рака — прямое тестирование чувствительности опухолевых клеток к широкой панели лекарственных препаратов. Как правило, на первом этапе анализа чувствительности у пациента берут биопсию или жидкую биопсию (кровь), в которой есть опухолевые клетки. На втором этапе клетки размножают до состояния двухмерной монослойной клеточной культуры или трёхмерной органоидной культуры. На третьем этапе к клеткам добавляют большое количество лекарственных препаратов и наблюдают за реакцией.
Есть и другой вариант — имплантировать прямо в опухоль небольшое устройство, которое будет высвобождать лекарственные препараты и их комбинации. Затем извлечь устройство и исследовать окружающий образец опухоли.
Лечение, основанное на принципах персонализации и таргетной терапии, всё еще стоит достаточно дорого. Основная причина: длительный процесс исследований, разработки и выведения лекарств и диагностических средств на рынок. Однако мы можем видеть, что принципы персонализированной медицины неумолимо входят как в нашу жизнь, так и в государственные структуры здравоохранения. Оптимизация этого процесса повлияет и на стоимость лечения (снизит его), и на эффективность.
Авторы статьи:
Владимир Евгеньевич Войцицкий, главный врач ГБУЗ СНО НООД, заведующий кафедрой Онкологии НГМУ, главный онколог Новосибирской области, заслуженный врач Российской Федерации
Максим Леонидович Филипенко, кандидат биологических наук, ведущий научный сотрудник и заведующий группой фармакогеномики Института химической биологии и фундаментальной медицины СО РАН
Ольга Анатольевна Ткачук, доцент кафедры онкологии НГМУ, кандидат медицинских наук
Центр новых медицинских технологий город Новосибирск
- 3.41
- 1
- 2
- 3
- 4
- 5


Об инновациях в лечении рака и о том, как компания Bristol-Myers Squibb поддерживает Нацпроект "Здравоохранение", "РГ" рассказал ее генеральный директор в России Марек Вашичек.
Г-н Вашичек, ваша компания прекратила поставки препаратов от ВИЧ/СПИДа в Россию с этого года. С чем это связано?
Марек Вашичек: "Бристол Майерс Сквибб" уже много лет поставляет в Россию свои оригинальные лекарства для лечения ВИЧ/СПИДа. Мы работаем в сотрудничестве с нашим российским партнером "Р-Фарм", поставляя им препарат, а "Р-Фарм" производит вторичную упаковку и совершает поставки в соответствии с государственным заказом. В 2017 году на рынок пришел российский дженерик (препарат-копия. - Ред.). С момента его появления у нас не было заказов, поэтому в соответствии с новыми требованиями закона компания уведомила государство о прекращении поставок на российский рынок, а также обратилась с заявлением об изъятии препарата из госреестра цен. Более того, мы решили отменить регистрацию нашего препарата в России. Эта ситуация схожа с той, когда истекает срок действия патента, и дженерики появляются на рынке. Мы поддерживаем модель, позволяющую фармацевтическим компаниям, ведущим НИОКР, получать поддержку в финансировании исследований, разработки и выпуска инновационных способов лечения для повышения качества препаратов и обеспечения их доступности для пациентов в таких странах, как Россия. Окончание действия патента позволяет дженерикам выйти на рынок, и цикл запускается вновь.
Компания ведет процесс по нарушению прав на интеллектуальную собственность. В чем суть спора?


Марек Вашичек: Мы - исследовательская фармкомпания, инвестируем в открытие, разработку и реализацию новых и инновационных методов лечения пациентов по всему миру, преследуя цель улучшить качество лечения и жизни пациентов. Это длительный и сложный процесс научного поиска, доклинических и клинических исследований, который может занять в среднем до 10-12 лет и требует значительных финансовых вложений - около 2,5 миллиарда долларов на одну молекулу. В 2018 году мы инвестировали 5,1 миллиарда долларов в научные исследования и разработки, что составляет половину наших операционных расходов. Расходы на исследовательскую деятельность и проведение разработок не только обеспечивают создание новых лекарств, но и дают дополнительные доходы для других участников процесса - медицинских центров, научно-исследовательских учреждений, клинических испытательных площадок, больниц и т. д. Это является нашей инвестицией в инфраструктуру стран, в которых мы работаем, в том числе России. Заработать такие деньги на разработку новых эффективных молекул было бы невозможно без правовой защиты интеллектуальной собственности. Она обеспечивает доступность новых методов лечения для пациентов.
Но в 2017 году одна компания зарегистрировала и ввела в оборот "дженерик" до истечения срока действия нашего патента на оригинальный препарат. Если препарат зарегистрирован как копия, проводить полный цикл исследования не требуется, учитывается лишь его биоэквивалентность, то есть концентрация препарата в крови пациента - она должна быть такой же, как у оригинального препарата. Позже компания получила патент, хотя никаких доклинических и клинических исследований его эффективности и безопасности, как того требует закон, не проводила, что является нарушением.
Нашей компании принадлежат исключительные права на препарат по патенту Российской Федерации, срок действия которого заканчивается в январе 2023 года. Введение в оборот дженериков до истечения срока патента на оригинальный препарат рано или поздно может привести к нерентабельности регистрации оригинальных препаратов и их поставок на территорию России. Снижение инвестиций и ограничение присутствия мировых лидеров фармацевтической отрасли на российском рынке идет в разрез с интересами пациентов - Россия может лишиться целого ряда высокоэффективных оригинальных противоопухолевых препаратов.
В рамках Нацпроекта "Здравоохранение" с 2018 по 2024 год будет реализована новая программа по борьбе с онкологическими заболеваниями. Будет ли ваша компания участвовать в ее реализации?
Марек Вашичек: Мы возлагаем большие надежды на эту программу и считаем, что это правильный шаг со стороны правительства. В России в 2018 году было выявлено 617 тысяч новых случаев онкологических заболеваний - на 20 тысяч больше, чем в 2017-м. Смертность от них составила 193,1 случая на 100 тысяч населения - это значительно больше, чем в Японии или Европе. Высокая смертность связана с диагностикой на поздних стадиях заболевания и с ограниченными возможностями существующих видов лечения для этих пациентов.
Так, одной из основных причин онкологической смертности в мире является рак легкого - по данным ВОЗ, ежегодно от него умирает около 1,7 миллиона человек. В 70,3 процента случаев диагностируется уже III-IV стадии заболевания, летальность в первый год с момента постановки диагноза - 50,5 процента. Показатели выживаемости варьируются в зависимости от типа заболевания и стадии на момент постановки диагноза. Это доказывает, как важны своевременная диагностика и доступность инновационных препаратов, которые эффективно лечат этот вид рака.


Мы уже начали поддерживать новую онкологическую программу. В прошлом году участвовали в проведении кампании для пациентов по раннему выявлению рака и провели несколько скрининговых программ по меланоме в регионах: все, кого беспокоили нетипичные родинки, могли прийти и бесплатно получить экспертную консультацию. Кроме того, мы поддерживаем программы по информированию и просвещению пациентов, оказываем поддержку деятельности пациентских организаций. Сейчас обсуждаются проекты, к которым могла бы подключиться наша компания. Одновременно с участием в уже существующих программах и мероприятиях мы рассматриваем возможность сотрудничества с российскими инновационными стартапами.
Как компания участвует в информировании врачей-онкологов?
Марек Вашичек: Основная сфера нашей деятельности - иммунология, это самое современное и сложное направление в медицине. Мы нацелены инвестировать в научное образование, чтобы обеспечить качественное обучение специалистов, дать им возможность улучшить качество онкотерапии и результаты лечения пациентов здесь в России. В фокусе обучения - использование иммунологических препаратов в лечении рака, выявление пациентов, нуждающихся в таких препаратах, определение возможной комбинации препарата и способов борьбы с возникающими побочными явлениями. В первую очередь мы будем стараться охватить врачей-онкологов в регионах.
Современные иммунопрепараты уже стали золотым стандартом в лечении различных видов рака. Однако они довольно дороги, поэтому обсуждается возможность сокращения бюджетных расходов за счет таких форм закупок, как риск-шеринг или долгосрочные контракты. Как ваша компания расценивает такие возможности?
Марек Вашичек: Мы готовы участвовать в государственных программах с инновационными препаратами и иметь возможность реализовывать программы риск-шеринга и кост-шеринга, а также в программах, поддерживающих доступность препаратов для пациентов в других странах. Считаем это правильным подходом к работе в партнерстве с правительствами и системами здравоохранения, ведь цель - сделать все возможное для обеспечения доступности лечения пациентам. Мы ведем разработки, выбирая оптимальный подход на каждом из рынков, и отталкиваемся от потребностей пациентов и возможностей, которые предоставляет существующая инфраструктура здравоохранения. Мы всегда открыты для обсуждения и пересмотра подходов в работе с российскими пациентами. В нашем портфеле есть иммунные препараты для лечения нескольких видов рака. Они продлевают жизнь пациентам, а в некоторых случаях превращают рак из абсолютно смертельного заболевания в хроническое. Например, прежде пациенты с метастатической меланомой жили в среднем до 6 месяцев после диагностирования, а теперь с помощью новых иммунных препаратов могут прожить 5 и даже 10 лет.
Есть ли прогресс в исследовании новых эффективных противораковых молекул? Появятся ли в ближайшем будущем новые препараты?


Марек Вашичек: Мы стараемся развивать такое направление, как персонализированная медицина. Проводим новые научные изыскания, которые помогут глубже понять роль иммунных биомаркеров и определить группы пациентов, для которых иммуноонкологическая терапия может быть наиболее эффективной. В дальнейшем, основываясь на генетическом профиле пациента или на результатах определения биомаркеров, мы сможем сразу же идентифицировать пациента, который может эффективно лечиться тем или иным препаратом или их комбинацией. Эта технология будет полезна пациенту и системе здравоохранения, позволит улучшить результаты лечения и снизить затраты. Ряд таких биомаркеров уже используется.
Так, по одному из наших препаратов расширился спектр применения, уже зарегистрировано его применение в лечении рака почек, легких и толстой кишки. Также внедряется комбинация двух препаратов, показывающая большую эффективность, чем монотерапия. И есть дополнительные препараты, применяющиеся одновременно с иммунотерапией, надеемся, что их можно будет применять самостоятельно или в сочетании с химиотерапией.
Мы совершенствуем методы лечения и стремимся к достижению большой цели - созданию новых возможностей лечения и повышению стандартов клинической практики, ведь в долгосрочной перспективе наша миссия - излечить рак.
Персонализированная онкология — это будущий стандарт мировой медицины. Вся суть проекта заключается в том, что для каждого пациента в ближайшем будущем будет свое индивидуальное лекарство. Но более того, некоторые онкологические заболевания уже успешно лечатся персональными вакцинами. В Израиле разрабатывается глобальная система персонализированных тестов для онкологических пациентов с целью точнейшего подбора целевой терапии и вы или ваши близкие уже можете стать кандидатами для целевой терапии практически всех типов опухолей.
Стратегия, направленная на развитие персонализированной медицины, позволяет Израильским онкологам подбирать наиболее эффективные препараты в лечении многих онкологических заболеваний.

Инновационные препараты и современные средства диагностики, имеющиеся в Израильских клиниках, спасают жизнь многим пациентам, значительно продлевая и улучшая качество их жизни. Это подход, основанный на обширных знаниях о молекулярной природе развития рака и богатом опыте применения многих противоопухолевых препаратов, а также на всё более глубоком понимании индивидуальных биологических особенностей каждого человека.

- 1Ваш результат — алгоритм действийСроки, стоимость, врачи, процедуры
- 2БесплатноВас это ни к чему не обязывает
- 3Без давления и запугиванияВы просто смотрите и выбираете
- 4Только Израильские специалистыНикаких операторов коллцентра

Цель персонализированной медицины – обеспечить наиболее точный, целевой подбор препаратов, подходящих отдельно взятому пациенту, выбранный опытным онкологом в соответствии с многими критериями и основываясь на научном опыте. Это возможно при использовании соответствующих диагностических тестов, определяющих наличие у пациента определённой мутации генов опухоли, или при применении препаратов, эффективных в отношении определённых мутаций, которые имеются в большинстве опухолей.
В течение последних нескольких лет Израильские онкологи в совместной работе с Американскими коллегами, ввели в практику несколько уникальных методик не только диагностики типа опухоли, но и прогнозирования ответа опухоли на имеющуюся терапию. Большое количество совместных проектов ведущих клиник нацеленны на развитие персонализированной медицины. Наиболее наглядно это можно представить на следующих примерах:
Онкология
Назначение генетического теста Foundation One состоит прежде всего в оказании помощи онкологу в выборе методик биотерапии на основе молекулярного профиля клеток опухоли. FoundationOne и FoundationOne Heme предназначены для анализа любого типа опухоли независимо от того, где она находится в теле, или при наличии метастаз рака. Тест FoundationOne® обеспечивает усовершенствованный и более тщательный анализ злокачественной опухоли на молекулярном уровне, чем все известные ранее лабораторные тесты — он проверяет последовательность 315 связанных с раком генов, плюс не-наследственные мутации 28 генов, часто перестроенные или измененные при развитии солидных раковых опухолей у человека. Этот тест позволяет лучше понять свойства опухоли и помогает при выборе конкретного лечения, для анализа необходим биоптат опухоли. Читать полностью …

- 1Ваш результат — алгоритм действийСроки, стоимость, врачи, процедуры
- 2БесплатноВас это ни к чему не обязывает
- 3Без давления и запугиванияВы просто смотрите и выбираете
- 4Только Израильские специалистыНикаких операторов коллцентра

- Рак молочной железы:
Тест на гормонозависимость опухоли HER2. С помощью специального теста компании (гистологическая диагностика) на поверхности клеток опухоли молочной железы определяется гиперэкспрессия рецепторов эпидермального фактора роста (HER2). Это позволяет выявить пациенток, для которых терапия Герцептином будет наиболее эффективна, поскольку действие препарата направлено именно против этого фактора роста.
- Рак толстой и прямой кишки:
Тест на мутацию K-RAS. Тест-система K-RAS Mutation Test выявляет опухоль-специфические мутации, определяющие прогноз заболевания у пациентов с колоректальным раком. Некоторые препараты для лечения колоректального и других типов рака показаны только тем пациентам, у которых такие мутации не обнаруживаются. Таким образом, тест для определения мутаций помогает врачам выявлять тех пациентов, которые лучше ответят на проводимую терапию.
Мутации KRAS и BRAF. Мутации KRAS и BRAF как биологические маркеры чувствительности к анти-EGFR терапии пациентов с онкологическими заболеваниями
В настоящее время терапия пациентов с колоректальным раком основывается на использовании таргетных моноклональных антител, которые блокируют рецептор эпидермального фактора роста (EGFR), в сочетании с традиционными хемотерапевтическими агентами. EGFR представляет собой трансмембранный рецептор тирозин-зависимой киназы, контролирующий запуск каскада фосфорилирований, передающих сигнал от клеточной мембраны к ядру клетки, что играет ключевую роль в клеточном росте, дифференцировке, адгезии и апоптозе. Дезрегуляция этого сигнального пути приводит к онкогенезу. Таким образом, EGFR является объектом направленной антиопухолевой терапии препаратами нового поколения на основе моноклональных антител. Читать полностью …
Тест Oncotype DX® при раке толстой кишки. Тест Oncotype DX является единственной на сегодняшний день проверкой, которая позволяет точно предсказать риск рецидива опухоли. Результаты теста дадут врачу и пациентке количественную оценку вероятности рецидива рака толстой кишки и позволят выработать программу дополнительного лечения, оптимальную для каждого пациента. Читать полностью …

- 1Ваш результат — алгоритм действийСроки, стоимость, врачи, процедуры
- 2БесплатноВас это ни к чему не обязывает
- 3Без давления и запугиванияВы просто смотрите и выбираете
- 4Только Израильские специалистыНикаких операторов коллцентра

- Рак легкого
Тест на мутацию гена EGFR при раке легких. Анализ мутаций рецептора эпидермального фактора роста предназначен для пациентов, у которых диагностирована карцинома легкого немелкоклеточного типа. Его выполняют в Израиле тем пациентам, у которых есть соответствие для получения лечения методами иммунотерапии, в частности, препаратами гефитиниб или эрлотиниб. Читать полностью …
- Все типы солидных опухолей
Тест Caris Target Now™. Caris Target Now™ представляет собой всеобъемлющий молекулярный тест, помогающий сориентироваться в индивидуальном подборе методов лечения на основе уникальных биологических характеристик опухоли каждого пациента. Назначение теста: Помощь в выборе методик химиотерапии и биотерапии на основе молекулярного профиля клеток опухоли. Может быть применен практически ко всем типам опухолей (рака). Читать полностью …
Наступает новая эра в лечении онкологических заболеваний и эта технология уже доступна в Израиле. Индивидуальный подход дает возможность своевременной доставки правильной дозы правильного препарата, направленного на разрушение конкретной опухоли.Представьте, что врач-онколог может заранее знать, как отреагирует опухоль пациента на то или иное лечение. Уже сейчас существуют методы, способные предоставить дополнительную информацию об опухоли, важную для принятия четкого решения о выборе методов воздействия на нее. Читать далее…

- 1Ваш результат — алгоритм действийСроки, стоимость, врачи, процедуры
- 2БесплатноВас это ни к чему не обязывает
- 3Без давления и запугиванияВы просто смотрите и выбираете
- 4Только Израильские специалистыНикаких операторов коллцентра

CANscript
CANscript это инновационный метод функционального анализа для высокочувствительной оценки реакции опухоли на противоопухолевые препараты. В ходе анализа происходит самовоспроизведение собственной микросреды опухоли пациента в лабораторных условиях, и измеряется множество различных параметров для определения реакции опухоли. Затем CANscript конвертирует данные измерения в одно значение, которое позволяет сделать прогноз реакции на каждую терапию, назначаемую врачом.
Читайте также:

