Паллиативным хирургическим вмешательствам при раке поджелудочной железы
Ниже дан краткий обзор радикальных и паллиативных вмешательств при раке ПЖ.
В настоящее время хирургическое лечение остается единственно эффективным методом, однако опухоль можно удалить только на ранних стадиях (до 15% опухолей головки ПЖ), а операционный риск чрезвычайно высок. Радикальную операцию можно выполнить всего лишь у 1 — 5% больных, что обусловлено, в первую очередь, поздней диагностикой.
Выделяют следующие радикальные операции: гастропанкреатодуоденальная резекция, панкреатэктомия, дистальные комбинированные резекции ПЖ, расширенная субтотальная и тотальная панкреатодуоденэктомия. Радикальные операции технически очень сложны, их могут выполнить только высококвалифицированные хирурги в крупных центрах. Летальность после этих операций составляет от 27% при дистальной резекции ПЖ — до 17—39% при расширенной панкреатэктомии, пятилетняя выживаемость не превышает 8%. Последний факт обусловлен, прежде всего, тем, что у 50% больных в послеоперационном периоде возникает рецидив опухоли и в 90—95% случаев на первом году после операции развиваются отдалённые метастазы.
Существует мнение, что панкреатодуоденальную резекцию необходимо выполнять во всех случаях при подозрении на рак ПЖ даже без гистологической или цитологической верификации. Данное мнение отчасти обусловлено тем, что даже при лапаротомии и интраоперационном гистологическом исследовании частота ложноотрицательных ответов превышает 10%.
Перед операцией можно лишь предварительно судить о возможности удаления опухоли. Окончательное решение принимают после интраоперационного осмотра органов брюшной полости при исключении отдалённых метастазов и местной распространённости процесса. Наиболее часто во время операции обнаруживают такую причину нерезектабельности опухоли, как опухолевая инфильтрация забрюшинной клетчатки, включая нервные сплетения и поражение метастазами регионарных лимфатических узлов.
Панкреатодуоденальная резекция — основной тип радикальной операции при расположении опухоли в головке ПЖ. Нельзя её выполнить при прорастании опухолью нижней полой вены, аорты, верхней брыжеечной артерии и воротной вены. Для принятия окончательного решения следует отделить ДПК и головку ПЖ от подлежащих нижней полой вены и аорты, что позволяет судить и о вовлечённости верхней брыжеечной артерии; важна также оценка возможности диссекции воротной вены и верхней брыжеечной вены.
Удалённый при панкреатодуоденальной резекции анатомический препарат состоит из общего желчного протока, жёлчного пузыря, головки, шейки и секреторной части ПЖ, ДПК, проксимальной части тощей кишки, малого и части большого сальника, дистальной половины желудка. Кроме тою, иссечению подлежит паракавальная клетчатка, удаляют супрапилорические, инфрапилорические, передние и задние панкреатодуоденальные лимфатические узлы, лимфатические узлы гепатодуоденальной связки и по ходу общей печёночной артерии. Иссекают верхнюю брыжеечную вену (при изолированном опухолевом её поражении) или место се слияния с воротной веной. Такая лимфодиссекция улучшает прогноз, в то время как травматичность вмешательства увеличивается незначительно.
Простое перечисление удалённых органов свидетельствует о сложнейшей технике вмешательства. Ведь хирургу ещё предстоит выполнить серию восстановительных манипуляций — панкреатоностомию, билиодигестивный анастомоз (см. рис. 5-21), гастроеюностомию и межкишечный анастомоз. Средняя продолжительность операции составляет 6,5—7 ч.
Важны три технических приёма во время выполнения панкреатодуоденальной резекции — объём резекции паракавальной клетчатки и забрюшинной сосудистой диссекции, а также сохранение пилорического отдела желудка.
Особое внимание резекции паракавальной клетчатки уделяют потому, что именно в этой зоне чаще всего возникают рецидивы опухоли. Резекцию сосудов осуществляют при изолированном опухолевом поражении верхней брыжеечной вены или места её соединения с воротной веной. Прорастание верхней брыжеечной артерии чаще всего сопровождается обширным метастазированием в забрюшинные лимфатические узлы, что исключает возможность удаления опухоли.
Существуют мнения, что необходимо удалять узлы чревного сплетения, что позволяет существенно уменьшить выраженность болевого абдоминального синдрома в послеоперационном периоде, особенно в поздние сроки, когда заболевание прогрессирует.
Сохранение пилородуоденального сегмента при панкреатодуоденальной резекции улучшает пищеварительные функции и способствует более быстрому восстановлению массы тела больных.
Важно выявить зону первичного расположения опухоли в ПЖ, в первую очередь для исключения периампуллярных и ампулярных аденокарционом, имеющих значительно лучший прогноз.
Результаты стандартной панкреатодуоденальной резекции во многих больницах неудовлетворительные.
Послеоперационная летальность состав.ляет 12,3%, 1 год проживает 43,1% больных, средняя выживаемость больных составляет 15,5 мес, пятилетняя выживаемость не превышает 3,5—16.7%.
Неудовлетворительные отдалённые результаты, высокая послеоперационная смертность и техническая сложность панкреатодуоденальной резекции послужили основанием для отказа от радикальных вмешательств при раке ПЖ. Однако следует помнить, что репрезентативность результатов сравнительных исследований, проводимых в разных странах, может быть неодинаковой ввиду различий в диагностических критериях и подходах к стадированию рака ПЖ. В частности, в Японии применяют собственную классификацию опухолей ПЖ, отличающуюся от применяемых в США и Европе.
Выживают после гастропанкреатодуоденальной резекции лишь те больные, у которых по данным гистологического исследования послеоперационного материала по краям резекции нет опухолевых клеток. Напротив, в случаях их обнаружения больные живут приблизительно столько же, сколько больные после химиолучевого лечения.
При подтверждённом раке ПЖ выполняют ещё более объёмные операции — тотальную панкреатэктомию и расширенную панкреато-дуоденалъную резекцию. Необходимость в панкреатэктомии обусловлена важностью удаления мультифокальных очагов рака в ПЖ и более радикальным иссечением регионарных лимфоузлов (лимфатических узлов корня селезёнки, вокруг хвоста ПЖ). Несмотря на расширенный объём операции, показатели послеоперационной летальности сократились, однако отдалённые результаты от расширения объёма операции не улучшились, преимущественно за счёт развития тяжёлого сахарного диабета.
Расширенная панкреатодуоденальная резекция предусматривает удаление сегмента воротной вены и вовлечённых в опухолевый процесс артерий с реконструкцией сосудов. Кроме того, удаляют забрюшинные лимфатические узлы от чревной артерии до бифуркации подвздошных артерий. Разработчик техники этой операции Фортнер добился уровня отдалённой выживаемости 20% при послеоперационной летальности 23%.
При нерезектабельной опухоли, наличии или угрозе возникновения желтухи, гастродуоденальной непроходимости, если предполагаемая продолжительность жизни больного составляет более 6—7 мес, производят паллиативные вмешательства, в частности наложение билиодигестивного и гастроеюнального шунта (см. рис. 5-22).
При предполагаемой продолжительности жизни 1-2 мес показано эндоскопическое введение стента в жёлчные протоки. Установка эндопротеза вместо хирургического шунтирования (холедоходуоденостомии и гастроэнтеростомии) подходит больным с тяжёлыми сопутствующими заболеваниями и липам старческого возраста. Она позволяет уменьшить число осложнений и смертность. Использование новых стентов из металлической сетки даст возможность увеличить продолжительность их нахождения в протоках и снизить частоту возникновения холангита. Рецидивирование желтухи после установления стента чаще всего связано с его обтурацией вследствие сладжа жёлчи; в этом случае проводят замену стента.
Предоперационное дренирование жёлчных протоков с целью уменьшения холестаза не приводит к увеличению продолжительности жизни больных. Недавно описана методика дренирующих малоинвазивных операций с целью декомпрессии жёлчевыводяших путей с помощью ЭУС, позволяющей более точно произвести стентирование.
Пример паллиативной операции — введение спирта (50 мл) или фенола в зону чревного сплетения дая купирования болевого абдоминального синдрома. Такой подход позволяет уменьшить боли или даже купировать их на короткое время, однако у 2/3 пациентов болевой синдром рецидивирует в течение месяца. Блокаду чревного сплетения можно выполнять повторно, однако эффективность следующих процедур более низкая. Тем не менее блокада чревного сплетения более эффективна, чем применение наркотических анальгетиков в сроки до 6 нед.
Появление методики нейролизиса чревного сплетения с использованием ЭУС повысило эффективность вмешательства ввиду большой точности определения зоны введения спирта. Боль проходит у 52% пациентов, а у 30% удаётся уменьшить суточные дозы наркотических анальгетиков.
Существуют указания об эффективности торакоскопической сплапхнэктомии в лечении болевого абдоминального синдрома. Для улучшения результатов хирургического лечения его дополняют химио-и лучевой терапией. Применяют эти методы не только после операции, но и интраоперапионно (введение в воротную вену или печёночную артерию фторурацила, митомицина). Возможны различные схемы комбинации лучевой, химиотерапии и хирургического лечения, введение препаратов в ткань опухоли под контролем ЭУС.
В последние годы всё чаще применяют трансплантацию ПЖ, селективную трансплантацию островковых и ацинарных клеток, что позволяет существенно улучшить качество жизни больных после панкреатэктомии по поводу ранних стадий негенерализованного рака ПЖ.

При раке поджелудочной железы выполняют радикальные (направленные на удаление опухоли) и паллиативные (для уменьшения симптомов и увеличения продолжительности жизни) операции. В зависимости от размеров, расположения и других характеристик злокачественной опухоли, может быть выполнен один из следующих видов хирургических вмешательств:
- дистальная комбинированная резекция поджелудочной железы;
- стандартная панкреатодуоденальная резекция (операция Уиппла);
- гастропанкреатодуоденальная резекция;
- расширенная панкреатодуоденальная или гастропанкреатодуоденальная резекция;
- панкреатэктомия;
- расширенная тотальная панкреатодуоденэктомия.

Обычно в операционную бригаду входит 4–5 хирургов, вмешательство продолжается 4–5 часов. Прогноз сильно зависит от того, насколько правильно выполнена операция. Важно тщательно придерживаться современных стандартов. Операции при раке поджелудочной железы – не тот случай, когда уместна импровизация и авторские методики.
Всегда ли можно выполнить операцию? Хирургия – единственный метод, который потенциально может избавить от экзокринного рака поджелудочной железы. К сожалению, только у одного из пяти пациентов в принципе возможно хирургическое лечение – у остальных четырех на момент установления диагноза опухоль уже успевает сильно прорасти в окружающие ткани и дать метастазы. Но и у этого одного из пяти рак удается удалить не всегда. Иногда, уже начав операцию, хирург обнаруживает, что резекция невозможна.
Дистальная резекция поджелудочной железы
Поджелудочная железа состоит из трех частей: головки, хвоста и тела. Во время дистальной резекции удаляют часть тела и хвост. Зачастую одновременно удаляют селезенку. Такие операции проводят, как правило, при нейроэндокринных опухолях, которые происходят из клеток, вырабатывающих инсулин и другие гормоны. Экзокринный рак к моменту обнаружения чаще всего прорастает в соседние ткани, дает метастазы, и хирургическое лечение становится невозможным.После удаления селезенки снижаются защитные силы организма, и пациент становится более уязвимым к инфекциям.
Панкреатодуоденальная резекция (операция Уиппла)
Эту операцию традиционно выполняют у большинства пациентов с экзокринным раком поджелудочной железы. Во время вмешательства удаляют головку поджелудочной железы (иногда вместе с телом), желчный пузырь, часть желчного протока и кишки (иногда вместе с частью желудка), близлежащие лимфатические узлы. Затем оставшиеся концы кишки соединяют между собой или с желудком, к кишке подшивают конец желчного протока, поджелудочную железу. Это очень сложная операция. Для того чтобы ее успешно выполнять, хирург должен ежегодно оперировать 15–20 таких пациентов. Но даже в этом случае из-за осложнений операции погибает 5% пациентов. Если хирург не имеет достаточного опыта, смертность составляет 15%.
Операцию Уиппла можно выполнять разными способами:
- Чаще всего делают большой разрез посередине живота.
- В некоторых клиниках практикуют лапароскопические вмешательства через проколы в брюшной стенке. Для этого нужно специальное оборудование, врачи должны обладать соответствующими навыками.
Основные осложнения после панкреатодуоденальной резекции:
- инфекции;
- несостоятельность швов на кишечнике;
- кровотечение;
- нарушение пищеварения, которое требует приема препаратов ферментов поджелудочной железы;
- непроходимость в месте соединения желудка с кишкой;
- нарушение стула;
- снижение веса;
- сахарный диабет (когда удаляют много эндокринной ткани, нарушается выработка инсулина).

Расширенная гастропанкреатодуоденальная резекция
В последнее время отношение врачей к операции Уиппла изменилось не в лучшую сторону. Она недостаточно эффективна, потому что часто остаются микрометастазы в лимфоузлах, которые хирург не удаляет во время вмешательства. В США, Японии и Европе сейчас чаще выполняют другую операцию: расширенную гастропанкреатодуоденальную резекцию. Во время нее удаляют:
- поджелудочную железу;
- часть желудка и тонкой кишки;
- желчный пузырь;
- часть желчных протоков;
- близлежащие лимфатические узлы;
- часть воротной вены и артерии, пораженные раком;
- забрюшинные лимфатические узлы.

Северцев Алексей Николаевич
д.м.н., профессор, врач хирург-онколог
Радикальная панкреатэктомия
Во время такого вмешательства полностью удаляют поджелудочную железу, а также желчный пузырь, часть кишки, желудка, селезенку. К радикальной панкреатэктомии в настоящее время прибегают редко. Иногда ее можно выполнить, если опухоль распространилась по всей поджелудочной железе.
Паллиативные операции
Если рак поджелудочной железы нельзя удалить, возможны некоторые хирургические вмешательства, которые помогают улучшить состояние пациента:
- При нарушении оттока желчи в желчные пути можно установить стент – полый каркас с сетчатой стенкой из металла или пластика. Стентирование может быть выполнено во время чрезкожного чрезпеченочного дренирования или ретроградной холангиопанкреатодуоденографии (РХПГ).
- Билиодигестивный анастомоз – создание сообщения между желчным протоком и кишкой в обход поджелудочной железы.
- Гастроеюноанастомоз – создание сообщения между желудком и тощей кишкой.
Каков прогноз после радикальных операций при раке поджелудочной железы?
Основные цифры при гастропанкреатодуоденальной резекции выглядят следующим образом:
- Во время операции погибает один пациент из ста.
- В течение года остаются в живых 30–70% пациентов.
- Средняя продолжительность жизни после операции – 12–15,5 месяцев.
- Пятилетняя выживаемость (количество пациентов, которые остаются в живых в течение 5 лет) – 3,5–15,7%.
Выполняют ли такие операции в России?
В России проводят радикальные вмешательства при раке поджелудочной железы, но выбор клиник, где есть врачи с соответствующим опытом, весьма невелик. Мы поможем подобрать клинику, в которой вас прооперируют на уровне западных онкологических центров.
При раке поджелудочной железы (РПЖ) операция – один из многих методов, которые применяются в комплексном лечении и существенно повышают вероятность полного выздоровления.
Необходимость оперативного лечения
В большинстве случаев рака поджелудочной железы операция – единственный способ спасти жизнь пациенту при такой патологии. Это связано с тяжестью заболевания, которое объясняется:
- бессимптомностью течения на ранних этапах либо неспецифическими клиническими проявлениями, характерными для патологии многих органов системы пищеварения;
- поздней диагностикой в связи с несвоевременным обращением пациента;
- высокой агрессивностью рака ПЖ – происходит быстрое распространение метастазов в соседние и отдаленные органы.
Хирургическое вмешательство облегчает страдания больного и продляет его жизнь.
Типы операций
Радикальные. Лечение возможно при ограничении опухоли в пределах поджелудочной железы. Согласно статистике, это 10 % от всех случаев с подтвержденным диагнозом злокачественного новообразования. Если рак ПЖ распространяется в соседние и отдаленные лимфатические узлы и органы, хирургическое вмешательство по удалению самого новообразования возможно только в 1–5 %.
Паллиативные. Она необходима для облегчения состояния пациента и не решает полностью проблему с опухолью. поскольку направлена на уменьшение боли и других патологических симптомов. Выполняются паллиативные вмешательства при тяжелых осложнениях далеко зашедшего рака поджелудочной железы.
Помимо перечисленных видов оперативной помощи при раке поджелудочной железы, в течение последних лет разработаны и внедрены в практику новые методики:
- трансплантация ПЖ;
- селективная пересадка клеток островков Лангерганса и ацинусов.
Типы операций на поджелудочной железе при раке
Сегодня используются несколько основных видов радикального хирургического лечения. Выбор той или иной операции определяют особенности клинического случая. В каждой ситуации учитываются:
- стадия рака;
- степень его агрессивности;
- общее состояние здоровья пациента и пр.
Резекция головки по Уипплу
Это классическая операция, которая проводится в случаях, когда опухоль локализована в головке поджелудочной железы или стенке Вирсунгова канала. Названа по имени автора, является основной из всех разработанных видов радикального лечения. Проводится при подозрении на РПЖ, не дожидаясь результатов гистологического и цитологического исследований, подтверждающих диагноз. Это связано с большим количеством ложноотрицательных ответов (более 10 %) даже в тех случаях, когда биопсия берется лапароскопическим методом или забор тканей для гистологического изучения проводится интраоперационно.
В техническом плане операция чрезвычайно сложная, делается под общим наркозом, длится 8–12 часов. Состоит из 2 этапов.
Предварительно для уточнения локализации опухоли и масштаба поражения железы выполняется лапароскопия. В ходе вмешательства удаляются не только головка органа с имеющимся в ней образованием и прилежащий сегмент тела ПЖ, но также близлежащие ткани, которые потенциально могут содержать в себе раковые клетки:
- пилорическая часть желудка и 12-перстной кишки (ДПК);
- желчный пузырь;
- тощая кишка протяженностью 10–12 см;
- лимфатические узлы.
Лимфоузлы, подлежащие резекции при операции Уиппла:
- регионарные;
- забрюшинные;
- локализованные вдоль печеночно-дуоденальной связки.
Следующим этапом является формирование гастроэнтероанастомоза: воссоединяют желудок с тощей кишкой. В тощую кишку выводится холедох. Через него непосредственно в просвет кишки поступают панкреатический секрет и желчь. Они нейтрализуют соляную кислоту желудочного сока. В результате значительно снижается риск развития язвы.
Выключение из процессов пищеварения такого важного органа, как ДПК, приводит к анатомическим и функциональным перестройкам желудочно-кишечного тракта, значительно снижает качество жизни.
При небольших размерах опухолевого образования привратник (пилорическая часть) и антральный отдел желудка сохраняют. Это модифицированная операция Уиппла. В отличие от стандартной панкреатодуоденальной резекции она:
- менее травматична;
- сохраняет функции желудка;
- не нарушает пищеварительных процессов.
Применяется при отсутствии метастазов в тонкую кишку и регионарные лимфатические узлы. Выживают после такой операции пациенты, у которых в ходе гистологического исследования тканей, взятых из краев резекции, отсутствуют атипичные клетки. Отдаленные результаты указывают на полное исчезновение болевого синдрома у 91 % пациентов.
Резекция по Лонгмайр-Траверсо
Является более современным вариантом операции – модифицированная панкреатодуоденальная резекция. Проводится с сохранением всех тканей и частей желудка. Заключается в полном удалении железы. Операция сложная, ее выполнение занимает 4–6 часов.
- быстрое прогрессирование ракового процесса с метастазированием в селезенку;
- диффузный (мультифокальный) рак ПЖ;
- злокачественное поражение головки и тела поджелудочной железы;
- распространение опухоли вдоль всего главного панкреатического протока;
- подозрение на малигнизацию на фоне длительно существующего непрерывно-рецидивирующего хронического панкреатита;
- редкий вид опухоли;
- невозможность технически выполнить безопасное соединение ПЖ с тощей кишкой.
Также такая операция назначается в крайних случаях, когда более щадящее предыдущее вмешательство не остановило процесс или если рак распространился на весь орган. Чрезвычайно редкое применение такой методики обусловлено:
- значительной травматичностью;
- большой интра- и послеоперационной смертностью;
- высокой частотой тяжелых осложнений.
После полной резекции ПЖ развивается сахарный диабет, что приводит к пожизненному лечению инсулином. Пациент также нуждается в постоянной заместительной ферментотерапии, что переносится очень тяжело. Не доказана эффективность в плане повышения выживаемости по сравнению с операцией Уиппла.
Резекция сегмента
При этой операции удаляется только часть поджелудочной железы, которая поражена опухолью. Показания: рак тела и хвоста ПЖ без метастазов. Но злокачественные опухоли ПЖ, как правило, выявляются чаще всего в запущенной стадии, когда радикальную операцию выполнить уже невозможно.
Паллиативные операции
При неоперабельных формах рака ПЖ проводятся паллиативные вмешательства. Они направлены на устранение тяжелых осложнений в организме, вызванных распространением злокачественного образования в соседние и отдаленные органы. Самые известные из них:
- механическая желтуха из-за сдавливания опухолью общего желчного протока;
- стеноз луковицы ДПК с нарушением прохождения пищи из желудка в тонкий кишечник или развитие полной непроходимости 12-перстной кишки;
- перфорация стенки желудка;
- высокое давление разросшейся опухоли на нервные окончания и соседние органы с выраженным болевым синдромом.
Для облегчения состояния больного в случае развития механической желтухи проводятся:
- холецистостомия или холедохоеюностомия на выключенной тощей кишке (по Ру);
- наружная холангиостомия (выполняется под контролем УЗИ или КТ);
- эндопротезирование конечного отдела общего желчного протока.
При непроходимости ДПК проводится гастроэнтеростомия. В результате восстанавливается эвакуация пищи из желудка, пищеварение улучшается. В связи с тяжестью состояния пациента на таких стадиях болезни подобные операции позволяют уменьшить страдания, частично восстановить функции пищеварительной системы, продлить жизнь больному на 7–10 месяцев.
Стентирование
Для устранения непроходимости холедоха, обтурированного проросшей опухолью, устанавливается стент. Это металлическая или пластиковая трубка, которую вводят в просвет общего желчного протока. Таким образом восстанавливается поступление желчи в просвет луковицы ДПК. Хирургическое лечение проводится двумя способами:
- при помощи эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ);
- чрескожным методом – стент вводится в суженный проток через разрез. В последнем случае желчь стекает в специальную сумку, расположенную снаружи. Каждые 3 месяца проводится замена трубки.
Шунтирование
С помощью хирургического вмешательства восстанавливается проходимость желчного протока. Выбор операции зависит от уровня поражения. Возможны 3 варианта.
- Холедохоеюностомия – холедох выводится в полость тонкого кишечника. Процедура выполняется лапароскопически, безопасна.
- Гепатикоеюностомия – вывод общего печеночного желчного протока в тощую кишку. Это менее травматичный и опасный способ.
- Гастроэнтеростомия – воссоединение желудка с тонкой кишкой. Это исключает проведение повторной операции при прогрессировании онкологического заболевания, когда остается риск развития непроходимости ДПК.
Осложнения оперативного лечения
Успех любого хирургического вмешательства зависит от многих факторов. При раке поджелудочной железы важную роль играют тяжесть состояния больного, распространенность опухоли, ее стадия, иммунитет человека. После полостной операции на поджелудочной железе с полной или частичной резекцией органа в 30–50 % случаев развивается ряд осложнений, которые в дальнейшем требуют медикаментозной коррекции или повторного хирургического вмешательства.
Болевой синдром. Связан с травмированием тканей в процессе операции. Интенсивность и продолжительность боли зависит от болевого порога и скорости восстановления организма.
Инфицирование внутренних органов с последующим их воспалением обусловлено наличием дренажей. Их устанавливают для ускорения процессов заживления.
Кровотечение разной степени тяжести. Связано с неизолированным сосудом или нарушением свертываемости крови после операции. Наличие следов крови или незначительное ее количество в отделяемом из дренажа является нормой. Если кровопотеря большая, проводится эмболизация поврежденного сосуда или хирургическое вмешательство – в исключительных случаях.
Утечка анастомоза. Подтекание желчи, панкреатического или желудочного сока в месте проведения оперативного вмешательства. Это происходит в случаях плохого заживления раны. Агрессивная соляная кислота повреждает ткани, ферменты поджелудочной железы подвергают их перевариванию, желчные кислоты раздражают и разрушают близлежащие ткани. В таких случаях проводится медикаментозная коррекция. Назначается курс лекарственной терапии, в первую очередь препараты, блокирующие выработку панкреатических ферментов (октреотид) и соляной кислоты (группа ИПП, блокаторы Н2-гистаминовых рецепторов).
Утечка лимфатической жидкости. Редкое осложнение. В ее составе – лимфа и эмульгированные жиры. Пациента переводят на парентеральное специальное питание либо ограничивают количество жиров в рационе.
Сахарный диабет. Требуется инсулинотерапия или назначение сахароснижающих препаратов.
Задержка опорожнения желудка. Результат повреждения нерва в процессе проведения операции. Развивается частичный парез желудка, который проходит через 1–3 месяца. Проявляется тошнотой, рвотой после еды. В отдельных случаях прибегают к зондовому кормлению. Такое осложнение чаще всего наблюдается после модифицированной операции Уиппла.
Демпинг-синдром. Результат быстрого прохождения непереваренной пищи из желудка в тонкий кишечник. Часто развивается после операции Уиппла в стандартном исполнении. Проявляется тяжелыми для больного симптомами: выраженной потливостью после еды, спазмами в животе, метеоризмом, жидким стулом. Выбор лечения зависит от тяжести состояния: проводятся коррекция питания, медикаментозное или хирургическое лечение.
Послеоперационный период
После операции пациенту необходимо провести в отделении 10–14 дней, если не возникнет осложнений, требующих продолжения стационарного лечения. На протяжении этого времени применяются:
- парентеральное питание;
- обезболивание (медикаментозное или при необходимости – эпидуральная анестезия);
- инсулинотерапия;
- подбор адекватной дозы ферментов.
Если в процессе операции была проведена частичная резекция ПЖ, оставшаяся часть органа продолжает вырабатывать ферменты и гормоны (инсулин). Во время пребывания в стационаре индивидуально подбираются эти препараты каждому пациенту, проводится обучение правильного их введения и использования. Через определенное время функции поджелудочной железы восстанавливаются, препараты частично или полностью отменяются. При полном удалении ПЖ пациент переводится на инсулинотерапию и прием ферментов, которые необходимо принимать всю жизнь.
Выбор клиники

- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
В последние десятилетия отмечается рост пациентов со злокачественными опухолями органов гепатопанкреатодуоденальной зоны. При этом частота диагностики рака этих органов на ранних стадиях практически не повысилась. В основном пациенты продолжают поступать в стационары только при развитии осложнений, наиболее частым из которых является механическая желтуха. Рак головки поджелудочной железы находится на втором месте среди причин подпеченочной желтухи (30–35%), уступая лишь холедохолитиазу (35–40%), третье место занимает рак внепеченочных желчных протоков (10–12%), затем — рак большого сосочка двенадцатиперстной кишки (1–2%).

При этом, по данным литературы, только в 10–20% случаев при выявлении рака поджелудочной железы пациентам выполняется радикальная операция, несмотря на которую большинство умирает в первый год после вмешательства. К сожалению, большая часть больных по разным причинам не может рассчитывать на радикальное лечение. Лечение больных этой категории осложняется наличием обтурации желчных путей, холангита, а в большинстве случаев и печеночной недостаточности. Общепризнано, что оперативное вмешательство, выполненное при нарастающей механической желтухе, является чрезвычайно рискованным и сопровождается высокой летальностью, достигающей 20-60%, что наряду с возрастающей частотой опухолевого поражения поджелудочной железы, несомненно, обусловливает актуальность данной проблемы.
Антеградные методы декомпрессии желчевыводящей системы, реализуемые в виде чрескожно-чреспеченочной холангиостомии, продленного наружно-внутреннего дренирования, антеградного эндобилиарного стентирования, могут служить альтернативой эндоскопическим методам при их неэффективности или невозможности выполнения. При этом чрескожные миниинвазивные вмешательства позволяют либо успешно подготовить пациентов к основному этапу операции, в случае возможного выполнения радикального хирургического лечения, либо могут стать окончательным вмешательством, являясь примером паллиативного лечения. Целью нашего исследования явилась оценка эффективности паллиативного лечения с применением антеградных миниинвазивных технологий при раке поджелудочной железы.
Материалы и методы
За период с января 2010 по декабрь 2016 года в хирургическом отделении Орловской областной клинической больницы под наблюдением находилось 160 больных со злокачественным поражением поджелудочной железы, осложненным синдромом механической желтухи. В связи с чем все пациенты были госпитализированы в экстренном порядке. Больные доставлялись в стационар скорой медицинской помощью, направлялись другими лечебно-профилактическими учреждениями города и области, а также обращались самостоятельно. Женщин в исследуемой группе было 76 (47,5%), мужчин — 84 (52,5%). Возраст больных колебался от 48 до 76 лет. Проводилось комплексное обследование больных, включающее исследование клинико-лабораторных данных (общий и биохимический анализ крови, общий анализ мочи, коагулограмма и др.), выполнялось ультразвуковое исследование брюшной полости, гастродуоденоскопия, по показаниям эндоскопическая ретроградная холангиопанкреатография и мультиспиральная компьютерная томография, а также ряд других инструментальных исследований в зависимости от сопутствующей патологии.
У всех пациентов, находящихся под нашим наблюдением, при ультразвуковом исследовании были выявлены признаки актуальной желчной гипертензии, что наряду с невозможностью выполнения по различным причинам ретроградного эндоскопического дренирования явилось основанием для антеградного дренирования желчных путей под сонофлюороскопическим контролем по срочным показаниям (1-2 сутки от момента поступления в стационар). При этом во всех случаях антеградные миниинвазивные вмешательства несли не только лечебную, но и диагностическую нагрузку. Так как выполняемая интраоперационная антеградная холангиография позволяла уточнить уровень и степень блока. Адекватность выполненного чрескожного чреспеченочного дренирования оценивалась по изменению интенсивности желтухи, по суточному дебиту желчи, степени снижения гипербилирубинемии в биохимическом анализе крови, а также по устранению признаков билиарной гипертензии при динамическом ультразвуковом исследовании. После снижения уровня билирубина крови, дообследования и стабилизации состояния пациентов решался вопрос о переводе наружной холангиостомы в наружно-внутреннюю или об антеградном эндобилиарном стентировании.
Результаты исследования
Чувствительность, специфичность и диагностическая точность холангиографии во время постановки холангиостомы при раке поджелудочной железы составила соответственно 91,2%, 80,1% и 85,3%. Всего в группе пациентов со злокачественным поражением поджелудочной железы выполнено 204 минимально инвазивных вмешательств. Распределение характера вмешательств было следующим: наружная холангиостомия — 62,7% (128); антеградное эндобилиарное стентирование — 25% (51); наружно-внутреннее дренирование протоков — 10,3% (21); чрескожно-чреспеченочная микрохолецистостомия — 2% (4).
Учитывая, что у 51 пациента (32%) в исследуемой группе при проведении клинико-инструментальных и морфологических исследований был подтвержден неоперабельный характер поражения поджелудочной железы, выполнение радикального оперативного лечения не представлялось возможным. В связи с этим окончательным видом хирургического лечения, направленным на улучшение качества жизни, у данных больных, явилось антеградное стентирование внепеченочных желчных протоков.
В каждом исследуемом случае стентирование выполнялось вторым этапом после предварительной чрескожно-чреспеченочной холангиостомии или наружно-внутреннего дренирования. Техника стентирования заключалась в проведении металлического проводника через опухолевую структуру за зону большого сосочка двенадцатиперстной кишки под сонофлюороскопическим контролем, по которому в последующем производилась транспапиллярная установка стента. После выполненного стентирования в обязательном порядке производили постановку страховочной наружной холангиостомы, которая позволяла выполнять динамическую антеградную холангиографию для контроля процесса раскрытия стента и адекватности его функционирования в раннем послеоперационном периоде.
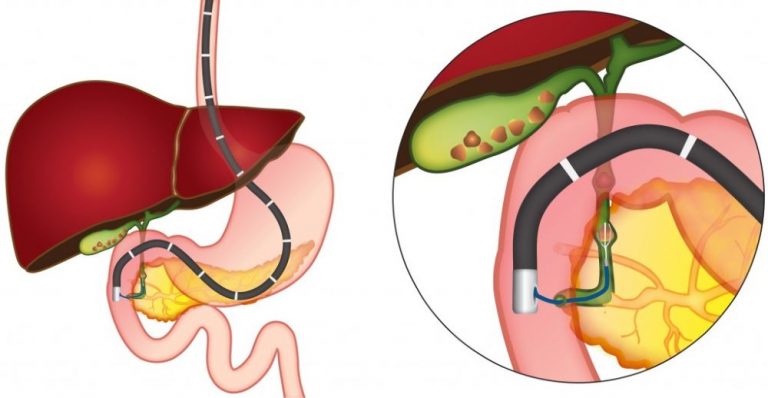
Выбор стента по диаметру раскрытия, длине и типу покрытия осуществлялся индивидуально в каждом конкретном случае в зависимости от протяженности зоны поражения. Использование покрытого стента при неоперабельном раке поджелудочной железы имеет ряд преимуществ, так как позволяет предотвратить возможное прорастание опухолевой или грануляционной тканью ячеистой стенки стента, тем самым вызывая обтурацию его просвета. Однако учитывая транспапиллярное положение устанавливаемого стента, применение покрытых форм было ограничено у пациентов с сохраненной проходимостью и функцией панкреатического протока.
Использование в подобных случаях покрытых форм стента значительно повышало риск перекрытия устья панкреатического протока. Как правило, в большинстве случаев сразу же после установки нитинолового саморасправляющегося стента под рентгенологическим контролем отмечали поступление контрастного препарата в просвет двенадцатиперстной кишки. Однако при этом рентгенологически сохранялась зона сужения в пораженном участке билиарного тракта. Полное раскрытие стента, сопровождавшееся свободным поступлением контрастного вещества в просвет двенадцатиперстной кишки, определялось в течение 24-48 часов с момента его установки. Восстановление пассажа подтверждалось контрольной антеградной холангиографией.
Обсуждение результатов
Осложнения после проведенных миниинвазивных вмешательств возникли в 26 случаях, и были связаны у 12 пациентов (7,5%) с дислокацией холангиостомического дренажа; в 4 случаях (2,5%) с развившимся острым холециститом; в 2 случаях (1,2%)с развившимся острым панкреатитом; у 5 пациентов с гидротораксом (3,1%). В отдаленные сроки после стентирования у 3 (1,9%) больных развился рецидив механической желтухи, обусловленный нарушением функции эндобилиарного стента.
В 2 наблюдениях через 4-5 мес. с момента постановки непокрытого стента произошла обтурация его внутреннего просвета за счет прорастания опухолевыми тканями ячеистой стенки.
Среди осложнений, развившихся после проведения антеградного эндобилиарного стентирования в ранний послеоперационный период, были зафиксированы острый холецистит (4 пациента) и острый панкреатит (2 пациента). В 3 случаях после установки непокрытого стента и в 1 после установки покрытого у пациентов отмечены клинико-эхографические признаки острого холецистита. У одного больного выполнена лапароскопическая холецистэктомия, у трех других произведена постановка чрескожно-чреспеченочной микрохолецистостомии под контролем УЗИ, на фоне которой клинические проявления острого холецистита удалось полностью купировать. Клиническая картина острого панкреатита, развившаяся в течение 24-48 часов после выполненного стентирования у двух пациентов, полностью купировалась на фоне проведенной консервативной терапии.
Выводы
У пациентов с неоперабельным раком поджелудочной железы выполнение антеградного эндобилиарного стентирования представляет собой окончательный вариант хирургического лечения, позволяющий при минимальном объеме вмешательства обеспечить адекватный дренирующий эффект желчевыводящих путей. Кроме того, отсутствие наружных дренажей улучшает качество жизни пациента, его психологическое состояние, позволяет активизировать его в более ранние сроки, избавляет от необходимости приема желчи внутрь.
Литература:
- Альянов А.Л., Мамошин А.В., Борсуков А.В., Мурадян В.Ф. Эффективность применения минимально инвазивных технологий в лечении больных с синдромом механической желтухи // Ученые записки Орловского государственного университета. Серия: Естественные, технические и медицинские науки. 2015. № 4. С. 280-284.
- Гальперин Э.И., Ветшев П.С. Руководство по хирургии желчных путей. М.: Издательский дом Видар-М, 2006.
- Данилов М.В., Фёдоров В.Д. Повторные и реконструктивные операции при заболеваниях поджелудочной железы.М.: Медицина, 2003.
- Долгушин Б.И., Авалиани М.В., Буйденок Ю.В. и др.Эндобилиарная интервенционная онкорадиология.М.: ООО "Медицинское информационное агентство«.2004. — 224 с.
- Затевахин И.И., Цициашвили М.Ш., Дзарасова Г.Ж. и др.Возможности доплеровской сонографии в оценке функционального состояния печени при механической желтухе // Анн. хирург. гепатолог. 2001. Т. № 1. С. 113-124.
- Ившин В.Г., Якунин А.Ю., Лукичев О.Д. Чрескожные диагностические и желчеотводящие вмешательства у больных механической желтухой. Тула, 2000. — 312 с.
- Израилов Р.Е. Миниинвазивные технологии в лечении больных с опухолями органов билиопанкреатодуоденальной зоны: автореф. дис. докт. мед. наук / Р.Е. Израилов.Москва, 2011. — 47 с.
- Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М., 2003.
- Охотников О.И., Яковлева М.В., Григорьев С.Н., Пахомов В.И. Антеградные эндобилиарные вмешательства в лечении осложненной желчнокаменной болезни // Анн.хирург. гепатолог. 2013. Т. 18. № 1. С. 29-37.
- Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. М.: Медицина, 2007.
- Costamagna G., Pandolfi M. Endoscopic stenting for biliary and Pancreatic malignancies. J ClinGastroenterol 2004; 38: 59–67.
- Hans-Joachim Wagner. With or Against the Bile Flow?Radiology. 2002; 225: 7-9.
- Katsinelos P., Paikos D., Kountouras J. et al. Tannenbaum and metal stents in the palliative treatment of malignant distal bileduct obstruction: a comparative study of patency and cost effectiveness. SurgEndosc 2006; 20: 1587–1593.
- May A., Ell C. A New Self-Expanding Nitinol Stent for Palliation of Malignant Biliary obstruction. Endoscopy 2004; 36: 329–333.
- Mehmet M.D., Aksungur E., Seydaolu G. Percutaneousplacement of biliary metallic stents in patients with malignanthilar obstruction, unilobar versus bilobar drainage. Journal ofVascular and Interventional Radiology. 2003; 14: 1409-1416.
- Yushidome H., Miyazaki M., Shimizu H. et al. Obstructivejaundice impairs hepatic sinusoidal endothelial cell functionand renders liver susceptible to hepatic ischemia/ reperfusion //J. Hepatology. 2000. V.33 (1). P.59-67.
Читайте также:





