Пациенты с хроническим миелолейкозом

Что такое хронический миелолейкоз?

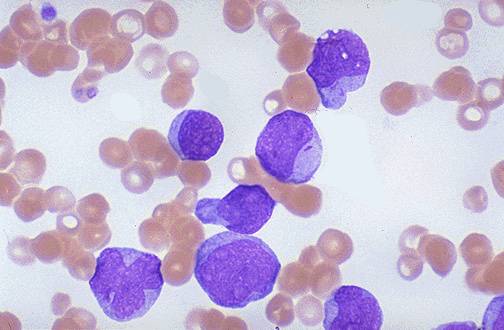
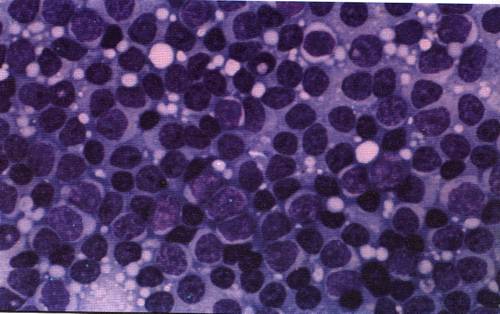
Мазок крови пациента с хроническим миелолейкозом
Хронический миелолейкоз (ХМЛ) — злокачественное новообразование кроветворной ткани, сопровождающееся прогрессирующей пролиферацией незрелых гранулоцитов. Заболевание изначально обладает вялотекущим характером, постепенно перетекая в стадию обострения с выраженной симптоматикой и образованием системных нарушений. Является одной из самых опасных и инвалидизирующих болезней.
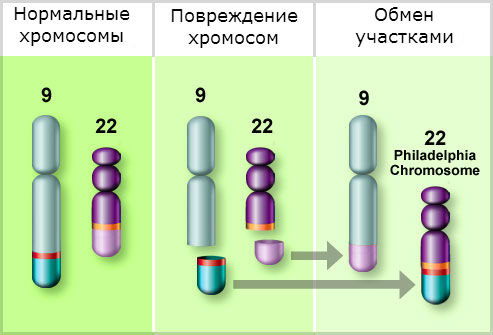
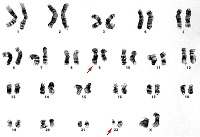
ХМЛ — первое онкологическое заболевание, у которого определена связь между развитием канцерогенеза и мутацией в гене. Характерная аномалия основана на транслокации 9-й и 22-й хромосом, то есть участки данных хромосом меняются местами, образуя аберрантную хромосому. Выявлена мутировавшая хромосома исследователями из Филадельфии, поэтому она получила название филадельфийская или Ph-хромосома.
Причины развития

Негативное воздействие на кроветворение оказывают ядохимикаты
Заболевание известно науке с 1811 года, но до сих пор факторы, провоцирующие мутацию в гене, определить не удалось. Существует ряд причин, способствующих развитию патологии:
- радиоактивное облучение, в том числе при лучевой терапии;
- химиотерапия иных онкологических заболеваний;
- ряд генетических заболеваний, характеризующихся хромосомной аномалией (например, синдром Дауна);
- взаимодействие с химическими соединениями (нефтепродукты, пестициды).
Патогенез хронического миелолейкоза

Патогенез хронического миелолейкоза
Гибридный ген BCR-ABL 1, образованный в результате транслокации хромосом, продуцирует синтез белка BCR-ABL. Данный белок представляет собой тирозинкиназу, которая в норме способствует передаче сигнальных импульсов для роста клетки. Созданная путём мутации тирозинкиназа становится активным фактором пролиферации клеток, они начинают делиться и распространяться уже независимо от факторов роста. Происходит процесс создания клонов мутировавшей клетки.
Бесконтрольное деление сопровождается нарушением апоптоза — запрограммированной гибели клеток. Также гибридная тирозинкиназа подавляет естественные функции восстановления в молекулах ДНК, создавая предпосылки для последующих мутаций, что усугубляет патологический процесс.
Размножающиеся клетки являются незрелыми, бластными предшественниками полноценных элементов крови. Постепенно бластные клетки вытесняют функциональные эритроциты, тромбоциты и лейкоциты. Добавляются нарушения и в других хромосомах, что запускает ускоренный процесс разрушения организма в целом.
Стадии хронического миелолейкоза

Бластный криз — одна из стадий миелолейкоза
- Хроническая — 30% бластных клеток. Стадия характеризуется агрессивным характером мутировавших клеток, состояние пациента резко ухудшается. Дополнительные аномалии как в гене BCR-ABL, так и в геноме в целом, провоцируют цепь патологических реакций, которые уже практически не поддаются лечению. На этом этапе могут поражаться ткани внутренних органов, кожные покровы и слизистые оболочки, миелоидные клетки преобразовываются в саркому.
Симптомы и признаки

Признаки ХМЛ становятся заметны ближе к прогрессирующей стадии.
- Симптомы опухолевой интоксикации: снижение массы тела, быстрая утомляемость, волнообразное повышение температуры, кожный зуд, тошнота, суставные боли.
- Симптомы опухолевой пролиферации — увеличение селезёнки и печени, боль в левом подреберье, поражение кожных покровов.
- Анемический синдром — головокружение, выраженная бледность, учащённое сердцебиение, чувство нехватки воздуха.
- Геморрагический синдром — склонность к кровоточивости слизистых оболочек, сыпь в виде красных точек, длительное кровотечение при незначительных порезах.
Диагностика заболевания

Один из методов диагностики заболевания — рентгенологический
Диагностика ХМЛ включает:
- Первичный осмотр пациента с изучением анамнеза, жалоб, а также исследование при помощи пальпации размеров селезёнки и печени.
- Общий анализ крови выявляет число и характеристики форменных элементов крови.
- Биохимический анализ проводится для определения уровня билирубина, электролитов, глюкозы, ЛДГ, АСТ, АЛТ.
- Гистологическое исследование костного мозга определяет скопления бластных клеток.
- Цитогенетический анализ выявляет транслокацию хромосом.
- На 3-й стадии проводится иммунофенотипирование для идентификации бластных клеток.
- Метод генного секвенирования применяется для выявления генных мутаций.
- Проводится УЗИ внутренних органов, в первую очередь селезёнки и печени.
- Дополнительно назначают рентгенографию органов грудной клетки, ЭКГ, эхокардиографию, ИФА на маркеры различных заболеваний, коагулограмму и другие исследования.
Лечение

Основа лечения — ингибиторы тирозинкиназы
Выбор препарата и доза определяются в зависимости от стадии ХМЛ и риска побочных эффектов. Обычно лечение начинается с приёма иматиниба в дозировке 400 мг/день при начальной стадии, 600 мг/день при последующих стадиях, затем дозу могут увеличивать или снижать. Различные аберрации в генах обусловливают низкую чувствительность к препаратам, поэтому пациенту могут менять одни ингибиторы на другие.

Трансплантация костного мозга
Если терапия не оказывает действия, рекомендуется аллогенная трансплантация костного мозга. Новые стволовые клетки могут выработать здоровые элементы кровеносной системы. Но операция сопряжена с рядом высоких рисков.
Терапия препаратами интерферона назначается обычно в 1-й стадии ХМЛ, так как не обладает эффективностью при последующих.
Для уменьшения массы опухоли и при отсутствии результата в лечении ингибиторами проводится химиотерапия. В стадии бластного криза используется полихимиотерапия аналогично лечению острого лейкоза.
Лучевая терапия может быть назначена в случае выраженной спленомегалии. При риске разрыва селезёнки проводят спленэктомию.
Профилактика и прогноз

Прогноз заболевания определяет врач
Причина образования ХМЛ не установлена, поэтому профилактикой являются меры по избеганию контактов с канцерогенными веществами, воздействия радиоактивного облучения.
Прогноз определяется стадией и тяжестью болезни. Одна из прогностических моделей (Kantarjian H.M.) включает факторы:
- преклонный возраст пациента при постановке диагноза;
- концентрация бластных клеток в крови ≥ 3%, в костном мозге ≥ 5%;
- концентрация базофилов ≥ 7%;
- концентрация тромбоцитов ≥ 700*10 9/л;
- выраженная спленомегалия.

Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10

- Причины
- Патогенез
- Симптомы хронического миелолейкоза
- Диагностика
- Лечение хронического миелолейкоза
- Прогноз
- Цены на лечение
Общие сведения
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.

Причины
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
- При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния.
- Во второй фазе хронического миелолейкоза – фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения.
- Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100x10 9 /л, тромбоцитопению менее 150x10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.

Наш эксперт – заведующая научно-консультативным отделением химиотерапии миелопролиферативных заболеваний Гематологического научного центра Минздрава России Анна Туркина.

Всех посчитали
Среди злокачественных болезней крови это третье по частоте встречаемости заболевание, оно составляет около 20% лейкозов. Болеют им взрослые. Недуг поражает преимущественно людей активного, трудоспособного возраста – от 30 до 50 лет. В России средний возраст заболевших – 50 лет, в Германии, Швеции, Италии – 62 года.
Ещё не так давно хронический миелолейкоз считался неизлечимым, выживаемость больных редко превышала 5 лет. Сегодня же прогноз более оптимистичен, но зависит от стадии, на которой было обнаружено заболевание.

Кому это надо?
Для чего нужен такой документ? Не только и не столько для формальной медицинской статистики, сколько для врачей и их пациентов. Систематизированные данные, как показывает опыт других стран, помогают стандартизировать лечение таких тяжёлых заболеваний, как лейкозы, по всей стране и сделать так, чтобы лекарства, спасающие жизнь, доходили до каждого пациента своевременно. По мнению экспертов, врачи смогут отслеживать эффективность, безопасность и результаты лечения в условиях реальной клинической практики и в случае необходимости (когда развивается устойчивость к тем или иным лекарствам) быстро менять один препарат на другой.
Государственной системе здравоохранения регистр позволит совершенствовать льготное лекарственное обеспечение пациентов с хроническим миелолейкозом (лечение которого, как и большинства онкогематологических заболеваний, очень дорогостоящее).
К счастью, сегодня этих больных лечат за счёт средств федерального и региональных бюджетов.

Как распознать миелолейкоз?
Статистика свидетельствует, что 85% пациентов к моменту постановки диагноза находятся в хронической фазе. В том-то и проблема, решить которую можно банальной ежегодной диспансеризацией.

Развитие лейкоза, к сожалению, медицина предотвратить пока не может, но диспансеризация – это лучшая профилактика. У людей, которые ежегодно её проходят, заболевание выявляют достаточно рано.
Окончательный диагноз ставится на основании результатов генетического молекулярного исследования, для которого проводится биопсия костного мозга.
Врач-онкогематолог Михаил Фоминых про хронический миелоидный лейкоз

Михаил Фоминых — научный сотрудник Российского НИИ гематологии и трансфузиологии, Санкт-Петербург. Практикующий онкогематолог, который посвятил свою научную деятельность хроническому миелолейкозу, и в 2016 году защитил на эту тему диссертацию. В ходе дискуссии он раскрыл основные симптомы ХМЛ, рассказал про зоны риска и ограничения, а также объяснил, можно ли родить здорового ребенка с таким диагнозом.
Зачастую самого человека ничего особо не беспокоит. Очень часто пациент попадает к нам от другого специалиста: терапевта или хирурга. Люди сдают плановые анализы и выясняется, что у них повышенное количество белых кровяных телец. Обнаружив повышенные лейкоциты, терапевт или хирург направляет пациента к гематологу.
Если говорить о симптоматике, то это может быть повышенная усталость, потливость, немотивированные подъемы температуры тела до 38 без явных признаков инфекции, тяжесть в левом подреберье за счет того, что селезенка увеличивается в размере. Если следить за здоровьем и каждый год сдавать анализы, то хронический миелоидный лейкоз можно выявить на ранней стадии. На сегодняшний день 95% случаев ХМЛ диагностируется в хронической фазе и только 5% - в запущенных, продвинутых. Это фазы акселерации и бластного криза, когда начинают проявляться симптомы опухолевой интоксикации.
Самый яркий симптом ранней стадии ХМЛ - немотивированная потеря массы тела в течение полугода. Если вы не сидите на диете и не работаете над снижением веса, но теряете килограммы, а помимо этого наблюдается повышенная потливость и температура выше 38 - это повод насторожиться и пойти сдать анализы.
ХМЛ в "продвинутой" стадии проявляется слабостью и повышенной утомляемостью вследствие анемии, может появляться повышенная кровоточивость из десен или из носа, появление синяков. В принципе, эти симптомы характерны для всех гематологических болезней, которые связаны с поражением костного мозга.
На сегодняшний день норма лейкоцитов составляет от 4 до 9 на десять в девятой степени в литре. Но нужно понимать, что эти цифры зависят от многих факторов: перенесенная инфекция, операция. Только по количеству лейкоцитов никто не скажет, что у вас лейкоз - в любом случае необходимо будет провести дополнительное обследование. Если повышенный лейкоцитоз 10-11 проявляется однократно - это еще не повод бежать к гематологу, так как это может быть вполне нормальная реакция организма на перенесенную вирусную или бактериальную инфекцию. Но если в течение трех месяцев наблюдается лейкоцитоз выше 15, то это повод обратиться к гематологу. Мы рекомендуем наблюдать за показателями крови и сдавать анализы хотя бы раз в год, чтобы вовремя выявить сбой и начать лечение, если оно необходимо.
Наследственность здесь не играет абсолютно никакой роли. Если у родителей был ХМЛ, то далеко не факт, что он будет у детей: наследственная теория пока не нашла подтверждения. То же самое касается всех остальных существующих теорий: вирусной, бактериальной.
Не так давно произошла ужасная история, когда больных лейкозом детей выселяли из квартир, потому что жители дома считали, будто рак может передаваться воздушно-капельным путем. Это, разумеется, не так: онкологические заболевания не передаются таким способом. Если бы онкологические болезни передавались воздушно-капельным путем, то я и другие врачи-онкологи уже, наверное, поумирали бы: своего первого онкологического пациента я увидел на третьем курсе, за 15 лет практики я повидал их тысячи и пока, к счастью, жив, здоров и не имею никакого онкологического диагноза.
После получения ионизирующего излучения риск действительно повышается: после Чернобыля, Хиросимы и Нагасаки отмечался всплеск развития острых лейкозов. Это подтвержденный факт, но наследственность на возникновение лейкозов никаким образом не влияет. Другие теории пока тоже не нашли подтверждения. Врачи, к сожалению, пока не выявили причину.
Да, это именно так. Я сейчас сижу перед вами, а вы сидите за своими гаджетами, и внутри каждого организма прямо в это время происходит энное количество мутаций. Это случается, пока мы спим, едим, идем по улице. Пока наша иммунная система справляется с возникающими мутациями, все хорошо. Когда возникает сбой и система перестает справляться, начинает развиваться опухолевый процесс. В случае с гематологическими болезнями, для этого достаточно мутации одной клетки. И это действительно, как кирпич на голову. Хронический лейкоз возникает спонтанно, мы не можем его спрогнозировать.
В первой линии терапии назначается Иматиниб. Если до 1999-го года после постановки диагноза пациенты проживали 3-4 года, то сегодня можно говорить о 20-летней выживаемости. Пациенты с ХМЛ продолжают жить полноценной спокойной жизнью и умирают также, как их сверстники от сердечно-сосудистых заболеваний, сахарного диабета и так далее. Лечение Иматинибом происходит амбулаторно. Пациент получает препарат в аптеке, принимает дома и живет, в общем, как совершенно обычный человек. Помимо Иматиниба, существуют препараты второго и третьего поколения. И даже уже четвертого, они пока проходят клинические исследования.
При лечении новыми препаратами, которые проходят клинические исследования, необходимо применять контрацептивы, потому что мы пока не знаем, как эти новые лекарства могут повлиять на плод. В случае с уже хорошо известными, необходимо принимать решение совместно с лечащим врачом, гематологом и гинекологом, ведущим беременность. Например, у Екатерины Юрьевны Челышевой, которая работает в НМИЦ гематологии, огромный опыт и большой регистр пациенток с хроническим миелолейкозом, которые забеременели и родили здоровых детишек. Если ситуация позволяет безопасно отменить терапию на время зачатия и хотя бы первый триместр, необходим ежемесячный мониторинг. Если мы видим, что молекулярный ответ потерян, то по жизненно важным показаниям терапию придется вернуть.
Полная отмена происходит, к сожалению, не так быстро, как нам хотелось бы. В случае с ингибиторами тирозинкиназы первого поколения – чуть дольше. Со вторым поколением – чуть раньше: примерно от трех до пяти лет постоянного приема. Достигаем молекулярного ответа, отменяем терапию, и там - пожалуйста. Снимаем ограничения в плане беременности и вообще, в принципе, большинство ограничений. Это обычный выздоровевший человек, излеченный от онкологического заболевания. Беременеть – можно. Единственное, что требуется - постоянный мониторинг со стороны именно гематолога.
Лечение препаратами второго и последующих поколений позволяют сохранить репродуктивные функции, хотя раньше это казалось нонсенсом. Сейчас даже в рекомендациях по лечению онкологических заболеваний рекомендовано обсудить с пациентами их репродуктивные планы, и только после этого назначать препарат. Сегодня существуют препараты, которые не так сильно влияют на фертильность, и у женщины остается возможность забеременеть и выносить здорового ребенка. Сейчас сохранение репродуктивных функций является нормой и одной из целей при лечении больных с ХМЛ. Это ли не счастье?
Я так радужно говорю о том, что все победили, все выиграли, но чтобы этого добиться, необходимо тесное сотрудничество между лечащим врачом и самим пациентом. Какие-либо изменения в жизни необходимо обсуждать с лечащим врачом, нельзя принимать решения самостоятельно - только после консультации с лечащим врачом.
Единственное строгое ограничение, которое действительно существует, - это употребление грейпфрутового сока. Это категорически запрещено. Если упростить, грейпфрутовой сок влияет на усваиваемость препаратов с ингибиторами тирозинкиназы, и они становятся неэффективными: то есть, ты принимаешь лекарство, а оно не действует так, как должно. Также существует ряд препаратов, которые могут усиливать эффект препаратов или снижать его, поэтому перед началом лечения у гематолога необходимо сообщить о всех лекарствах, которые вы принимаете постоянно. Если длительность приема препаратов не превышает неделю, то это ни на что не влияет, но если терапию назначают на постоянной основе, то может возникнуть конфликт. Особенно это касается гипотензивных препаратов для нормализации давления.
Если говорить о спорте, то можно постепенно возвращаться к нему после того, как всё - размеры селезенки, анализ крови, общее самочувствие - нормализуется. Умеренные физические нагрузки - это пожалуйста. Наши коллеги из США недавно провели исследования, которые доказали, что занятия йогой, дыхательные упражнения, цигун позитивно сказываются на качестве жизни пациентов с миелопролиферативными заболеваниями.
Этот вопрос до конца неясен. Раньше каждый онкологический диагноз ставил крест на любой физиотерапии, любом санаторно-курортном лечении. Сейчас единственное, что я запрещаю всем, и не только своим пациентам, но и здоровым здоровым людям – избегать повышенного излучения солнечных лучей. В море купайтесь, сколько влезет, но от солнца следует закрываться. И мы сейчас говорим не только о тех, кто находится в ремиссии, но и о тех, кто находится на лечении, принимает медикаменты. Если чувствуете себя хорошо, анализ крови нормальный, то море - пожалуйста. Но вот активного солнца следует избегать - это пагубно сказывается на всех без исключения. Повышенное воздействие солнечных лучей, ультрафиолета повышает риск развития меланомы. Это доказано.
Хронический миелолейкоз - это заболевание, с которым можно жить, и мы этому учим. Существуют школы для диабетиков, школы для больных с артериальной гипертензией, а мы теперь проводим школы для больных с хроническим миелолейкозом: читаем лекции, консультируем больных, образовываем, чтобы они знали про болезнь больше, чем мы. При ХМЛ необходимо мониторить свое состояние и раз в полгода сдавать контрольные анализы. Сейчас проводятся общемировые исследования по поводу возможности полной отмены терапии. Примерно половине пациентов терапию отменяют. В другой половине случаев в течение первого полугода, к сожалению, приходится вернуться к терапии, потому что возникает рецидив. Все очень индивидуально.
Хронический миелолейкоз - опухолевое заболевание крови. Характеризуется бесконтрольным ростом и размножением всех ростковых клеток крови, при этом молодые злокачественные клетки способны созревать до зрелых форм.
Во время хронического миелолейкоза в крови повышается содержание особой разновидности лейкоцитов – гранулоцитов. Они образуются в красном костном мозге в огромном количестве и выходят в кровь, не успевая до конца созреть. Одновременно содержание всех остальных видов лейкоцитов снижается.
Причины хронического миелолейкоза
Причины хромосомного нарушения, приводящего к хроническому миелолейкозу, до сих пор изучены недостаточно.
Считается, что имеют значение следующие факторы:
![]()
Слабые дозы радиации. Их роль доказана только у 5% больных.- Электромагнитные излучения, вирусы и некоторые химические вещества – их влияние не доказано окончательно.
- Применение некоторых лекарственных препаратов. Известны случаи возникновения хронического миелолейкоза при лечении цитостатиками (противоопухолевые препараты) в сочетании с лучевой терапией.
- Наследственные причины. Люди с хромосомными нарушениями (синдром Клайнфелтера, синдром Дауна) имеют повышенный риск хронического миелоидного лейкоза.
- Клетки размножаются неконтролируемо, как раковые.
- Для этих клеток перестают работать естественные механизмы гибели.
Фазы хронического миелолейкоза
- Хроническая фаза. В этой фазе находится большинство пациентов, которые обращаются к врачу (около 85%). Средняя продолжительность – 3 – 4 года (зависит от того, насколько своевременно и правильно начато лечение). Это стадия относительной стабильности. Пациента беспокоят минимальные симптомы, на которые он может не обращать внимания. Иногда врачи выявляют хроническую фазу миелолейкоза случайно, при проведении общего анализа крови.
- Фаза акселерации. Во время этой фазы патологический процесс активируется. Количество незрелых белых кровяных телец в крови начинает быстро нарастать. Фаза акселерации является как бы переходной от хронической к последней, третьей.
- Терминальная фаза. Финальная стадия болезни. Возникает при нарастании изменений в хромосомах. Красный костный мозг практически полностью замещается злокачественными клетками. Во время терминальной стадии пациент погибает.
Проявления хронического миелолейкоза
![]()
Вначале симптомы могут полностью отсутствовать, либо они выражены настолько слабо, что больной не придает им особого значения, списывает на постоянное переутомление. Заболевание выявляется случайно, во время очередной сдачи общего анализа крови.- Нарушение общего состояния: слабость и недомогание, постепенная потеря веса, снижение аппетита, повышенная потливость по ночам.
- Признаки, обусловленные увеличением размеров селезенки: во время приема пищи больной быстро наедается, боли в левой части живота, наличие опухолевидного образования, которое можно прощупать.
- Признаки, связанные с нарушением функции тромбоцитов и белых кровяных телец: различные кровотечения либо, напротив, образование тромбов.
- Признаки, связанные с повышением количества тромбоцитов и, как следствие, повышением свертываемости крови: нарушение кровообращения в головном мозге (головные боли, головокружения, снижение памяти, внимания и пр.), инфаркт миокарда, нарушение зрения, одышка.
- Резкая слабость, значительное ухудшение общего самочувствия.
- Длительные ноющие боли в суставах и костях. Иногда они могут быть очень сильными. Это связано с разрастанием злокачественной ткани в красном костном мозге.
- Проливные поты.
- Периодическое беспричинное повышение температуры до 38 - 39⁰C, во время которого возникает сильный озноб.
- Снижение массы тела.
- Повышенная кровоточивость, появление кровоизлияний под кожей. Эти симптомы возникают в результате уменьшения количества тромбоцитов и снижением свертываемости крови.
- Быстрое увеличение размеров селезенки: живот увеличивается в размерах, появляется чувство тяжести, боли. Это происходит за счет роста опухолевой ткани в селезенке.
Диагностика заболевания
| Название исследования | Описание | Что выявляет? |
| Общий анализ крови | Рутинное клиническое исследование, выполняется при подозрении на любые заболевания. Общий анализ крови помогает определить общее содержание лейкоцитов, их отдельных разновидностей, незрелых форм. Кровь для анализа берут из пальца или вены в утренние часы. |
Симптомы
- Приапизм – болезненная, чрезмерно длительная эрекция.
Данные симптомы это предвестники тяжелого состояния (бластного криза), появляются за 6- 12 месяцев до его начала.
- Снижается эффективность лекарств (цитостатиков)
- Развивается анемия
- Увеличивается процент бластных клеток в крови
- Ухудшается общее состояние
- Увеличивается селезенка
- Симптомы соответствую клинической картине при остром лейкозе (см. Острый лимфолейоз).
Как лечат миелолейкоз?
Цель лечения снизить рост опухолевых клеток и уменьшить размеры селезенки.
Лечение заболевания должно быть начато сразу после того, как установлен диагноз. От качества и своевременности терапии во многом зависит прогноз.
Лечение включает различные методы: химиотерапия, лучевая терапия, удаление селезенки, пересадка костного мозга.
Химиотерапия
- Классические препараты: Миелосан (Милеран, Бусульфан), Гидроксиуреа (Гидреа, Литалир), Цитозар, 6-меркаптопурни, альфа-интерферон.
- Новые препараты: Гливек, Спрайсел.
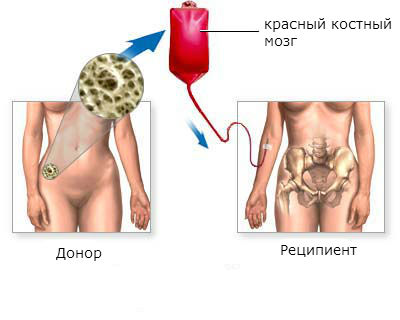
Пересадка костного мозга даёт возможность полностью выздороветь больным хроническим миелолейкозом. Эффективность пересадки выше в хронической фазе заболевания, в остальных фазах гораздо ниже.
Трансплантация красного костного мозга является наиболее эффективным методом лечения хронического миелоидного лейкоза. Более чем у половины пациентов, которым была произведена пересадка, наступает стойкое улучшение в течение 5 лет и дольше.
Чаще всего выздоровление происходит в том случае, когда красный костный мозг пересаживают больному моложе 50 лет в хроническую фазу заболевания.
Этапы трансплантации красного костного мозга:
- Поиск и подготовка донора. Лучшим донором стволовых клеток красного костного мозга является близкий родственник больного: близнец, брат, сестра. Если близких родственников нет, или они не подходят, ищут донора. Проводят ряд тестов для того, чтобы убедиться, что донорский материал приживется в теле пациента. Сегодня в развитых странах созданы большие банки доноров, в которых находятся десятки тысяч донорских образцов. Это дает шанс быстрее найти подходящие стволовые клетки.
- Подготовка пациента. Обычно этот этап продолжается от недели до 10 дней. Проводят лучевую терапию и химиотерапию для уничтожения как можно большего количества опухолевых клеток, предотвращения отторжения донорских клеток.
- Собственно пересадка красного костного мозга. Процедура похожа на переливание крови. В вену пациента заводят катетер, через который в кровь вводят стволовые клетки. Они какое-то время циркулируют в кровотоке, а потом оседают в костном мозге, приживаются там и начинают работать. Для предотвращения отторжения донорского материала врач назначает противовоспалительные и противоаллергические средства.
- Снижение иммунитета. Донорские клетки красного костного мозга не могут прижиться и начать функционировать сиюминутно. Для этого нужно время, обычно 2 – 4 недели. В течение этого срока у больного сильно снижен иммунитет. Его помещают в стационар, полностью ограждают от контакта с инфекциями, назначают антибиотики и противогрибковые средства. Этот период является одним из самых сложных. Сильно повышается температура тела, в организме могут активироваться хронические инфекции.
- Приживление донорских стволовых клеток. Самочувствие пациента начинает улучшаться.
- Восстановление. В течение нескольких месяцев или лет функция красного костного мозга продолжает восстанавливаться. Постепенно пациент выздоравливает, восстанавливается его работоспособность. Но он все еще должен находиться под наблюдением врача. Иногда новый иммунитет не может справиться с некоторыми инфекциями, в этом случае примерно через год после пересадки костного мозга делают прививки.
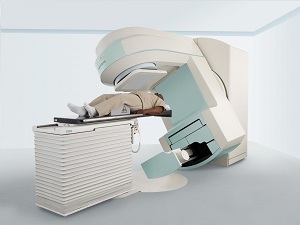
Проводится в случаи отсутствия эффекта от химиотерапии и при увеличенной селезенке после приема медикаментов (цитостатиков). Метод выбора при развитии локальной опухоли (гранулоцитарная саркома).
В какой фазе заболевания применяется лучевая терапия?
Лучевая терапия используется в развернутой стадии хронического миелолейкоза, которая характеризуется признаками:
- Значительное разрастание опухолевой ткани в красном костном мозге.
- Рост опухолевых клеток в трубчатых костях 2.
- Сильное увеличение печени и селезенки.
Применяется гамма-терапия – облучение области селезенки гамма-лучами. Основная задача – уничтожить или прекратить рост злокачественных опухолевых клеток. Лучевую дозу и режим облучения определяет лечащий врач.
| К длинным трубчатым костям относят кости плеча, предплечья, пальцев, голени, бедра. В детстве эти кости целиком заполнены красным костным мозгом. У взрослого человека красный костный мозг сохраняется только в головках костей, а в теле кости он замещается на желтый костный мозг (жир). При хроническом миелоидном лейкозе желтый костный мозг может быть вытеснен опухолевой тканью. |
Удаление селезенки используется редко по ограниченным показаниям (инфаркт селезенки, тромбоцитопения, выраженный дискомфорт в животе).
Операцию обычно проводят в терминальную фазу заболевания. Вместе с селезенкой из организма удаляют большое количество опухолевых клеток, тем самым облегчая течение заболевания. После операции обычно увеличивается эффективность медикаментозной терапии.
Каковы основные показания к операции?
- Разрыв селезенки.
- Угроза разрыва селезенки.
- Значительное увеличение органа в размерах, что приводит к сильному дискомфорту.
При высоких уровнях лейкоцитов (500,0 · 10 9 /л и выше), могут использовать лейкаферез для предотвращения осложнений (отек сетчатки, приапизм, микротромбозы ).
При развитии бластного криза, лечение будет таким же, как при острых лейкозах (см. острый лимфолейкоз).
Лейкоцитаферез – лечебная процедура, напоминающая плазмаферез (очищение крови). У пациента берут определенное количество крови и пропускают через центрифугу, в которой она очищается от опухолевых клеток.
В какой фазе заболевания проводят лейкоцитаферез?
Так же, как и лучевую терапию, лейкоцитаферез проводят во время развернутой стадии миелолейкоза. Нередко его применяют в тех случаях, когда отсутствует эффект от применения лекарственных средств. Иногда лейкоцитаферез дополняет медикаментозную терапию.
Читайте также: