Механизм злокачественной трансформации у высокоонкогенных ретровирусов
Каким же образом вирус превращает нормальнуйю клетку в опухолевидную. На этот вопрос, исключительно важный не только для онкологии и вирусологии, но и для понимания важнейших аспектов биологии в настоящее время еще нет четкого и полного ответа.
Можно представить себе два принципиально различных механизма влздействия опухолеродного вируса на клетку: 1)вирус или вирусный геном осуществляет запуск трансформированного процесса, но не участвует в его поддержании (гипотеза запуска); 2)для возникновения и поддержания трансформированного состояния клетки необходимо постоянное присутсвие вирусного генома (гипотеза присутсвия). Если верна вторая гепотеза, то вирусный геном может действовать на клетку одним из двух общих механизмов: 1)вирусный геном включается в клеточный геном и занимает такое положение, при котором нарушается контроль клеточного деления; функционирование вирусного генома при этом не обязательно (гипотеза положения); 2)не вирусный геном а продукты его функционирования непосредственно отвечают за возникновение и поддержания трансформированного состояния клетки (гипотеза функционирования).
В основе современных представлений о механизме вирусного канцерогенеза лежит понятие онкогена.
Онкоген - специфический ген опухолеродного вируса, продукция которого непосредственно отвечает за превращение нормальной клетки в трансформированную из-за поддержание трансформированного фенотипа. Для того, чтобы трансформация имела стойкий характер, вирусный онкоген должен закрепится в клетке и постоянно функционировать с образованием специфической иРНК и соответсвующего “онкогенного” белка. Таким образом онкогенное действие вирусов можно рассматривать как следствие хронической вирусной инфекции. Если инфекции клетки опухолеродным вирусом не будет хронической, трансформационные изменения под влиянием онкогена будут носить временный характер и исчезнут как только прекратится инфекционный процесс.
Онкогенность герпесвирусов.
Онкогенные вирусы этой группы превликают в настоящее время большое внимание как возбудители ряда злокачественных опухолевых заболеваний человека и животных. Для онкогенных герпес вирусов характерна способность вызывать лимфоидные опухоли; так вирус Эпштейна-Барра, являюшийся возбудителем инфекционного мононуклеоза, он же является возбудителем лимфомы Беркитта у негров в Африке и назофарингеального рака и китайцев в Юго-Восточной Азии и рака шейки матки.
Онкогенность аденовирусов.
Многие аденовирусы человека и животных в эксперементальных условиях проявляют онкогенную активность. Особенно четко эта активность проявляется при заражении новорожденных сирийских хомячков, у которых спустя нескольло недель на месте инъекции появляются саркомы, не содержащие инфекционного вируса. Аденовирусы представляют большой интерес как одна из лучших моделей для изучения вирусного канцерогенеза.
Онкогенность ретровирусов.
В этой группе известны вирусы саркомы кур, мышей, кошек и обозьян. У человека примером ретровирусного канцерогенеза является острый Т-клеточный лейкоз. Эндемичные районы заболевания - юг Японии, Западная Индия, Центральная Африка.
Изучения данного вопроса требует дальнейших больших усилий.
Трансдукция.
Трансдукция (от лат. transductio - перемещение) - передача генетического материала от одной клетки к другой, что приводит к изменению наследственных свойств.
Явление трансдукции было открыто американским ученым Д.Ледербергом и Н.Циндером в 1952 году. Особые бактериальные вирусы - умеренные фаги - в процессе вегетативного размножения способны случайно захватывать и переносить в другие клетки любые участки ДНК, разрушенных ими клеток. Длина переносимого отрезка ДНК определяется размером белковой оболочки фаговой частицы и обычно не превышае 1-2 % бактериального генома. Переносимый отрезок может содержать несколько генов.
Поскольку вероятность успешной трансдукции зависит от расстояния между генами в молекуле ДНК, образующих хромосому бактерии, явления трансдукции широко используется при состовлении генетических карт хромосом бактерий. Гнетический материал фага в таких частицах отсутсвует. Поэтому при вводе ДНК в клетку они не осуществляют все функции фага: размножение, разрушение клетки. Внесенный фрагмент может существовать в клетке в виде дополнительного генетического элемента, обладающего функциональной активностью. Такой фрагмент не способен воспроизводится при каждом делении клетки, поэтому он передается в одну из дочерних клеток. За исключением этой клетки свойство всего остального потомства не изменяются. В дальнейшем фрагмент может быть либо разрушен, либо внесен в хромосому бактерии, заменив в ней гомологичный участок ДНК. В последнем случае новые признаки, приобретенные клеткой - трансдуктантом, будут свойственны всемы потомству клетки.
Существует группа бактериофагов, способных переносить лишь определенные гены, расположенные рядом с местом вхождения генома фага в хромосому бактерии при разрушении (лизогенизации).
Молекулярный механизм трансдукции в настоящее изучен недостаточно.
Вирусы, вызывающие рак, называются онкогенными. Среди онкогенных вирусов есть вирусы, наследственной молекулой которых является РНК (их называют ретровирусами). Было установлено, что и в этом случае на вирусной РНК с помощью особого фермента ревертазы синтезируется ДНК, которая встраивается в хромосому хозяина. Таким образом вирусы, встроившиеся в хромосому, могут приводить к превращению здоровой клетки в раковую. Для возникновения рака существенен не весь геном вируса, а лишь один из его генов. Такой ген, вызывающий рак, назвали онкогеном.
Ретровирусы высокоонкогенные
Высокоонкогенные ретровирусы получили свое название благодаря способности трансформировать культивируемые клетки в течение нескольких дней и индуцировать опухоли у инфецированных животных с коротким латентным периодом в течение 2-3 недель. За злокачественную трансформацию отвечают входящие в состав вирусного генома онкогенные последовательности.
Обнаружены трансдуцирующих вирусов, геномы которых приобрели клеточные последовательности. На рис. 1 показан геном одного из таких вирусов. Часть вирусной последовательности - в данном случае ген env - замещена геном v-onc. Образовавшийся вирус дефектен по репликации и не способен поддерживать самостоятельно инфекционный цикл. Такой вирус может сохраняться вместе с вирусом-помощником, который восполняет утраченные вирусные функции.

Рис. 1. у дефектных в отношении репликации трансформирующих вирусов часть вирусной последовательности замещена последовательностью клетки. Длина замещенной последовательности характерна для каждого вируса
Онкогены РНК-содержащих вирусов (v-onc) не являются вирусспецифическими генами и ведут свое происхождение от ядерной ДНК клеток-хозяев, а именно: от клеточных протоонкогенов.
Захват клеточных последовательностей осуществляется в результате рекомбинационно-интеграционных процессов, происходящих между клеточным и вирусным геномами. В этих процессах участвует кодируемый вирусом фермент обратная транскриптаза, которая синтезирует ДНК-копии вирусной РНК.
Таким образом, вирусные онкогенные последовательности являются чужеродным генетическим материалом, не участвуют в процессах размножения вируса и, более того, в подавляющем большинстве случаев делают вирус дефектным по репликации за счет замещения онкогеном части необходимых вирусных генов.
Большинство высокоонкогенных ретровирусов можно считать лабораторными конструкциями, поскольку они были получены в ходе пассирования родительских ретровирусов в опухолевых клетках. В нелабораторных условиях эти вирусы быстро исчезают или теряют онкогены.
Однако вирусы лейкоза кошек, которые трансдуцировали клеточные протоонкогены, служат примером онковирусов, встречающихся в природных популяциях.
В настоящее время выделено значительное количество независимых изолятов высокоонкогенных ретровирусов. Молекулярно-биологическими методами были идентифицировано более 20 различающихся по структуре онкогенов.
С помощью гибридизации нуклеиновых кислот эукариотических клеток с ретровирусными зондами практически для всех известных v-onc были найдены гомологичные клеточные последовательности (c-onc). Таким образом, этим способом было выявлено наибольшее число с-onc (более 20), в том числе с-Ha-ras 1 - по гомологии с онкогеном штамма Харви вируса мышиной саркомы Ha-MSV и c-myc - по гомологии с онкогеном ретровируса птиц МС29. [10]
Онкогенный потенциал v-onc, также как и c-onc, может определяться как качественными, так и количественными изменениями. Наряду с повышенным уровнем экспрессии v-onc за счет сильных вирусных промоторов во многих случаях в них наблюдается много структурных изменений, происходящих в ходе захвата клеточного гена, а также в ходе пассирования вируса. Однако встречаются и единичные точковые замены.
Ретровирусы низкоонкогеные
Помимо высокоонкогенных ретровирусов, практически не встречающихся в природных популяциях, существует группа низкоонкогенных ретровирусов. Причем большинство вирус-индуцированных опухолей животных в природе возникают под действием данных вирусов.
Свое название низкоонкогенные ретровирусы получили благодаря ряду принципиальных отличий от высокоонкогенных вирусов. Они не несут трансформирующих генов, не вызывают злокачественной трансформации при размножении клеток в культуре и способны индуцировать опухоли у части инфецированных животных лишь после длительного латентного периода от 4 до 12 месяцев.
Механизм онкогенного действия
Механизм онкогенного действия низкоонкогенных ретровирусов также существенно отличается от действия высокоонкогенных ретровирусов. В данном случае злокачественная трансформация является следствием так называемого инсерционного мутагенеза. При этом если встройка провирусной ДНК происходит внутри или вблизи клеточного протоонкогена, она превращает его в онкоген.
Поскольку известно, что инсерция ретровирусов происходит нелокусоспецифично, т.е. в любые точки клеточного генома, то очевидно, такое попадание в локус c-onc должно быть редким событием. Эта редкая и единственная трансформированная клетка, имея селективные преимущества перед нормальными клетками, должна образовать опухоль клонального происхождения только после достаточно длительного периода размножения, что и наблюдается в действительности. [14]
Все опухолевые вирусы могут индуцировать рак, если перенесённая генетическая информация сохраняется в клетке. ДНК-содержащие вирусы должны обеспечивать продукцию белков, они должны действовать так, чтобы клетка трансформировалась. Такими белками являются белки необходимые для репродукции вируса. РНК-содержашие вирусы не имеют таких белков. Тут иной механизм (имеются особые онкогены, которые не нужны для репродукции) Ретровирусы должны перисестировать в клетке не вызывая её гибели. Их геном обязательно встраивается в геном хозяина. Опухолевые гены являются слегка изменёнными клеточными генами.
В настоящее время изучены основные молекулярные механизмы вирусного канцерогенеза.
Ведущая роль в опухолевой трансформации клеток отводиться онкогенам. Онкогены - это гены, обуславливающие неконтролируемый опухолевый рост клеток и представляющие собой либо интегрированные гены онкогенных вирусов, либо активированные вследствие мутаций или по другим причинам клеточные протоонкогены. Протоонкогены - это нормальные клеточные гены, отвечающие за рост, деление и дифференцировку клеток. Соответственно различают вирусные (v-onc) и клеточные (c-onc) онкогены.
В настоящее время установлено, что опухоли могут вызываться как ДНК-вирусами, так и РНК-вирусами, причем механизм их действия различен. И в том и другом случае опухолевая трансформация клеток есть результат включения (интеграции) вирусной ДНК (или ДНК-копий в случае РНК-вирусов) в геном клеток хозяина. Однако, в случае ДНК-содержащих онковирусов (вирусы группы Папова, аденовирусы, герпес вирусы и т.д.) в геном клеток включаются вирусоспецифичные онкогены (что, собственно, и вызывает опухолевую трансформацию клеток). Онкогены РНК-содержащих вирусов не являются вирусоспецифическими генами и ведут свое происхождение от ядерной ДНК клеток-хозяев, а именно: от клеточных протоонкогенов. Считается, что онкогены РНК-вирусов происходят из протоонкогенов, которые на определенном этапе эволюции были захвачены вирусом из генома позвоночных во время инфекционного цикла.
Онкогенез, индуцируемый генами опухолеродных вирусов и клеточными онкогенами, — это многоступенчатый процесс, который включает по крайней мере два (а возможно, три и более) этапа.
На первом из них,иммортализации, первичные клетки в культуре превращаются в клеточные линии с неограниченным временем жизни; это предотвращает запрограммированное старение первичных клеток или кризис, которые в норме происходят в культуре клеток. Трансформирующие белки, кодируемые генами, которые детерминируют функцию иммортализации, — это, как правило, ДНК-связывающие белки, локализованные в клеточном ядре.
На втором этапе, который можно назвать этапом трансформации, происходит индукция полного набора фенотипических изменений, связанных с онкогенной трансформацией клеток. Это морфологические изменения, способность расти в обедненной сывороткой среде, способность делиться без прикрепления к подложке и опухолеродность. Трансформирующие белки, ответственные за трансформирующую функцию, ассоциированы с плазматической мембраной и с цитоплазматическими мембранными структурами.
Функция иммортализации, кодируемая генами опухолеродных ДНК-вирусов и онкогена myc ретровируса, может дополнять трансформирующую функцию вирусных и клеточных онкогенов.
1. Клетки округлой формы.
2. Могут быть легко отдиференцированы от нормальных.
3. Увеличено ядерно-цитоплазматическое соотношение.
4. Увеличено количество ядрышек и число митозов.
5. Нормальные клетки распознают друг друга по поверхностным рецепторам, а раковые клетки могут нести изменённые рецепторы, которые позволяют клеткам обособляться от опухоли, поскольку связь между клетками ослабевает. =>Могут распространяться по организму.
6. Раковые клетки способны преодолевать базальные барьеры, непреодолимые для нормальных клеток.
7. Раковые клетки противостоят защитным механизмам организма. Их узнают Т-киллеры и в определённых случаях могут их инактивировать, но часто раковые клетки избегают неблагоприятных воздействий Т-киллеров. Есть механизмы. Которые позволяют им быть неузнаваемыми.
Малигнизированные клетки характеризуются так же:
Неограниченным размножением, ростом до более высоких плотностей, пониженной потребностью к сывороточным факторам (?факторы роста?), диффузным ростов в полужидком агаре, различной морфологией клеточных клонов, ростом на поверхности монослоя клеток, лёгкой агглютинацией лактинами.
Раковые клетки характеризуются общими свойствами:
1. Раковые признаки передаются по наследству от клетки к клетке.
2. Раковые клетки не чувствительны к факторам ограничения роста.
3. Способны внедряться в другие ткани, вегетировать и давать начало другим опухолям.
Раковые клетки, а также нормальные тромбоцитарные клетки обладают определённым набором ферментов, которые способствуют преодолению механических барьеров типа межклеточный матрикс и базальной мембраны и эти ферменты относятся к категории металлопротеаз. В нормальных клетках, исключая фагоцитарные клетки, активность металлопротеаз низкая, либо вообще отсутствует. У фагоцитарных клеток она возникает в ответ на определённые сигналы. У малигнизированных клеток активность данных ферментов достаточно высока и с этим связана их возможность проникать через механические барьеры. Если в нормальных фагоцитарных клетках активность металлопротеаз повышается в ответ на определённые сигналы, то у малигнизированных клеток таких сигналов не возникает, а они постоянно продуцируют данные ферменты. Конечно, кроме металопротеаз должны быть и другие гидролитические белки, которые способствуют разрушению механических барьеров представленных матриксами и мембранами. В раковых клетках, в которых регистрируется высокая активность металлопротеаз отмечается прекращение синтеза белков ингибирующих активность металопротеаз т.е белков которые блокируют метастазирование.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Значительная часть онкогенных вирусов принадлежит к семейству ретровирусов , геном которых представлен одноцепочечной РНК . После проникновения вируса в клетку на матрице вирусной РНК при участии обратной транскриптазы образуется двухцепочечная ДНК — провирус, который встраивается в ДНК клетки-хозяина.
Изредка встроенный провирус затем освобождается, захватывая смежный участок клеточной ДНК клетки-хозяина. Если такой участок содержит ген, стимулирующий пролиферацию клетки, то ретровирус приобретает трансформирующие свойства.
К числу вирусов, ответственных за возникновение опухолей человека следует отнести вирусы прямого действия — вирусы папиллом , которые являются этиологическим фактором опухолей шейки матки и содержат собственные трансформирующие гены, два типа ДНК- содержащих вирусов — вирус гепатита В , ассоциированный с опухолями печени , и два герпес-вируса — Эпстайна-Барр , ассоциированные с раком носоглотки и лимфомой Беркитта, а на фоне иммунодефицита обусловливает развитие лимфом, и вирус герпеса типа 8 , связанный с саркомой Капоши. Известно, что Т-лимфотропный вирус человека (HTLV) индуцирует Т-клеточный лейкоз у взрослых. Вирусы гепатита B (HBV) и вирусы гепатита С (HCV) способствуют развитию карциномы печени, они относится к числу вирусов непрямого действия, поскольку не содержит в своем составе онкогена, а онкогенный потенциал проявляет путем активации клеточных генов, участвующих в процессах пролиферации.
Высокоонкогенные ретровирусы получили свое название благодаря способности трансформировать культивируемые клетки в течение нескольких дней и индуцировать опухоли у инфецированных животных с коротким латентным периодом в течение 2-3 недель. За злокачественную трансформацию отвечают входящие в состав вирусного генома онкогенные последовательности. Помимо высокоонкогенных ретровирусов, практически не встречающихся в природных популяциях, существует группа низкоонкогенных ретровирусов. Причем большинство вирус-индуцированных опухолей животных в природе возникают под действием данных вирусов. Свое название низкоонкогенные ретровирусы получили благодаря ряду принципиальных отличий от высокоонкогенных вирусов. Они не несут трансформирующих генов, не вызывают злокачественной трансформации при размножении клеток в культуре и способны индуцировать опухоли у части инфецированных животных лишь после длительного латентного периода от 4 до 12 месяцев.
Механизм онкогенного действия низкоонкогенных ретровирусов также существенно отличается от действия высокоонкогенных ретровирусов. В данном случае злокачественная трансформация является следствием так называемого инсерционного мутагенеза. При этом если встройка провирусной ДНК происходит внутри или вблизи клеточного протоонкогена, она превращает его в онкоген.
Поскольку известно, что инсерция ретровирусов происходит нелокусоспецифично, т.е. в любые точки клеточного генома, то очевидно, такое попадание в локус c-onc должно быть редким событием. Эта редкая и единственная трансформированная клетка, имея селективные преимущества перед нормальными клетками, должна образовать опухоль клонального происхождения только после достаточно длительного периода размножения, что и наблюдается в действительности.
Около четверти из приблизительно 600 вирусов животных обладают онкогеным потенциалом. Вирусы, связанные с раковыми образованиями людей описаны в. Среди онкогенных вирусов есть и РНК- и ДНК-содержащие. Ретровирусы ответственны за естественно возникающую лейкемию и саркому у нескольких видов животных. Среди ДНК-содержащих вирусов, некоторые герпесвирусы вызывают злокачественные опухоли у их естественных хозяев.
Обнаружение вирусов в целом ряде злокачественных опухолей, позволило Л.А. Зильберу в 1945 году сформулировать теорию вирусной природы рака. Основным постулатом этой теории является утверждение о том, что геном клетки может нарушаться вследствие активации ингегрированной в него ДНК вируса.
Согласно вирусной теории рака, геном опухолеродного вируса интегрируется в геном нормальной клетки, что вызывает её бесконтрольное деление. Геном вируса, встроенного в ДНК клеток хозяина был назван провирусом. В 70-е годы 20-го столетия в некоторых РНК-содержащих вирусах были обнаружены гены, необходимые для превращения нормальной клетки в опухолевую. Эти гены были названы онкогенами или трансформирующими генами вирусов - v-onc. В дальнейшем копии или аналоги вирусных онкогенов были найдены в геномах нормальных клеток человека и животных, а также была экспериментально доказана способность онкогенов клеток теплокровных встраиваться в геном вируса. В настоящее время большинство онкогенов идентифицировано, установлена их химическая структура, локализация в хромосомах, а также выявлены белки - продукты активности этих генов.
Прямая роль вирусов в возникновении злокачественных и доброкачественных опухолей человека доказана пока лишь в единичных случаях и концепция о едином механизме канцерогенеза, связанным с провирусами, не нашла своего подтверждения. В настоящее время вирусная теория канцерогенеза рассматривается как частный случай, а общим механизмом в возникновении опухолей считается преобразование собственных клеточных генов (протоонкогенов) в онкогены путем их активации. Следует отметить, что даже в случаях доказанной вирусной природы опухоли нет оснований подозревать заразность заболевания. Вирусы, которые считаются причиной возникновения некоторых форм рака животных и человека не передаются контактным путем.
Наиболее часто используемыми ретровирусными векторами являюти векторы на основе ретровирусов мыши типа С (вирус лейкемии мыши) Такие векторные системы состоят из двух компонентов: векторнов конструкции и линии клеток-упаковщиц.
В векторной конструкции (провирусная ДНК) гены, кодируюрущие структурные белки ретровируса (gag, pol, env),замешают другими интересующими генами (генами в- галактозидазы и устойчивости к неомицину). Источником структурных белков является клеточная линия, содержащая интегрированный в геном провирус.
Данный провирус модифицируют таким образом, что у него отсутствует сигнал узнавания ш, необходимый для упаковки вирусной РНК. Таким образом, транскрибируемая вирусная РНК не может быть упакована в вирусные частицы.
РНК векторной конструкции, наоборот, содержит сигнал узнавания ш и поэтому может быть упакована в рибонуклеопротеидный комплекс. Таким образом, происходит формирование инфекционных вирусных частиц, содержащих информацию ретровирусного вектора и переносящих ее в инфицируемые клетки. Однако такие вирусные частицы не способны к образованию новых вирусов, так как в инфицируемой клеточной линии отсутствует генетическая информация о структурных белках, необходимых для формирования вирусных частиц.
Необходимыми составными частями векторной конструкции являются 5" и 3" LTR, а так же сигнал упаковки, расположенный "вниз по течению" от 5" UTR. Экспрессия трансгена направляется промотором и энхансером 5" UTR или альтернативными вирусными или клеточными промотерами (например, вирус саркомы Рауса, тирозин, б-казеин). Впервые присутствие вирусной ДНК в клетках взрослых мышей установлено в 1974 году. Ретровирусные векторы могут служить альтернативой для эффективного транспорта генов у сельскохозяйственных животных. Инфекция зигот или предимплантационных эмбрионов в большинстве случаев приводит к получению трансгенных животных-мозаиков. Объяснением этому служить то, что интеграция происходит только в том случае, если клетка вступает в митоз после предварительной репликации ДНК. Все потомки, родившиеся из инфицированных ооцитов, были трансгенными <табл. 1). Не смотря на ограниченное число полученных трансгенных животных, были доказаны передача трансгена по наследству и экспрессия рекомбинантного продукта.
Преимуществом использования ретровирусных векторов для получения трансгенных животных является то, что до 100% обработанных эмбрионов могут быть успешно инфицированы ретровирусами.
Недостатком применения ретровирусных векторов является их ограниченная емкость (размер вставки не должен превышать 8 тысяч п. н. Кроме того, в результате сплайсинга из ретровирусов вырезаются интроннные последовательности, которые как и другие дистальные или проксимальные последовательности играют важную роль в эффективной экспрессии генов у трансгенноых животных. К недостаткам использования ретровирусных векторов следует так же отнести подавление экспрессии трансгенов in vivo вследствие инактивации вирусных промоторов в клетках, например, посредством а- и у-интерферонов, действующих на вирусные LTR. Однако данная проблема может быть решена посредством включения в ретровирусную конструкцию внутренних промоторов или использованием нового поколения ретровирусов, содержащих модифицированные участки контроля экспрессии, такие как внутренний рибосомный сайт (IRES) и тетрациклиновая регуляторная система.
За последние 25 лет произошел существенный прогресс в нашем понимании молекулярных механизмов развития злокачественных опухолей. Идентифицировано три типа генов, нарушения в которых приводят к раку: доминантные трансформирующие, или онкогены; рецессивные трансформирующие, или опухолевые супрессоры; гены, ответственные за репарацию ДНК. Многие онкогены были впервые выделены как формы протоонкогенов онкогенных РНК-содержащих вирусов.
На протяжении многих лет известно, что вирусы способны вызывать злокачественные опухоли у животных. Это наблюдение послужило стимулом к обширным исследованиям, направленным на выявление генов, которые вызывают рак и переносятся вирусами, и генов человека, повреждающихся при развитии злокачественных опухолей. В итоге обнаружили удивительный факт, что гены, вовлеченные в канцерогенез, часто представляют собой измененные формы вирусных генов.
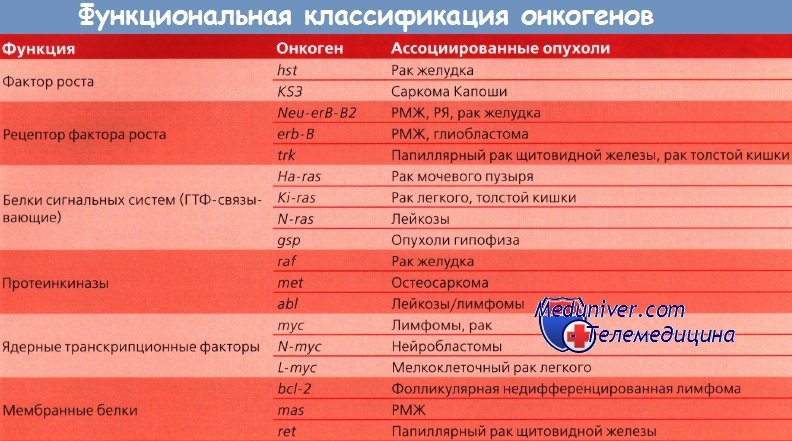
Другие протоонкогены кодируют внутриклеточные белки, ответственные за усиление митогенного сигнала; третьи — кодируют белки, вовлеченные в контроль клеточного деления и находящиеся под контролем ядра. Такие онкогены могут быть активированы посредством нескольких механизмов: возможна амплификация гена и активация его копий; в редких случаях наблюдается траислокация гена на другую хромосому, где он попадает под контроль чужого промотора и стимулирует неконтролируемый рост. Три группы онкогенов находятся под разным контролем.
Первая группа включает пептидные факторы роста и их рецепторы, как, например, эпидермальный или тромбоцитарный.
Эти пептиды служат скорее костимуляторами опухолевого роста, чем факторами, непосредственно инициирующими опухолевую трансформацию. По мере расшифровки механизмов, стимулирующих опухолевую прогрессию, все более реальной становится молекулярно-нацеленная (таргетная) терапия, направленная непосредственно против продуктов этих генов или против белков, активируемых ростовыми факторами. Так разработаны препараты:
1) трастузумаб (Герцептин) — моноклональные антитела, блокирующие Her-2/neu;
2) иматиниба мезилат (Гливек) — препарат, частично блокирующий активность c-kit, BCR-ABL и некоторых других тирозинкиназ;
3) цетуксимаб (Эрбитукс) — моноклональные антитела, связывающиеся с рецептором эпидермального фактора роста;
4) гефитиниб (Пресса) — низкомолекулярный ингибитор некоторых изоформ рецептора эпидермалыюго фактора роста.

Другой класс онкогенов происходит из немембранных внеядерных факторов роста, передающих каскадные сигналы внутри клетки. К ним относятся G-белки и белки семейства ras. Наконец, некоторые онкогены кодируют ядерные регуляторные белки, например myc. Схематическое изображение функций онкогенов представлено на рисунке.
Открытие человеческих аналогов вирусных генов привело к формулировке многообещающей гипотезы, согласно которой злокачественные опухоли человека, включая большинство невирусной этиологии, могут возникать вследствие мутаций, превращающих полезные протоонкогены в опасные онкогены. В подтверждение этой гипотезы показано, что повреждение даже одного аллеля таких протоонкогенов достаточно для злокачественной трансформации некоторых клеток in vitro. Подобные доминантные мутации ведут к гиперэкспрессии нормального гена и, следовательно, гиперпродукции нормального белка или же к синтезу его аберрантной формы, обладающей повышенной активностью.
В любом случае результатом оказывается усиление стимулирующих сигналов внутри клетки, даже в отсутствие стимулирующих воздействий извне.
Парадоксально, но первым ключом к выявлению некоторых онкогенов стало исследование РНК-содержащих онкогенных вирусов животных, не вызывающих опухолей у человека. Эти ретровирусы, инфицирующие кур, грызунов, кошек и обезьян, оказались крайне высокоонкогенными: развитие опухоли часто наблюдали уже при первом контакте. У одного из вирусов этой группы, вируса саркомы кур Рауса, выявлен ген, ответственный за злокачественное перерождение инфицированных клеток. Этот тип трансформирующих онкогенов был назван вирусным онкогеном.
Единственный онкоген вируса саркомы Рауса, проникая в клетки кур, способен нарушать и перестраивать их метаболизм, направляя его по пути злокачественной трансформации.
В 1976 г. Varmus и Bishop показали, что онкоген вируса саркомы Рауса в действительности вовсе не есть вирусный ген, а происходит от предсуществовавшего клеточного гена, захваченного предком вируса саркомы Рауса. Однажды встроив его в свой геном, вирус далее использовал этот ген для трансформации клеток млекопитающих.
Более ранние предки вируса саркомы Рауса были способны реплицироваться в инфицированных клетках, но не могли трансформировать ее; туморогенный потенциал был приобретен после захвата нормального клеточного гена — протоонкогена. В связи с этим значение работы Varmus и Bishop гораздо больше, чем просто исследование вируса саркомы Рауса: показано существование гена в нормальном геноме клеток млекопитающих, обладающем трансформирующим потенциалом при соответствующей активации, в данном случае ретровирусом.
Информация, полученная при исследовании ретровирусов и онкогенов, существенно помогла в изучении причин злокачественных новообразований. Ретровирусы, так же как вирус саркомы Рауса, неинфекционны для человека и, соответственно, не могут активировать протоонкогены человека. Однако возможны альтернативные механизмы их активации. Эффекты, сходные с производимыми вирусом в последовательности ДНК, могут быть вызваны химическими или физическими воздействиями.
Это было подтверждено в начале 80-х годов прошлого столетия: в геноме опухолевых клеток были выявлены мутированные гены (протоонкогены). Во всех случаях причиной превращения протоонкогена в активный онкоген оказались изменения последовательности гена. Например, онкоген ras образуется из протоонкогена-предшественника в клетках рака мочевого пузыря человека вследствие замены одной пары нуклеотидных оснований; онкоген myc появляется во многих злокачественных новообразованиях в результате амплификации.
В последующем были изучены механизмы, посредством которых большинство, если не все онкогены вызывают трансформацию клеток. Это стало возможным благодаря определению путей, посредством которых клетки регулируют свой собственный рост. Рост иделение нормальной клетки вткани контролируется преимущественно ее окружением. В норме клетка редко или даже никогда не определяет скорости своего деления, а только реагирует на сигналы от окружающих клеток.
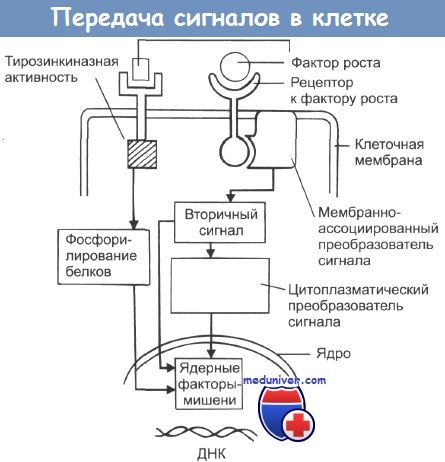
Эти сигналы, стимулирующие или подавляющие рост, передаются посредством ростовых факторов, выделяемых окружающими клетками. Ростовые факторы попадают в межклеточное пространство и связываются с рецепторами на поверхности клеток-мишеней. Клетки реагируют на сигналы ростовых факторов активацией механизмов синтеза клеточных структур, удвоением ДНК и делением. Нормальная клетка никогда не запускает программу роста, если она не получила внешнего сигнала. Каждая клетка обладает сложной системой, позволяющей ей получать ростовые сигналы, обрабатывать их и запускать программу деления. Эта система состоит из большого количества белков, ответственных за получение ростовых сигналов и передачу их в клетку. К этим белкам относятся:
1) рецепторы на клеточной поверхности, распознающие наличие во внеклеточном пространстве ростовых факторов и передающие сигнал во внутриклеточное пространство;
2) белки внутриклеточной сигнальной системы, которые активируются поверхностными рецепторами и затем передают сигнал дальше в клетку;
3) ядерные транскрипционные факторы, активирующиеся в ответ на сигнал, переданный белками внутриклеточной сигнальной системы, и, в свою очередь, активирующие широкий спектр клеточных генов.
Активирующиеся гены руководят программой роста клетки; именно эти гены определяют те события, которые вместе взятые приведут к делению клетки. Протоонкогены кодируют многие белки в этой сложной сигнальной системе, позволяющей нормальной клетке отвечать на экзогенные ростовые факторы. Белки онкогенов участвуют в сигнальной системе, отбирая ее неправильно функционирующие версии нормальных компонентов, и вызывают ее постоянную стимуляцию в отсутствие внешних ростовых сигналов. В результате клетка постоянно растет, даже если окружающая среда не содержит каких-либо факторов, в норме необходимых для клеточного роста.
Некоторые исследователи указывают, что в злокачественной клетке должны присутствовать как минимум две мутации в протоонкогенах, причем только строго определенные мутации могут вызывать злокачественную трансформацию. Это связано с тем, что отдельные онкогены, даже если они служат важными регуляторами клеточного метаболизма, сами по себе не способны индуцировать злокачественное новообразование. Данная точка зрения подтверждается выявлением в опухолевых клетках более 10 различных онкогенов. Однако при тщательном исследовании ожидаемые нарушения обнаруживают лишь примерно в 20 % опухолей.
Ни одна опухоль не несет ни одной пары сочетанных нарушений из выявляемых в культивируемых линиях злокачественных клеток. Предполагается также, что врожденные мутации, ответственные за предрасположенность людей к раку, не есть онкогены. Это объясняется существованием рецессивных антионкогенов, получивших название генов-супрессоров, тоже играющих крайне важную роль в развитии опухолей.
Читайте также:

