Острый лейкоз со смешанным фенотипом
К сожалению, оптимальная терапия для MPAL не установлена, и прогноз неблагоприятный. Matutes et al. [2] проанализировали клинические признаки и результаты 100 пациентов с MPAL. Реакция на терапию наблюдалась у 67 пациентов. Из них 27 были обработаны протоколами острой лимфобластной лейкемии (ВСЕ), 34 с протоколами о остром миелоидном лейкозе (AML), пять из которых сочетались с терапией для ALL + AML, а один — с иматинибом. Полный ответ (CR) наблюдался у 85% пациентов, получавших ALL-направленную терапию, и у 41% пациентов, получавших направленную на AML терапию. Общая выживаемость составила 18 месяцев, а 5-летняя выживаемость составила 37% [2].
В повседневной практике клиницисты должны решить между терапиями для ПОД / ФТ, или комбинированной терапии на основе иммунофенотипических, цитогенетических и молекулярных данных. Здесь мы приводим случай MPAL, обработанного децитабином, который нацелен на миелоидные и лимфоидные линии.
81-летнюю женщину отправили в нашу больницу для случайно обнаруженной панцитопении в июле 2013 года. В то время ее результаты полного анализа крови были следующими: лейкоциты, 5,4 × 109 / л; гемоглобин, 7,7 г / дл; и тромбоциты, 51 × 109 / л. Ни спленомегалия, ни лимфаденопатия не присутствовали. Была проведена биопсия костного мозга, а анализ аспирата костного мозга выявил 60,8% доменных клеток (рис.1). Иммунофенотипирование проточной цитометрией выявило совместную экспрессию миелоид-ассоциированных антигенов (например, миелопероксидазы) и Т-клеточных антигенов (то есть CD2, CD3, CD5 и CD7) на бластных клетках, а также экспрессию CD34 и человеческого лейкоцитарного антигена ( HLA) -DR. Хромосомное кариотипирование выявило 46, XX кариотип без аномалий. Молекулярные анализы для MLL, BCR / ABL, AML1-ETO и PML-RARA были отрицательными. Исходя из результатов иммунофенотипирования, у пациента считалось, что MPAL, T / myeloid, не указано иначе, согласно классификации ВОЗ 2008.
Мы решили лечить нашего пациента децитабином, а не цитотоксической химиотерапией из-за ее низкого уровня работоспособности, который характеризовался общей общей слабостью. Дозированная схема была аналогичной применяемой для миелодисплазии и AML (20 мг / м2, 1-часовая непрерывная внутривенная инфузия в течение 5 дней, каждые 4 недели). После четырех циклов химиотерапии, в декабре 2013 года, она достигла полной ремиссии с помощью анализа костного мозга (рис.2). Результаты полного анализа крови во время полной ремиссии были следующими: лейкоциты, 5,3 × 109 / л; гемоглобин, 8,3 г / дл; и тромбоциты, 247 × 109 / л. Умеренный оральный мукозит наблюдался во время лечения децитабином, тогда как других побочных эффектов не было. Пациент прошел еще три цикла химиотерапии. Впоследствии она попросила прекратить химиотерапию по финансовым соображениям. На момент написания статьи пациент был ремиссией на 5 месяцев.
Децитабин является гипометилирующим агентом, который ингибирует активность ДНК-метилтрансферазы и приводит к реактивации экспрессии генов-супрессоров опухолей. Он также обладает прямыми и непрямыми цитотоксическими эффектами, которые приводят к апоптозу опухолевых клеток.
Decitabine показал клиническую активность в миелоидных злокачественных новообразованиях и одобрен для лечения миелодиспластического синдрома и AML у пожилых пациентов. Кроме того, исследования in vitro показали, что децитабин оказывает цитотоксическое действие на ВСЕ клетки. В связи с этим были проведены два клинических исследования, посвященных децитабину у пациентов со ВСЕМИ. Garcia-Manero et al. [3] провели исследование фазы I децитабина с или без гипер-CVAD (циклофосфамид, винкристин, адриамицин и дексаметазон) у взрослых пациентов с рецидивирующим / рефрактерным ВС. CR был достигнут у семи из 30 пациентов (23%), получавших децитабин самостоятельно, и у 13 из 25 пациентов (52%) получали комбинацию децитабина и гипер-CVAD. Совсем недавно исследование II фазы исследовало эффективность децитабина и вориностата плюс химиотерапию у пациентов с рецидивирующим / рефрактерным ВС [4]. Затем вводили децитабин (внутривенная инфузия 15 мг / м2 в течение 1 часа, в течение 4 дней) и вориностат (230 мг / м2, разделяемый дважды в день перорально, в течение 4 дней), а затем винкристин, преднизон, пэгилированная аспарагиназа и доксорубицин. Четыре из 13 пациентов (30,8%) достигли полной ремиссии. Общий коэффициент ответа (CR + частичный ответ) составлял 46,2%.
У пожилых пациентов с лейкемией имеются ограниченные варианты лечения из-за токсичности, связанной со стандартной терапией. Однако децитабин хорошо переносится с контролируемым профилем токсичности у пожилых пациентов с ОМЛ. Рандомизированное исследование III фазы у пожилых пациентов с AML показало, что частота побочных эффектов (AEs) была сходной для децитабина и низкозатратного цитарабина, даже если воздействие исследуемого препарата было более длительным с децитабином, чем при низкой дозе цитарабина. У 3-х или 4-х связанных с наркотиками AE у 141 пациента (59%), получавших децитабин, и у 144 пациентов (55%), получавших низкую дозу цитарабина. Наиболее распространенными наркотическими AE с децитабином были тромбоцитопения (27%), анемия (21%), нейтропения (24%) и фебрильная нейтропения (21%) [5].
Поскольку нет установленных методов лечения MPAL, мы решили использовать децитабин, поскольку он показывает преимущества как для лимфоидных, так и для миелоидных клеток. Безопасность и переносимость также были важны для нашего пациента, так как она была пожилой с низким уровнем работоспособности. Фактически, децитабин эффективен как при лимфоидном лейкозе, так и при миелоидном лейкозе, и он связан с благоприятным профилем безопасности и хорошей переносимостью у пожилых пациентов. У нашего пациента децитабин был эффективным и хорошо переносимым, и пациент оставался в состоянии ремиссии в течение как минимум 5 месяцев.
Таким образом, мы приводим случай MPAL, который успешно обрабатывался децитабином. Более того, если применять в течение более длительных периодов времени, можно ожидать, что лечение децитабином еще больше улучшит выживаемость, хотя также были полезны четыре цикла. Поэтому мы предлагаем, чтобы децитабин можно было считать допустимым вариантом лечения в MPAL.
Не сообщалось о потенциальном конфликте интересов, относящемся к этой статье.
Биопсия костного мозга и аспирация при постановке диагноза. Большинство (60,8%) рассеянных клеток были незрелыми взрывными клетками. Взрывы были малыми и средними по размеру с тонким ядерным хроматином, отчетливыми ядрышками и скудной базофильной цитоплазмой. У некоторых также были цитоплазматические выступы. Ауэр-стержни не были обнаружены, а пропорции других гемопоэтических клеток были уменьшены. (A) Биопсия костного мозга (H & E, × 100). (B) Устремление костного мозга (пятно Wright-Giemsa, × 1,000).
Биопсия костного мозга и аспирация после четырех циклов децитабина. Нет заметных незрелых лимфоидных и миелоидных клеточных кластеров. (A) Биопсия костного мозга (H & E, × 100). (B) Устремление костного мозга (пятно Wright-Giemsa, × 1,000).

Автор Статьи: Крючкова Оксана Александровна.
Острый лейкоз— это патологическое заболевание костного мозга, заключающееся в том, что происходит поражение клеток костного мозга (в частности лейкоцитов), в результате чего происходит их видоизменение, а затем начинается ненормально усиленное деление измененных клеток. Распространенность острого лейкоза велика (одна из самых частых форм гемобластозов), и варьирует от 3 до 5 человек на 100.000 населения, причем у взрослых после сорока лет он возникает в 3 раза чаще чем у детей. Если классифицировать по видам лейкоза, то у взрослого населения чаще выставляется диагноз острого миелобластного лейкоза, у детей же преобладают лимфобластные формы лейкоза.
Острый лейкоз: основные причины.
Основной причиной, в результате которой развивается данная патология, является то, что происходит мутация клеток костного мозга, отвечающих за гемопоэз. Эти клетки и являются родоначальниками опухолевых ростков, в которых сначала происходит массовой размножение патологически измененных клеток, а затем их распространение по всему организму больного. Причем мутационные изменения происходят в тот период, когда клетки костного мозга находятся еще на самых ранних этапах развития- бластные формы, что в дальнейшем ведет к тому, что именно эти бластные формы начинают пролиферативные процессы в костном мозге. Происходит постепенное и практически полное замещение нормальных клеток крови бластами. А их перенос с током крови в различные органы вызывает инфильтративные изменения в последних. Эти изменения носят лейкемический характер.

При этом, несмотря на современные этапы развития медицины, до сих пор остается неизвестным что приводит к тому, что данная мутация происходит в организме пациента. Можно лишь выделить предрасполагающие факторы, которые могут привести к развитию мутации. Это:
- Ионизирующее излучение.
- Наследственная предрасположенность. Если у кого то из ближайших родственников имеется данное заболевание, то шанс того, что оно будет в следующих поколениях велик. Кроме того, наличие патологии хромосомной (Дауна или Клайнфельтера болезни) также может служить одной из причин развития лейкозов.
- Воздействие на организм человека отравляющих веществ, веществ запускающих канцерогенез- развитие опухолей в организме.
- Прием цитостатиков при некоторых онкологических заболеваниях.
- В ряде случаев причиной развития лейкоза может служить проведение терапии лекарственными препаратами при наличии сопутствующей патологии- гемобластозов.
- Некоторые вирусные заболевания также могут стать причиной развития лейкозов.
- Различные патологические изменения со стороны кроветворной системы.
Острый лейкоз: классификация.
Классификация принятая в 1976 году совместно группой врачей-гематологов из Франции, Великобритании и Америки. В ее основе лежит деление данного заболевания по цитохимическим и морфологическим признакам. Таким образом эта классификация выделила 2 вида лейкозов- лимфобластного происхождения и миелоидного (нелимфобластного) происхождения. Во всем мире она получила название FAB-классификации. Вот как произошло разделение патологии согласно ей:

Острые лейкозы миелоидного происхождения:
- М0— если бластные клетки имеют недифференцированный характер.
- М1— лейкоз не имеющий признаков того, что бластные клетки созрели.
- М2— лейкоз при котором имеются признаки того, что бластные клетки находятся в зрелом состоянии.
- М3— лейкоз промиелоцитарный.
- М4— лейкоз миеломоноцитарный.
- –М4-Е0— эта степень выставляется при наличии в анализе крови эозинофилов, имеющий аномальный характер развития.
- М5— лейкоз моноцитарный/ монобластный.
- –М5а— выставляется если в анализе крови практически все клетки представляют собой монобласты. Тогда лейкоз считается недифференцированным.
- –М5b— в анализе крови выявляют признаки диффе5ренцирования клеток крови. Причем клетки представляют собой моноцитарный ряд. Монобласты при этом находятся в количестве до восьмидесяти процентов, а все остальное составляют моноциты и промоноциты.
- М6— лейкоз имеющий острое течение, причем основной росток-эритроцитарный.
- М7— мегакариобластный острый лейкоз.
Острые лейкозы лимфобластного происхождения:
- L1 – данный тип встречается в основном в детском возрасте и характеризуется тем, что бластные клетки имеют малые размеры.
- L2 – встречается в основном у взрослого населения. Бластные клетки имеют крупные размеры.
- L3 – бластные клетки сходны с клетками, которые наблюдаются при лимфомах.
Данная классификация хоть и характеризует лейкозы по типу клеток, но совершенно не дает представления о том, как организм человека, у которого наблюдается данная патология отвечает на проводимую лечебную терапию, не показывает того, какие особенности в клиническом течении имеет тот или иной тип лейкоза. Поэтому была предложена другая классификация. Она основана на иммунофенотипических особенностях лимфобластного лейкоза. Согласно данной классификации выделяют:
- Острый лимфобластный лейкоз про-В-клеточный.
- Острый лимфобластный лейкоз общий В-клеточный.
- Острый лимфобластный лейкоз пре-В-клеточный.
- В-клеточный острый лимфобластный лейкоз.
- Острый лимфобластный лейкоз про-Т-клеточный.
- Острый лимфобластный лейкоз пре-Т-клеточный.
- Т-клеточный кортикальный острый лимфобластный лейкоз.
- Т-клеточный зрелый острый лимфобластный лейкоз.
В 2008 году принята классификация ВОЗ. Согласно ей выделяют:
- Острые лейкозы миелоидного происхождения и новообразования, появившиеся из тех же клеток-предшественников, что и сам лейкоз.
А) Лейкоз острый миелоидный, при котором часто и стабильно повторяются различные цитогенетические аномалии.
Б) Миелоидный острый лейкоз при котором изменения в кроветворной системе связаны с миелодисплазиями.
В) Новообразования миелоидного типа, которые возникли вследствие проводимой терапии.
Г) Миелоидные острые лейкозы, которые не удалось специфицировать каким-либо образом.
Д) Саркома миелоидного происхождения.
Е) Опухоли, развивающиеся из клеток, имеющих бластное плазмоцитоидное дендритное происхождение.
Ж) Патологические процессы миелопролиферативного характера, наблюдаемые при синдроме Дауна.
- Лейкозы острые, которые невозможно дифференцировать или они имеют смешанный фенотип.
А) Лейкоз острый недифференцированный.
Б) Лейкоз острый, имеющий смешанный фенотип t(9;22)(q34;q11.2); BCR-ABL1.
В) Лейкоз острый, имеющий смешанный фенотип t(v;11q23); MLL с перестройкой.
Г) Лейкоз острый, имеющий смешанный В- миелоидный фенотип, который не удается специфицировать никаким другим образом.
Д) Лейкоз острый, имеющий смешанный Т- миелоидный фенотип, который не удается специфицировать никаким другим образом.
Е) Острый лейкоз, имеющий смешанный фенотип, при этом он не поддается никакой спецификации.
Ж) Иные виды лейкозов.
- Острые лейкозы, имеющие Т- или В- лимфобластное происхождение, новообразования лимфоидного генеза.
А) Лейкоз или лимфома В-лимфобластного происхождения, при этом никак иначе специфицировать данную патологию невозможно.
Б) Лейкоз или лимфома В-лимфобластного происхождения, при котором наблюдаются цитогенетические аномалии, при этом они повторяются довольно стабильно.
В) Лейкоз или лимфома, имеющие Т-лимфобластное происхождение.

Профессор Шатохин Юрий Васильевич
ДМН, Зав. кафедрой гематологии РостГМУ.
![]()
Профессор Лысенко Ирина Борисовна
ДМН, Зав. отд. гематологии Ростовского Онкологического Института.
![]()
Снежко Ирина Викторовна
Кандидат медицинских наук Ассистент кафедры гематологии РостГМУ Врач высшей квалификационной категории.
Острый лейкоз – это заболевание кроветворной системы, при котором происходят нарушения в работе костного мозга человека. Лейкоциты заменяются незрелыми клетками. Нарушается формула крови. Поражаются ткани и органы всего организма. От хронического течения отличается скоростью прогрессирования патологии и по морфологическим признакам. Болезнь наиболее распространенная среди онкогематологических процессов.
Острая форма заболевания делится на 2 основные формы:
- Острый миелобластный лейкоз. Код по МКБ-10 – С92. Диагностируется у взрослых. Представлен миелоцитами.
- Лимфобластный рак крови. Код по МКБ-10 – С91. Выявляется у детей. Представлен предшественниками лимфоцитов.
Для острого течения болезни характерны следующие виды рака крови:
- Монобластный лейкоз развивается из недоразвитых моноцитов.
- Мегакариобластный рак возникает, когда незрелый тромбоцит начинает делиться.
- Миеломонобластный злокачественный процесс формируют предшественники гранулоцитов и моноцитов.
- Недифференцированный рак развивается на основе стволовой клетки, продуцирующей предшественников, не поддающихся дифференцировке.
- Промиелоцитарный лейкоз является разновидностью миелобластной патологии. Возникает из молодых гранулоцитов. Промиелоцитная клетка отличается крупным размером и содержанием в ядре хроматина.
- Плазмобластный вид рака может быть первичный, при этом пациент не имел проблем со здоровьем до начала болезни, и вторичным, когда патология развивается на фоне миеломной болезни.
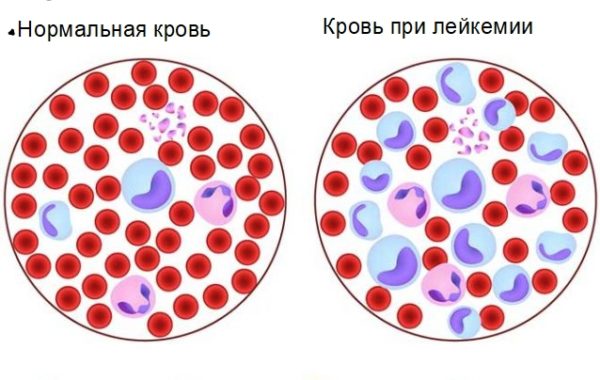
Этиология заболевания
Острый процесс развивается на фоне возникновения опухолевого клона, получившегося из-за сложных мутаций в костном мозге. Нормальная клетка не дозревает и выпускается в кровоток неполноценной. Начинается деление и распространение бластов, которые поражают костный мозг и другие органы человека. Происходит лейкемическая инфильтрация.
Точные причины, почему происходит мутация, неизвестны. Гематологи отмечают взаимосвязь вспышки заболевания с определёнными факторами:
- Основная предполагаемая причина развития рака крови – результат генетических мутаций в эмбриональном периоде. Дети с врождёнными синдромами наиболее подвержены развитию острого лейкоза.
- Наследственная предрасположенность провоцирует онкологический процесс у человека, чьи кровные родственники страдали от лейкемии.
- Радиационное облучение может поражать кроветворные органы, нарушать их функции и изменять вид кровяных телец.
- Профессиональные издержки, при которых человек вынужден контактировать с тяжёлыми химическими элементами.
- Лечение других онкологических болезней химиопрепаратами и ионизирующим излучением вызывает данное заболевание.
- Лейкоз может возникать на фоне тяжёлых вирусных патологий, которые угнетают иммунитет.

Классификация болезни
Онкологические процессы крови классифицируют по FAB:
- Острые лимфобластные патологии в любом возрасте имеют формы:
- Пре-В;
- В;
- Пре-Т;
- Т;
- Ни Т, ни В.
- Острый миелоидный лейкоз характеризуется следующими видами:
- Миелобластный рак вызван предшественниками гранулоцитов;
- При миеломонобластной патологии основные злокачественные клетки – монобласты;
- При лейкозе мегакариобластном отмечаются недифференцированные предшественники тромбоцитов;
- Эритробластный вид представлен делением незрелых эритроцитов.
- Острая недифференцированная лейкемия.
При острых лейкозах патология развивается в течение 3-х стадий:
- Этап зарождения болезни, когда клетка подвергается первой мутации. Показатели крови изменяются. Возникают первые симптомы.
- На развернутой стадии симптомы ярко выражены. Происходит метастазирование в органы и лимфатическую систему. При лечении возможна неполная или стойкая ремиссия, после которой может возникнуть рецидив или полное выздоровление.
- При терминальной стадии максимально поражается кроветворная система. Мутационный процесс необратим.
Отличия хронической формы лейкоза от острой заключаются в том, что лейкоциты дозревают, но лишаются способности защищать организм от внешних воздействий. Поэтому анализ крови может долго содержать сформировавшиеся клетки. Хронический рак развивается от 4-х до 12-ти лет.
Острый процесс никогда не сможет перейти в хронический и наоборот.
Клиническая картина
Симптомы острого лейкоза взрослых и детей схожи между собой. На начальной стадии больной отмечает признаки простуды. Затем развиваются воспалительные процессы в ротовой полости (стоматит, гингивит), не поддающиеся лечению. При этой болезни возникают недомогание, утомляемость, боль в костях и суставах, обильное потоотделение, повышение температуры тела, тошнота, рвота с кровью. Больной отказывается от еды, быстро теряет вес. Кожные покровы приобретают серый бледный цвет. Обнаружить процесс может гемограмма, выполняемая для диагностики другого заболевания.
Нарушается процесс создания эритроцитов, развивается анемия. Больной жалуется на кровоточивость слизистых оболочек. Кожные покровы бледнеют, отмечается учащённое сердцебиение, больному тяжело двигаться из-за слабости в теле и головокружения, начинают выпадать волосы. Ухудшается состояние зубов и ногтей. Организм поражают грибки и бактерии.
Клиника заболевания развивается стремительно:
- Тело больного покрывается синяками и кровоподтеками. Часто возникают носовые и желудочные кровотечения. Воспаляются лимфатические узлы и миндалины. Происходит метастазирование в органы и позвоночник. Кожа покрывается инфильтратами. Лёгкие, сердце и почки перестают нормально функционировать.
- Поражается головной мозг. Развиваются эпилептические припадки, помутнение рассудка, нарушение зрения и речи. Продолжительность жизни резко сокращается.
Способы диагностики
К определению проблемы врачи подходят с особым вниманием. Разновидности лейкоза требуют индивидуального лечения. Диагноз ставится на основе результатов лабораторных анализов и инструментальных диагностик.

Важна диагностика периферической крови и ликвора:
- При остром лейкозе результат анализа крови покажет сильное снижение гемоглобина, тромбоцитов, повышенный показатель СОЭ. Лейкоцитарный индекс значительно изменен. Обнаруживаются бласты.
- Исследование костного мозга, миелограмма обнаруживает увеличенное количество бластов, лимфоцитов и полное или частичное отсутствие гигантских клеток – мегакариоцитов.
Для диагностики острого лейкоза смешанного фенотипа используют 4-цветную проточную цитометрию.
Метастазы обнаруживают с помощью ультразвуковой диагностики, магнитно-резонансной и компьютерной томографии, эхокардиографии и рентгенографии.
Проводят диагностику и исключение заболеваний, подавляющих иммунитет человека. ВИЧ, цитомегаловирус, инфекционный мононуклеоз и лейкемоидные реакции при инфекционных заболеваниях имеют одинаковую симптоматику с острым лейкозом.
Лечебная тактика
Лечение проводят в стерильных условиях стационара, потому что пациент особо подвержен бактериям и инфекциям. Необходима обработка ротовой полости, половых органов и пролежней для предотвращения присоединения патогенной микрофлоры.
Клинические рекомендации основываются на соблюдении высококалорийной богатой витаминами диете. Пища не должна вызывать брожения. Исключаются жирные сорта мяса, копчёная и жареная пища. Строго запрещено употребление спиртосодержащих напитков. Разрешено есть растительную пищу после термической обработки, варёную рыбу и птицу, каши и травяные чаи.
Основное лечение заключается в проведении комплексной химиотерапии, продолжительность которой занимает до 6-ти недель. После достижения ремиссии курс приёма препаратов продолжается в домашних условиях. Следующие 3 года пациент принимает противорецидивные лекарства.
При вторичных новообразованиях применяют лучевую терапию. Метод уничтожает аномальные клетки и устраняет болевые ощущения в теле больного.
Действия врачей направлены на достижение ремиссии, закрепление результата и поддержание эффекта.
Масштабное развитие атипичных клеток и полное поражение костного мозга требует трансплантации донорского материала. Метод проводят путём интенсивной химиотерапии, направленной на уничтожение собственного кроветворного органа. В этот период человек лишается иммунитета и организм не в силах бороться с простейшими инфекциями. Поэтому пациента содержат в специализированном стерильном блоке, доступ в который имеет только медперсонал. Помещение обрабатывается дезинфицирующими средствами. Малейший контакт с внешним миром может стать причиной скоропостижной смерти.
Забор донорского материала проводят из кости бедра или ребра. Введение новых клеток происходит как при переливании крови. Катетер вводят в артерию.
Донорами могут стать близкие родственники или посторонние люди, однако подходящий биоматериал тяжело найти. Для этой роли лучше всего подходят однояйцевые близнецы.
Процент выживших после проведения трансплантации – 50%. Организм остальных пациентов не принимает чужой материал, и развиваются осложнения.
Прогнозы на жизнь
Лейкоз даёт непредвиденные осложнения. Жизненно важные органы могут включиться в раковый процесс в любой момент. Постоянное наблюдение врачей и нахождение в стационаре в период лечения способствуют предотвращению опасных ситуаций.
После трансплантации костного мозга и его приживления формируется новый иммунитет и здоровые клетки крови. Человек возвращается к нормальной жизни. После подготовительного этапа, на котором были уничтожены раковые клетки, риск возникновения вторичного заболевания сводится к нулю. Пациент наблюдается у онкогематолога следующие 5 лет. Если за это время не возникает жалоб и симптомов, человек считается здоровым.
Прогноз на жизнь при остром лейкозе положительный при вовремя начатом лечении. Терапевтические действия оказывают положительное влияние в 80% случаев. 20% пациентов полностью выздоравливают.
Острый лейкоз — злокачественное заболевание кроветворной системы; морфологический субстрат — властные клетки. Частота. 13,2 случаев на 100000 населения среди мужчин и 7,7 случаев на 100 000 населения среди женщин. Классификация и эпидемиология. По цитохимическим исследованиям (определение ферментов, характерных для разных бласт-ных клеток) различают лимфобластные и миелобластные лейкозы. Франко-американо-британская (FAB) классификация основана на морфологии лейкемических клеток (строение ядра, соотношение размеров ядра и цитоплазмы)
● Острый миелобластный (нелимфоб-ластный) лейкоз (ОМЛ)
● М0- без созревания клеток, миелогенная дифференцировка доказывается только иммунологически
● М, — без созревания клеток
● М2 — ОМЛ с дифференцировкой клеток
● М5- моно-бластный лейкоз
● М7 — мегакариобластный лейкоз
● Острый лимфобластный лейкоз (ОЛЛ)
● L, — без дифференцировки клеток (морфологически гомогенные клетки)
● L2 — с дифференцировкой клеток (морфологически гетерогенная популяция клеток)
● L3 — беркеттоподобные лейкозы
● Недифференцируемый лейкоз — к этой категории относят лейкозы, клетки которых невозможно идентифицировать как миелобластные или лимфобластные (ни химическими, ни иммунологическими методами)
● рефрактерная анемия без бластоза (в костном мозге бласты
● рефрактерная анемия с бластозом (в костном мозге бласты
● промиелоциты 10-30%). Иммуногистохимическое исследование (определение клеточного фенотипа) необходимо для уточнения иммунологического варианта лейкоза, влияющего на схему лечения и клинический прогноз
● Острый лимфобластный лейкоз (247640, р, мутация соматических клеток) — 85% всех случаев диагностируют у детей, составляя до 90% всех лейкозов детского возраста. У взрослых развивается достаточно редко. Цитохимические реакции — положительная на терминальную дезоксинуклеотидил трансферазу, отрицательные на миелопероксидазу, гликоген. Использование маркёров клеточной мембраны позволило выделить подвиды
● В-клеточные (75% всех случаев) с отсутствием розеткообразования
● реже -другие варианты. Дифференциальная диагностика подвидов важна для прогноза, т.к. Т-клеточные варианты плохо поддаются лечению
● Острый миелобластный лейкоз (острая гранулоцитарная лейкемия, острая миелоцитарная лейкемия) чаще возникают у взрослых, подтип зависит от уровня дифференцировки клеток. В большинстве случаев миелобластный клон клеток происходит из стволовых кроветворных клеток, способных к множественной дифференцировке в колониеобразующие единицы гранулоцитов, эритроцитов, макрофагов или мегакариоцитов, поэтому у большинства больных злокачественные клоны не имеют признаков лимфоидных или эритроидных ростков
● ОМЛ наблюдают наиболее часто; имеет четыре варианта (М0 — М3)
● mo и М1 — острый без дифференцировки клеток
● М2 — острый с дифференцировкой клеток
● М3 — промиелобласт-ный лейкоз, характеризуется наличием аномальных промиелоцитов с гигантскими гранулами; часто сочетается с ДВС, обусловленным
тромбопластическим эффектом гранул, что подвергает сомнению целесообразность применения гепарина при терапии. Прогноз при М:, более благоприятен, чем при М0-М,
● Миеломонобластный и монобластный лейкозы (соответственно М4 и М5) характеризуются преобладанием неэритроидных клеток типа монобластов. М
● Эрит-ролейкоз (Мв). Вариант острого миелобластного лейкоза, сопровождающийся усиленной пролиферацией эритроидных предшественников; характерно наличие аномальных бластных ядросодержащих эритроцитов. Эффективность лечения эритролейкоза сходна с результатами терапии других подтипов или несколько ниже
● Мегакариобластный лейкоз (М7) — редкий вариант, сочетающийся с фиброзом костного мозга (острый миелосклероз). Плохо поддаётся терапии. Прогноз неблагоприятный.
Патогенез обусловлен пролиферацией опухолевых клеток в костном мозге и их метастазированием в различные органы. Угнетение нормального кроветворения связано с двумя основными факторами
● Повреждение и вытеснение нормального ростка кроветворения низкодифференцированными лейкемическими клетками
● Выработка властными клетками ингибиторов, подавляющих рост нормальных кроветворных клеток.
✎ Клиническая картина острых лейкозов определяется степенью инфильтрации костного мозга бластными клетками и угнетения ростков кроветворения
● Угнетение костномозгового кроветворения
● Анемический синдром (миелофтизная анемия)
● Геморрагический диатез (вследствие тромбоцитопении отмечают кожные геморрагии — петехии, экхимозы; кровотечения из слизистых оболочек — носовые кровотечения, внутренние кровотечения)
● Инфекции (нарушение функции лейкоцитов)
● Увеличение лимфатических узлов
● Поражения кожи (лейкемиды), мозговых оболочек (нейролейкоз) и внутренних органов
● Снижение массы тела
✎ Диагноз: острого лейкоза подтверждают наличием бластов в костном мозге. Для идентификации подтипа лейкоза применяют гистохимические, иммунологические и цитогенетические методы исследования.
● Панцитопения при увеличении бластных форм (в 50% случаев -- гиперлейкоцитоз)
● Гиперурикемия вследствие ускоренного жизненного цикла клеток
● Гипофибри-ногенемия и повышение содержания продуктов разрушения фибрина вследствие сопутствующего ДВС.
Влияние лекарственных препаратов. Глюкокортикоиды не следует назначать до постановки окончательного диагноза. Высокая чувствительность к преднизолону бластных клеток приводит к их разрушению и трансформации, затрудняющим диагностику.
✎ Лечение комплексное; цель — достижение полной ремиссии.
● Химиотерапия состоит из нескольких этапов
● При ОЛЛ — одна из схем: комбинации винкри-стина в/в еженедельно, преднизолона внутрь ежедневно, даунорубицина (рубомицина гидрохлорид) и L-аспарагиназы в течение 1-2 мес непрерывно
● При остром миелобластном лейкозе — сочетание цитарабина в/в капельно или п/к каждые 12 ч в течение 6-7 дней, даунорубицина (рубомицина гидрохлорид) в/в в течение 3 дней, иногда в сочетании с тиогуанином. Более интенсивная постиндукционная химиотерапия, уничтожающая оставшиеся лейкозные клетки, увеличивает длительность ремиссии
● Консолидация ремиссии: продолжение системной химиотерапии и профилактика нейролейкоза при ОЛЛ (эндолюмбальное введение метотрексата при ОЛЛ в сочетании с лучевой терапией на головной мозг с захватом сегментов С1-С2 спинного мозга)
● Поддерживающая терапия: периодические курсы реиндукции ремиссии.
● Трансплантация костного мозга — метод выбора при острых миелобластных лейкозах и при рецидивах всех острых лейкозов. Главное условие для проведения трансплантации — полная клинико-гематологическая ремиссия (бластов в костном мозге
● Оптимальный донор — однояйцевый близнец или сибс; чаще используют доноров с 35% совпадением по Аг HLA. При отсутствии совместимых доноров используют аутотрансплантацию костного мозга, взятого в период ремиссии
● Главное осложнение — реакция трансплантат против хозяина. Развивается вследствие пересадки Т-лимфоцитов донора, распознающих Аг реципиента как чужеродные и вызывающих иммунную реакцию против них. Острая реакция развивается в течение 20-100 дней после трансплантации, отсроченная — через 6-12 мес
● Основные органы-мишени — кожа (дерматит), ЖКТ (диарея) и печень (токсический гепатит)
● Лечение длительное, обычно ограничено назначением комбинаций преднизолона, циклоспорина и малых доз азатиоприна
● На течение посттрансплантационного периода влияют также подготовительные схемы лечения, развитие интерстициальной пневмонии, отторжение трансплантата (редко).
● Трансфузия эритроцитарной массы. Показания: Нb ниже 70 г/л при клинических проявлениях анемии, перед предстоящим введением цитостатиков. При компенсированном состоянии больного следует ограничить показания к заместительной терапии, во избежание заражения посттрансфузионным гепатитом и нежелательной сенсибилизации
● Трансфузия свежей тромбоцитарной массы (снижает риск кровотечений). Показания: содержание тромбоцитов менее 20х109/л; геморрагический синдром при содержании тромбоцитов менее 50х109/л.
● Профилактика инфекций — главное условие выживания пациентов с нейтропенией, возникшей вследствие химиотерапии
● Полная изоляция пациента
● Строгий санитарно-дезинфекционный режим — частые влажные уборки (до 4-5 р/сут), проветривание и кварцевание палат; использование одноразового инструментария, стерильной одежды медицинского персонала
● Профилактическое применение антибиотиков, противовирусных препаратов (при количестве сегментоядерных нейтрофилов
● При повышении температуры тела проводят клиническое и бактериологическое исследования и немедленно начинают
лечение комбинациями бактерицидных антибиотиков широкого спектра действия: цефалоспоринов, аминогликозидов (тобрамицин) и полусинтетических пенициллинов
● При вторичных подъёмах температуры тела, возникших после лечения антибиотиками широкого спектра действия, эмпирически применяют противогрибковые средства (амфотери-цин В)
● Для профилактики и лечения нейтропении можно назначить молграмостим.
✎ Прогноз
● Прогноз у детей с острым лимфолейкозом хороший: у 95% и более наступает полная ремиссия. У 70-80% больных проявлений болезни нет в течение 5 лет, их считают излечившимися. При возникновении рецидива в большинстве случаев можно достичь второй полной ремиссии. Больные со второй ремиссией — кандидаты на трансплантацию костного мозга с вероятностью долговременного выживания в 35-65% случаев
● Прогноз у больных острым миелобластным лейкозом неблагоприятный. У 75% больных, получающих адекватное лечение с использованием современных химиотерапев-тических схем, достигают полной ремиссии, 25% больных погибают (длительность ремиссии — 12-18 мес). Есть сообщения об излечении в 20% случаев при продолжении интенсивной терапии после ремиссии. Больным моложе 30 лет после достижения первой полной ремиссии можно проводить трансплантацию костного мозга. У 50% молодых больных, подвергшихся аллогенной трансплантации, развивается длительная ремиссия. Обнадёживающие результаты получены и при пересадках аутологичного костного мозга. Возрастные особенности
● Дети лучше поддаются лечению
● Пожилые. Снижена толерантность к аллогенному костному мозгу. Максимальный возраст для трансплантации — 50 лет. Аутологичную трансплантацию можно проводить пациентам старше 50 лет при отсутствии органных поражений и общем соматическом благополучии.
✎ См. также: Лейкоз, рис. 1-8-1-12
✎ Сокращения:
● ОЛЛ — острый лимфобластный лейкоз
● ОМЛ -острый миелобластный лейкоз
✎ МКБ: .
● С91 Лимфоидный лейкоз
● С92 Миелоидный лейкоз
● С93 Миелоцитарный лейкоз
● С94 Другой лейкоз уточнённого клеточного типа
● С95 Лейкоз неуточнённого клеточного типа Литература. 34: 154-159
Читайте также:



