Основное звено патогенеза рака простаты тест
Рак простаты — это злокачественное новообразование, возникающее в результате перерождения собственных клеток предстательной железы. Опухоль имеет небольшие размеры и долгое время не причиняет пациенту беспокойства, но она имеет свойство расти и образовывать метастазы. Больше всех подвержены риску возникновения рака простаты мужчины после 50-ти лет, что объясняется различными возрастными гормональными изменениями.
- Этиология и патогенез рака простаты
- Классификация рака простаты
- Стадии развития рака простаты
- Симптомы рака простаты
- Диагностика рака простаты
- Лечение рака простаты
- Прогноз и профилактика рака простаты
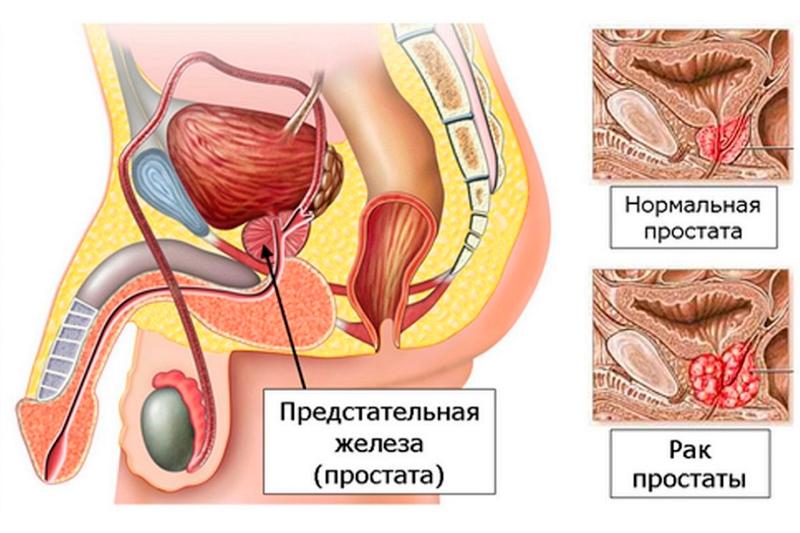
Предстательная железа — один из самых важных органов мужской половой сферы. Именно она отвечает за активность сперматозоидов, сперматогенез, оказывает влияние на сексуальное влечение мужчины, участвует в эрекции (перекрывает мочевой пузырь) и выполняет множество других функций. Располагается простата под мочевым пузырем, окружает уретру и находится между прямой кишкой и лобковой костью.
Этиология и патогенез рака простаты
Этиология развития данной патологии активно обсуждается среди ученых. Существует несколько теорий, весьма убедительно доказывающих, что есть ряд этиологических причин развития этой патологии, а именно:
- эндокринные факторы;
- наличие аденомы простаты;
- генетическая предрасположенность;
- влияние различных канцерогенов.
Кроме того, существуют некоторые факторы риска, способствующие развитию рака простаты:
- возраст мужчины более 50-ти лет;
- принадлежность к расе (более предрасположены к развитию рака простаты представители негроидной расы, а у азиатов рак простаты встречается крайне редко);
- возрастные изменения гормонального фона;
- неправильное питание (мужчины, употребляющие пищу, богатую животными жирами, более других подвержены риску заболевания);
- различные вирусные инфекции (чаще — ретровирусы);
- различные экзогенные факторы (ультрафиолетовое излучение и т.д.);
- производственные факторы.
Классификация рака простаты
Еще в 1971 году была предложена классификация рака простаты, согласно которой выделяются следующие гистологические формы данной патологии:
- Недифференцированные формы рака простаты. Для них характерно большое количество активно делящихся клеток различных форм и размеров.
- Малодифференцированные формы рака: анапластическая аденокарцинома, солидный рак, скиррозный рак и т.д.
- Дифференцированные формы рака простаты. Это рак, возникающий из железистого эпителия (аденокарцинома), плоского эпителия (плоскоклеточный рак простаты), кубического или пластического эпителия узких каналов (тубулярный рак) или концевых отделов некоторых желез (альвеолярный рак).
Согласно системе TNM, принято различать несколько стадий рака простаты:
- Т1: заболевание протекает абсолютно бессимптомно. Опухоль не обнаруживается ни при ручном, ни при ультразвуковых и рентгенологических исследованиях. Чаще всего на этой стадии рак бывает обнаружен только в том случае, если пациент проходит процедуру биопсии с последующим исследованием материала;
- Т2: рак простаты может быть определен при пальпаторном или инструментальном методах исследования. Опухоль ограничивается капсулой простаты или тканью железы;
- Т3: инвазия опухоли за пределы капсулы предстательной железы или в семенники;
- Т4: рак простаты распространяется на соседние органы и ткани (мочевой пузырь, прямую кишку, стенки таза или мышцу заднего прохода);
- N1: происходит метастазирование в близлежащие лимфатические узлы малого таза;
- М1: метастазы находятся в других внутренних органах, костно-мышечной системе и лимфоузлах.
Стадии развития рака простаты
Принято выделять четыре степени рака предстательной железы. В зависимости от того, на какой из этих стадий заболевание было диагностировано, и начато адекватное лечение, зависит возможность полного излечения пациента. Каждая стадия имеет свои характерные особенности:
- Первая стадия рака предстательной железы может быть полностью вылечена. Однако процесс заболевания на этом этапе протекает, как правило, абсолютно бессимптомно, поэтому рак простаты обнаруживается чаще всего случайно при обследовании пациентов по поводу каких-либо других заболеваний.
- Вторая стадия рака простаты характеризуется отсутствием каких-либо клинических проявлений. Размер новообразования больше, чем при первой стадии, её уже можно выявить при пальпаторном обследовании. За пределы простаты опухоль не выходит, метастазы не развиваются.
- Третья стадия заболевания отличается от предыдущих наличием характерных симптомов. У пациента наблюдаются явления гематурии, появляется болевой синдром (в лобковой области и области промежности). На данном этапе происходит прорастание опухоли в соседние органы и регионарные лимфатические узлы.
- Рак простаты четвертой степени не поддается лечению. Опухоль имеет большие размеры, а метастазы распространяются на соседние органы, ткани, кости и лимфатические узлы.
Симптомы рака простаты
В дебюте заболевания рак простаты у мужчин не имеет каких-либо специфических симптомов или других проявлений. Имеют место некоторые признаки, напоминающие воспалительные заболевания предстательной железы. Это могут быть, например, частые позывы к мочеиспусканию. Сам акт мочеиспускания сопровождается болезненными ощущениями, а после него остается чувство не полностью опорожненного мочевого пузыря. В некоторых случаях больные раком простаты страдают недержанием мочи.
Характерные симптомы онкологического заболевания проявляются, когда опухоль приобретает достаточно большие размеры, выходит за границы предстательной железы, наблюдается развитие метастазов. При метастазировании в кости больной испытывает постоянную тупую боль в ребрах или поясничной области.
Если стадия рака характеризуется как местно-распространенная, то у пациента появляются такие характерные симптомы, как кровь в моче или сперме, проблемы с эрекцией, анурия и т.д. Кроме того, на последних стадиях рака наблюдаются признаки острой почечной недостаточности, общей интоксикации организма и ухудшение соматического состояния (анемия, быстрая утомляемость, тошнота и головокружение, резкое похудение, нарушение функции сна и т.д.).
Диагностика рака простаты
Для того чтобы поставить точный диагноз, следует провести ряд диагностических мероприятий. Сначала проводится пальцевое исследование железы, помогающее выявить изменение в ее структуре (наличие инфильтратов, узлов и т.д.), увеличение железы в размерах, неоднородность структур и пр. Пальпация простаты выявляет те или иные изменения, но не позволяет поставить точный диагноз.
Наиболее информативным методом является биопсия предстательной железы с последующим исследованием полученного материала. Биопсия позволяет не только выявить наличие опухоли, но и определить, к какому именно типу новообразований она относится.
Важными методами диагностики являются ультразвуковое исследование и ультразвуковая допплерография, позволяющие визуализировать даже незначительные по размерам новообразования, что является важным моментом в ранней диагностике рака предстательной железы.
Судить о наличии рака простаты можно по показателю простатспецифического антигена в крови пациента. Если его уровень превышает 30 нг\мл, то можно уверенно говорить о раке простаты, если этот показатель колеблется от 20 до 30 нг\мл, то вероятность наличия рака простаты составляет 50-70%, при показателях от пяти до двух нг\мл рак простаты обнаруживается у одного из пяти пациентов.
Лечение рака простаты
Рак предстательной железы не имеет стандартов лечения в настоящее время. При выборе метода терапии учитывается стадия развития заболевания, возраст пациента, наличие осложнений или сопутствующих патологий, результаты анализа и, конечно, пожелания самого больного. На начальных этапах эффективным методом является хирургическое удаление предстательной железы, семенников, некоторых участков регионарных лимфоузлов, шейки мочевого пузыря и частично простатического отдела мочеиспускательного канала.
Медикаментозный подход включает гормональную терапию, направленную на уменьшение выработки мужских половых гормонов и, как следствие, некоторое замедление роста новообразования. В случае неэффективности подобной терапии применяется хирургическая кастрация.
Если у пациента рак простаты третьей или четвертой степени, то применяются радиотерапия или химиотерапия, направленные только на поддержание и продление жизни больного.
Прогноз и профилактика рака простаты
Врачи не могут объяснить, почему у одного мужчины возникает рак простаты, а у другого нет. Однако существуют факторы риска и профилактические меры. Некоторые факторы риска можно избежать самостоятельно, например, курения, наличия избыточного веса, злоупотребления алкоголем и пр., но не удается обойти генетическую предрасположенность.
Ежегодное профилактическое обследование мужчин в возрасте более 45-ти лет у врачей урологов-андрологов — эффективная профилактическая мера. Она позволяет своевременно диагностировать рак простаты и вовремя начать адекватную терапию.
Наряду с профилактическим осмотром большое значение имеют диета и образ жизни, физическая активность мужчины.
На первой и второй стадиях заболевания полное хирургическое удаление предстательной железы позволяет врачам прогнозировать пятилетнюю выживаемость у 75-80% больных и однолетнюю выживаемость — более чем у 50% пациентов.
На третьей и четвертой стадиях заболевания медицинский прогноз является крайне неблагоприятным. При адекватном лечении пятилетняя выживаемость прогнозируется у 50% больных, находящихся на третьей стадии рака простаты, а на четвертой стадии — лишь у 20%.
К сожалению, в современной медицине не существует каких-либо препаратов, снижающих риск заболевания раком простаты.
Эпидемиология
РПЖ — мировая социальная проблема. В 2002 г. в мире диагностировано 679 тыс. новых случаев РПЖ, что составило 11,7% всех онкологических заболеваний у мужчин, а в 5,8% случаев стало причиной смерти. В последние годы отмечена тенденция к росту заболеваемости РПЖ. Только в США в 2006 г. обнаружено 234 тыс. новых случаев рака предстательной железы. Следует отметить, что в разных странах эти показатели различны: например в Швеции, где велика средняя продолжительность жизни и сравнительно низка смертность от болезней, вызванных курением, РПЖ — самая частая опухоль у мужчин, составляющая 31,5% случаев всех онкологических заболеваний (по данным за 1999 г.).
Самую высокую заболеваемость наблюдают среди афроамериканцев, наименьшую — у китайцев. Однако даже в Китае зарегистрирован рост заболеваемости РПЖ. Многие исследователи связывают его с изменениями окружающей среды и стиля жизни (например, употребление высококалорийной жирной пищи). В странах с широко распространённым скринингом и ранней диагностикой в последние годы отмечены высокие показатели пятилетней выживаемости (около 100%), что связано с диагностикой и лечением локализованных и местнораспространённых форм. Аналогичный показатель при диссеминированном процессе составляет не более 30%.
В последние годы в крупных городах России отмечена тенденция к увеличению доли локализованных форм в общей структуре обнаруженного РПЖ. В 1999 г. доля ранних стадий рака предстательной железы составляла всего 20%, к 2004 г. — 40%. Заболеваемость и смертность во всех странах возрастает с увеличением возраста пациентов. По данным National Cancer Institute (США, 2004), в возрасте 40—49 лет заболеваемость и смертность от РПЖ составляет 25 и 0,6 случаев на 100 тыс. населения, а в возрасте 50—59 лет — 237 и 6,1 случаев соответственно.
Заболеваемость РПЖ зависит от возраста, расы и наследственности пациентов. При РПЖ у ближайших родственников риск возникновения заболевания возрастает по крайней мере вдвое, если больны два родственника и более — в 5—11 раз. Около 9% случаев рака предстательной железы составляет истинный наследственный РПЖ. Он вероятен, если РПЖ был у трёх родственников и более или у двух родственников в возрасте до 55 лет. По данным аутопсий, распространённость заболевания во всём мире примерно одинакова. В то же время заболеваемость в разных странах различна: в США и Северной Европе она намного выше, чем в Юго-Восточной Азии.
Впрочем у японцев, проживающих на Гавайях, заболеваемость возрастает, а у населяющих Калифорнию — приближена к таковой у американцев. Судя по этим данным, в переходе от скрытого к клинически манифестирующему раку играют роль определённые факторы окружающей среды. Вместе с тем у японцев гораздо реже, чем у европейцев и американцев, обнаруживают мутации гена р53. Кроме того, мутации андрогенных рецепторов при латентном РПЖ встречают реже, чем при клинически выраженном заболевании.
По данным исследования Giovannucci Е. и соавт. (1999), риск развития онкологического заболевания у мужчин, выкуривающих более одной пачки сигарет ежедневно на протяжении десяти лет, на 85% выше, а риск смерти от РПЖ — на 200% больше по сравнению с некурящими. Однако значительной разницы в показателях заболеваемости и смертности между этими двумя группами не обнаружено. Hickey и соавт. (2001) изучили возможные биологические механизмы, объясняющие связь курения и рака предстательной железы: повреждающее действие кадмия, содержащегося в табаке; изменения гормонального фона; иммунная супрессия; мутации генов (например, р53). Таким образом, курение можно считать фактором риска РПЖ и его агрессивного течения.
В настоящее время отсутствуют данные о влиянии алкоголя па развитие РПЖ. Известно, что красное вино в связи с содержанием в нём ресвератрола оказывает протективное действие на клетки предстательной железы.
В последнее время были проведены исследования микро- и макроэлементов, входящих в обычный рацион питания, в целях поиска факторов, способных изменить или уменьшить риск развития РПЖ. По данным двух рандомизированных исследований, при ежедневном приёме селена в дозе 200 мг и витамина Е по 50 мг отмечено уменьшение риска возникновения рака предстательной железы на 52 и 36% соответственно. К 2013 г. будет закончено исследование SELECT (Selenium and Vitamin E Prostate Cancer Prevention Trial), изучающее эффективность селена и витамина Е в качестве химиопрофилактических средств.
Множество исследований посвящено изучению эффективности лекарственных средств, влияющих на андрогенный статус (ингибиторы 5α-редуктазы), жировой обмен (статины) и воспаление (нестероидные противовоспалительные средства). Поскольку андрогены участвуют в патогенезе РПЖ, ингибиторы 5α-редуктазы способны снизить риск возникновения заболевания на 25%, однако при этом возрастает доля низкодифференцированного рака. В настоящее время нельзя рекомендовать эти препараты для химиопрофилактики РПЖ.
Влияние нестероидных противовоспалительных средств (НПВС) и статинов на риск развития РПЖ чётко не доказано, поэтому их широкое использование с химиопрофилактической целью также не рекомендовано. Таким образом, наиболее важную роль в патогенезе рака предстательной железы играют наследственные факторы, а на его развитие влияют факторы окружающей среды.
Профилактика
Поскольку для течения рака предстательной железы характерен достаточно длительный латентный период, идеальным средством профилактики считают назначение превентивных средств. Кроме того, на важность профилактических мероприятий указывает высокая стоимость скрининга и лечения. Несмотря на успехи в изучении факторов риска РПЖ, до сих пор не существует мультифакторной модели, прогнозирующей риск заболевания (как, например, для рака молочной железы у женщин).
Многочисленные исследования продемонстрировали хорошие результаты использования ингибиторов 5α-редуктазы в качестве химиопрофилактических средств. Однако полученные данные предварительные и не могут служить руководством к действию. До сих пор не ясна целесообразность рекомендаций по изменению рациона в качестве профилактических мер (ограничение животных жиров и увеличение потребления фруктов, овощей и злаков). Тем не менее об этом следует сообщать мужчинам, чьи родственники страдают раком предстательной железы.
За последние 20 лет заболеваемость и смертность от РПЖ в большей мере снижена в странах Азии, чем в Европе и США, что можно объяснить влиянием генетических факторов, стиля жизни, рациона питания и окружающей среды.
Скрининг
Цель скрининга РПЖ — снижение смертности от рака путём раннего обнаружения опухолей. Раннюю диагностику проводят с помощью массовых или индивидуальных обследований. Показателем эффективности скрининга служит сокращение смертности от рака предстательной железы и обеспечение высокого качества жизни. Обнаружение опухолей и увеличение выживаемости не могут служить таким показателем, поскольку сама ранняя диагностика способствует повышению выживаемости (эффект опережения).
Во всех странах внедрение скрининга рака предстательной железы остаётся актуальным. Данные об уменьшении смертности в связи с применением скрининга противоречивы. Поскольку организация скрининговых исследований требует значительных финансовых затрат, необходимо предварительное решение вопросов о возрасте начала и прекращения скрининговых обследований и сроках повторных обследований.
Динамика смертности от рака предстательной железы в развитых странах различна. В США, Великобритании, Франции и Австрии её снижение происходит примерно равными темпами. Снижение смертности, наблюдаемое в последние годы в США, часто объясняют массовыми обследованиями (на основе определения простатоспецифичного антигена), но окончательного подтверждения этому пока нет.
Значение скрининга подтверждают данные исследования, проведённого в Тироле (Австрия). После внедрения программы раннего обнаружения и бесплатного лечения рака предстательной железы смертность от него снижалась на 33% быстрее, чем в остальной Австрии. Рандомизированное испытание в Квебеке (Канада) также показало снижение смертности в результате ранней диагностики.
Сравнение смертности от рака предстательной железы в Сиэтле, где были проведены массовые обследования, и Коннектикуте, где их не было, не показало существенных различий, хотя жителям Сиэтла регулярно определяли уровень простатоспецифичного антигена (ПСА) и они намного чаще получали радикальное лечение. Определять эффективность скрининга должны крупные рандомизированные исследования. Два таких испытания проходят в США и Европе; первые результаты ожидают в 2008 г.
Таким образом, для того чтобы рекомендовать массовые обследования для скрининга РПЖ, данных недостаточно. Американская и Европейская ассоциации урологов рекомендуют всем мужчинам старше 50 лет проводить определение уровня ПСА и пальцевое ректальное исследование. Только у 8% афроамериканцев в возрасте 40—50 лет, имеющих наследственную предрасположенность, при обследовании обнаружили патологию, однако у 55% из них диагноз РПЖ был подтверждён. Именно поэтому всем больным, входящим в группу риска, после 40 лет следует ежегодно проходить урологическое обследование.
В экономически развитых странах информированность населения о РПЖ поставлена на высокий уровень и большинство мужчин самостоятельно обращаются к врачу любой специальности для определения уровня ПСА. В России онконастороженность крайне низка, поэтому существует объективная необходимость в создании системы информирования потенциальных больных и популяризации ранней диагностики рака предстательной железы (местная пресса, телевидение).
Классификация
1) величина первичной опухоли (Т);
2) метастазы в региональных лимфатических узлах (N);
3) отдалённые метастазы (М).
Классификация рака предстательной железы по системе TNM (2007)
- Т — первичная опухоль.
- Тх — недостаточно данных для оценки первичной опухоли.
- Т0 — первичную опухоль не определяют.
- Т1 — опухоль клинически не обнаруживают, не пальпируют и не визуализируют специальными методами.
- Т1а — опухоль, случайно обнаруженная при гистологическом исследовании, составляет менее 5% резецированной ткани.
- Т1b — опухоль, случайно обнаруженная при гистологическом исследовании, составляет более 5% резецированной ткани.
- Т1с — опухоль диагностируют с помощью игольной биопсии (выполняют в связи с высоким уровнем простатоспецифичного антигена).
- Т2 — опухоль ограничена предстательной железой или распространена в капсулу.
- Т2а — опухоль поражает половину одной доли или меньше.
- Т21b — опухоль поражает более половины одной доли, но не обе доли.
- Т2с — опухоль поражает обе доли.
Примечание. Опухоль, диагностированную с помощью игольной биопсии в одной или обеих долях, но непальпируемую и невизуализируемую, классифицируют как Т1с.
- Т3 — опухоль распространена за пределы капсулы предстательной железы.
- Т3а — опухоль распространена за пределы капсулы (с одной или двух сторон).
- Т3b — опухоль распространена на семенной пузырёк.
Примечание.Распространение опухоли на верхушку предстательной железы или в капсулу (но не за её пределы) предстательной железы классифицируют как Т2, а не Т3.
- Т4 — несмещаемая опухоль или опухоль, распространённая на соседние структуры (не на семенные пузырьки): шейку мочевого пузыря, наружный сфинктер, прямую кишку, мышцу, поднимающую задний проход, и/иди тазовую стенку.
- N — регионарные лимфатические узлы
- Nx — недостаточно данных для оценки регионарных лимфатических узлов.
- N0 — метастазы в регионарных лимфатических узлах отсутствуют.
- N1 — метастазы в регионарных лимфатических узлах.
- М — отдалённые метастазы
- Мх — определить наличие отдаленных метастазов невозможно.
- М0 — признаки отдалённых метастазов отсутствуют.
- М1 — отдалённые метастазы.
- М1а — поражение нерегионарных лимфатических узлов.
- М1b — поражение костей.
- М1c — другая локализация отдалённых метастазов.
Патогенез
Патогенез заболевания обусловлен изменением функции половых желёз и концентрации мужских половых гормонов (андрогенов) в сыворотке крови. Однако половая активность не влияет на риск развития рака предстательной железы. В норме андрогены — стимуляторы роста, развития и функциональной активности предстательной железы. С возрастом в предстательной железе происходит усиление образования 5α-редуктазы, отвечающей за трансформацию тестостерона в дигидротестостерон, что приводит к увеличению уровня последнего в тканях железы. Дигидротестостерон, в свою очередь, индуцирует в клетках простаты синтез инсулиноподобного фактора роста.
Дигидротестостерон и инсулиноподобный фактор роста действуют на стромальную клетку аутокринным и паракринным путём и достигают эпителиальных клеток железы, усиливая в них синтез РНК. Таким образом, повышение содержания дигидротестостерона в предстательной железе — один из пусковых механизмов доброкачественных и злокачественных гиперпластических процессов. Открытие гена НРС-1 (наследственный рак предстательной железы) в I хромосоме подтвердило предрасположенность человека, носящего этот ген, к РПЖ.
В зависимости от формы, характера расположения железистых структур в опухоли и соотношения эпителиального и соединительнотканного компонентов гистологически различают:
- аденокарциному, происходящую из железистого эпителия;
- плоскоклеточный рак, происходящий из плоского эпителия;
- тубулярный рак, происходящий из узких каналов, выстланных эпителием (кубическим или призматическим), в просвете которых возможно обнаружение секрета;
- альвеолярный рак, происходящий из концевых отделов ветвящихся желез.
Вышеперечисленные формы рака называют дифференцированными.
Для диагностики наиболее распространённых очаговых поражений предстательной железы (гиперплазия, рак) необходимо знание зональной анатомии предстательной железы, предложенной McNeal. Рак обычно происходит из периферических отделов предстательной железы (в 90% случаев), в то время как гиперплазия — из центральной и транзиторной зон. В 5—25% случаев отмечено сочетание рака и гиперплазии предстательной железы. При патологоанатомическом исследовании поражённая раком предстательная железа имеет серо-белый цвет, плотную консистенцию, неровную (асимметричную) узловатую или бугристую поверхность.
Распространение метастазов при раке предстательной железы происходит гематогенным и лимфогенным путями в паховые и подвздошные лимфатические узлы, печень, лёгкие, костную ткань (в основном кости таза). Регионарными считают тазовые лимфатические узлы ниже бифуркации общих подвздошных артерий. К ним относят подчревные, запирательные, подвздошные (внутренние и наружные), перипростатические и сакральные лимфатические узлы. Отдалённые лимфатические узлы расположены вне границ таза и их поражение рассматривают в качестве отдалённых метастазов. К ним относят аортальные (парааортальные, периаортальные, поясничные), общие подвздошные, паховые, бедренные, надключичные и шейные лимфатические узлы.
В клинических и прогностических целях важно определить гистологические особенности роста и степень дифференцировки опухолевых клеток. Чем менее дифференцированы опухолевые клетки, тем быстрее опухоль метастазирует и хуже поддаётся лечению, т.е. имеет более злокачественный характер. Для оценки степени злокачественности РПЖ используют систему Глисона, согласно которой (на основании гистологических признаков) выделены пять степеней злокачественности (табл. 4-1). В клинической практике применяют сумму баллов по шкале Глисона из двух наиболее типичных участков (например, 3 + 4 = 7).
Таблица 4-1. Характеристика степеней злокачественности рака простаты по Глисону

Простатическая интраэпителиальная неоплазия (ПИН) — клеточная пролиферация выстилающего эпителия простатических протоков и ацинусов, ограниченная эпителиальным слоем, в сочетании с прогрессирующей утратой маркёров секреторной дифференцировки и патологическими изменениями ядер, ядрышек, плотности микрососудов, содержания ДНК, а также генетической нестабильностью. Выделяют ПИН низкой степени дисплазии и ПИН высокой степени дисплазии. Различия основаны на цитологических критериях.
Клиническая картина
Клиническая картина РПЖ зависит от стадии процесса. Выделяют локализованный, местнораспространённый и генерализованный рак предстательной железы. К локализованному РПЖ относят T1-2N0M0 стадии опухолевого процесса, т.е. опухоли, ограниченные капсулой предстательной железы без инвазии, регионарных и отдалённых метастазов. К местнораспространённому РПЖ относят T3..4N0M0 стадии опухолевого процесса. При генерализованном процессе обнаруживают регионарные или отдалённые метастазы (Mt). Такое разделение определяет выбор оптимального способа лечения из существующих методов терапии. Задача диагностики — определение больного в одну из этих трёх групп.
На ранних стадиях больные практически не предъявляют жалоб, поскольку обычно опухолевые узлы расположены в периферической зоне и не сдавливают простатический отдел уретры. На более поздних стадиях РПЖ возникают признаки обструкции мочевых путей и симптомы, связанные с распространением опухоли (гематурия, боль). Системные признаки заболевания (боли в костях, почечная недостаточность, анемия) обусловлены распространением опухоли за пределы простаты и отдалённым метастазированием.
Именно поэтому при обследовании больных с доброкачественной гиперплазией предстательной железы (ДГПЖ) следует исключить рак предстательной железы. Местнораспространённый РПЖ может прорастать в устья мочеточников, что приводит к одно- или двустороннему уретерогидронефрозу, пиелонефриту и хронической почечной недостаточности. В таких случаях показано выполнение больному чрескожной нефростомии. Иногда местное распространение опухоли приводит к обструкции семявыносящих протоков (гематоспермии, уменьшению объёма эякулята). При прорастании опухоли в сосудисто-нервные пучки может возникнуть эректильная дисфункция.
Гематурию отмечают на четвёртой стадии заболевания (Т4), что связано с прорастанием опухоли в мочевой пузырь. В некоторых случаях опухоль может прорастать в дистальный отдел прямой кишки и сдавливать её просвет, что приводит к запорам, тенезмам, кровотечениям, толстокишечной непроходимости. При прорастании опухоли предстательной железы в окружающую ткань возможен лимфостаз. Возникновение отдалённых метастазов ведет к изменениям в клинической картине болезни.
Основной симптом, который заставляет больного обратиться к врачу, — боли, возникающие при метастазах в кости. Локализация боли обычно соответствует локализации метастаза, за исключением конечностей, где боли могут быть проводниковыми (из-за сдавления нервных корешков при метастатическом поражении позвоночника). Боли имеют тенденцию к постепенному усилению. Особенно резкая боль возникает при патологических переломах.
Глава 1. Этиология и патофизиология рака предстательной железы
Рак предстательной железы (РПЖ) - злокачественная опухоль, которой с каждым годом уделяется все больше внимания. Это обусловлено тем, что быстрыми темпами увеличивается заболеваемость, особенно у мужчин пожилого возраста. В структуре онкологических заболеваний в ряде стран рак предстательной железы выходит на 2-3 место после рака легких и желудка, а в США - на первое место. Если принять во внимание, что в экономически развитых странах продолжительность жизни увеличивается и имеется общемировая тенденция к старению населения, соответственно вырастает и заболеваемость. Вместе с тем смертность от рака предстательной железы среди прочих онкологических заболеваний занимает второе место после рака легких.
По оценке, проведенной в Западных странах, до 30% мужского населения может иметь микроскопический рак предстательной железы. В связи с особенностями клинического развития опухоль может долгие годы не сказываться на самочувствии больного и проявит себя только у 10% заболевших. Вероятность умереть от рака предстательной железы снижается до 30%. Также следует отметить, что в мире заболеваемость раком предстательной железы имеет значительные географические и этнические различия (табл. 1).
Таблица 1. Заболеваемость РПЖ в различных странах мира (мировой стандарт) на 100000 населения.
Как видно из табл. 1, отмечаются значительные колебания заболеваемости рака предстательной железы - самой высокой в США и самой низкой в странах Азии и Африки. Причем имеются большие колебания в пределах одной страны среди различных этнических групп. Например, самая высокая заболеваемость зарегистрирована среди темнокожих мужчин США (102.0 на 100000 населения) по сравнению с белыми (60.0 на 100000 населения). По данным Parkin Dile с соавт. (1992) имеются различия в заболеваемости рака предстательной железы среди темнокожих мужчин в зависимости от места проживания. Так заболеваемость среди негров, проживающих в штате Атланта, равна 102.0 на 100000 населения, в то время как в Лос-Анджелесе - 82.0 на 100000 населения.
Как было отмечено выше, заболеваемость раком предстательной железы в странах Азии и Африки в 100 раз ниже, чем в США. Например, в Китае приходится только один больной на 100.000 населения. Примерно такие же показатели в Японии (6.6 на 100000 населения), Алжире (2.0) и т.д. Однако заболеваемость тех же китайцев и японцев, проживающих в США, значительно возрастает.
По данным Д.Г. Заридзе (1997) заболеваемость раком предстательной железы среди китайцев, проживающих в Лос-Анджелесе, равна 19.8, а на Гавайях - 28.0 на 100000 населения, т. е. более чем в 20 раз выше, чем в КНР (табл. 2 и табл. 3).
Таблица 2. Заболеваемость РПЖ среди этнических китайцев в зависимости от страны жительства.
Таблица 3. Заболеваемость РПЖ среди этнических японцев в зависимости от места проживания.
То же самое - соотношение японцев. Заболеваемость раком предстательной железы среди японцев в Лос-Анджелесе равна 32.9, а на Гавайях - 34.4 на 100000 населения. Как справедливо отмечает Д.Г. Заридзе, эти наблюдения указывают на то, что расы и соответственная заболеваемость рака предстательной железы в целом не связаны с генетическими факторами, а обусловлена окружающей средой и бытом населения.
Несмотря на большую разницу в выявлении клинических форм рака предстательной железы в различных странах мира, частота латентно протекающего рака практически одинакова во всех регионах. На это указывают результаты вскрытий, проведенные в разных странах. Латентный рак встретился на вскрытии у 10-15% мужчин, умерших от различных причин. В старших возрастных группах (75 лет и выше) частота его 30-35% (Zaridze D., Boyle P., 1997). По данным тех же авторов изучение динамики заболеваемости рака предстательной железы на протяжении 25 лет показывает неуклонный рост ее практически во всех странах мира. Так за указанный срок заболеваемость в Канаде, США, Финляндии, Швеции и Японии выросла в 2 раза.
В конце восьмидесятых годов отмечался некоторый скачок в росте заболеваемости рака предстательной железы, который постепенно снизился до обычных показателей. Резкий рост заболеваемости многие специалисты склонны объяснять широким внедрением в повседневную практику диагностики опухолевого маркера - простато-специфического антигена (ПСА), что привело к выявлению большого количества бессимптомных форм рака. В течение 2-3 лет активного выявления (скрининга) практически все латентные случаи рака простаты были выявлены, что привело в последующем к снижению заболеваемости.
О заболеваемости в России можно говорить, начиная с 1989 г., когда в отчетных формах онкодиспансеров был отдельно выделен рак предстательной железы. Доля рака предстательной железы в структуре заболеваемости мужского населения России неуклонно росла и в 1996 составила 4% (в 1989 г. - 2.8%). За 1989-1996 г. число впервые диагностированных заболеваний увеличилось с 5.5 тыс. до 8.3 тыс., т.е. на 52%. Средний возраст больных раком предстательной железы в России - 69 лет, а умерших - 70 лет; в США - 72 и 77 лет соответственно. Стандартизованный показатель заболеваемости в России в 1996 г. составил 11.3 (на 100000 мужского населения, см. табл. 4 и табл. 5).
Таблица 4. Динамика заболеваемости раком предстательной железы в России.
Таблица 5. Динамика заболеваемости раком предстательной железы в России на 100000 населения.
| Годы | Заболеваемость | Смертность |
| 1989 | 8.4 | 6.5 |
| 1990 | 8.3 | 6.5 |
| 1991 | 8.6 | 7.2 |
| 1992 | 9.3 | 7.4 |
| 1993 | 9.7 | 7.4 |
| 1994 | 9.8 | 7.4 |
| 1995 | 10.9 | 7.4 |
| 1996 | 11.3 | 7.7 |
| Темп роста (%) | ||
| 1989-1992 | 10.71 | 10.77 |
| 1993-1996 | 16.5 | 4.1 |
| 1989-1996 | 34.5 | 18.5 |
| 1991-1996 | 31.4 | 18.5 |
При распределении больных по стадиям заболевания на 1 и 2 стадию в среднем приходиться только 30% . По-видимому, это больные, у которых диагноз был случайно установлен при гистологическом исследовании материала, удаленного при доброкачественной гиперплазии предстательной железы (см. табл. 6). При сравнении динамики стандартизованных показателей заболеваемости злокачественными новообразованиями населения России выясняется любопытная деталь.
По величине прироста заболевание желудка занимает 12-е место, легких - 9-е, а рак предстательной железы 2-е место (темп прироста 31.4%), уступив первое место меланоме кожи. (см. табл. 7).
Таблица 6. Распределение вновь выявленных больных раком предстательной железы по стадиям.
| Годы | Стадия | |||
| I-II | III | IV | не установлена | |
| 1986 | 34.9 | 32.0 | 17.1 | 16.0 |
| 1987 | 34.7 | 31.4 | 16.4 | 17.5 |
| 1988 | 32.1 | 34.2 | 16.0 | 17.7 |
| 1989 | 39.7 | 33.4 | 16.3 | 10.6 |
| 1990 | 34.5 | 35.6 | 18.4 | 11.4 |
| 1991 | 29.5 | 37.9 | 28.5 | 4.1 |
| 1992 | 33.7 | 36.5 | 18.7 | 11.1 |
| 1993 | 34.0 | 37.0 | 19.3 | 19.3 |
| 1994 | 33.6 | 37.4 | 20.3 | 8.8 |
| 1995 | 33.4 | 38.8 | 21.5 | 6.4 |
| 1995 | 32.5 | 38.3 | 22.5 | 6.6 |
Таблица 7. Динамика и ранг стандартизованных показателей заболеваемости злокачественными новообразованиями населения России 1991-1996 г.
| Локализация | Заболеваемость | Место по уровню заболеваемости | Темп прироста % | Место по величине прироста | ||
| 1991 | 1996 | 1991 | 1996 | |||
| Желудок | 43.0 | 38.6 | 2 | 2 | -10.2 | 12 |
| Легкие | 75.7 | 71.9 | 1 | 1 | -5.0 | 9 |
| Меланома кожи | 2.0 | 2.7 | 14 | 14 | 35.0 | 2 |
| Предстательная железа | 8.6 | 11.3 | 10 | 7 | 31.4 | 2 |
Наибольшая заболеваемость отмечается в Томской (34.7) и Астраханской (24.5) областях, Калмыкии (22.6) и г. Санкт-Петербурге (17.2); меньшая (менее 5.5) - в Туве (2.9), Адыгее (5.2), Дагестане (4.9), Бурятии (4.0), Читинской области (5.0), Чукотском автономном округе (4.4). Выше среднероссийской заболеваемость раком предстательной железы - в Беларуси (16.1) и во всех странах Европейского союза (табл. 1). Число умерших от рака предстательной железы возросло с 2.7 тыс. в 1980 г. до 5.6 тыс. в 1996 г., т.е. на 108%, а в структуре смертности от злокачественных новообразований его доля достигла 3.4%. Стандартизованный показатель смертности увеличился по сравнению с 1980 г. на 50%, и составил 7.5 на 100 тыс. мужского населения России, а в ряде стран ЕС (например, в Дании, Ирландии и Швеции) его величина равнялась 18-20.5.
Этиология
В этиологии рака предстательной железы, помимо приведенных данных, большую роль играют и многие другие факторы, например, возраст больного, гормональный статус организма, диета, половое поведение, факторы внешней среды и генетические особенности. Коротко остановимся на значении каждого из них.
Пожилой возраст. Возраст - это один из главных факторов, оказывающих большое влияние на развитие рака предстательной железы. Общеизвестно, что заболевание с клиническими проявлениями редко возникает у мужчин до 50 лет, и вместе с увеличением возраста резко возрастает заболеваемость. Микроскопические очаги рака предстательной железы находят у 30% мужчин от 50 до 60 лет (Кирби Р., 1997).
Таблица 8. Заболеваемость РПЖ в зависимости от возраста на 100000 человек.
Гормональные изменения организма. Гормональная гипотеза в этиологии рака предстательной железы появилась давно, после известных работ Hagins. Было установлено, что тестостерон и его известный метаболит дигидротестостерон необходимы для нормального роста и развития предстательной железы. Подтверждением гормональной гипотезы служили успехи в лечении рака предстательной железы эстрогенами, которые подавляют образование андрогенов. Кроме того, в экспериментах была показана возможность индуцирования рака предстательной железы в результате длительного воздействия на животных андрогенами.
Однако убедительных эпидемиологических работ в поддержку гормональной гипотезы рака предстательной железы практически нет, хотя проведено достаточное количество исследований. Интерес представляет сообщение long с соавт. (1990). Было проведено изучение гормонального статуса японцев и голландцев. При этом было показано, что уровень тестостерона и эстрадиола были достоверно ниже у японцев. Однако,в этом же исследовании не было обнаружено разницы в содержании этих же гормонов в крови больных раком предстательной железы и контрольной группой. Hill P. с соавт. (1980) предполагает, что разница в гормональном профиле у европейцев и японцев связана с особенностями их питания. Так например, Hamalaisnen Е. с соавт (1984), изучали гормональный профиль у двух групп мужчин с различным уровнем потребления животных жиров. При этом установили, что содержание тестостерона в плазме было значительно ниже у мужчин с низким потреблением жира.
Появились отдельные сообщения о значении 5-альфа льфа редуктазы в развитии опухолевого процесса. Klein Н. с соавт. (1988) показал, что опухолевая ткань обладает значительно меньше выраженной активностью 5-альфа льфа редуктазы, чем нормальная ткань предстательной железы и доброкачественная гиперплазия простаты. Однако недостаточность 5-альфа льфа редуктазы скорее всего снижает риск рака предстательной железы, в связи с чем делаются попытки применять ингибиторы 5-альфа редуктазы для профилактики рака. Эти исследования еще не закончены. Тем не менее следует отметить, что хотя прямой зависимости между уровнем андрогенов в крови и риском развития рака предстательной железы не выявлено, все же предполагается связь между повышенным уровнем 5-альфа редуктазы и заболеваемостью.
Питание. Значение питания в этиологии рака предстательной железы обсуждается много лет. В ряде исследований была установлена корреляция заболеваемости рака предстательной железы и питания, богатого животными жирами. (Armstrong В. с соавт., 1975 , Boyle P. и Zaridze D., 1993 и др). Однако в ряде исследований эта связь не подтвердилась (Rohan Т. с соавт., 1995), хотя отмечено, что риск заболеть раком предстательной железы повышается в случаях употребления высококалорийной пищи. Отмечается более частое возникновение рака у полных мужчин, и меньшая вероятность заболеть - у мужчин, занимающихся физическим трудом (Talamini R. с соавт., (1986). Теоретически влияние питания на развитие рака предстательной железы объясняется следующим образом. Предполагается, что жирная пища снижает всасывание витамина А, что приводит к снижению уровня бета-каротина в крови. В то же время считается, что бета-каротин защищает организм от возникновения некоторых злокачественных опухолей. В рационе жителей Азиатских стран, где заболеваемость раком предстательной железы самая низкая, содержится много витамина А и эстрогенов растительного происхождения, которые нейтрализуют действие андрогенов на предстательную железу. За последние годы заболеваемость раком предстательной железы в Японии и Китае стала увеличиваться, и предполагается, что это обусловлено растущей популярностью западной диеты. Однако в исследовании Rohan Т. с соавт. (1995), проведенном в Канаде, показана защитная роль ретинола, но не бета-каротина, против рака предстательной железы. В ряде исследований показано, что потребление витамина А и бета-каротина повышает риск заболеть раком предстательной железы в основном для больных в возрасте старше 70 лет (West D. с соавт., 1996). Таким образом, как видно из приведенных данных, единой точки зрения о влиянии питания на развитие рака предстательной железы нет.
Генетический фактор. Роль генетической предрасположенности к раку предстательной железы как фактора риска установлен многими специалистами. Риск заболеть раком предстательной железы примерно в 2-3 раза выше у мужчин, у ближайших родственников которых рак предстательной железы был выявлен в относительно молодом возрасте. Однако риск еще больше увеличивается при наличии более одного родственника, больного раком предстательной железы. В исследовании методом случай-контроль, которое было проведено в Канаде (Ihadirian P. с соавт., 1991), установлено, что риск рака предстательной железы увеличился в 8 раз у мужчин, кровные родственники которых болели раком простаты. Согласно оценкам специалистов, примерно 9% случаев рака предстательной железы обусловлено генетическими причинами, хотя локализация генетического дефекта еще не установлена.
Внешние и профессиональные факторы. Данные о влиянии вредных профессиональных условий на риск заболеть раком предстательной железы весьма противоречивы. Было предположено, что некоторые вещества способствуют развитию рака предстательной железы. В частности утверждалось, что у мужчин, находящихся в контакте с кадмием и работающих на атомных электростанциях, риск заболеть раком предстательной железы повышен. Однако в эпидемиологическом исследовании по изучению влияния кадмия на развитие рака предстательной железы эта версия не подтвердилась.
Выдвигалось предположение, что риск заболевания повышается при избыточном воздействии ультрафиолетовых лучей. В доказательство приводился тот факт, что на юге США заболеваемость раком предстательной железы выше, чем в северной части страны. Не подтвердились предположения о возможном повышении риска заболеваемости раком предстательной железы среди работников резиновой промышленности и сельскохозяйственных рабочих.
Роль инфекции в этиологии РПЖ изучалась многократно. В качестве инфекционных факторов изучали вирус гепатита, цитомегаловирус, вирус простого герпеса. Предполагалось, что они способствуют развитию рака предстательной железы, однако их роль еще не нашла должного подтверждения. Проводимые эпидемиологические исследования показали лишь, что больные раком предстательной железы чаще болеют венерическими заболеваниями, и что рак шейки матки чаще встречается у жен больных раком простаты (Boyle P. и Zaridze D., 1993).
Не получило подтверждения значение в этиологии рака предстательной железы половое поведение мужчин. Предполагалось, что риск заболеть выше у тех мужчин, которые рано начинают половую жизнь и имеют много партнеров. Однако доказательства правильности этого предположения противоречивы. Также не нашло подтверждения предположение о роли вазэктомии в развитии опухоли.
Неоднократно обсуждался вопрос взаимосвязи доброкачественной гиперплазии и рака предстательной железы. Является ли ДГП предшественником рака простаты? Проводимые гистологические и эпидемиологические исследования противоречивы. Как считает Boyle P. и Zaridze D., основным аргументом против этой гипотезы является то, что рак чаще развивается в наружном сегменте простаты, в то время как ДГП встречается во внутреннем сегменте органа. Вместе с тем в 1.5-24% случаев рак и доброкачественная гиперплазия предстательной железы встречаются одновременно.
Читайте также:

