Органический растворитель с хлором
Хлорсодержащий органический растворитель
Хлорсодержащие органические растворители - например, дихлорэтан, четы-реххлористый углерод - широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. С развитием техники область применения хлорорганических продуктов расширяется; это ведет к непрерывному увеличению производства хлора. [2]
Молекулы хлорсодержащих органических растворителей при повышенных температурах разлагаются с образованием молекул НС1, разрушающих магнетитовые слои. Образующийся при этом хлорид железа гидролизуется с образованием хлористо-водородвой кислоты, вновь и вновь взаимодействующей с магнетитом. [3]
Огромное количество хлора расходуется для получения соляной кислоты, хлорной извести, хлорсодержащих органических растворителей ( дихлорэтана, тетрахлорида углерода), стерилизации воды и в других областях. [4]
Хлор применяют для отбелки тк 1ней и бумажной массы, для стерилизации питьевой воды, обеззараживания сточных вод. Широко распространены хлорсодержащие органические растворители : дихлорэтан С2Н4С12, тетрахлорид углерода СС14, которые применяются, в частности, для обезжиривания материалов, для растворения и экстракции жиров. [5]
Бесцветное кристаллическое вещество с температурой плавления 115 5 - 117 С, в воде растворим слабо, хорошо растворяется в ацетоне, спирте и хлорсодержащих органических растворителях . [6]
Хлорсодержащие органические растворители , - например, дихлорэтан, четыреххлористый углерод - широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. С развитием техники область применения хлорорганических продуктов расширяется; это ведет-к непрерывному увеличению производства хлора. [7]
Хлорсодержащие органические растворители - например, дихлорэтан, четыреххлористый углерод - широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. С развитием техники область применения хлорорганкческих продуктов расширяется; это ведет к непрерывному увеличению производства хлора. [8]
Хлорсодержащие органические растворители - например, дихлорэтан, четыреххлористый углерод - широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйч ственных культур. С развитием техники область применения хлорорганических продуктов расширяется; это ведет к непрерывному увеличению производства хлора. [9]
Хлорсодержащие органические растворители - например, дихлорэтан, четыреххлористый углерод - широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. С развитием техники область применения хлорорганических продуктов расширяется; это ведет к непрерывному увеличению производства хлора. [10]
Хлорсодержащие органические растворители - например, дихлорэтан, четыреххлористый углерод - широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. С развитием техники область применения хлорорганкческих продуктов расширяется; это ведет к непрерывному увеличению производства хлора. [11]
Хлорсодержащие органические растворители - например, дихлорэтан, четыреххлористый углерод - широко применяются для экстракции жиров и обезки-ривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. [12]
Хлорсодержащие органические растворители - например, дихлорэтан, четыреххлористый углерод - широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. [13]
Хлорсодержащие органические растворители , - например, дихлорэтан, четыреххлористый углерод - широко применяются для экстракции жиров и обезжиривания металлов. Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур. С развитием техники область применения хлорорганических продуктов расширяется; это ведет к непрерывному увеличению производства хлора. [14]
Он представляет собой белый порошок с розово-кремовым оттенком. Практически нерастворим в горячей и холодной воде, но достаточно хорошо растворим в водноспиртовой щелочи и в горячих водных щелочных растворах. Легко растворяется во многих кислород - и хлорсодержащих органических растворителях , в ароматических углеводородах; слабо растворим в алифатических углеводородах. По характеру физиологического действия на организм человека аналогичен фенолу. [15]
Хлорорганическое соединение, хлоруглерод или хлорированный углеводород, - это органическое вещество, содержащее по крайней мере один ковалентно связанный атом хлора, который влияет на химическое поведение молекулы. Класс хлоралканов (алканы с одним или несколькими атомами водорода, замещенными хлором) дает общие примеры. Широкое структурное разнообразие и различные химические свойства хлорорганических соединений приводят к широкому спектру названий и областей применения. Органохлориды являются очень полезными веществами во многих областях применения, но некоторые из них представляют серьезную экологическую проблему.
Влияние на свойства
Хлорирование изменяет физические свойства углеводородов несколькими способами. Соединения, как правило, более плотные, чем вода, из-за более высокого атомного веса хлора по сравнению с водородом. Алифатические органохлориды являются алкилирующими агентами, потому что хлорид является уходящей группой.
Определение хлорорганических соединений

Многие такие соединения были выделены из природных источников, от бактерий до людей. Хлорированные органические соединения содержатся почти в каждом классе биомолекул, включая алкалоиды, терпены, аминокислоты, флавоноиды, стероиды и жирные кислоты. Органохлориды, включая диоксины, образуются в высокотемпературной среде лесных пожаров, а диоксины были обнаружены в сохранившемся пепле пожаров, вызванных молнией, которые предшествовали синтетическим диоксинам.
Кроме того, различные простые хлорированные углеводороды, включая дихлорметан, хлороформ и четыреххлористый углерод, были выделены из морских водорослей. Большая часть хлорметана в окружающей среде образуется естественным путем в результате биологического разложения, лесных пожаров и вулканов. Широко известны и хлорорганические соединения в нефти (по ГОСТу - Р 52247-2004).
Эпибатидин
Природный хлорорганический эпибатидин, алкалоид, выделенный из древесных лягушек, обладает сильным обезболивающим действием и стимулирует исследования новых обезболивающих препаратов. Лягушки получают эпибатидин через пищу, а затем изолируют его на коже. Вероятными источниками пищи являются жуки, муравьи, клещи и мухи.
Алканы
Алканы и арилалканы могут быть хлорированы в условиях свободных радикалов с ультрафиолетовым излучением. Однако степень хлорирования трудно контролировать. Арилхлориды могут быть получены галогенированием Фриделя-Крафтса с использованием хлора и кислотного катализатора Льюиса. Методы определения хлорорганических соединений включают в себя в том числе и применение этого катализатора. Другие методы также упомянуты в статье.
Реакция галоформа с использованием хлора и гидроксида натрия также способна генерировать алкилгалогениды из метилкетонов и родственных соединений. Хлороформ ранее производился таким образом.
Хлор добавляет к множественным связям алкены и алкины, давая ди- или тетрахлорсоединения.
Алкилхлориды
Алкилхлориды являются универсальными строительными блоками в органической химии. Хотя алкилбромиды и йодиды являются более реакционноспособными, алкилхлориды менее дорогие и более доступные. Алкилхлориды легко подвергаются атаке нуклеофилов.
Нагревание алкилгалогенидов с гидроксидом натрия или водой дает спирты. Реакция с алкоксидами или ароксидами дает эфиры в синтезе эфира Уильямсона; реакции с тиолами дают тиоэфиры. Алкилхлориды легко вступают в реакцию с аминами с образованием замещенных аминов. Алкилхлориды замещены более мягкими галогенидами, такими как йодид, в реакции Финкельштейна.
Также возможна реакция с другими псевдогалогенидами, такими как азид, цианид и тиоцианат. В присутствии сильного основания алкилхлориды подвергаются дегидрогалогенированию с образованием алкенов или алкинов.
Алкилхлориды реагируют с магнием с образованием реактивов Гриньяра, превращая электрофильное соединение в нуклеофильное. Реакция Вюрца восстанавливающим образом соединяет два алкилгалогенида с натрием.
Применение
Крупнейшим применением хлорорганической химии является производство винилхлорида. Годовой объем производства в 1985 году составил около 13 миллиардов килограммов, почти все из которых были преобразованы в поливинилхлорид (ПВХ). Определение хлорорганических соединений (по ГОСТу) является процессом, который невозможно совершить без специального стандартизованного оборудования.
Большинство низкомолекулярных хлорированных углеводородов, таких как хлороформ, дихлорметан, дихлорэтан и трихлорэтан, являются полезными растворителями. Эти растворители имеют тенденцию быть относительно неполярными; поэтому они не смешиваются с водой и эффективны при очистке, такой как обезжиривание и химическая чистка. Эта очистка также относится к методам определения хлорорганических соединений (нефть и другие вещества очень богаты этими соединениями).
Наиболее важным является дихлорметан, который в основном используется в качестве растворителя. Хлорметан является предшественником хлорсиланов и силиконов. Исторически значимым, но меньшим по масштабу является хлороформ, в основном предшественник хлордифторметана (CHClF2) и тетрафторэтена, который используется при производстве тефлона.
Двумя основными группами хлорорганических инсектицидов являются вещества типа ДДТ и хлорированные алициклические растворы. Механизм их действия немного отличается от хлорорганических соединений в нефти.
ДДТ-подобные соединения
Хлорированные циклодиены включают альдрин, дильдрин, эндрин, гептахлор, хлордан и эндосульфан. Длительность воздействия от 2 до 8 часов приводит к снижению активности центральной нервной системы (ЦНС), за которой следуют повышенная возбудимость, тремор, а затем приступы. Механизм действия заключается в связывании инсектицидов на участке ГАМК в комплексе ионофоров хлорида гамма-аминомасляной кислоты (ГАМК), который препятствует поступлению хлорида в нерв.
Другие примеры включают дикофол, мирекс, кепон и пентахлорфенол. Они могут быть либо гидрофильными, либо гидрофобными, в зависимости от их молекулярной структуры.
Дифенилы
Полихлорированные дифенилы (ПХД) когда-то были широко используемыми электрическими изоляторами и теплоносителями. Их использование, как правило, было прекращено из-за проблем со здоровьем. ПХБ были заменены полибромированными дифениловыми эфирами (ПБДЭ), которые вызывают аналогичные проблемы с токсичностью и биоаккумуляцией.
Некоторые типы хлорорганических соединений обладают значительной токсичностью для растений или животных, включая человека. Диоксины, образующиеся при сжигании органических веществ в присутствии хлора, являются стойкими органическими загрязнителями, которые представляют опасность при их выбросе в окружающую среду, как и некоторые инсектициды (такие как ДДТ).
Например, ДДТ, который широко использовался для борьбы с насекомыми в середине 20-го века, также накапливается в пищевых цепях, как и его метаболиты DDE и DDD, и вызывает проблемы с репродуктивной системой (например, истончение яичной скорлупы) у некоторых видов птиц. Некоторые соединения такого типа, такие как серная горчица, азотная горчица и люизит, даже используются в качестве химического оружия из-за своей токсичности.
Интоксикация хлорорганическими соединениями

Однако наличие хлора в органическом соединении не обеспечивает токсичность. Некоторые органохлориды считаются достаточно безопасными для употребления в пищу и лекарства. Например, горох и бобы содержат природный хлорированный растительный гормон 4-хлориндол-3-уксусную кислоту и подсластитель сукралоза (Splenda) широко используются в диетических продуктах.
По состоянию на 2004 год по крайней мере 165 органохлоридов были одобрены во всем мире для использования в качестве фармацевтических препаратов, включая природный антибиотик ванкомицин, антигистамин лоратадин (кларитин), антидепрессант сертралин (золофт), антиэпилептический ламотриджин (ламиктал) и ингаляционные препараты. анестетик изофлуран. Знать эти соединения обязательно для определения хлорорганических соединений в нефти (по ГОСТу).
Выводы ученых
В арктических районах особенно высокие уровни встречаются у морских млекопитающих. Эти химические вещества концентрируются у млекопитающих и даже содержатся в грудном молоке человека. У некоторых видов морских млекопитающих, особенно тех, которые производят молоко с высоким содержанием жира, у самцов, как правило, гораздо более высокие уровни, так как самки снижают концентрацию, передавая вещества потомству в результате лактации. Также эти вещества могут находиться в нефти, что важно учитывать во время определения хлорорганических соединений в нефти (по ГОСТу). Обычно это касается пестицидов, хотя может также относиться к любому соединению такого типа.
Хлорорганические пестициды можно классифицировать по их молекулярным структурам. Циклопентадиеновые пестициды представляют собой алифатические циклические структуры, полученные в результате реакций Пентахлорциклопентадиена Дильса-Альдера, и включают хлордан, нонахлор, гептахлор, эпоксид гептахлора, дильдрин, альдрин, эндрин, мирекс и кепон. Другими подклассами хлорорганических пестицидов являются семейство ДДТ и изомеры гексахлорциклогексана. Все эти пестициды имеют низкую растворимость и летучесть и устойчивы к процессам разрушения в окружающей среде. Их токсичность и стойкость в окружающей среде привели к их ограничению или приостановке для большинства видов применения в Соединенных Штатах.
Пестициды
Хлорорганические пестициды очень эффективны для уничтожения вредителей, особенно насекомых. Но многие из этих химических продуктов негативно воспринимаются экологическими активистами и потребителями из-за одного хорошо известного и ныне запрещенного хлорорганического пестицида: дихлордифенилтрихорэтана, более известного как ДДТ.
Хлорорганические пестициды относятся к химическим веществам с углеродом, хлором и водородом. Как пояснила Служба рыбного хозяйства и дикой природы США, хлор-углеродные связи особенно прочны, что не позволяет этим химическим веществам быстро разрушаться или растворяться в воде. Химическое вещество также привлекает жир и накапливается в жировой ткани животных, которые его потребляют.
Долговечность химического состава хлорорганических пестицидов является одной из причин, по которой он так же эффективен, как и инсектицид, и потенциально вреден - он может защищать сельскохозяйственные культуры в течение длительного времени, но также может оставаться в организме животного.
Наряду с ДДТ агентство по охране окружающей среды США запретило использование других хлорорганических пестицидов, таких как альдрин, дильдрин, гептахлор, мирекс, хлордекон и хлордан. В Европе аналогичным образом запрещены многие хлорорганические пестициды, но в обоих этих регионах хлорорганические химические вещества по-прежнему являются активными ингредиентами в ряде продуктов для борьбы с вредителями в домашних условиях, в саду и в окружающей среде, согласно данным EPA. Хлорорганические пестициды также чрезвычайно популярны в развивающихся странах по всему миру для использования в сельском хозяйстве.

Независимо от того, исследуете ли вы сельскохозяйственные угодья, чтобы убедиться, что они все еще заполнены летними хлорорганическими пестицидами, или осматриваете воду на наличие хлорорганических соединений, тестирование - лучший способ узнать, есть ли эти химические вещества рядом с вами. EPA методы 8250A и 8270B могут быть использованы для проверки этих химических веществ. 8250A может тестировать отходы, почву и воду, в то время как 8270B использует газовую хроматографию/масс-спектрометрию (ГХ/МС).
Хотя хлорорганические пестициды наиболее известны тем, что они наносят ущерб способности некоторых птиц откладывать здоровые яйца, известно, что эти химические вещества негативно влияют на людей, которые потребляют или вдыхают пестициды. Случайное вдыхание или употребление загрязненной рыбы или тканей животных является наиболее вероятным способом проглатывания хлорорганических пестицидов. Чтобы подтвердить, что кто-то имеет признаки отравления хлорорганическим соединением, кровь или мочу обычно отправляют в университет или государственное учреждение, которое использует ГХ/МС для проверки химических соединений.
Признаки отравления
Предупреждающие признаки токсичности хлорорганических пестицидов включают судороги, галлюцинации, кашель, кожную сыпь, рвоту, боль в животе, головные боли, спутанность сознания и, возможно, дыхательную недостаточность согласно Мэтью Вонгу, доктору философии, доктору философии, и медицинскому центру Beth Israel Deaconess, Medscape. Хотя в США и Европе существуют запреты на многие из этих пестицидов, их использование в других частях света и хранение в некоторых частях США и Европы создают ситуации, когда отравления хлорорганическими соединениями все еще возможны.
Хлорорганические пестициды включают в себя большое количество стойких химических веществ, которые являются одновременно эффективными и несут значительный риск по всему миру.
Хотя галогенированные органические соединения относительно редки по природе по сравнению с негалогенированными, многие такие соединения были выделены из природных источников, от бактерий до людей. Существуют примеры природных хлорсодержащих соединений, обнаруживаемых почти в каждом классе биомолекул, включая алкалоиды, терпены, аминокислоты, флавоноиды, стероиды и жирные кислоты.
Органохлориды, в том числе диоксины, образуются в высокотемпературной среде лесных пожаров, а диоксины были обнаружены в сохранившемся пепле пожаров, вызванных молнией, которые предшествовали синтетическим диоксинам. Кроме того, различные простые хлорированные углеводороды, включая дихлорметан, хлороформ и четыреххлористый углерод, были выделены из морских водорослей.
Большая часть хлорметана в окружающей среде образуется естественным путем в результате биологического разложения, лесных пожаров и вулканов. Природный хлорорганический эпибатидин, алкалоид, выделенный из древесных лягушек, обладает сильным обезболивающим действием и стимулирует исследования новых обезболивающих препаратов.
Диоксины
Некоторые типы хлорорганических соединений обладают значительной токсичностью для растений или животных, включая человека. Диоксины, образующиеся при сжигании органических веществ в присутствии хлора, и некоторые инсектициды, такие как ДДТ, являются стойкими органическими загрязнителями, которые представляют опасность для окружающей среды. Например, чрезмерное использование ДДТ в середине двадцатого века, которое накапливается у животных, привело к серьезному сокращению популяций некоторых птиц. Хлорированные растворители при неправильном обращении с ними и их утилизации создают проблемы с загрязнением подземных вод.
Некоторые органохлориды, такие как фосген, даже использовались в качестве боевых отравляющих веществ. Некоторые из искусственно созданных и токсичных органохлоридов, таких как ДДТ, будут накапливаться в организме с каждым воздействием, что в конечном итоге приведет к смертельному количеству, потому что организм не может их разрушить или избавиться от них. Однако присутствие хлора в органическом соединении никоим образом не обеспечивает токсичность. Многие хлорорганические соединения достаточно безопасны для употребления в пищу и лекарства.
Например, горох и бобы содержат природный хлорированный растительный гормон 4-хлориндол-3-уксусную кислоту (4-Cl-IAA) и подсластитель сукралоза (Splenda) широко используются в диетических продуктах. По состоянию на 2004 год во всем мире было одобрено, по меньшей мере, 165 хлорорганических соединений для применения в качестве фармацевтических препаратов, включая антигистамин лоратадин (кларитин), антидепрессант сертралин (золофт), антиэпилептический ламотриджин (ламиктал) и ингаляционный анестетик изофлуран.
Открытие Рэйчел Карсон
Хлорорганические соединения (по ГОСТу) входят в список веществ, опасных для человека.
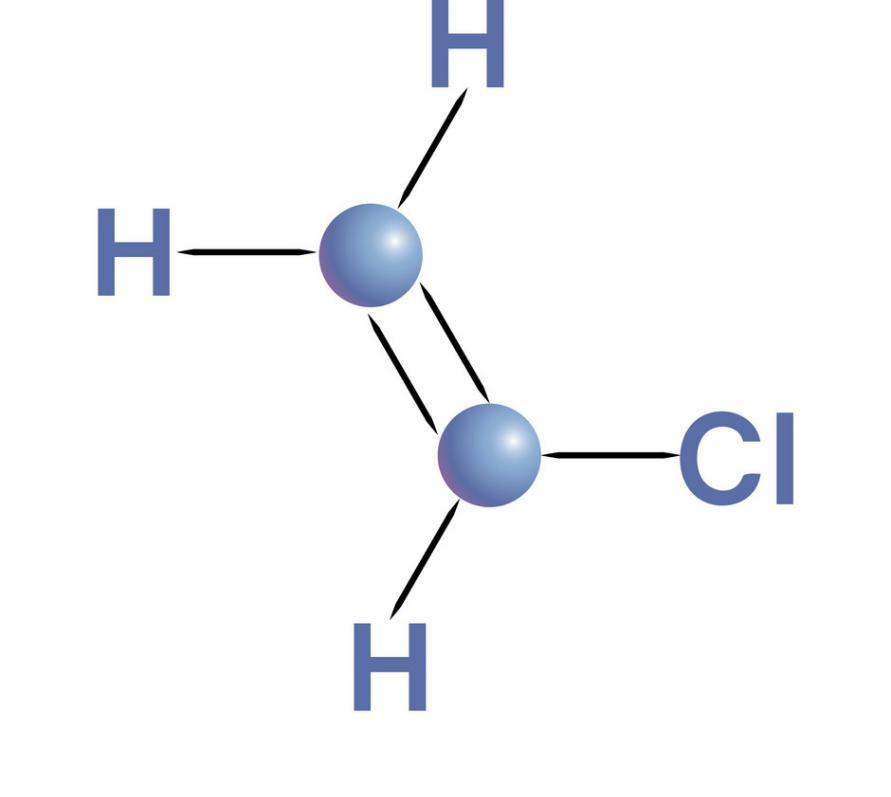
Перхлорэтилен — органическое вещество, хлорпроизводное этана и этилена с формулой C2Cl4. Химическое название — 1,1,2,2-тетрахлорэтен. В Европе этот реактив называют тетрахлорэтиленом. Получают его искусственным синтезом.
1,1,2,2-тетрахлорэтен — прозрачная плотная жидкость с резким 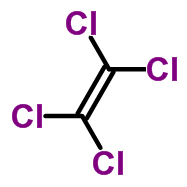
запахом эфира, текучая. Не горит, не поддерживает горения, не взрывается. Почти не растворяется в воде; легко смешивается с органическими растворителями, например, с этиловым и метиловым спиртом, уксусной и муравьиной кислотой, пропанолом, бутанолом, этиленгликолем и др. Сам является растворителем для масел, жиров, воска и подобных им веществ.
Перхлорэтилен — самый стабильный реактив среди хлорпроизводных этана и этилена. Реагирует с кислородом, хлором, водой, водородом. Реакцией перхлорэтилена с хлором и фтороводородом получают фреон 113. Взаимодействие с водой приводит к образованию трихлоруксусной кислоты и соляной кислоты.
Меры предосторожности

Хим.реактив относится к 3-му классу опасности, обладает наркотическим воздействием, токсичен, его категорически нельзя глотать. Длительное вдыхание паров или проглатывание приводит к раздражению дыхательных путей, негативному воздействию на центральную нервную систему, поражению внутренних органов, в том числе, почек и печени.
Нежелателен контакт перхлорэтилена с кожей, так как он может проникать через кожу и всасываться в кровь. На кожу и слизистую глаз оказывает раздражающее воздействие, при регулярном контакте с кожей может вызывать дерматит.
Кратковременное вдыхание паров вещества оказывает наркотическое воздействие; вызывает головные боли, возбуждение, головокружение, потерю координации движений, повышенное потоотделение. Затем появляется слабость, тошнота, сонливость вплоть до потери сознания.
Работа с перхлорэтиленом требует принятия мер предосторожности. Опыты с веществом следует проводить в вытяжном шкафу. Работники должны использовать средства защиты кожи, глаз, органов дыхания.
Транспортируют реактив в алюминиевых бочках по 200 л или железнодорожных цистернах. Хранят в бочках в крытых складских помещениях, в которых должны быть установлена приточно-вытяжная вентиляция.
- Больше половины всего производимого
![]()
перхлорэтилена используется в химчистках для сухой чистки одежды. - В машиностроении и металлургии для обезжиривания поверхностей металлов, промывки промышленных агрегатов.
- На предприятиях по производству игл для одноразовых шприцов.
- В качестве сырья в химпроме для синтеза хладагентов (фреона 113), треххлоруксусной кислоты, активных красителей.
- В кожевенной индустрии для выделки кож и мехов.
- В радиоэлектронике для очистки фотополимерных печатных плат.
- Как универсальный многофункциональный растворитель.
- В текстильной, деревообрабатывающей индустрии.
Достоинства перхлорэтилена как растворителя и очистителя
- Он не требует принятия строгих мер безопасности, т.к. не горит, не воспламеняется и не взрывается.
- Отлично растворяет все органические загрязнения с одежды.
- Легко проникает во все волокна, быстро разлагает загрязнения.
- Не разрушает волокна большинства тканей.
- Не вызывает повреждения окраски на тканях.
- Быстро выветривается, не оставляет остаточных запахов обработки.
- Не оказывает коррозионного воздействия на детали оборудования.
Хлор получение на производстве

Первое, на что обращаешь внимание, попав на хлорный завод, это многочисленные линии электропередачи. Хлорное производство потребляет много электроэнергии — она нужна для того, чтобы разложить природные соединения хлора.
Естественно, что основное хлорное сырье — это каменная соль. Если хлорный завод расположен вблизи реки, то соль завозят не по железной дороге, а на баржах — так экономичнее. Соль — продукт недорогой, а расходуется ее много: чтобы получить тонну хлора, нужно примерно 1,7— 1,8 т соли.
Соль поступает на склады. Здесь хранятся трех — шестимесячные запасы сырья — хлорное производство, как правило, многотоннажное.
Соль измельчают и растворяют в теплой воде. Этот рассол по трубопроводу перекачивается в цех очистки, где в огромных, высотой с трехэтажный дом баках рассол очищают от примесей солей кальция и магния и осветляют (дают ему отстояться). Чистый концентрированный раствор хлористого натрия перекачивается в основной цех хлорного производства — в цех электролиза.
Аноды сделаны из графита, потому что любой металл (кроме платины и ее аналогов), отбирая у ионов хлора лишние электроны, быстро корродирует и разрушается.
Существуют два типа технологического оформления производства хлора: диафрагменный и ртутный. В первом случае катодом служит перфорированный железный лист, а катодное и анодное пространства электролизера разделены асбестовой диафрагмой.
На железном катоде происходит разряд ионов водорода и образуется водный раствор едкого натра. Если в качестве катода применяют ртуть, то на нем разряжаются ионы натрия и образуется амальгама натрия, которая потом разлагается водой. Получаются водород и едкий натр. В этом случае разделительная диафрагма не нужна, а щелочь получается более чистой и концентрированной, чем в диафрагменных электролизерах.
Это одновременно производство едкого натра и водорода.
Водород отводят по металлическим, а хлор по стеклянным или керамическим трубам. Свежеприготовленный хлор насыщен парами воды и потому особенно агрессивен. В дальнейшем его сначала охлаждают холодной водой в высоких башнях, выложенных изнутри керамическими плитками и наполненных керамической насадкой (так называемыми кольцами Рашига), а затем сушат концентрированной серной кислотой. Это единственный осушитель хлора и одна из немногих жидкостей, с которыми хлор не взаимодействует.
Что же такое хлор, можно дать минимум десяток ответов. Во-первых, это галоген; во-вторых, один из самых сильных окислителей; в-третьих, чрезвычайно ядовитый газ; в-четвертых, важнейший продукт основной химической промышленности; в-пятых, сырье для производства пластмасс и ядохимикатов, каучука и искусственного волокна, красителей и медикаментов; в-шестых, вещество, с помощью которого получают титан и кремний, глицерин и фторопласт; в-седьмых, средство для очистки питьевой воды и отбеливания тканей…
Это перечисление можно было бы продолжить. При обычных условиях элементный хлор — довольно тяжелый желто-зеленый газ с резким характерным запахом. Атомный вес хлора 35,453, а молекулярный —70,906, потому что молекула хлора двухатомна. Один литр газообразного хлора при нормальных условиях (температура 0° С и давление 760 мм ртутного столба) весит 3,214 г. При охлаждении до температуры —34,05° С хлор конденсируется в желтую жидкость (плотностью 1,56 г/см3), а при температуре — 101,6° С затвердевает. При повышенном давлении хлор можно превратить в жидкость и при более высоких температурах вплоть до +144° С. Хлор хорошо растворяется в дихлорэтане и некоторых других хлорсодержащих органических растворителях.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 1022 раз хуже серебра.
Скорость звука в хлоре примерно в- полтора раза меньше, чем в воздухе.
Сейчас известны десять изотопов этого элемента, но в природе встречаются только два — хлор-35 и хлор-37. Первого примерно в три раза больше, чем второго.
Остальные восемь изотопов получены искусственно. Самый короткоживущий из них — 32Сl имеет период полураспада 0,306 секунды, а самый долгоживущий —36Сl — 310 тыс. лет.
Вы читаете, статья на тему хлор получение
обзоры, методики, рецепты
- В целом об эмалях и красках
- Выбор эмалей и красок
- Книги
- Контакты
Галогенсодержащие растворители
Галогенсодержащие (особенно хлорсодержащие) углеводороды отличаются высокой растворяющей способностью и пониженной горючестью. Хлорзамещенные углеводороды смешиваются со многими органическими растворителями; ограниченно растворяют глицерин и гликоли. При нагревании выше 110 0C и действии открытого пламени хлорзамещенные углеводороды разлагаются с выделением фосгена. Из-за высокой токсичности хлорзамещенные углеводороды не применяются в качестве растворителей лакокрасочных материалов, наиболее широко они используются в составах для обезжиривания и в смывках. Эти растворители оказывают коррозионное воздействие на металлы.
В лакокрасочной промышленности из галогенсодержащих растворителей применяются также фторхлорзамещенные углеводороды хладоны (фреоны) — в качестве пропеллентов в аэрозольных упаковках и обезжиривающих средств. По сравнению с хлорзамещенными углеводородами они обладают меньшей токсичностью, химической стойкостью, отсутствием коррозионного воздействия на металлы; не смешиваются с водой, совмещаются с большинством органических растворителей, негорючи.
Физико-химические свойства галогенсодержащих растворителей приведены в табл. 16 и 17.
Хлорсодержащие растворители
Метиленхлорид CH2Cl2 (ГОСТ 9968—73). Получают хлорированием метана при 500—5500C в газовой фазе, хлорированием метилового спирта. Является хорошим растворителем жиров, масел, многих полимеров. Не растворяет политетрафторэтилен, сополимер гексафторпропилена и винилиденфторида. Разлагается на свету под действием УФ-лучей с образованием хлороводорода; для стабилизации вводят уротропин или триэтаноламин.
Х лороформ CHCl3 (ГОСТ 20015—74) и четыреххлористый углерод (тетрахлорметан) ССl4 (ГОСТ 4—84). Получают хлорированием метиленхлорида в жидкой фазе или хлорированием метана; перспективным является метод получения хлороформа из диацетилбензола.
Четыреххлористый углерод обладает высокой токсичностью и способностью быстро разлагаться на свету. Вызывает коррозию алюминия и его сплавов. Растворяет битумы, пеки, жиры, каучуки. Применяется только в смывках.
Дихлорэтан (ГОСТ 1942—74). Получают хлорированием этилена. Различают два изомера: 1,1-ди-хлорэтан CH3CHCI2 и 1,2-дихлорэтан CH2ClCH2Cl. Первый изомер отличается значительно меньшей токсичностью, второй вызывает слабую коррозию металла. Растворяет даммару, кумарон, а также виниловые полимеры. Не растворяет шеллак, пчелиный воск. Дихлорэтан применяется в синтезе тиоколов.
1,1,2,2-Тетрахлорэтан CHCl2CHCl2 (четыреххлористый ацетилен). Один из способов получения — хлорирование ацетилена с помощью катализаторов. Является промежуточным продуктом синтеза трихлорэтилена, тетрахлорэтилена и дихлорэтилена.
Растворяет ацетилцеллюлозу, масла, воска, битумы, пеки, серу.
1,2-Дихлорэтилен CHCl = CHCl. Получают при действии на тетрахлорэтан влажной цинковой пыли. Растворяет ацетилцеллюлозу, шеллак, воска, каучуки, масла. Практического применения в качестве растворителя не нашел.
Трихлорэтилен CHCl = CCl2 (ГОСТ 9976—83). Получают дегидрохлорированием тетрахлорэтана. По растворяющей способности подобен тетрахлорэтану. Разлагается под действием УФ-лучей, поэтому следует хранить в непрозрачной таре. Разлагается также при действии магния, алюминия, калия, натрия, стронция, кальция; с алюминием образует взрывоопасные смеси.
Из числа углеводородных растворителей трихлорэтилен самым первым начали применять для обезжиривания поверхностей, при изготовлении негорючих быстросохнущих лаков и красок, наносимых методом окунания, при неводном крашении тканей, при газоочистке в качестве растворителя серы и фосфора, для экстракции жиров, масел, восков и парафинов .
Трихлорэтан. Различают два изомера: 1,1,1-трихлорэтан CH3CCI3 и 1,1,2-трихлорэтан CHCl2CH2Cl. 1,1,1-Трихлорэтан (метилхлороформ) применяется для обезжиривания изделий из меди, железа, алюминия, цинка, свинца, олова и их сплавов; для очистки кинематографической пленки, изделий из пластмасс, шерсти, хлопка.
Используется в полиграфических красках и при изготовлении клеев. Является составной частью смазочных масел и охлаждающих жидкостей, применяемых при обработке сверхтвердых сплавов вольфрама, титана, тантала, молибдена.
Тетрахлорэтилен (перхлорэтилен) CCl2=CCl2. Более стоек к разложению, чем трихлорэтилен. При температуре свыше 140 0C разлагается под действием света, озона, кислорода. Инертен по отношению к алюминию и хлоридам алюминия. В основном используется для химической чистки одежды; для сушки мокрых металлических изделий после полировки или нанесения гальванического покрытия, при этом вода удаляется в азеотропной смеси с тетрахлорэтиленом. Применяется для удаления с металлических поверхностей смол, парафинов, для обезжиривания типографских форм.
Хлорбензол C6H5Cl (ГОСТ 646—84). Получают хлорированием бензола. В качестве растворителя из-за высокой токсичности применяется ограниченно. Входит в состав лаков для проводов ПЭ-939 и ПЭ-955.
Фторхлорсодержащие растворители (хладоны)
В промышленности для получения хладонов используется жидкофазный метод замещения хлора на фтор в хлороформе, четыреххлористом углероде и других хлорсодержащих углеводородах с помощью фтороводорода. Фторирование проводят в присутствии солей сурьмы или мышьяка при температуре 45—200 0C и давлении до 1,6 МПа.
Применяются хладоны в качестве пропеллентов. Обычно основным пропеллентом служит хладон-12 CCl2F2, (ГОСТ 19212—73), к которому добавляют хладон-11 CC3F, этиловый спирт, метиленхлорид или хлороформ для создания определенного давления в аэрозольной упаковке. Хладон-11 и хлорзамещенные углеводороды склонны к гидролизу, поэтому вместо них часто применяют хладон-114 CClF2CClF2.
Как растворитель чаще всего применяется хла-дон-113 CFCl2CF2Cl (ГОСТ 23844—79), который широко применяется в электронной и радиотехнической промышленности для обезжиривания поверхностей, особенно поверхности пластмасс, так как он не вызывает их набухания. Вводится в состав лакокрасочных материалов для снижения их пожароопасности. Входит в состав лаков на основе фторопластов. Хладон-113 отличается химической стойкостью.
ТАБЛИЦА 16. Физико-химические свойства галогенсодержащих растворителей
Читайте также:


