Опухоли яичников и рак толстой кишки

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Существует огромное количество самых разнообразных осложнений, которые проявляются при раке яичников. Самыми распространенными из них являются:
- Перерастание доброкачественных опухолей.
- Асцит.
- Адгезивные процессы.
- Перекручивание ножки раковой опухоли.
- Разрыв стенок, что приводит к загноению.

[1], [2], [3], [4], [5], [6], [7]
Код по МКБ-10
Асцит
Асцит при раке яичников считается очень тяжелым состоянием, которое вызывает воспаление, некрозы и абсцессы. Развитие этого процесса происходит, когда жидкость в брюшной полости плохо циркулирует. Такой симптом часто появляется при опухоли в яичниках. Чтобы устранить его нужно использовать специальные методы лечения.
Жидкость при раке яичников обычно образуется из-за того, что поражаются лимфатические узлы. Иногда жидкость выходит, если произошел разрыв одного или двух яичников. Обычно асцит развивается на последних стадиях.
Одышка при раке яичников возникает на фоне асцита, когда жидкость попадает в брюшную полость и затрудняет дыхание. Также этот симптом может указывать на то, что рак яичников находится уже на такой стадии, когда его метастазы дошли до легких.
Если количество жидкости меньше 200 мл, то увидеть асцит довольно сложно. При большом количестве выпирается одна или две стороны живота, происходит его вздутие. Также среди основных симптомов асцита выделяют:
Лечить асцит можно:
- С помощью консервативных методов: лекарства помогают нормализовать обмен жидкости в организме.
- С помощью малоинвазивной операции.
- С помощью стандартных хирургических вмешательств.

[8], [9], [10], [11], [12]
Лимфостаз
Лимфостаз ног у больных на рак яичников является обычным симптомом. Это так называемый отек нижних конечностей. Он проявляется, когда происходит нарушение в работе лимфатической системы. Чтобы снять отечность пациентам назначают:
- Специальные массажи.
- Различные методы физиотерапии.
- Консервативное лечение.
- Специальную диету без соли.
Отеки ног
Отеки ног очень часто проявляются после проведения операции у больных на рак яичников. Это происходит потому, что в тканях скапливается большое количество лимфы. Чаще всего отеки ног после хирургического вмешательства проявляются если:
- Рак распространился уже на лимфатические узлы.
- Проводилась также радиотерапия лимфоузлов в паховой области.
Отек при этом появляется либо через несколько дней, либо через неделю после операции.
Плеврит
Метастатический или опухолевый плеврит часто возникает на поздних стадиях рака яичников. Это обусловлено тем, что в плевре собирается большое количество жидкости. Лечение состоит в том, что необходимо вывести жидкость, которая скопилась. Для этого назначают специальные лекарственные препараты.
Куда метастазирует рак яичников?
Прежде всего, необходимо знать, что метастазы из яичников обычно распространяются с помощью трех путей:
- Гематогенного.
- Имплантационного.
- Лимфатического.
Имплантационный, который также называют контактным путем, является самым частым при ранних стадиях болезни. Метастазы в этом случае переходят в брюшную полость, а также в другие органы малого таза. Переход проводится раковыми клетками, которые выходят из самой опухоли. Обычно первыми страдают те органы, которые являются соседними: маточные трубы, матка, мочевой. Потом клетки переходят и в брюшную полость. Также этим путем рак переходит в такие органы:
- Связки матки.
- Прямая кишка.
- Слепая кишка.
- Сигмовидная кишка.
- Ободочная кишка.
- Шейка матки.
- Влагалище.
- Печень.
После имплантационного начинает свое развитие лимфатический путь. Он отличается тем, что клетки опухоли начинают попадать в лимфатические узлы, что увеличивает шанс на перенос их в другие органы. Гематогенный путь отличается тем, что ток крови переносит раковые клетки по всему организму. Но это происходит лишь в 5% случаев. Метастазы могут проявляться в коже, костях, легких, головном мозге.
Если от рака яичников проходят метастазы в кишечнике или же сама опухоль разрастается до этой области, то у больного проявляются следующие симптомы:
- Частые расстройства пищеварительной системы.
- Тенезма.
- Частые запоры.
- Непроходимость кишечника.
На поздних стадиях рака яичников метастазы могут переходить в кости или костный мозг. Если такое случилось, то пациентка может видеть у себя такие симптомы:
- Частые переломы даже от несильных падений.
- Хрупкость костей от их истончения.
- Неврологические расстройства.
Канцероматоз брюшины при раке яичников диагностируется в том случае, если метастазы в брюшной полости достигают большого количества. При этом они могут располагаться в разных ее местах. Это происходит тогда, когда раковые клетки активно переносятся через кровеносные или лимфатические сосуды. Канцероматоз брюшины развивается довольно медленно. На начальных стадиях немногочисленные клетки их опухоли попадают в полость и начинают прикрепляться к ее мягким тканям. Именно из них потом появятся маленькие опухоли. Постепенно они сливаются, образовывая одну большую. Из-за того, что площадь брюшины довольно большая (она покрывает все органы, которые там находятся), то метастазы могут без проблем переходить в эти органы.
При наличии огромного количества метастазов в этой области, нарушается функционирование всех органов. Обычно канцероматоз сопровождается такими симптомами:
- Болевые ощущения в животе.
- Быстрая потеря в весе.
- Рвота и тошнота.
- Асцит.
Непроходимость кишечника при раке яичников является довольно частым симптомом, который возникает уже на поздних стадиях заболевания. При чем наблюдается в некоторых случаях так называемая механическая непроходимость, когда сдавливается кишечник и его кишки. Иногда может проявляться псевдообструкция, которая отличается тем, что круговая стенка кишки проходит инфильтрацию. В последнем случае перистальтическая волна не может пройти.

[13], [14], [15], [16], [17], [18], [19]
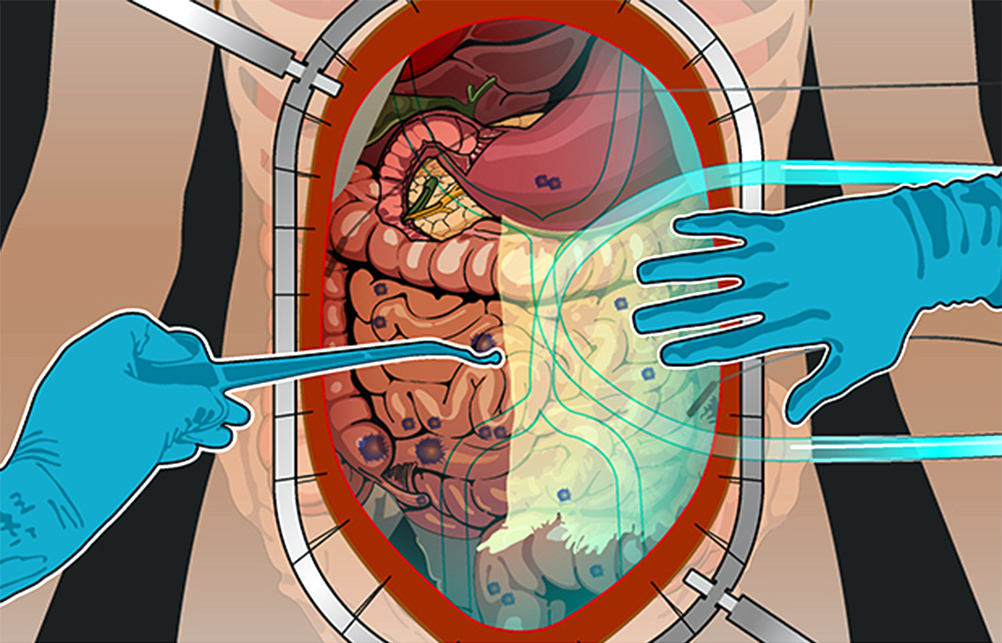
Средняя продолжительность жизни при карциноматозе брюшины без лечения – от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) – гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40-50%, а иногда дает полное излечение.
Самое плохое – даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Цель – уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников – в 60-70% случаев приводит к канцероматозу;
- рак желудка – канцероматоз в 40-50% случаев;
- рак поджелудочной железы – в 30-40% случаев;
- рак толстой и прямой кишки (колоректальный рак) – в 10-15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы – иногда это происходит во время хирургических операций по поводу первичных опухолей.
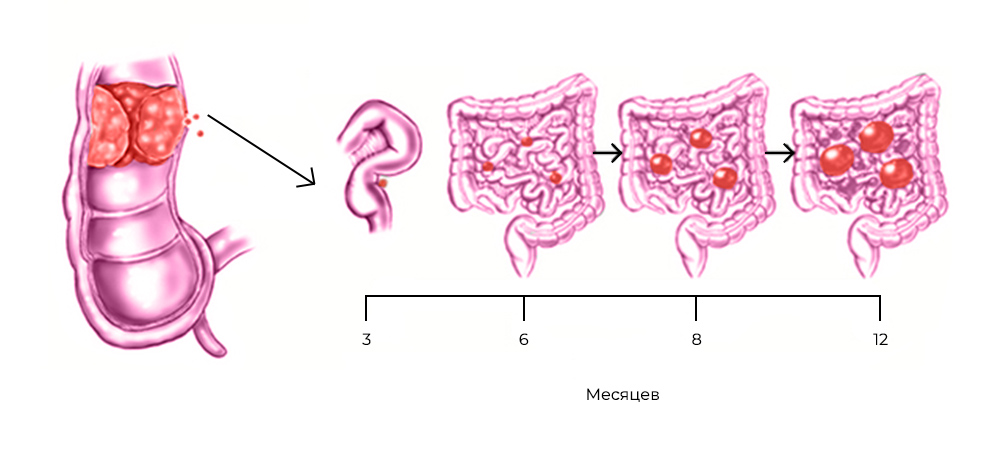
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной – они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань – богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит – выпот и скопление жидкости в брюшной полости – наиболее распространенный симптом при канцероматозе.
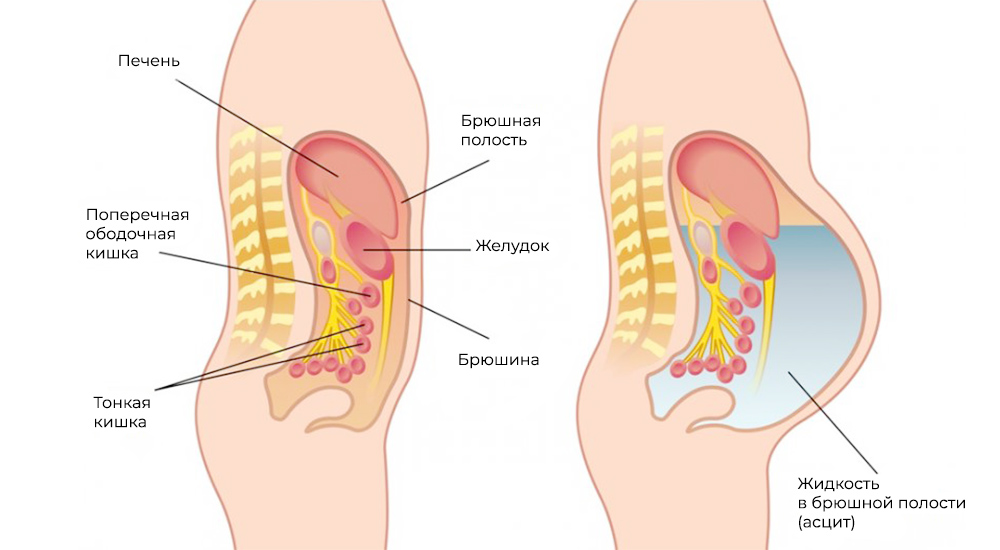
Асцит – скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците – это причины, почему пациенты с канцероматозом без лечения не проживают и года.
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т.к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины –опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов – и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области – невозможно, т.к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер – он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
Гипертермия – это повышение температуры.
- Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
- Причем чувствительность увеличивается избирательно – опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые – сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
- Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов – клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крове увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т.д. Все они имеют собственную противоопухолевую активность, и дополнительно способны усиливать эффект некоторых химиопрепаратов.
- Еще один важный плюс гипертермии – она способствует более активному проникновению препарата в ткани – на глубину до 3 мм – этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины – химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе – куда эффективнее.
Процедура HIPEC – это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно процедура – продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index – PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера— 3 балла.
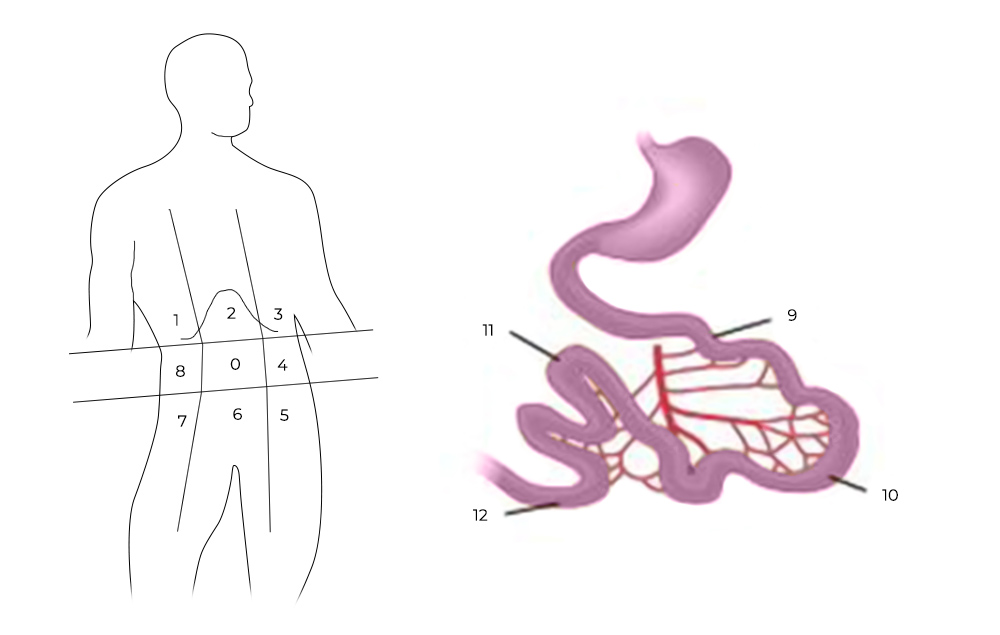
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам – это и есть значение PCI. Чем больше баллов – тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) – то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно – т.е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции – малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
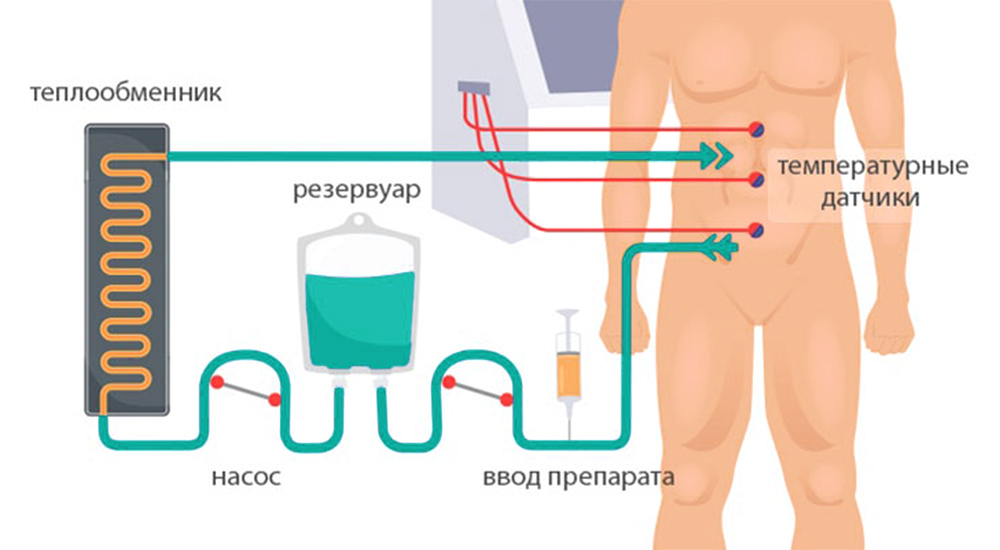
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки – формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2-4 недели. Через 2-3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны – и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении – при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать – например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить – они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины – удалить их все будет невозможно.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ребенка.

Jessica Blackford-Cleeton, которой HIPEC позволила выжить и стать мамой.
К сожалению, HIPEC пока применяется в считанном количестве клиник. Причин этому несколько, и они характерны для всех новых технологичных способов лечения.
- Методика все еще считается инновационной, не все врачи имеют нужный опыт работы. К тому же, для проведения процедуры нужен не 1 и не 2, а целая бригада медиков самой высокой квалификации – это длительная, сложная и напряженная операция.
- Оборудование дорогое, не все страны и не все клиники могут потратиться на перфузионную систему и расходные материалы.
- Врачи бывают довольно консервативны. Кто-то считает, что процедура требует более подробного изучения. А кто-то из них не любит участвовать в проведении гипертермической химиотерапией, потому что опасается за собственное здоровье – испарения химиопрепаратов во время HIPEC могут быть вредными для медиков, которые при этом присутствуют. Хотя, в целом, испарения из закрытого контура минимальны, негативные последствия, даже если есть – не являются необратимыми, врачу нужно лишь более внимательно следить за состоянием почек и печени.
Однако более 70 ведущих хирургов-онкологов из 55 онкоцентров в 14 странах мира, включая США (где и родилась эта процедура), Канаду, Францию и Великобританию, пришли к выводу о том, что HIPEC может существенно повысить ожидаемую продолжительность жизни у пациентов, страдающих канцероматозом, особенно при колоректальном раке.
Клинические исследования из разных стран показывали результаты, когда пациенты после лечения канцероматоза брюшины с применением HIPEC жили 7 лет при опухолях аппендикса, более 5 лет при мезотелиоме брюшины, 5 лет при колоректальном раке, 2 года при раке яичников – тогда как при стандартном лечении их выживаемость колебалась от 2 до 14 месяцев.
Мы в свою очередь убедились в эффективности HIPEC на собственном обширном клиническом опыте. Мы надеемся, что через несколько лет HIPEC будет внедряться в стандарты лечения по ОМС и станет доступна по всей стране. А пока – мы даем пациентам возможность не искать подобную помощь за рубежом, а получить ее в Москве.
Аннотация научной статьи по клинической медицине, автор научной работы — Паяниди Ю. Г., Сельчук В. Ю., Жорданиа К. И., Захарова Т. И., Анурова О. А.
Проведен анализ 49 наблюдений синхронных и метахронных злокачественных муцинозных опухолей толстой кишки и яичников (материал НИИ клинической онкологии ГУ РОНЦ им. Н. Н. Блохина РАМН, 1990-2004 гг.). Полученные данные подтвердили имеющиеся в мировой литературе сведения о том, что поражение яичников в подобных случаях чаще всего является метастатическим, а первичная опухоль расположена в толстой кишке. Окончательно диагноз можно установить только при комплексном обследовании. Результаты иммуногистохимического исследования (экспрессия цитокератинов 7 и 20) являются объективным критерием дифференциальной диагностики первичных и метастатических муцинозных опухолей яичников.
Похожие темы научных работ по клинической медицине , автор научной работы — Паяниди Ю. Г., Сельчук В. Ю., Жорданиа К. И., Захарова Т. И., Анурова О. А.
MUCINOUS CARCINOMA OF THE OVARY AND COLON. METASTASIS OR POLYNEOPLASIA?
We analyzed 49 cases with synchronous or metachronous mucinous carcinomas of the colon and ovary (data on file, Clinical Oncology Research Institute, N. N. Blokhin Russian Cancer Research Center, 19902004). Our findings were in agreement with reports from the world literature about the ovarian lesions being most likely metastatic while the colon being the site of the primary. Only comprehensive examination may provide accurate diagnosis. Immunohistochemistry findings (cytokeratin 7 and 20 expression) are objective criteria to differentiate between primary and metastatic mucinous carcinomas of the ovary.
Ю. Г. Паяниди, В. Ю. Сельчук, К. И. Жорданиа, Т. И. Захарова,
О. А. Анурова, Н. А. Савелов, Е. А. Мороз ЗЛОКАЧЕСТВЕННЫЕ МУЦИНОЗНЫЕ ОПУХОЛИ ЯИЧНИКОВ И ТОЛСТОЙ КИШКИ. МЕТАСТАЗЫ ИЛИ ПОЛИНЕОПЛАЗИИ?
НИИ клинической онкологии ГУ РОНЦ им. Н. Н. Блохина РАМН, Москва
Проведен анализ 49 наблюдений синхронных и метахронных злокачественных муцинозных опухолей толстой кишки и яичников (материал НИИ клинической онкологии ГУ РОНЦ им. Н. Н. Блохина РАМН, 1990—2004 гг.). Полученные данные подтвердили имеющиеся в мировой литературе сведения о том, что поражение яичников в подобных случаях чаще всего является метастатическим, а первичная опухоль расположена в толстой кишке. Окончательно диагноз можно установить только при комплексном обследовании. Результаты иммуногистохимического исследования (экспрессия цитокератинов 7 и 20) являются объективным критерием дифференциальной диагностики первичных и метастатических муцинозных опухолей яичников.
Ключевые слова: муцинозные опухоли, рак яичников, рак толстой кишки, метастазы в яичниках, иммуногистохимическое исследование.
Диагностика первично-множественных злокачественных новообразований являлась предметов активных дискуссий в литературе на протяжении всей истории изучения этой патологии. Сказать, в каких случаях имеется первичная множественность, а в каких - метастазы, порой бывает очень сложно. Практически каждое наблюдение первично-множественного рака сопровождается повышенным вниманием к обоснованию диагноза и дифференциальной диагностике первичной опухоли и метастазов на клиническом, морфологическом, а в последние годы и молекулярном уровнях. Клинический диагноз первично-множественных злокачественных опухолей без гистологического подтверждения всегда является только предположительным [1; 2].
Вместе с тем результаты стандартного морфологического исследования не всегда позволяют дифференцировать первично-множественный процесс от метастатического поражения. Неправильная трактовка диагноза ведет к неадекватному лечению и ухудшает его результаты. В связи с этим сегодня в большинстве клиник проводят комплексную дифференциальную диагностику, включающую ряд клинических, лабораторных, инструментальных, иммуногистохимических и молекулярно-генетических исследований.
Малоизученным и во многих отношениях спорным остается вопрос дифференциальной диагностики синхронных и метахронных злокачественных муцинозных опухолей толстой кишки и яичников. В мировой литературе описаны единичные наблюдения муцинозной аденокарциномы яичников и толстой кишки, интерпретиро-
УДК 618.11 +616.345]-006.04-079.4
вавшиеся как первично-множественные опухоли [1; 2; 5]. В силу топографо-анатомических особенностей (расположение в малом тазу, обилие кровеносных и лимфатических сосудов, напрямую и посредством многочисленных анастомозов связывающих яичники с регионарными лимфатическими узлами, соседними и отдаленными органами) яичники чаще всего поражаются при злокачественных опухолях других органов. Однако с учетом одинакового морфологического строения для дифференциальной диагностики первично-множественного и метастатического поражения яичников только гистологических критериев часто бывает недостаточно.
МАТЕРИАЛЫ И МЕТОДЫ
Синхронные и метахронные злокачественные муци-нозные опухоли толстой (ободочной и прямой) кишки и яичников выявлены у 49 больных, находившихся на лечении в НИИ клинической онкологии ГУ РОНЦ им. Н. Н. Блохина РАМН с 1990 по 2004 г. У 37 (75,5%) из них морфологически уставлен диагноз рака толстой (ободочной или прямой) кишки с метастазами в яичниках, у 12 (24,5%) — после планового гистологического исследования поставлен диагноз первично-множественного синхронного (метахронно-го) рака яичников и рака толстой кишки.
Для подтверждения диагноза во всех 12 наблюдениях первично-множественного муцинозного рака и в 10 наблюдениях метастатических муцинозных опухолей яичников мы применили иммуногистохимический метод. Этот метод позволяет выявлять экспрессию антигенов определенными компонентами тканей, клетками и клеточными структурами [3; 5; 7]. Дифференциальная диагностика основана на биологических особенностях опухолевого роста, к которым относится сохранение экспрессии ряда генов. Это проявляется сходством фенотипов опухолевых клеток и их нормальных анало-
гов: эпителиальные и мезенхимальные опухоли имеют характерные наборы иммуногистохимических признаков и ультраструктуру.
Объектом исследования был операционный материал. Фрагменты опухолей яичников предварительно фиксировали в забуференном 10% растворе формалина и заливали в парафин. Иммуногистохимическое исследование выполнено на серийных срезах толщиной 5 мкм и минимальной площадью 1 см. Срезы обрабатывали антителами к цитокератинам 7 и 20. Семейство цитокератинов объединяет большое число полипептидов, кодируемых разными генами. Их классификация и нумерация приведена в каталоге R. Moll и соавт. [4]. Цитокератины — основные маркеры эпителиальных клеток. Набор экспрессируемых цитокератинов отражает не только клеточный тип, но и степень дифференцировки. Способность экспрессировать определенный спектр цитокератинов, характерный для данной ткани, сохраняется и у исходящей из нее опухоли. Так, муцинозная аденокарцинома яичников экспрессирует цитокератины простого эпителия (в том числе цитокератин 7), а колоректальный рак — специфический набор цитокератинов, характерный для кишечного эпителия (в том числе цитокератин 20, но не цитокератин 7). Таким образом, цитокератиновый профиль, отражающий тип эпителия и степень дифференцировки, можно использовать для дифференциальной диагностики первичных и метастатических муцинозных опухолей яичников [5—7].
Для выявления иммунного окрашивания применялся стрептавидин-биотиновый пероксидазный метод. Ядра во всех случаях докрашивали гематоксилином.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Диффузная цитоплазматическая экспрессия цитокератина 20 выявлена во всех 22 (100%) исследуемых опухолях яичников. Напротив, экспрессия цитокератина 7 практически отсутствовала (рис. 1).
Полученные результаты опровергают первоначальный диагноз первично-множественных опухолей у 12 больных и позволяют думать, что подобные случаи в клинической практике встречаются крайне редко, т. е. муцинозные опухоли яичников при наличии синхронных или метахронных муцинозных опухолей толстой кишки в подавляющем большинстве случаев являются метастатическими.
Нам представилось целесообразным сравнить клинические проявления метастатических муцинозных опухолей яичников (1-я группа — 37 (75,5%) больных) и первично-множественного муцинозного рака яичников и толстой кишки (2-я группа — 12 (24,5%) больных, диагноз поставлен после планового гистологического исследования).
В табл. 1 представлено распределение больных 1-й группы в зависимости от сроков появления метастазов в яичниках. Метастазы в яичниках обнаруживали как одновременно с первичным очагом, так и в разные сроки после установления диагноза рака ободочной или прямой кишки. В зависимости от этого можно выделить два варианта клинического течения заболевания.
В группу с метахронными метастатическими опухолями яичников вошли 22 (59,5%) пациентки. В анамнезе все они имели указания на злокачественное новообразо-
Рисунок 1. Муцинозная аденокарцинома толстой кишки и яичников (микропрепараты).
А. Муцинозная аденокарцинома толстой кишки (окраска гематоксилином и эозином, 40). Б. Метастаз муцинозной аденокарциномы толстой кишки в яичнике (окраска гематоксилином и эозином, 200). В. Выраженная экспрессия цитокератина 20 клетками опухоли толстой кишки ( 200). Г. Выраженная экспрессия цитокератина 20 клетками опухоли яичника ( 200). Д. Отсутствие экспрессии цитокератина 7 клетками опухоли толстой кишки ( 200). Е. Отсутствие экспрессии цитокератина 7 клетками опухоли яичника ( 200).
вание ободочной или прямой кишки. Всем женщинам проведено хирургическое лечение первичного очага. При этом операции в большинстве случаев носили радикальный характер. Минимальный срок развития метастазов в яичниках составил 5 мес, максимальный — 8 лет.
У 15 (40,5%) больных имелись синхронные метастатические опухоли яичников. Заболевание у этих пациенток отличалось тяжелым клиническим течением и менее благоприятным прогнозом. Это объяснялось невозможностью проведения надлежащего лечения из-за распространенности опухоли и тяжести общего состояния. Двенадцати (80%) из 15 больных выполнены хирургические вмешательства, которые в основном носили паллиативный характер. Девять (60%) пациенток прооперированы только по поводу метастазов в яичниках. На втором этапе лечения они получали полихимиотерапию.
В нашем исследовании в 1-й группе преобладали больные в возрасте до 50 лет (64,9%) с сохраненной менструальной функцией. Чаще всего первичная опухоль локализовалась в сигмовидной (48,7%) и прямой (13,5%) кишке, в единичных наблюдениях — в других отделах толстой кишки. Необходимо подчеркнуть, что у 16
Сроки появления метастазов в яичниках у больных раком толстой кишки
Сроки появления метастазов Число больных
Одновременно 15 40,5
После лечения первичного очага 22 59,5
(43,2%) больных отмечалось циркулярное поражение, у 14 (37,8%) опухоль занимала более половины окружности кишки, у 7 (19,0%) — менее половины окружности. При этом инвазия в кишечную стенку была ограничена мышечным слоем только у 5 (13,5%) больных. У 32 (86,5%) пациенток имело место прорастание серозного покрова органа. У 16 (43,2%) больных раком толстой кишки наряду с метастазами в яичниках имелось синхронное метастатическое поражение регионарных лимфатических узлов, у 12 (32,4%) — большого сальника. В большинстве случаев (23 больные, 62,2%) метастазы рака толстой кишки в яичниках были двусторонними.
На рис. 2 представлена выживаемость больных этой группы в зависимости от сроков выявления метастазов в яичниках. Пятилетняя выживаемость больных с синхронными метастазами в яичниках составила 23,8% (медиана продолжительности жизни 22,5 мес), с метахронными — 51,2% (медиана продолжительности жизни 44,5 мес).
Всем 12 (24,5%) больным 2-й группы после планового гистологического исследования поставлен диагноз первично-множественного рака яичников и рака толстой кишки. Средний возраст этих пациенток составил 47,7 года. При анализе менструальной функции выявлено, что 4 (33,3%) женщины находились в постменопаузе, у 8 (66,7%) менструальная функция была сохранена. Изучение репродуктивной функции показало, что только у 2 (16,7%) больных не было беременностей.
По локализации опухолей толстой кишки больные распределились следующим образом: опухоль сигмовидной кишки — у 5 (41,7%) пациенток, прямой кишки — у 2 (16,7%), опухоли других отделов толстой кишки — в единичных наблюдениях. При этом опухоль занимала более половины окружности кишки у 4 (33,3%) пациенток, менее половины окружности — у 8 (66,7%). Циркулярного поражения стенки кишки не было ни у одной больной.
При микроскопическом исследовании выявлено, что глубина инвазии в кишечную стенку во всех наблюдениях ограничилась только мышечной оболочкой. Метастатического поражения регионарных лимфатических узлов не было.
Во всех исследованных случаях опухоли яичников клинически проявляли себя как самостоятельные заболевания, часто полностью затушевывая симптомы пора-
Рисунок 2. Выживаемость больных раком толстой кишки в зависимости от сроков развития метастазов в яичниках.
1 — метахронные опухоли; 2 — синхронные опухоли.
жения желудочно-кишечного тракта. Так, 3 (25%) пациенткам диагноз рака толстой кишки поставлен только после гистологического исследования удаленной опухоли. Основными симптомами были боль внизу живота и увеличение живота в объеме. Две (16,7%) пациентки отмечали нарушения менструального цикла, одна (8,3%) —нарушение мочеиспускания. У 6 (50%) женщин отмечался канцероматоз брюшины, у 8 (66,7%) — асцит.
При определении уровня СА-125 в сыворотке у 9 (75,0%) больных отмечено его повышение до 44,1—1275,4 ед/мл.
В 7 (58,3%) наблюдениях опухоль яичников была двусторонней. У большинства больных наблюдались многокамерные кистозно-солидные образования. Изредка опухоли имели солидную структуру. Их диаметр, как правило, превышал 10 см.
Всем больным этой группы выполнены операции на толстой кишке и на гениталиях. В основном операции носили радикальный характер. Семи (58,3%) пациенткам помимо хирургического лечения проведена полихимиотерапия.
На рис. 3 представлена выживаемость больных этой группы. Пятилетняя выживаемость составила 41,0%. Следует отметить, что более 5 лет после лечения без признаков прогрессирования прожили 2 женщины (одна из них жива в течение 8 лет).
Особенности клинического течения заболевания в исследуемых группах больных (с полинеоплазиями и метастазами в яичниках) представлены в табл. 2. Несмотря на имеющиеся различия в клиническом течении заболевания, с учетом результатов иммуногистохимиче-ского исследования все муцинозные опухоли яичников во 2-й группе больных следует считать метастазами опухолей толстой (ободочной или прямой) кишки. Это еще раз подтверждает имеющиеся в мировой литературе сведения о том, что поражение яичников в подобных случаях чаще всего является метастатическим, а первичная опухоль расположена в толстой кишке.
Рисунок 3. Выживаемость больных со злокачественными муцинозными опухолями толстой кишки и яичников с момента выявления опухоли яичников.
Резюмируя полученные данные, можно утверждать, что окончательный диагноз первичных (при полинеопла-зиях) или метастатических муцинозных опухолей яичников можно установить только при комплексном обследовании больных, а также что экспрессия цитокератинов является объективным критерием дифференциальной диагностики первичных и метастатических муцинозных опухолей яичников.
1. Попова Т. Н., Сельчук В. Ю., Баталина Л. Д. Диагностика первично-множественных синхронных злокачественных новообразований женских половых органов // Акуш. и гин. — 2001. — №4. — С. 45—46.
2. Lee R. R., Young R. H. The distinction between primary and metast-stic mucinous carcinomas of the ovary. Gross and histologic findings in 50 cases // Am. Surg. Pathol. — 2003. — Vol. 27. — P. 281—292.
3. McCluggage W. G. Recent advances in immunohistochemistry in gynaecological pathology // Histopathology. — 2002. — Vol. 46. — P. 309—326.
4. Moll R., Franke W. W., Schiller D. L. et al. The catalog of human cytokeratins: patterns of expression in normal epithelia, tumors and cul-
Клиническое течение первично-множественного муци-нозного рака яичников и толстой кишки и метастатических муцинозных опухолей яичников3
Группы больных 1-я группа (метастазы в яичниках, n = 37) 2-я группа (полинеоплазии, n = 12)
Локализация опухоли по окружности кишечной стенки
циркулярное поражение 16 (43,3) -
более половины окружности 14 (37,8) 4 (33,3)
менее половины окружности 7 (18,9) 8 (66,7)
Синхронные метастазы в регионарных лимфатических узлах 16 (43,2) -
Глубина инвазии в кишечную стенку
в пределах мышечной оболочки 5 (13,5) 12 (100,0%)
прорастание серозного покрова 32 (86,5%) -
а В скобках указаны проценты.
tured cells // Cell. — 1982. —Vol. 31. — P. 11—24.
5. Park S. J., Kim H. S., Hong E. K. et al. Expression of cytokeratins 7 and 20 in primary carcinomas of the stomach and colorectum and their value in the differential diagnosis of metastatic carcinomas to the ovary // Hum. Pathol. — 2002. — Vol. 33. — P. 1078—1085.
6. Seidman J. D., Horbayne-Szakaly I., Haiba M. et al. The histologic type and stage distribution of ovarian carcinomas of surface epithelial type // Int. J. Gynecol. Pathol. — 2004. — Vol. 23. — P. 41—44.
7. Young R. H., Scully R. E. Metastatic tumors in the ovary: a problem-oriented approach and review of the recent literature // Semin. Diagn. Pathol. — 1991. —Vol. 8. — P. 250—276.
Yu. G. Payanidi, V. Yu. Selchuk, K. I. Zhordania, T. I. Zakharova, O. A. Anurova,
N. A. Savelov, E. A. Moroz MUCINOUS CARCINOMA OF THE OVARY AND COLON. METASTASIS OR
Institute of Clinical Oncology, N. N. Blokhin Cancer Research Center RAMS, Moscow
We analyzed 49 cases with synchronous or metachronous mucinous carcinomas of the colon and ovary (data on file, Clinical Oncology Research Institute, N. N. Blokhin Russian Cancer Research Center, 19902004). Our findings were in agreement with reports from the world literature about the ovarian lesions being most likely metastatic while the colon being the site of the primary. Only comprehensive examination may provide accurate diagnosis. Immunohistochemistry findings (cytokeratin 7 and 20 expression) are objective criteria to differentiate between primary and metastatic mucinous carcinomas of the ovary.
Key words: mucinous carcinomas, ovarian carcinoma, colonic carcinoma, ovarian metastases, immu-nohistochemical assay.
Читайте также:

