Опухоли тонкого кишечника на кт
Первичные новообразования тонкой кишки встречаются нечасто. В большинстве случаев опухоли протекают бессимптомно, и их обнаруживают случайно. Конкретных рекомендаций по лучевой диагностике при подозрении на доброкачественную опухоль тонкой кишки не существует. В клинической практике используют рентгенографию с пассажем бария по тонкой кишке, энтероклизму, КТ и КТ-энтерографию. К основным опухолям относят аденомы, лейомиомы, липомы и гемангиомы. За исключением липом, которые характеризуются специфическими проявлениями при КТ, рентгенологическое описание доброкачественных опухолей является сложным, поскольку все они обычно выглядят в виде неспецифических полиповидных образований. Несмотря на свою редкость, клиническое значение имеют семейный аденоматозный полипоз и синдром Пейтца-Егерса, которые могут вовлекать тонкую кишку и проявляются полипозом. Оба заболевания имеют высокий злокачественный потенциал.
а) Клиническая картина доброкачественной опухоли тонкой кишки. Первичные новообразования тонкой кишки встречают не часто. В большинстве случаев опухоли клинически не проявляются, однако возможны такие симптомы, как боль в животе, кровотечения и кишечная непроходимость (Rangiah et al., 2004). Системные проявления нехарактерны. Доброкачественные новообразования могут быть выявлены на любом участке тонкой кишки, на всем ее протяжении.
Стандартное лечение доброкачественных опухолей тонкой кишки — резекция, которая может быть проведена как эндоскопически, так и открытым доступом. При большинстве аденом можно ограничится местной резекцией, даже при наличии признаков злокачественного перерождения.
Любые полипы, выступающие в просвет кишки, оказывают воздействие на пассаж каловых масс, поэтому они могут приводить к появлению симптомов. Полипы могут изъязвляться и кровоточить. Перистальтические волны приводят полип в движение, что может вызывать боль в животе; крупные полипы могут даже приводить к обтурационной непроходимости. Клинические симптомы при полипах возникают нечасто.
б) Методы визуализации доброкачественной опухоли тонкой кишки. Конкретные рекомендации по лучевой диагностике при подозрении на доброкачественную опухоль тонкой кишки отсутствуют, что обусловлено редкостью этих заболеваний и сложностями в визуализации тонкой кишки. Обзорная рентгенография брюшной полости, как правило, неинформативна, хотя у пациентов с острой симптоматикой может быть выявлена обтурационная непроходимость.
Основным методом диагностики служит рентгенография с пассажем бария в тонкой кишке с распознаванием, по возможности, вида опухоли тонкой кишки. Энтероклизма (энетроклизис) — технически сложный, однако более чувствительный метод диагностики опухолей (Nagi et al., 2001). При наличии достаточного рефлюкса через илеоцекальный клапан ирригоскопия может быть информативной в обнаружении патологических изменений дистального отдела подвздошной кишки.
В настоящее время для выявления и описания опухолей тонкой кишки все больше используют КТ. Этот метод особенно информативен при выявлении экстралюминальных образований. КТ-энтерография — новый перспективный метод визуализации (Horton и Fishman, 2003).

Гемангиома подвздошной кишки у пациента 18 лет.
(а) При КТ с контрастированием в поперечной проекции выявлено мягкотканное образование (стрелки) с центральной зоной, накапливающей контраст.
(б) В макропрепарате полученным после сегментарной резекции подвздошной кишки видна округлая опухоль (стрелки). 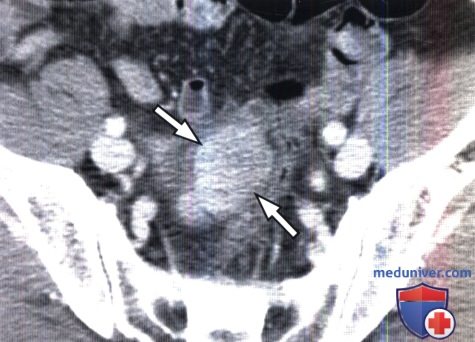
Лейомиома подвздошной кишки у мужчины 60 лет.
При КТ с контрастированием в поперечной проекции выявлено мягкотканное образование (стрелки), умеренно накапливающее контрастное вещество. 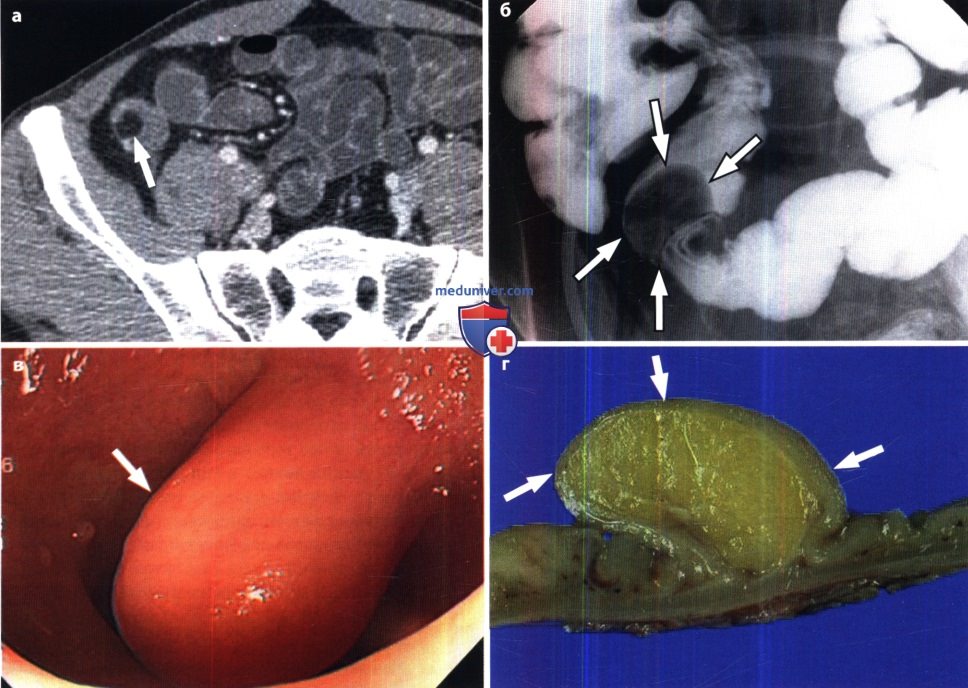
Липома подвздошной кишки у пациента 18 лет.
(а) При КТ с контрастированием в поперечной проекции в тонкой кишке визуализировано внутрипросветное образование (стрелка) с сигналом,характерным для жировой ткани.
(б) При исследовании толстой кишки, вследствие идеального рефлюкса в подвздошной кишке выявлен дефект наполнения (стрелки).
(в) При колоноскопии с введением зонда в подвздошную кишку визуализировано округлое образование (стрелка).
(г) На образце, полученном после сегментарной резекции подвздошной кишки, видно округлое образование (стрелки), содержащее жир. 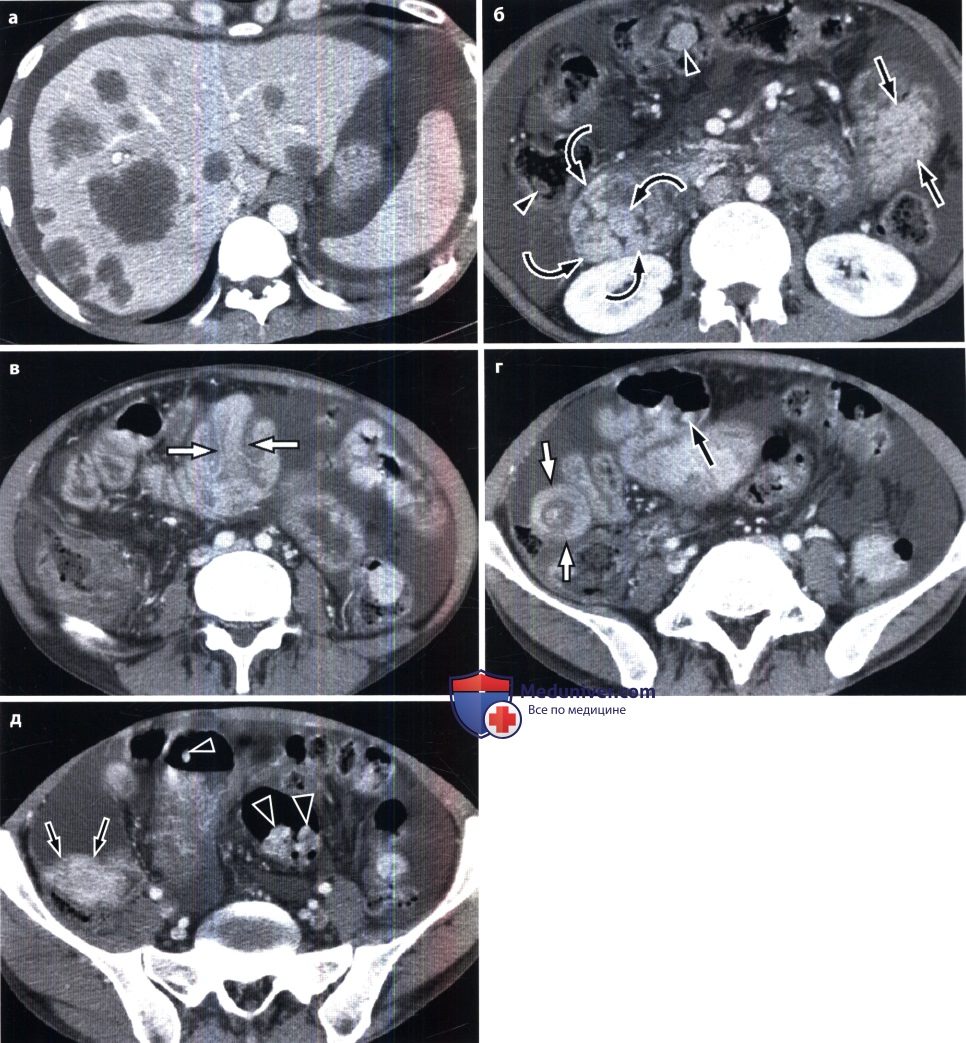
Синдром Пейтца-Егерса с раком двенадцатиперстной кишки и метастазами в печени у пациента 34 лет. При КТ с контрастированием в поперечной проекции получены следующие данные.
(а) Множественные узелки в печени, представляющие собой диссеминированные метастазы.
(б) Новообразование двенадцатиперстной кишки с неровной поверхностью, которое является раком двенадцатиперстной кишки (изогнутые стрелки), крупное полиповидное образование в тощей кишке (темные стрелки) и множественные полипы в толстой кишке (указатели).
(в) Инвагинация тонкой кишки (белые стрелки), ассоциированная с полипом (не виден), (г) Инвагинация тонкой кишки (белые стрелки) и полип тонкой кишки (темная стрелка).
(д) Полипы в тонкой (темные стрелки) и толстой кишке (указатели). 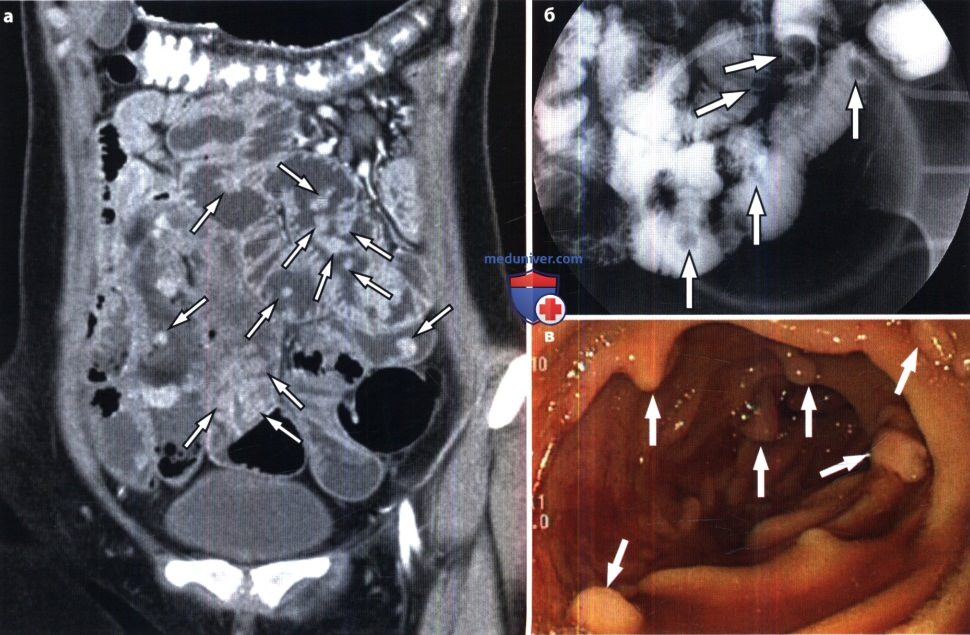
Синдром Пейтца-Егерса у женщины 23 лет.
Множественные небольшие полипы (стрелки) визуализированы при КТ с контрастированием в коронарной проекции (а), рентгенографии с пассажем бария в тонкой кишке (б) и энтероскопии (в). 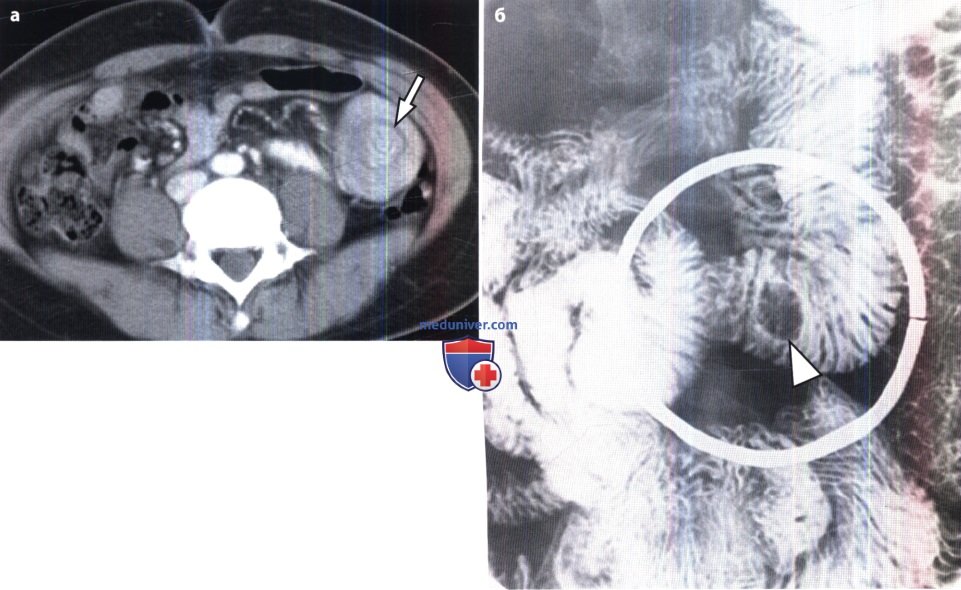
Синдром Пейтца-Егерса у женщины 23 лет.
(а) При КТ с контрастированием в поперечной проекции визуализирована инвагинация (стрелка).
(б) При рентгенографии с пассажем бария выявлен полип в тощей кишке (указатель). 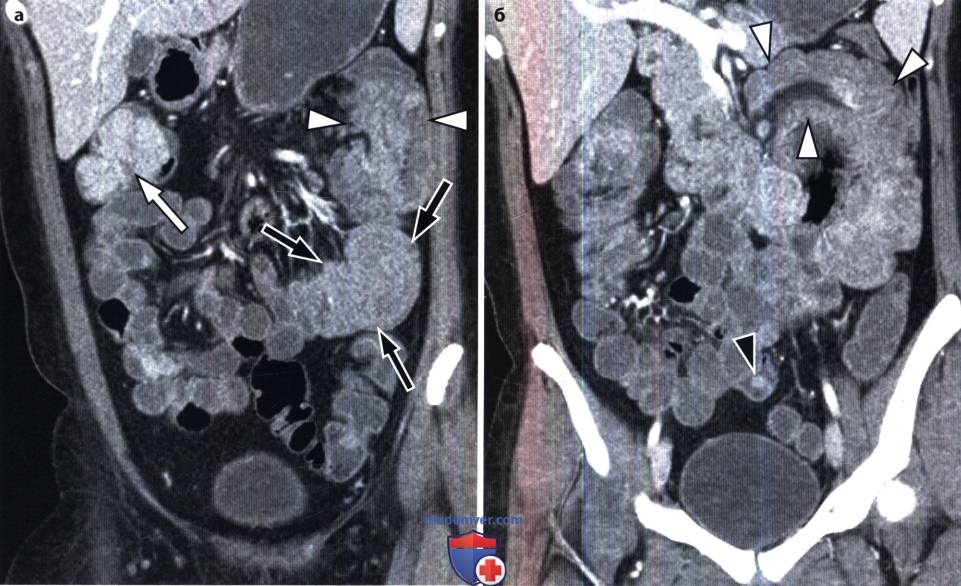
Синдром Пейтца-Егерса у пациентки 19 лет.
(а, б) При КТ с контрастированием в коронарной проекции визуализированы: инвагинация тонкой кишки (белый указатель), крупные полиповидные образования в тонкой (темные стрелки) и толстом (белая стрелка) кишке, небольшой полип в подвздошной кишке (черный указатель).
в) Описание с помощью методов визуализации. В тонкой кишке возможно развитие значительного количества разных типов опухолей, однако большинство из них составляют аденомы, лейомиомы, липомы и гемангиомы. За исключением липом, для которых характерны специфические проявления на КТ, описание доброкачественных опухолей тонкой кишки с помощью неинвазивных методов визуализации является сложным и часто невозможно из-за существенной схожести между доброкачественными и злокачественными опухолями, а также между различными видами доброкачественных опухолей.
г) Аденома. Аденомы тонкой кишки по своим клиническим и морфологическим характеристикам схожи с аденомами толстой кишки. Аденомы составляют около трети всех доброкачественных новообразований тонкой кишки. Они обладают злокачественным потенциалом. Эти новообразования редко приводят к появлению клинических симптомов.
На основании гистологического строения аденомы подразделяют на трубчатые, ворсинчатые и трубчато-ворсинчатые. Ворсинчатые аденомы встречают реже, чем трубчатые, но обычно они крупнее, чаще сидячие и обладают более высоким злокачественным потенциалом.
д) Лейомиома тонкой кишки. Лейомиомы — доброкачественные гладкомышечные новообразования, которые возникают из гладкомышечных клеток мышечной пластинки слизистой оболочки или собственно мышечного слоя стенки кишки. Эти опухоли могут расти внутрь просвета, экстралюминально или в обоих направлениях. В них могут возникать зоны некроза или кровоизлияния. На основании визуализационных характеристик их трудно отличить от гастроинтестинальной опухоли. Оптимальное лечение при лейомиах — сегментарная резекция.
е) Липома тонкой кишки. Липомы тонкой кишки возникают редко. Они представляют собой одиночные четко отграниченные подслизистые опухоли, имеющие внутри жировую ткань, растущие, как правило, внутрь просвета и расположенные чаще в подвздошной кишке. Редко они могут приводить к появлению клинических симптомов, например к инвагинации тонкой кишки. В последнее время липомы стали часто выявлять при КТ как случайные находки, что связано с более частым использованием этого метода. Данные КТ достаточно специфичны: опухоль имеет типичный сигнал, характерный для жировой ткани (Thompson, 2005).
ж) Гемангиома тонкой кишки. Гемангиому тонкой кишки относят к врожденным гамартомам. По сравнению с другими опухолями тонкой кишки гемангиомы чаще приводят к желудочно-кишечным кровотечениям и анемии. При визуализации они выглядят как полиповидные образования, иногда с признаками флеболита и гиперваскуляризации (Light-dale и Hornsby-Lewis, 1995).
При возможности необходимо выполнить сегментарную резекцию.
з) Семейный аденоматозный полипоз. Это наследственное заболевание, вызванное мутацией в гене аденоматозного полипоза толстой кишки (Bronner, 2003). Данный синдром имеет клиническое значение, поскольку для таких пациентов характерна высокая заболеваемость колоректальным раком, в связи с чем необходимы активный семейным скрининг и профилактическая тотальная колэктомия в молодом возрасте, до развития рака. Синдром Гарднера — вариант этого заболевания. В то время как поражение тонкой кишки отмечают реже, чем толстой кишке, а изолированное поражение тонкой кишки встречают редко, данные лучевой диагностики в обоих случаях схожи и представляют собой визуализацию множественных полипов в тонкой кишке. Пациентам, наблюдающимся после тотальной колэктомии, может быть необходимо проведение неинвазивных визуализационных исследований или даже колоноскопии, несмотря на технические трудности метода (Schulmann et al.,2005). Семейный аденоматозный полипоз ассоциирован с десмоидными опухолями брыжейки.
Хирургическое лечение — единственный возможный метод при семейном аденоматозном полипозе, а сроки и объем операции становятся главными вопросами для обсуждения. Поскольку любой оставленный участок слизистой оболочки прямой кишки представляет собой потенциальный источник развития рака, оптимальное лечение включает тотальную проктоколэктомию.
и) Синдром Пейтца-Егерса. Синдром Пейтца-Егерса — редкое наследственное заболевание, которое может иметь как семейный, так и спорадический характер. Характерно наличие желудочно-кишечных гамартомных полипов, чаще всего расположенных в тощей кишке, а также пигментных пятен на губах, слизистой оболочке щек, кистях и стопах. Образованию желудочно-кишечных полипов обычно предшествует поражение кожи, но оно может исчезнуть в подростковом возрасте, за исключением стойкого поражения слизистой оболочки щек. Желудочно-кишечные полипы обычно возникают в подростковом или юношеском возрасте и сопровождаются желудочно-кишечным кровотечением и инвагинацией тонкой кишки.
При визуализации выявляют сидячие или имеющие ножку полипы тонкой кишки различного размера, часто достигающего нескольких сантиметров (Buck et al., 1992). Полипы являются доброкачественными гамартомами, однако заболевание ассоциировано с высоким риском развития опухолей желудочно-кишечного тракта, молочной железы, яичников и поджелудочной железы (McGarrity et al., 2000). Для ранней диагностики потенциальных опухолей может быть информативной КТ.
Полипы при синдроме Пейтца-Егерса могут быть удалены как эндоскопически, так и открытым доступом.
1. Доброкачественные опухоли тонкой кишки встречают нечасто.
2. Доброкачественные опухоли тонкой кишки, как правило, бессимптомны.
3. Для выявления доброкачественных опухолей тонкой кишки используют рентгенографию с пассажем бария по тонкой кишке, энтероклизму, КТ и КТ-энтерографию.
4. Описание доброкачественных опухолей тонкой кишки с помощью неинвазивных методов визуализации является сложным.
5. Аденомы тонкой кишки по своим клиническим и морфологическим характеристикам схожи с аденомами толстой кишки, и также обладают злокачественным потенциалом.
7. Липомы тонкой кишки имеют специфические проявления на КТ: одиночные четко отграниченные подслизистые опухоли, имеющие типичный сигнал, характерный для жировой ткани.
8. При семейном аденоматозном полипозе в патологический процесс могут быть вовлечены как тонкая, так и толстая кишка.
9. Для пациентов с семейным аденоматозным полипозом характерна высокая заболеваемость колоректальным раком, в связи с чем необходимы активный семейный скрининг и профилактическая тотальная колэктомия в молодом возрасте, до развития рака.
10. Для пациентов с синдромом Пейтца-Егерса характерно наличие пигментных пятен на губах, слизистой оболочке щек, кистях и стопах.
11. Полипы тонкой кишки при синдроме Пейтца-Егерса бывают сидячими или имеют ножку.
12. Синдром Пейтца-Егерса ассоциирован с высоким риском развития различных злокачественных опухолей.
л) Список литературы:
- Bronner MR Gastrointestinal inherited polyposis syndromes. Mod Pathol. 2003;16:359-65.
- Buck JL, Harned RK, Lichtenstein JE, Sobin LH. Peutz-Jeghers syndrome. Radiographics. 1992;12:365-78.
- Horton KM, Fishman EK. The current status of multidetector row CT and three-dimensional imaging of the small bowel. Radiol Clin North Am. 2003;41:199-212.
- Lightdale CJ, Hornsby-Lewis L. Tumors of the small intestine. In: Haubrich WS, Schaffner F, Berk JE, Bockus HL, editors. Bockus gastroenterology. 5th ed. Philadelphia: Saunders; 1995. p. 1274-90.
- McGarrity TJ, Kulin HE, Zaino RJ. Peutz-Jeghers syndrome. Am J Gastroenterol. 2000;95:596-604.
- Nagi B, Verma V, Vaiphei K, Kochhar R, Bhasin D, Singh K. Primary small bowel tumors: a radiologic-pathologic correlation. Abdom Imaging. 2001;26:474-80.
- Rangiah DS, Cox M, Richardson M, Tompsett E, Crawford M. Small bowel tumours: a 10 year experience in four Sydney teaching hospitals. ANZ J Surg. 2004;74:788-92.
- Schulmann K, Hollerbach S, Kraus K, Willert J, Vogel T, Moslein G, et al. Feasibility and diagnostic utility of video capsule endoscopy for the detection of small bowel polyps in patients with hereditary polyposis syndromes. Am J Gastroenterol. 2005; 100: 27-37.
- Thompson WM. Imaging and findings of lipomas of the gastrointestinal tract. AJR Am J Roentgenol. 2005; 184:1163-71.
Редактор: Искандер Милевски. Дата публикации: 23.5.2019
С помощью компьютерной томографии кишечника возможно проведение виртуального исследования без проникновения в прямую кишку. Машина делает настолько тонкие срезы стенок кишки, сосудов, лимфатических узлов, что такая виртуальная процедура может составить альтернативу осмотра глазами. Возможно даже осмотреть соседние органы, лимфатические узлы на предмет метастазов. В целом, КТ кишечника — хороший способ ранней диагностики опухолей.
Виды КТ-диагностики
Существуют 3 основных вида КТ- диагностики, которые отличаются друг от друга техническими характеристиками:
- Пошаговая КТ. Самый первый вид КТ-диагностики. За один оборот рентгеновской трубки происходит один срез органа. Чтобы выполнить следующий срез необходимо передвинуть стол на определенное расстояние. Занимает по времени около 20 минут. Качество информации не уступает спиральной компьютерной томографии.
- Спиральная КТ (СКТ). В данном томографе излучатель рентгеновских лучей двигается по спирали вокруг своей оси с одновременным движением стола-транспортера с пациентом, что обеспечивает получение информации в нескольких плоскостях. С помощью СКТ возможно получение до 64 срезов органа. Высокая разрешающая способность дает возможность увидеть новообразования в диаметре 1 мм. Одновременное движение стола и излучателя позволяет сократить время процедуры, но иногда движущийся стол дает помехи на снимках.
- Мультиспиральная КТ (МСКТ). Является разновидностью спиральной КТ. Главное отличие заключается в высокой скорости вращения рентгеновского излучателя и в большем количестве специальных датчиков, которые получают информацию. С помощью МСКТ можно получить до 320 срезов органа, что повышает информативность и точность исследования. Является самым коротким по времени проведения исследованием, что существенно снижает лучевую нагрузку на организм.
Основные методы энтероскопии и их проведение
Что такое компьютерная томография?
КТ кишечника – это высокоскоростное рентгеновское сканирование. Но, если при обычном рентгене орган и его участки отображаются в виде плоских двухмерных объектов, то компьютерная томография воссоздает объемное изображение так, как если бы орган был представлен в разрезе. Для лучшей и качественной визуализации в кишечник предварительно подают немного углекислого газа, чтобы расправились анатомические складки и расширились кишечные протоки.
Рентгеновская трубка томографа, имеющая множество датчиков, с большой скоростью вращается вокруг пациента. Она сканирует строение тонкой и толстой кишки и передает мгновенные снимки на компьютер для обработки специальными программами, которые и создают виртуальную 3D модель. Поэтому очень часто компьютерную томографию называют виртуальной колоноскопией.
Подготовка к процедуре
При проведении КТ кишечника необходима специальная подготовка пациента, в отличие от КТ- диагностики других органов и систем.
- Питание. Исследование кишечника проводится натощак. За 3 дня до исследования назначается бесшлаковая диета, которая исключает из рациона копчености, черный хлеб, молочные продукты, цельнозерновые продукты, сухие и свежие овощи, фрукты, зелень, специи, алкогольные напитки, квас, бобовые. Разрешаются легкие куриные или говяжьи бульоны, белый хлеб, картофель отварной, котлеты и фрикадельки на пару, соки, рыба. Накануне исследования можно употреблять только жидкую пищу (бульоны, соки, воду, зеленый чай).
- Клизма. Используются 2 очистительные клизмы. Первая за 6-8 часов до исследования, вторая за 2 часа перед исследованием (см. клизма кишечника с помощью спринцовки и кружки Эсмарха).
- Слабительные препараты. Для очищения кишечника от содержимого используют слабительные препараты: Фортранс, Пикопреп, Флит фосфо-сода, эндофальк. При назначении слабительных препаратов очистительные клизмы противопоказаны.
Бережем детство
Компьютерная томография разрешена лишь при достижении пациентом 14-летнего возраста. В редких случаях допускаются исключения, но лишь по настоянию лечащего врача и при наличии официального обоснования применения этой методики, а не альтернативных, более мягких. Как правило, в возрасте до 14 лет делают МРТ. В то же время отзывы о компьютерной томографии кишечника показывают, что эта методология дает более точную информацию, нежели МРТ, поэтому зачастую предпочтительна с точки зрения пациентов.
Проведение КТ кишечника
- Процедура проводится натощак.
- Петли кишечника без введения контрастного вещества могут имитировать объемное образование или лимфатические узлы. Контрастное вещество вводят несколькими способами, в зависимости от того, какой отдел желудочно-кишечного тракта прицельно исследуется:
- За 1-2 часа до КТ- исследования пациенту дают выпить воду с контрастным веществом – так лучше осматриваются верхние отделы пищеварительного тракта.
- Для контрастирования всех отделов кишечника контрастное вещество выпивают за 10 часов, 2 часа и 30 минут до исследования.
- Непосредственно перед процедурой вводят в вену контрастное вещество при исследовании паренхимы органов, усиления контраста мягких тканей.
- Заполнение газом петель кишечника через прямую кишку. Петли расправляются, что улучшает визуализацию всех отделов кишечника (КТ-колонография).
- Подготовленного пациента укладывают на стол-транспортер, для лучшей фиксации и обеспечения обездвиженности могут привязать специальными ремнями.
- При исследовании кишечника руки убирают из зоны обследования, так как они в сканируемой зоне ухудшают визуализацию и дают помехи.
- После фиксации человека в нужной позе, рентгенолаборант устанавливает световой луч на уровень исследования, начинается сканирование. Стол-транспортер может двигаться в горизонтальной плоскости (назад-вперед).
- При выполнении некоторых срезов человека просят задержать дыхание. Вся процедура занимает не больше 10-15 минут.
- Врач-рентгенолаборант оценивает полученные данные.
- Выдача результатов на руки пациенту.
- Контрастное вещество выводится из организма в течение суток.
Подготовка и проведение ирригоскопии кишечника
Показания: когда делать?
Обычно КТ назначают, если предполагают опухоль или обилие полипов. За счет точности проводимого сканирования на изображениях можно увидеть воспаленные очаги и оценить их особенности. Так как на снимках особенно четко отражается система кровеносных сосудов, можно понять, как велики повреждения тканей, насколько сильно проросла опухоль сквозь кишечник. Если речь идет о полипах, то именно посредством КТ выясняют, как они перерождаются. Это дает возможность уже на ранней стадии начать эффективное лечение болезни.
КТ дает информацию о состоянии кишечника при заболевании Крона, анемии с невыявленной причиной, кровотечениях. Если диагностирован неспецифический колит, провоцирующий прободение стенок кишечника, именно КТ дает возможность точно оценить состояние больного и предположить, какие меры позволят восстановить здоровье. КТ информативна при болях в кишечнике с неясной причиной, при предположении аномалий. В возрасте 50 лет и старше рекомендовано регулярно делать КТ, чтобы вовремя выявить опасные с точки зрения онкологии нарушения здоровья.
Противопоказания к КТ-диагностике
Стоимость исследования
Исследование заболеваний кишечника при помощи КТ не входит в программу медицинского страхования, поэтому обследование полностью оплачивает пациент. Стоимость исследования зависит от вида используемого томографа, количества сделанных срезов, а также необходимости введения контраста и его объема, который зависит от массы тела диагностируемого.
В среднем, компьютерная томография желудка, кишечника и иных органов брюшины стоит от 3 500 рублей в государственных учреждениях и до 12 000 рублей в частных клиниках.
Сравнительная характеристика КТ, МРТ и колоноскопии
Общая информация
КТ кишечника – это такой способ исследования элементов ЖКТ, который позволяет точно и своевременно определить, не возникли ли новообразования, опасные для человеческого здоровья. В ходе неинвазивного изучения внутренних органов врачи оценивают состояние организма, выявляют проблемы кишечного тракта, если таковые присутствуют.
Обычно КТ кишечника назначают, если необходимо получить полное представление о ЖКТ пациента. По итогам исследования врач узнает, насколько велика длина кишечника, здорова ли слизистая ЖКТ, оценивает состояние просветов протоков. Проводится компьютерная томография кишечника в Москве на специальном современном оборудовании. При соблюдении требований врача процедура безопасна и безболезненна.
В каких случаях необходимо обязательно пройти обследование?
Решение о проведении КТ кишечника остается за врачом, когда основные методы диагностики не дают точного ответа о причине симптомов, а также в экстренных случаях:
- травмы живота;
- подозрение на онкологию (резкое похудение, появление тяжелой анемии, изменение стула и др.);
- болевой синдром неясной этиологии;
- кишечное кровотечение неясной этиологии, выделение крови с калом;
- частые вздутия живота, явления метеоризма;
- задержки стула;
- поиск воспалительного процесса.
- Как проверить кишечник на онкологию?
- Подготовка и проведение МРТ кишечника
- Эндоскопические методы обследования кишечника: описание и подготовка
- Что показывает биопсия кишечника и как проводится процедура?
- Гистологическое исследование тканей кишечника: подготовка и проведение
- Проверка кишечника на заболевания: физикальные, лабораторные и инструментальные методы
- Подготовка и проведение УЗИ кишечника
- Рентген кишечника: суть процедуры, подготовки и проведение
- Чаши Клойбера: как проявляются на рентгенограмме и на что указывают?
- Пневматоз кишечника на УЗИ: что означает патология и как лечится?
Результат исследования
Через полчаса или час после того, как была проведена КТ кишечника, пищевода и желудка, врач отдает готовые снимки и заключение. В некоторых случаях возможна запись исследования на диск, который выдается пациенту вместе со снимками. При точном и правильном соблюдении всех правил и рекомендаций по проведению томографии снимки получатся качественными, на них будут видны все изменения и патологические процессы в органе. Врач-рентгенолог выполняет подробное описание всех участков изображения, проводит расшифровку отклонений от нормы. По итогам диагностирования лечащий врач ставит окончательный диагноз. По этому диагнозу назначается лечение индивидуально для каждого пациента.
Основные преимущества и недостатки метода
Компьютерную томографию назначают, если по каким-то причинам невозможно провести гастроскопию, колоноскопию, рентген, или эти методы оказались неэффективными. Это достаточно дорогая процедура, а записаться на бесплатную диагностику сложно, так как в большинстве муниципальных клиник или отсутствует необходимая техника, или присутствуют большие очереди. Но врачи вынуждены часто отправлять пациентов именно на КТ для детальной визуализации желудка. Полученные снимки позволяют поставить правильный диагноз и назначить лечение.
Вот основные достоинства компьютерной томографии:
- минимальная вероятность ошибки при постановке диагноза;
- отсутствие болезненных ощущений во время обследования;
- высокое качество снимков.
Преимущество КТ перед рентгенографией и эндоскопией ещё и в том, что метод позволяет визуализировать не только слизистую, но и срез стенок органа, сосудистую систему. Сканирование позволяет выяснить факт наличия опухоли, её точные размеры, положение, тип и другие особенности. Выявляются метастазы, определяются границы онкологического процесса. Во время процедуры можно получить информацию о соседних органах: печени, поджелудочной железе, верхнем отделе кишечника, что зачастую упрощает диагностику заболеваний со схожей симптоматикой. Томография визуализирует скопление газов, что является явным признаком перфорации стенок желудка.
Недостатки этого исследования – высокая цена и ионизирующее излучение.
Похожие темы научных работ по клинической медицине , автор научной работы — Бронов О.Ю., Китаев В.М.
Бронов О.Ю., Китаев В.М.
СПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОНКОЙ КИШКИ
СПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОНКОЙ КИШКИ
Бронов О.Ю., Китаев В.М. УДК: 616.341-006-073.756.8
Национальный медико-хирургический Центр им. Н.Н. Пирогова
СПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОНКОЙ КИШКИ
Bronov O.Ju., Kitaev V.M.
Опухоли тонкой кишки составляют 3% от всех опухолевых поражений желудочно-кишечного тракта. Они включают аденокарциномы, карциноидные опухоли, лимфомы и опухоли мезенхимального происхождения. Аденокарцинома является наиболее частой опухолью, поражающую тонкую кишку, на ее долю приходится до 50% всех опухолей этой локализации. Чаще поражаются проксимальные отделы тонкой кишки. Основным методом лечения аденокарцином является хирургическое, объем которого зависит от локализации и распространения опухоли. Так же применяется адъювантная химиотерапия, к радиотерапии эта опухоль резистентна.
Нейроэндокринные опухоли (карциноид) - вторые по частоте образов ания тонкой кишки, их доля составляет 30-40%. Чаще карциноиды локализуются в терминальном отделе подвздошной кишки, вблизи илеоцекального угла и, нередко (в 1/3 случаев), обнаруживается множественное поражение. Большинство карциноидов имеют небольшой размер и достаточно медленный рост. При генерализации развивается, так называемый карциноидный синдром, который проявляется вазомоторным кризом, диареей с абдоминальными болями, фиброзным эндокардитом, бронхитом, кожными проявлениями в виде отека, склеродермии. По мнению Capella C. (2009), при развитии карциноидного синдрома, а так же, если образование более 1 см в диаметре, опухоль должна считаться злокачественной. В этих случаях показано хирургическое лечение с широким иссечением единым блоком.
Лимфомы по частоте занимают третье место и составляют 10-20% опухолей этой локализации. Чаще встречаются В-клеточные неходжкинские лимфомы, которые делятся на иммунопролиферативные и неим-мунопролиферативные. Другим подвидом В-клеточной лимфомы является MALT-лимфома (Mucosa Associated Lymphoid Tissue) - опухоль, ассоциированная со слизистой оболочкой. Характерной чертой этой опухоли считается наличие солитарного экзофитного опухолевого узла, чаще локализующегося в дистальном отделе подвздошной кишки.
Среди мезенхимальных опухолей наиболее часто встречаются гастроинтестинальные стромальные опухоли (ГИСТ), их размеры и форма вариабельны. По данным
Miettinen M. (2006) вероятность злокачественного течения опухоли повышается при размере более 5 см, и/или наличии более 5 митозов в 50 полях зрения при микроскопии. Злокачественные ГИСТ распространяются в окружающие ткани, а так же гематогенно в печень, легкие и кости. Патогенез возникновения ГИСТ обусловлен мутацией в гене с-Kit, который является тирозинкиназным рецептором, расположенным на клеточной мембране. В результате его активации отмечается стимуляция митоти-ческой активности клеток. Этот механизм отличает ГИСТ от других типов мезенхимальных опухолей. В настоящее время при адъювантной химиотерапии применяются ингибиторы рецепторов тирозинкиназы, механизм действия которых обусловлен блокированием активности киназ. Лейомиомы - это обычно доброкачественные небольшие образования, менее 1 см в диаметре, растут из подслизистой основы. Лейомиосаркомы - достаточно большие опухоли с неоднородной структурой за счет некроза и кровоизлияний. Лечение только хирургическое, эта опухоль резистентна к лучевой и химиотерапии. Лимфодиссекцию обычно не проводят, поскольку лим-фогенное распространение сарком крайне редко.
Бронов О.Ю., Китаев В.М.
СПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОНКОЙ КИШКИ
устройство. Устройство делает снимки с частотой 2 кадра в секунду. Заряда батареи хватает на 8 часов. Капсульная эндоскопия считается безопасной неинвазивной процедурой. Главный риск - это задержка капсулы более 2 недель в просвете кишки. Противопоказания для кап-сульной эндоскопии являются дисфагия, тонкокишечная непроходимость, различные кардиальные импланты. Основные ограничения в использовании капсульной эндоскопии являются отсутствие возможности проведения биопсии. К ограничениям можно отнести невозможность в некоторых случаях точно локализовать изменения. Примерно в 20% исследований капсула не достигает толстой кишки, в связи с задержкой в желудке, наличием в анамнезе оперативного вмешательства на тонкой кишке, недостаточной подготовкой тонкой кишки.
Другой разновидностью энтерскопии является спиральная энтероскопия. Для продвижения энтероскопа по тонкой кишке используется ротация по часовой стрелке специально установленного на трубке поливинилхлорид-ного элемента, закрученного по спирали. Преимуществом данного метода является меньшее время исследования, а так же меньшее количество осложнений при проведении резекции больших полипов.
Ряд отечественных (Диомидова В.Н., Михайлов М.К., Портной Л.М.) и зарубежных авторов являются инициаторами ультразвукового исследования тонкой кишки. Метод позволяет оценить толщину стенки, наличие стеноза или дилатации, подвижность кишки. Ограничениями при использовании метода являются выраженная подкожно-жировая клетчатка и артефакты от наличия внутрипросветного газа.
Компьютерная томография используется в диагностике заболеваний желудочно-кишечного тракта уже более 30 лет. Но большинство работ (Китаев В.М. Портной Л.М.) посвящено исследованию желудка и толстой кишки. В настоящее время внедрение многосрезовой компьютерной томографии в сочетании с внутривенным болюсным контрастным усилением поднимает диагностику патологии желудочно-кишечного тракта на качественно новый уровень. Появилась возможность полноценного применения болюсного контрастного усиления и получения на этой основе высокачественных, высокоразрешающих многоплоскостных изображений. В этой связи представляется перспективным применение СКТ для исследования тонкой кишки.
Цель работы: Определить возможности СКТ с внутривенным болюсным контрастным усилением в первичной и дифференциальной диагностике злокачественных опухолей тонкой кишки.
Материал и метод
Бронов О.Ю., Китаев В.М.
СПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОНКОЙ КИШКИ
фазу усиления - 60 с. При необходимости, в зависимости от цели исследования, для отчетливой визуализиции просвета кишечной трубки сканирование проводили после дробного приема 3% водорастворимого контрастного препарата - по 150 мл с интервалом 15 минут в течение часа. Заключения КТ исследований сопоставляли с операционными находками и результатами гистологических исследований.
Полученные результаты и их обсуждение
По окончательным диагнозам опухоли тонкой кишки обнаружены у 29 пациентов. Среди них аденокарциномы различной степени зрелости установлены у 11, лимф омы - у 9, саркома - у 2-х, гастроинтестинальная стромальная опухоль различной степени дифференцировки - у 4-х, карциноид - у 1, доброкачественные опухоли - у 2-х пациентов (лейомиома и гемангиома тощей кишки). Изучение полученных при СКТ результатов позволило выделить морфологические признаки различных опухолей.
Злокачественные эпителиальные опухоли диагностированы у 9 больных, возраст - 41-65 лет. Раковая опухоль чаще локализовалась в тощей кишке. Заболевание манифестировалось болями в животе, диареей, потерей массы тела, лихорадкой, симптомами кишечной непроходимости. Весьма характерно кишечное кровотечение.
На КТ опухоли проявлялись признаками нарушения проходимости и/или локальными изменениями в пораженном сегменте кишки (рис. 1). На нарушение проходимости указывало расширение диаметра сегмента тонкой кишки проксимальнее опухоли более чем на 3 см с появлением в просвете кишки жидкого содержимого. При эндофитном типе роста опухоли локальные изменения включали утолщение стенки кишки более 10-15 мм и сужение ее просвета. Экзофитный тип роста проявлялся узлом, растущим в просвет кишки. При контрастном усилении ткань опухоли накапливала контрастный препарат более интенсивно, чем подслизистый и мышечный слои неизмененной стенки кишки, что значительно облегчало ее выявление. Перфорации кишки с формированием межкишечного абсцесса наблюдали у 2 больных. В случаях перфорации на КТ обнаруживали типичные признаки межкишечного абсцесса (рис. 2).
Рис. 1. Аденокарцинома подвздошной кишки, эндофитный рост (стрелка)
поражалась реже (2 наблюдения). Распространенную форму поражения обнаружили у 1 больного. Вне зависимости от типа лимф омы на компьютерных томограммах опухоль проявлялась или узловой инфильтрацией, или утолщением стенки кишки в пределах сегмента, или распространенной формой поражения. Поражался под-слизистый слой кишки. Инфильтрация подслизистого слоя вела к исчезновению складок слизистой и замене рельефа кишки на нодулярный тип. Узловые формы имели вид однородного, солидного узла диаметром до 5 см и более (рис. 3). При контрастном усилении узел слабо набирал контрастное вещество и накопление препарата происходило преимущественно по его периферии в виде тонкого ободка, который отображал окрашивание неизменной слизистой оболочки. В других случаях разрастание лимфоидной ткани, сопутствующая инфильтрация подслизистого слоя вела к утолщению стенки, которое приводило к изъязвлению и даже перфорации. Пораженный сегмент имел протяженность 8-12 см (рис. 4).
Бронов О.Ю., Китаев В.М.
СПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОНКОЙ КИШКИ
Опухоль вызывала умеренный стеноз и локальное су-прастенотическое расширение. Поражение лимфоидного аппарата кишечника неминуемо вызывало нарушение иммунологического барьера слизистой оболочки кишки, что в свою очередь, являлось причиной возникновения энтерита, колита (рис. 5).
Саркомы обнаружены у 2 больных, возраст 25-40 лет. Эти опухоли имели вид неоднородного по структуре объемного образования с признаками ин-фильтративного роста. Неоднородность была обусловлена некрозом, как правило, массивным, с последующим развитием кистовидной дегенерации. Особенно ярко неоднородная структура проявлялась при контрастировании. В одном наблюдении при КТ в брюшной полости был обнаружен инфильтрат, включающий в свою структуру петли подвздошной кишки. Стенка включен-
Рис. 3. Неходжкинская лимфома подвздошной кишки (стрелка)
Рис. 5. Лимфома Ходжкина, проявления энтерита, колита. Асцит
ных в инфильтрат кишок была циркулярно утолщена и при контрастном усилении активно набирала препарат (рис. 6). Учитывая значительные перифокальные изменения в виде инфильтрации брыжейки, поражение сразу двух петель подвздошной кишки, диагноз опухоли при КТ был отвергнут. Выявленные изменения были расценены как воспалительный инфильтрат, вероятно, возникший вследствие перфорации тонкой кишки. После проведения противовоспалительной терапии при контрольном КТ исследовании наблюдалось убедительное уменьшение инфильтративных изменений. Больной оперирован. На операции обнаружена опухоль - саркома подвздошной кишки. В этом случае противовоспалительная терапия сняла параканкрозные воспалительная изменения, что и послужило причиной ошибочного заключения.
Рис. 4. Неходжкинская лимфома терминального отдела подвздошной кишки (стрелка), увеличенные лимфатические узлы брыжейки (двойная стрелка)
Рис. 6. Саркома подвздошной кишки (стрелка)
Бронов О.Ю., Китаев В.М.
СПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОНКОЙ КИШКИ
Карциноиды. На КТ карциноид имел вид подслизистого узла, локализующегося в подвздошной кишке. При
контрастном усилении узел проявлялся интенсивным окрашиванием, подобно окрашиванию ГИСТ опухоли. Опухоли сопутствовал мезентериальный фиброз, который отображался уплотнением структуры брыжейки и появлением спикулообразного рисунка в жировой клетчатке. В нашем наблюдении имело место метасти-зирование и по лимфатическим путям, и в печень. Метастатические узлы окрашивались, столь же интенсивно, как и материнский узел в кишке, кроме того в структуре отмечались участки обызвествления (рис. 9).
СКТ должна являться скрининговым методом в диагностике опухолей тонкой кишки, при этом болюс-ное контрастное усиление в ряде случаев позволяет распознать вид опухоли. Из всех опухолей только ГИСТ и карциноид имеют наиболее интенсивное окрашивание. Для аденокарцином характерно умеренное диффузное повышение денситометрического показателя узла. При
Бронов О.Ю., Китаев В.М.
СПИРАЛЬНАЯ КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ ТОНКОЙ КИШКИ
лимфоме существенного повышения денситометриче-ского показателя опухолевой ткани не наступает, а наблюдается окрашивание неизмененной слизистой оболочки. Для саркомы типичен инфильтративный рост и неоднородное окрашивание при контрастном усилении
28. Solem CA, Loftus EV Jr, Fletcher JG, et al. Small-bowel imaging in Crohn's disease: a prospective, blinded, 4-way comparison trial. Gastrointest Endosc. 2008; 68(2): 255-266.
29. Thompson W.A. Imaging strategies for tumors of the gastrointestinal system. Cancer journal clinicans 1987(V. 37); № 3: 165-185.
1. Блохин Н.Н., Петерсон Б.Е. Клиническая онкология. М.: Медицина, 1971; 456 с.
2. Власов П.В. Клинико-рентгенологическая семиотика рака желудка. М.: Медицина, 1974;220с.
3. Китаев В.М. Компьютерная томография в гастроэнтерологии. Издание Российской академии естественных наук. 2011; 315 с.
4. Кишковский А.Н. Дифференциальная диагностика заболеваний желудочно-кишечного тракта. М.: 1979; 415.
5. Момот Н.В., Поляк Е.З., Иваницкий С.М. и др. Компьютерная томография в диагностике рака желудка и оценке его распространенности. Вестник рентгенологии и радиологии 1992; № 3: С. 34-39.
6. Пажарисский К.М., Пучков Ю.Г., Климашевский В.Ф. Морфология опухолевого роста. В кн.: Общая онкология под ред. Н.П. Напалкова. М.: Медицина, 1989; С. 168-193.
7. Петров В.П., Лелиовский Ю.В., Рожков А.Г. Отдаленные результаты хирургического лечения рака желудка. Вестник хирургии 1990(Т. 144); № 5: 22-27.
8. Портной Л.М., Сташук Г.А., Денисова Л.Б. и др. Современные возможности лучевой диагностики рака желудка. Медицинская визуализация 2000; № 2: С. 3-14.
9. Портной Л.М. Рак желудка. Лучевая диагностика. М.: Медицина, 1999; 381с.
10. Фишер М.Е., Жаврид Э.А., Сачивко Н.В. Диагностика и лечение распространенного рака желудка. Минск: Навука i техшка, 1991; 157 с.
11. Чиссов В.И. Ошибки в клинической онкологии. М.: Медицина, 1993; 541с.
12. Botet J.E. Preoperative staging of gastric cancer: compazision of endoscopic US and dynamic CT. Radiology 1991(V. 181); № 2: 426-432.
13. Capella C, Solcia E, Sobin LH, et al. Endocrine tumours of the small intestine. In: Hamilton SR, Aaltonen LA, eds. Pathology and Genetics of Tumours of the Digestive System. Lyon, France: International Agency for Research on Cancer Press; 2000:77-82.
14. Crump M, Gospodarowicz M, Shepherd FA lymphoma of the gastrointestinal tract. Semin Oncol 1999, 26:324-337.
15. D'Elia F., Zingareli A., Palli D., Grani M. Hydro-dynamic CT preoperative staging of gastric cancer: correlation with pathological findings. A prospective study of 107 cases. Eur Radiol 2000(V. 10); № 12: 1877-1885.
16. Elsayes KM, Al-Hawary MM, Jagdish J, et al. CT enterography: principles, trends, and interpretation of findings. Radiographics. 2010;30:1955-70.
17. Hundt W., Braunschweig R., Reiser M. Assessment of gastric cancer: value of breath-hold technique and two phase spiral CT. Eur Radiol 1999(V. 9); 68-72.
18. Lee J.K.T. Computed body tomography with MRI correlation. Lippincott - Raven 1998(V. 1); P. 776.
19. Lee K.R, Levine E., Moffat R et al. Computed tomography staging of gastric neoplasms. Radiology 1979(V. 133); P. 151-155.
20. Li F, Gurudu SR, De Petris G, et al. Retention of the capsule endoscope: a single center experience of 1000 capsule endoscopy procedures. Gastrointest Endosc. 200-8;68:174-80.
21. Miettinen M, Lasota J Gastrointestinal stromal tumors: definition, clinical histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001, 438:1-12.
22. Modlin IM, Sandor A :An analysis of 8305 cases of carcinoid tumors. Cancer 1997, 79:813-829.
23. Neugut AI, Jacobson JS, Suh S, et al.: The epidemiology of cancer of the small bowel. Cancer Epidemiol Biomarkers Prev 1998, 7:243-251.
24. Nylund K, 0degaard S, Hausken T, et al. Sonography of the small intestine. World J Gastroenterol. 2009;15:1319-30.
25. Jones E.C., Chezmar J.L., Nelson R.C., Bernardino M.E. The frequency and
significance of small (>15 mm) hepatic lesions detected by CT. AJR 1991(V. 158); P. -
535-539. КОНТАКТНАЯ ИНФОРМАЦИЯ
26. Riddel RH, Petras RE, Williams GT, et al.: Tumors of the Intestines: Atlas of Tumor Pathology, series 3. Washington, DC: Armed Forces Institute of Pathology; 2002. Национальный медико-хирургический Центр им. Н.И. Пирогова
Читайте также:

