Опухоль верхушки пирамиды височной кости
Первичные опухоли височной кости встречаются редко, но сообщения о них имеются. К ним относят гигантоклеточную опухоль, ксантому, опухоль эндолимфатического мешка, гемангиому, гемангиоперицитому, хондрому, хондросаркому, аневризматическую костную кисту, плазмацитому, недифференцированную карциному, различные саркомы, распространенный рак носоглотки. За исключением аневризматической костной кисты, эти новообразования являются клеточными. Этиология аневризматической костной кисты до конца не выяснена.
Различные патоморфологи считают, что это экспансивное новообразование было бы правильнее называть гигантоклеточной опухолью, либо что она может развиваться из доброкачественных опухолей костной ткани. Признаки на КТ и МРТ достаточно характерны: определяется ремоделирование кости и множество кист, в большинстве из которых имеются газожидкостные уровни.
Опухоль эндолимфатического мешка представляет собой сосочковую аденому, развивающуюся из эндолимфатического мешка или его придатков. Обычно эта опухоль более агрессивна, чем другие новообразования височной кости.
Nager классифицировал саркомы, поражающие височную кость, согласно общим категориям рабдомиосаркомы, внекостной саркомы Юинга, миксомы и фибромиксомы, остеосаркомы. В состав всех этих сарком входит хотя бы один производный элемент мезенхимы. И хотя изолированное поражение височной кости при этих заболеваниях встречается редко, из-за своего крайне агрессивного течения они могут распространяться на височную кость.

Рабдомиосаркома представляет собой крайне злокачественную опухоль, состоящую из рабдомиобластов различной дифференцировки, с наличием или без наличия внутриклеточных миофибрилл и поперечных полос. Выделяют три подтипа опухоли: эмбриональный (включая гроздевидный), альвеолярный и плеоморфный. Первые два чаще встречаются у детей, третий, напротив, у взрослых.
Внекостная саркома Юинга представляет собой злокачественную опухоль, которая, как считается, происходит из примитивной мезенхимальной ткани без четкой дифференцировки. Клинически и гистологически ее часто путают с ювенильной рабдомиосаркомой. Примерно в 70% данное новообразование встречается у пациентов моложе 20 лет. Височная кость поражается редко, мы упоминаем ее лишь для полноты описания.
К другим саркомам, которые нужно включать в список заболеваний для дифференциальной диагностики, относятся миксома, фибромиксома и остеосаркома.
а) Эозинофильная гранулема: гистиоцитоз X из клеток Лангерганса. При гистиоцитозе X может поражаться основание черепа. Обычно заболевание начинается с клиники инфекционного воспаления уха, которое не разрешается после антибактериальной терапии и туалета. Височная кость может расширяться и разрушаться. Граница кость-образование на КТ может быть весьма четкой. Плотность внутренней части образования и данные МРТ могут быть различными.
Обычно пациенты достаточно молоды, что должно дополнительно насторожить врача. Также следует исключить тератому, невриному и гигантоклеточную опухоль.
б) Хордома. Хордомы, возникающие из остатков спинной струны зародыша, представляют собой расположенные вдоль средней линии тела новообразования, которые возникают в области ската и могут распространяться на височную кость. Возможна ситуация, в которой остатки нотохорды смещаются латеральнее, в сторону верхушки пирамиды. В таком случае возможно появление первичной хордомы пирамиды. Хордомы представляют собой крупные дольчатые опухоли.
Они расположены вдоль средней линии, накапливают контраст при выполнении контрастной КТ, разрушают костную ткань и содержат кальцификаты. На МРТ их внешний вид аналогичен хондросаркомам, но они менее интенсивно накапливают контраст и располагаются ближе к средней линии.

КТ височных костей без контраста в (а) аксиальной, (б) фронтальной и (в) сагиттальной проекциях: массивное образование, разрушающее пирамиду левой височной кости.
Опухоль распространяется в область ската, поражает основание клиновидной кости. Ее расположение в области каменисто-скатового синхондроза является признаком агрессивной хондросаркомы основания черепа.
Обычно структура таких опухолей представлена сильно кальцифицированным хондроидным матриксом, имеющим форму кольца или арки;
но у данного пациента содержание кальцифицированного матрикса в опухоли минимально, что затрудняет постановку диагноза.
Хондросаркому основания черепа всегда следует рассматривать в качестве возможного заболевания, поражающего костные структуры данной области.
Также стоит рассмотреть возможность наличия метастатического поражения, плазмоцитомы, холестеатомы верхушки пирамиды, хордомы.
в) Менингиома. Эти доброкачественные опухоли, происходящие из оболочек головного мозга, составляют примерно 14% от всех внутричерепных опухолей. Менингиома — наиболее распространенная солидная опухоль, поражающая верхушку пирамиды. Первичные менингиомы пирамиды встречаются редко, чаще они поражают ее вторично. Обычно менингиома выглядит как новообразование на широком основании, которое располагается вдоль задней поверхности пирамиды.
г) Параганглиома. Обычно параганглиомы (гломусные опухоли) не произрастают внутри пирамиды, а прорастают в нее. Первичные гломусные опухоли верхушки пирамиды при отсутствии других ее участков встречаются чрезвычайно редко.
д) Метастазы опухоли в височную кость. Первичные злокачественные опухоли вневисочной локализации могут гематогенно метастазировать в височную кость, особенно в пирамиду, богатую костным мозгом. Чаще всего метастазирует рак молочных желез, предстательной железы, легких, почек, а также меланома.
Внешний облик метастазов будет различным, он зависит от первичного очага. Иногда метастазы могут разрушать и ремоделировать кость, иногда же проявляют себя менее агрессивно. Подозрение на метастатический процесс должно возникнуть при наличии в анамнезе данных о первичной опухоли, а также при наличии метастазов другой локализации.
Алгоритм обследования и лечения поражения верхушки пирамиды
Верхушка пирамиды участвует в формировании средней черепной ямки и расположена в передне-верхней части височной кости. Чаще всего заболевания верхушки пирамиды являются осложнением хронического среднего отита. Благодаря совершенствованию методов лучевой диагностики стало возможным точно диагностировать эти состояния и более подробно планировать предстоящее оперативное вмешательство, которое выполняется в столь сложной анатомической области. Все поражения верхушки пирамиды подразделяются на инфекционные, воспалительные, неопластические и сосудистые.
Наиболее часто встречаются воспалительные и неопластические варианты. Как правило, клиническая картина обусловлена сдавлением (или иным поражением) близлежащих структур.
а) Эпидемиология. Заболевания верхушки пирамиды остаются относительно редкими. Ранее средней отит достаточно часто приводил к развитию различных инфекционных осложнений, но сейчас их число постепенно сокращается, в основном благодаря появлению антибиотиков, совершенствованию хирургической техники, более раннему и более частому использованию вентиляционных трубок. С другой стороны, из-за большей распространенности современных методик лучевой диагностики, поражения верхушки пирамиды стали чаще обнаруживать как случайные находки.

б) Анатомия верхушки пирамиды височной кости. Височная кость состоит из четырех частей: каменистой, чешуйчатой, барабанной и сосцевидной. Каменистая часть представлена пирамидой с направленной вперед и медиально верхушкой и основанием с заднелатеральным направлением. Основание пирамиды образуют внутренне ухо, внутренняя сонная артерия и слуховая труба. Средний остроконечный конец каменистой части соединяется со скатом черепа. Верхнепередняя часть пирамиды (мозговая) образует дно средней черепной ямки. Задневерхняя часть (мозжечковая) лежит вертикально, она образует переднюю границу задней черепной ямки.
Место соединения передней и задней поверхностей пирамиды называют каменистым гребнем. Нижняя поверхность пирамиды направлена кнаружи, она представляет собой дно латерального основания черепа.
Вблизи пирамиды расположен ряд сосудистых и нервных анатомических образований. На нисходящей верхнепередней поверхности пирамиды, в меккелевой полости, расположены тройничный нерв и тройничный ганглий. ЧН VI проходит в канале Дорелло в толще каменисто-клиновидной связки, а затем входит в кавернозный синус. ЧН VII и VIII входят в толщу височной кости через внутренний слуховой проход. В яремном отверстии, расположенном на задненижней поверхности, находятся луковица внутренней яремной вены и нижние черепные нервы. В переднелатеральной части пирамиды расположен канал внутренней сонной артерии, в котором проходит соответствующая артерия. Верхний каменистый синус идет вдоль каменистого гребня. Также к гребню крепится намет мозжечка. Степень пневматизации пирамиды может варьировать.
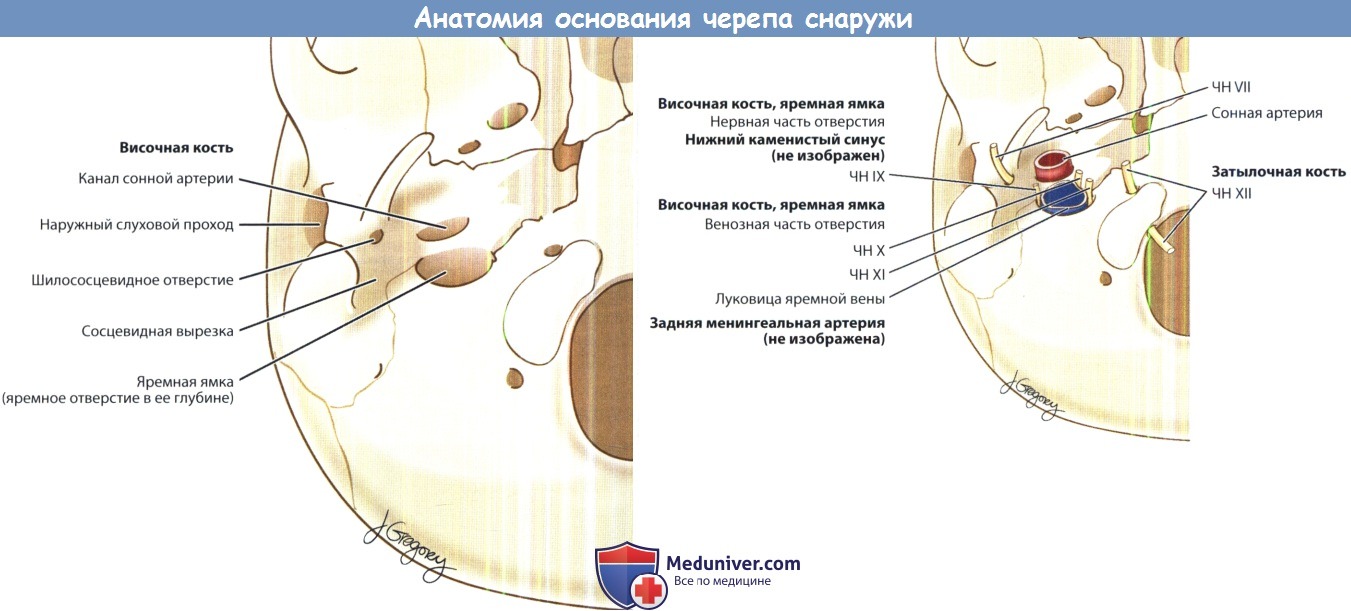
Анатомия основания черепа: вид снизу, включая отдельные сосуды и нервы. ЧН — черепной нерв.
в) Жалобы при болезни верхушки пирамиды. Понятно, что заболевания верхушки пирамиды могут сопровождаться появлением различных симптомов и признаков, связанных с поражением каких-либо из перечисленных выше структур. Снижение слуха может быть следствием скопления экссудата, который образовался из-за дисфункции слуховой трубы, либо следствием эрозии слуховых косточек при хроническом среднем отите; нейросенсорная тугоухость может развиваться из-за поражения внутреннего уха или преддверно-улиткового нерва. Иногда тиннитус и вертиго сопровождаются снижением слуха, иногда встречаются на фоне нормального слуха. Сдавление лицевого нерва на любом его участке в пределах височной кости приведет к развитию пареза или паралича лицевого нерва, особенно уязвим нерв в области коленчатого ганглия. Головная боль, которая вызвана растяжением твердой мозговой оболочки, обычно локализуется за глазницей или в области темени.
Обмороки, появление пелены перед глазами и даже инсульт могут стать следствием сдавления внутренней сонной артерии. Также возможно появление клиники парезов других черепных нервов: ЧН VIII—XII при расположении образования в задних отделах пирамиды, ЧН II—VI при расположении образования в передних отделах.
г) Воспалительные заболевания верхушки пирамиды. Наиболее распространенным кистозным образованием, поражающим верхушку пирамиды, является холестериновая гранулема. Точный механизм ее формирования неизвестен. Согласно одной из теорий, она возникает из-за плохой вентиляции с образованием относительного вакуума, резорбции воздуха, кровоизлияния в слизистую и распада гемоглобина, что ведет к образованию холестерина. По всей видимости, ключевым фактором, обусловливающим формирование гранулем, является кровоизлияние. Кристаллы холестерина образуются в ходе анаэробного распада свободного гемоглобина. Этот процесс вызывает активацию гигантоклеточной воспалительной реакции на инородное тело.
По мере повторения этого патологического цикла происходит формирование и увеличение в размерах холестериновой гранулемы. Образование содержит темно-бурую жидкость, содержащую светящиеся кристаллы холестерина. Кисты возникают как на фоне существующего воспаления среднего уха, так и без него. Клинически холестериновая гранулема проявляется головной болью, диплопией вследствие пареза ЧН VI, болью в ухе, головокружением, снижением слуха. Иногда кисты обнаруживают случайно при рутинном выполнении КТ или МРТ. На КТ или МРТ височных костей обнаруживается новообразование в верхушке пирамиды с тонкими костными стенками. Сигнал на МР-томограммах в режиме Т1 гомогенно гиперинтенсивный, в режиме Т2 — выраженный гиперинтенсивный с периферическим низкоинтенсивным кольцом, которое отражает скопление на периферии макрофагов, богатых гемосидерином.
По этим признакам холестериновую гранулему на МРТ можно отличить от эпидермоидной или арахноидальной кисты. Если гранулема была обнаружена случайно, либо если ее размер невелик (и отсутствует какая-либо клиника), возможно простое наблюдение за образованием путем регулярного выполнения КТ или МРТ. Крупные гранулемы вскрываются через трансмастоидальный инфралабиринтный доступ. После того, как в полость кисты начнет поступать воздух, вероятность ее повторного формирования очень мала.
Воспаление верхушки пирамиды также называют апицитом. Для апицита характерна триада Градениго: диплопия вследствие паралича ЧН VI, боль за глазным яблоком вследствие поражения ЧН VI, оторея как проявление инфекционного процесса в среднем ухе. Процесс обычно бактериальный, вызывается пиогенными микроорганизмами.
Воспаление верхушки пирамиды также может быть следствием остеомиелита основания черепа. Злокачественный наружный отит представляет собой одну из форм остеомиелита основания черепа, которая обычно встречается у больных с сахарным диабетом или другими формами иммунодефицита. Чаще всего злокачественный наружный отит вызывается синегнойной палочкой. В таких условиях продолжающийся остеомиелитический процесс распространяется на пирамиду височной кости. Заболевание проявляется хроническим воспалением уха, отореей, болью в ухе, на поздних стадиях — нарушением функций черепных нервов. Лечение заключается в длительном внутривенном введении подходящих антибиотиков. По показаниям проводится оперативное лечение.
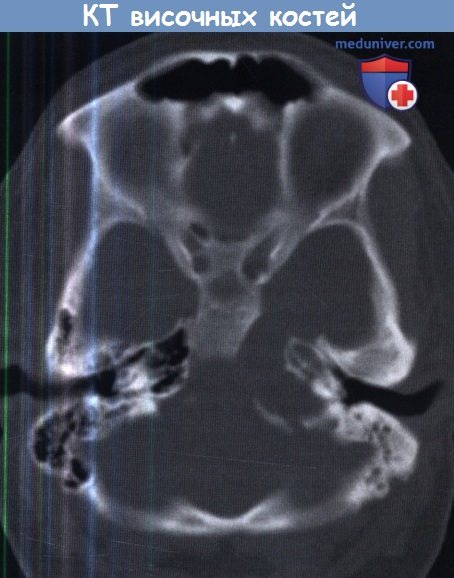
Компьютерная томография височных костей, на которой определяется
распространенное образование верхушки правой пирамиды с тонкими костными стенками. 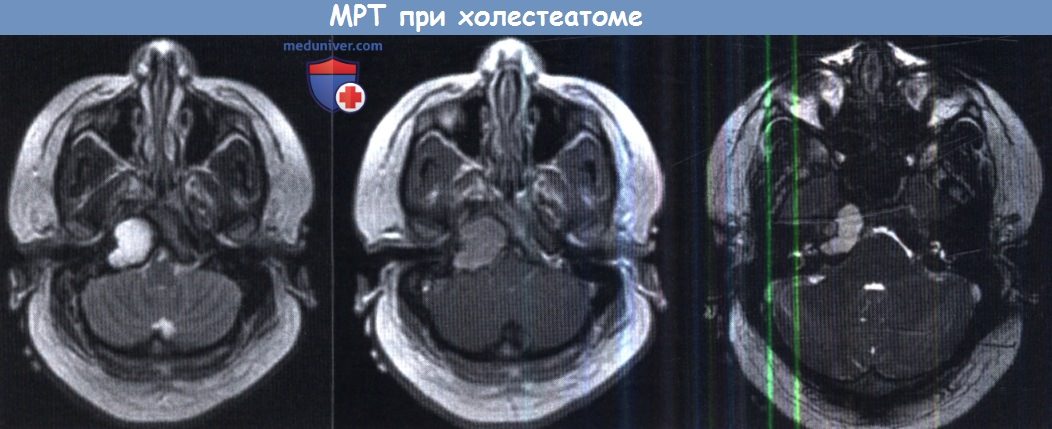
МРТ в режиме Т1 (слева), Т2 (посередине),
в режиме FIESTA визуализируется холестеатома верхушки правой пирамиды.
д) Опухоли верхушки пирамиды. Наиболее распространенными новообразованиями верхушки пирамиды являются менингиомы и шванномы, чаще всего тройничного нерва. Проявляются они дисфункцией ЧН V, VI, VII и VIII. Также опухоль может проявляться диффузной головной болью. При шванномах тройничного нерва часто возникает онемение в зоне иннервации одной или нескольких ветвей тройничного нерва. Лечение хирургическое, доступ через основание черепа. Для удаления менингиом верхушки пирамиды (петрокливальные менингиомы) используется латеральный височный доступ, работать нужно и над, и под наметом. Для получения широкого обзора менингиомы нужно рассечь намет и верхний каменистый синус. Такие операции проводятся нейрохирургами и нейроотиатрами совместно.
Хордомы представляют собой редкие опухоли, возникающие из клеток спинной струны, обычно в области клиновидной кости и ската. Опухоли, берущие начало непосредственно на верхушке пирамиды, встречаются редко, обычно процесс начинается со ската. Лечение комбинированное: хирургическое удаление опухоли с последующей лучевой терапией. Хордомы очень сложно удалить полностью, чувствительность к радиации средняя. Средняя выживаемость при агрессивном лечении составляет лишь четыре года. На хондросаркомы приходится 0,15% всех внутричерепных опухолей. Типичными жалобами являются снижение слуха, пульсирующий тиннитус, шаткость, головокружения, парез ЧН VI, головная боль.
Рак молочной железы и предстательной железы может метастазировать в височную кость, особенно в область верхушки пирамиды и ската. При раке почек, легких, желудка и щитовидной железы метастазы в верхушку пирамиды встречаются реже. Обычно при обнаружении метастазов височной кости опухоль уже метастазировала и в другие органы. Результаты КТ и МРТ зависят от типа первичной опухоли и зависят от того, вызывает ли она остеогенную или остеобластическую реакцию. У пациентов с отдаленными метастазами прогноз остается неблагоприятным.
Хирург, который хочет заниматься оперативным лечением заболеваний верхушки пирамиды, должен в совершенстве знать трехмерную анатомию этой области. Здесь сосредоточено гигантское количество важнейших анатомических структур, а незнание анатомии и малейшие неточности в хирургической технике могут оказаться роковыми.
е) Ключевые моменты:
• Целый ряд сосудистых опухолей могут поражать основание черепа. К ним относят гемангиомы, гемангиоперицитомы, лимфангиомы, ювенильные ангиофибромы носоглотки, ангиоматозные менингиомы и параганглиомы (гломусные опухоли).
• И хотя гломусные опухоли встречаются достаточно редко, они являются наиболее распространенными новообразованиями среднего уха и вторыми по частоте встречаемости опухолями височной кости.
• Опухоли основания черепа обычно поражают сразу несколько черепных нервов, в особенности ЧН VII-XII. Большая часть осложнений является следствием именно повреждения черепных нервов.
• Поскольку опухоли основания черепа располагаются вблизи таких жизненно важных структур, как сонная артерия и внутренняя яремная вена, их хирургическое удаление представляет собой очень сложную задачу. Лечением таких больных должна заниматься междисциплинарная бригада специалистов.
Шваннома преддверно¬улиткового нерва
Что такое шваннома преддверно-улиткового нерва. Клинические проявления. Признаки невриномы преддверно - улиткового нерва на МРТ и КТ снимках. Что хотел бы знать лечащий врач. С чем можно спутать невриному преддверно-улиткового нерва. Лечение невриномы слухового нерва. Врачи каких специальностей диагностируют и лечат невриному слухового нерва. Прогноз. Возможные осложнения и последствия

Аномалии пирамиды височной кости
Что такое пирамида височной кости. Клинические проявления. КТ и МРТ признаки аномалии пирамиды височной кости . Что хотел бы знать лечащий врач. Лечение. Врачи каких специальностей диагностируют и лечат аномалию пирамиды височной кости. Прогноз. Возможные осложнения и последствия
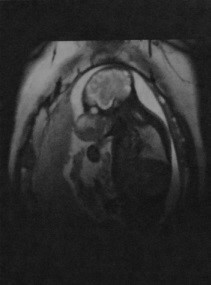
Рабдомиосаркома пирамидки височной кости
Причины появления рабдомиосаркомы височной кости. Клинические проявления. Какой метод диагностики рабдомиосаркомы височной кости выбрать: МРТ или КТ. Что хотел бы знать лечащий врач. Какие заболевания имеют симптомы, схожие с рабдомиосаркомой височной кости. Лечение рабдомиосаркомы. Врачи каких специальностей диагностируют и лечат рабдомиосаркому пирамидки височной кости. Прогноз. Возможные осложнения и последствия
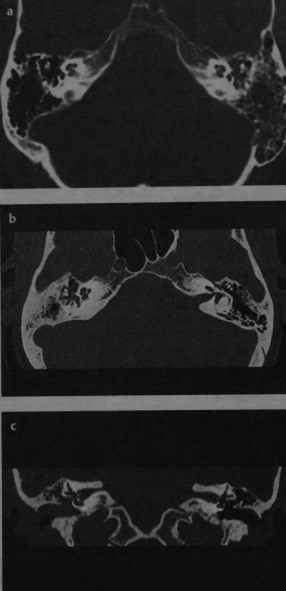
Холестеатома пирамидки височной кости
Причины появления холестеатомы височной кости. Клинические проявления. Какой метод диагностики холестеатомы височной кости выбрать: МРТ или КТ. Методы выбора. Что хотел бы знать лечащий врач. С чем можно спутать холестеатому пирамидки височной кости. Лечение холестеатомы височной кости. Врачи каких специальностей диагностируют и лечат холестеатому пирамидки височной кости. Прогноз. Возможные осложнения и последствия

Средний отит
Причины развития воспаления среднего уха. Клинические проявления. Какой метод диагностики острого отита выбрать: МРТ или КТ. Что хотел бы знать лечащий врач. С чем можно спутать отит среднего уха. Лечение среднего отита. Врачи каких специальностей диагностируют и лечат средний отит. Прогноз. Возможные осложнения и последствия
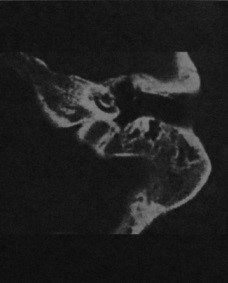
Отосклероз или отоспонгиоз
Что важно знать об отосклерозе и отоспонгиозе. Клинические проявления. Какой метод диагностики отосклероза выбрать: МРТ или КТ. Что хотел бы знать лечащий врач. Признаки отосклероза, схожие с другими заболеваниями. Лечение. Врачи каких специальностей диагностируют и лечат отосклероз. Прогноз. Возможные осложнения и последствия
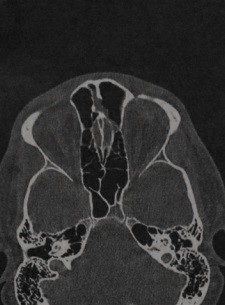
Пневматизация верхушки пирамиды височной кости
Что важно знпть о пневматизации височных костей. Клинические проявления. Какой метод диагностики пневматизации верхушки пирамиды височной кости выбрать: МРТ или КТ. Что хотел бы знать лечащий врач. Какие заболевания имеют симптомы, схожие с пневматизацией височной кости. Лечение. Врачи каких специальностей диагностируют и лечат пневматизацию височной кости. Прогноз. Возможные осложнения и последствия
Поражение лицевого нерва
Что нужно знать о поражении лицевого нерва. Клинические проявления. Признаки неврита лицевого нерва на КТ и МРТ снимках. Что хотел бы знать лечащий врач. Какие заболевания имеют симптомы, схожие с невритом лицевого нерва. Лечение. Врачи каких специальностей диагностируют и лечат паралич лица. Прогноз. Возможные осложнения и последствия

Переломы пирамиды височной кости
Что важно знать о повреждении височных костей. Клинические проявления. Какой метод диагностики перелома пирамиды височной кости выбрать: МРТ или КТ. Что хотел бы знать лечащий врач. Какие заболевания имеют симптомы, схожие с переломом пирамиды височной кости. Лечение. Врачи каких специальностей диагностируют и лечат перелом височной кости. Прогноз. Возможные осложнения и последствия
Параганглиома, опухоль гломуса
Что такое опухоль барабанного и яремного гломуса. Клинические проявления. Диагностика гломусной опухоли: МРТ, КТ, ангиография. Что хотел бы знать лечащий врач. Симптомы каких патологий похожи на барабанную параганглиому. Лечение. Врачи каких специальностей диагностируют и лечат опухоль барабанного гломуса. Прогноз. Возможные осложнения и последствия
За 3 года не нарушены, но врямя-то идет, еще не вечер. Выглядит, действительно, малосимпатично, ИМХО. Будем ждать данные биопсии, а что остается? Хотя. можно попытаться провести радиоизотопное исследование (стинциграфию).
Сергей Юрьевич, файлы-то, надо бы анонимизировать (удалять личные данные пациента).
Поясните, пжл, почему игх не поможет?
Действительно, звонил гистологам в онкодиспансере, они не могут определиться между рабдомиосаркомой, гистиоцитозом и ганглием. Про опухоль из хрящевой ткани речь вообще не идёт. Будут переделывать.
Опять буду ждать.
Я ведь понял, коллеги, что это за новообразование.
Фиброзная дисплазия (фиброзная остеодисплазия, фиброзная дисплазия костей, болезнь Лихтенштейна - Брайцева) - заболевание, характеризующееся замещением костной ткани фиброзной тканью, что приводит к деформации костей.
Этиология и патогенез. Причины развития фиброзной дисплазии недостаточно ясны, не исключается роль наследственности. Считают, что в основе заболевания лежит опухолеподобный процесс, связанный с неправильным развитием остеогенной мезенхимы. Болезнь часто начинается в детском возрасте, но может развиваться в молодом, зрелом и пожилом возрасте. Заболевание преобладает у лиц женского пола.
Классификация. В зависимости от распространения процесса различают две формы фиброзной дисплазии: монооссальную; при которой поражена лишь одна кость, и полиоссальную, при которой поражено несколько костей, преимущественно на одной стороне тела. Полиоссальная форма фиброзной дисплазии может сочетаться с меланозом кожи и различными эндокринопатиями (синдром Олбрайта), Монооссальная форма фиброзной дисплазии может развиваться в любом возрасте, полиоссальная - в детском возрасте, поэтому у больных этой формой фиброзной дисплазии выражена диффузная деформация скелета, отмечается предрасположенность к множественным переломам.
При микроскопическом исследовании очаги фиброзной дисплазии представлены волокнистой фиброзной тканью, среди которой определяются малообызвествленные костные балки примитивного строения и остеоидные балочки. Волокнистая ткань в одних участках состоит из хаотично расположенных пучков зрелых коллагеновых волокон и веретенообразных клеток, в других участках - из формирующихся (тонких) коллагеновых волокон и звездчатых клеток. Иногда встречаются миксоматозные очаги, кисты, скопления остеокластов или ксантомных клеток, островки хрящевой ткани. Отмечают некоторые особенности гистологической картины фиброзной дисплазии лицевых костей: плотный компонент в очагах дисплазии может быть представлен тканью типа цемента (цементиклеподобные образования).
Осложнения. В ряде наблюдений на фоне фиброзной дисплазии развивается саркома, чаще остеогенная.
Авторы: Струков А.И., Серов В.В
Осталось только гистологам рассказать. Непонятно только, что с пациентом дальше делать. Лечение (по той литературе, что нашёл ) предполагается только оперативное.
"Лечение. Кюретаж - это прошлое ортопедической хирургии. Рецидив неизбежен." А мы ему именно это и сделали. Не удалять же ему пирамидку. Думаю наблюдение и СКТ-контроль 1 раз в год.
Буду рад любому мнению.
В этих случаях стоит ориентироваться на клинику. Если в подозрениях гистологов прозвучал гистиоцитоз, то это очень подходит к данному слючаю. 1 Частая локализация в костях черепа, 2 гистологическое сходство с другими опухолями, 3. Есть формы гистиоцитоза, когда опухоль долгое время растёт местно без выраженной клиники. Тем не менее следовало бы также проконсультировать у гематолога. Иногда пунктат костного мозга и сонография печени-селезёнки проясняет системность патологии. В моём личном наблюдении был пациент с гистиоцитозом в сосцевидном отростке, которого оперировали по подозрению на мастоидит. Гистология была такая же не ясная. После этого с интервалом примерно в полгода была реоперация с тем же результатом. И только через год процесс стал системный и диагноз был ясен.
Степанян М.А., Черекаев В.А., Кушель Ю.В., Ротин Д.Л.
НИИ нейрохирургии им. акад. Н.Н. Бурденко, РАМН, Москва, Россия
Приведено подробное описание двух наблюдений метастазов саркомы Юинга в пирамиде височной кости. Обсуждены вопросы клинической, инструментальной и лабораторной диагностики, комбинированного подхода к лечению, дифференциально-диагностические аспекты, прогностические факторы. Приведен обзор литературы по данной проблеме.
Ключевые слова: саркома Юинга, основание черепа.
Саркома Юинга (СЮ) является второй по частоте злокачественной опухолью костной системы, в 47% наблюдений она встречается в длинных трубчатых костях, в 29% − в плоских костях таза, в 12% − в ребрах и позвонках и в 9% – в костях черепа [1, 12].
СЮ имеет агрессивное течение, в 14-45% при обнаружении первичного очага уже имеются отдаленные метастазы, в 30% встречается мультицентричный рост [5, 12].
Гистопатологическими характеристиками СЮ являются солидные скопления мономорфных округлых клеток со скудной цитоплазмой, округлыми ядрами с небольшим ядрышком. Характерной патоморфологической особенностью является наличие PAS (periodig acid-Shiff staining) – положительных гранул в цитоплазме клеток опухоли, что указывает на наличие гликогена и отличает СЮ от таких схожих опухолей, как лимфома и рабдомиосаркома. Иммуногистохимическая экспрессия CD99, трансмембранный протеин, кодированный геном MIC-2, являются дополнительной информацией, подтверждающей диагноз 12. Молекулярно-генетический анализ выявляет патогномоничные хромосомные транслокации t(11;22)(q24;q12).
В литературе встречаются редкие публикации о метастазах СЮ в основании черепа. В связи с этим считаем целесообразным представление двух наблюдений метастаза СЮ в пирамиде височной кости.
Материал и методы
За последние 10 лет в НИИ нейрохирургии им. академика Н.Н. Бурденко получали лечение 9 больных с СЮ костей черепа. Метастатическое поражение наблюдалось у 4 больных, у 5 была первичная опухоль. У двух пациентов метастазы локализовались в основной кости, в двух наблюдениях − в пирамиде височной кости. Ниже описываются случаи метастазирования СЮ в пирамиду височной кости.
1-е клиническое наблюдение
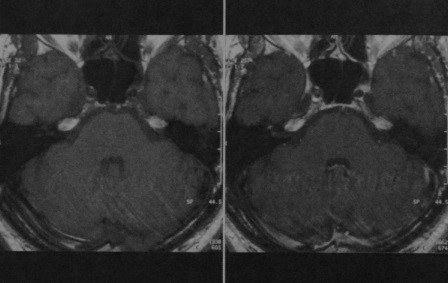
Пациент, 14 лет, в 2003 г. после травмы заметил образование в правом плече. При госпитализации в онкологическую клинику диагностирована СЮ, верифицированная при биопсии. Больной отказался от химиотерапии. Через 4 мес. после установления диагноза, в январе 2004 г. проведена межлопаточно-грудная экзартикуляция правой руки. Через месяц у больного выявлен метастаз в бедренную кость справа. Проведено 6 курсов полихимиотерапии. В этом же месяце произошел судорожный приступ с потерей сознания. МРТ головного мозга выявила объемное образование левой височной доли, неоднородно накапливающее контрастное вещество, с выраженным перифокальным отеком. Опухоль располагается в основании черепа в области пирамиды височной кости (рисунок 1).

Рис. 1. МРТ – метастаз саркомы Юинга исходит из твердой мозговой оболочки верхней поверхности пирамиды височной кости.
В марте выполнено оперативное вмешательство – удаление опухоли средней черепной ямки, распространяющейся в пирамиду височной кости. После операции в неврологическом статусе регрессировала гипертензивная симптоматика, был проведен курс лучевой и полихимиотерапии. Через 2 года появились головные боли с тошнотой и рвотой, выбухание в правой теменной области. На МРТ выявлен рецидив метастаза в основании средней черепной ямки с вовлечением пирамиды височной кости.
В неврологическом статусе – грубый парез лицевого нерва до 5 баллов, снижение слуха, выпадение вкуса в передних 2/3 языка со стороны поражения. В августе 2006 г. выполнено удаление крупной опухоли пирамиды височной кости слева. Внутри образования имелись очаги кровоизлияния разной степени давности. Опухоль отделена от базальных отделов височной доли, удалена тотально с иссечением инфильтрированной твердой мозговой оболочки верхней поверхности пирамиды и резекцией пораженных участков кости. Послеоперационное течение гладкое, при выписке в неврологическом статусе без отрицательной динамики. На выполненных КТ головного мозга остаточной опухолевой ткани не определяется (рисунок 2).

Рис. 2. КТ картина после удаления метастаза саркомы Юинга.
Больному проводили химиотерапию, но через 4 мес. после последнего оперативного вмешательства больной скончался от генерализации опухолевого процесса при множественных метастазах в печени и легких.
2-е клиническое наблюдение
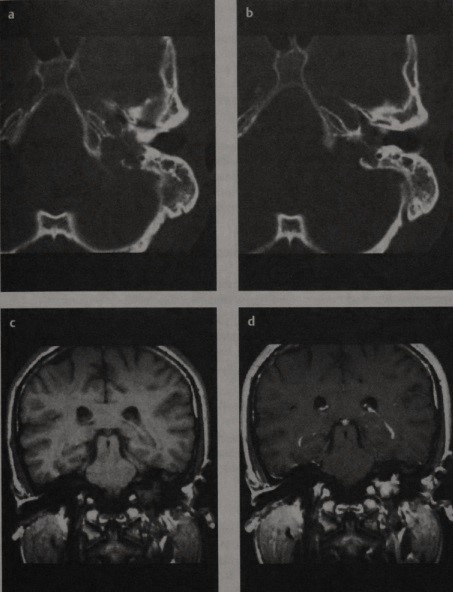
Больной, 14 лет, в 2008 г. был оперирован по поводу СЮ левой лопатки, после чего проходил курсы лучевой терапии и химиотерапии. Через 3 года (в 17 лет) у пациента возникли боли в левом ухе, обратился к отоларингологу. Проводили консервативное лечение с временным положительным эффектом. Через месяц возобновились боли с шумом в левом ухе. После физиотерапевтического лечения присоединился парез лицевой мускулатуры слева, возник лагофтальм. На МРТ головного мозга выявлено объемное образование петрокливальной области слева (рисунок 3).

Рис. 3. МР картина (с внутривенным контрастированием) метастаза СЮ в пирамиде височной кости и в левом мосто-мозжечковом углу.
В неврологическом статусе – недостаточность V нерва, парез VI и VII нервов до 3 баллов, левосторонняя нейросенсорная тугоухость вследствие поражения VIII нерва.
Больному проводили лучевую терапию, курсы химиотерапии. В декабре 2011 г. (через 4 мес. после операции) на МРТ головного мозга остаточная опухоль не выявляется (рисунок 4).

Рис. 4. МР картина после оперативного вмешательства через 2 месяца – остаточной опухолевой ткани не определяется.
У обоих больных окончательный диагноз был верифицирован при помощи патоморфологического и ИГХ исследований. Опухоль на всем протяжении была построена из плотно прилежащих друг к другу примитивных недифференцированных клеток с округлым или овальным ядром с плохо выраженным ядрышком и скудной слабо эозинофильной цитоплазмой (рисунок 5). Среди клеток опухоли встречались частые фигуры митоза. При ИГХ исследовании, проведенном для уточнения диагноза с широкой панелью антител, была выявлена экспрессия только CD99 (рисунок 6) и виментина, экспрессия всех остальных маркеров (десмина, актина, миогенина, S-100 протеина, цитокератинов, эпителиального мембранного протеина, CD45, CD20 и др.) была негативной. В опухоли отмечался высокий индекс мечения Ki-67 (рисунок 7), что свидетельствовало о высокой пролиферативной активности.

Рис. 5. Метастаз саркомы Юинга. Слева – разрастание мелко-круглоклеточной злокачественной опухоли, справа – твердая мозговая оболочка с опухолевым эмболом в просвете крупного сосуда (стрелка). Окраска гематоксилином и эозином, ув. ×100.

Рис. 6. Метастаз саркомы Юинга. Иммуногистохимическое окрашивание с антителами СD99. Мембранное окрашивание
опухолевых клеток говорит об их принадлежности к семейству опухолей саркомы Юинга. Ув. ×200.

Рис. 7. Метастаз саркомы Юинга. Иммуногистохимическое окрашивание с антителами Ki-67. Высокий индекс мечения
(свыше 50% клеток) – признак высокой злокачественности и пролиферативной активности опухоли. Ув. ×400.
Метастазы СЮ возникают в более чем 85% наблюдений в течение первых 2 лет после выявления первичной опухоли [12]. Частота метастазов в легких составляет 38-85%, в костях (включая позвоночник) – 31-69%, в плевре – 46%, в лимфатических узлах – 46%, твердой мозговой оболочке − 27%, головном мозге – 12%. Метастазы в ЦНС по различным данным встречаются в 10-35% [12, 22, 23, 25].
В костях черепа примерно с одинаковой частотой встречаются как первичная СЮ, так и ее метастазы. В возрасте до 20 лет СЮ составляет от 1% до 6% опухолей костей черепа [1, 12]. По убывающей частоте СЮ встречается в лобной, теменной, височной (чешуя и сосцевидная часть), решетчатой костях, в глазнице, верхней челюсти. Реже метастазы возникают в пирамиде височной кости [23].
В литературе имеются описания 11 наблюдений метастазов СЮ в черепе, 4 из них − в основании черепа. В наблюдении (М., 19 лет) поражения передней черепной ямки метастаз имитировал эстезионейробластому за счет поражения решетчатой кости [25]. Случай метастазирования СЮ в область ската клинически протекал в виде менингита [7]. У 21-летней женщины описан метастаз СЮ, исходящий из твердой мозговой оболочки медиальной поверхности пирамиды височной кости, распространяющийся в Меккелевую полость [22]. Имеется описание метастаза СЮ у пациента в малом крыле основной кости с глазодвигательными и зрительными нарушениями [19].
Клиническая картина при СЮ складывается из таких общих онкологических симптомов, как гипертермия, анемия, неспецифические симптомы воспаления в виде увеличения скорости оседания эритроцитов, умеренного лейкоцитоза, повышения лактатдегидрогеназы в крови [13].
При метастазах СЮ в основании черепа отмечается общемозговая симптоматика в виде головной боли, тошноты, рвоты, а также очаговая неврологическая симптоматика и признаки поражения краниальных нервов [12]. Первичное или метастатическое поражение пирамиды височной кости характеризуется прогрессирующим периферическим парезом лицевого нерва, снижением слуха, нарушением вкуса передних 2/3 языка [1, 3, 5].
Рентгенологическими признаками поражения плоских костей, в т.ч. костей черепа, являются деструкция внутренней и наружной кортикальных пластинок с образованием мягкотканного компонента. Рентгенологические изменения при СЮ схожи с изменениями при остеомиелите, остеогенной саркоме, эозинофильной гранулеме, лимфоме Burkitt’a, фиброзной дисплазии и ряде других заболеваний [1, 6].
Сцинтиграфия с Технецием-99 информативна для выявления костных метастазов в ранних стадиях, а сканирование с применением талиума-201 позволяет оценить чувствительность к лечению [1, 12].
Характерной особенностью при МРТ является сигнал низкой интенсивности в режиме Т2, связанный с повышенной клеточностью СЮ. МРТ часто выявляет некроз, геморрагические изменения и кальцификаты внутри опухоли. Описаны метастазы СЮ в твердой мозговой оболочке, рентгенологически имитировавшие менингиому и шванному [21]. Современные методы нейровизуализации не позволяют отличить первичные СЮ от метастатических [18].
Окончательная диагностика возможна по результатам патоморфологического анализа, ИГХ исследования и FISH анализа [17]. При ИГХ исследовании выявляется экспрессия виментина и CD99. Экспрессия других маркеров: десмина, актина, миогенина, белка S-100, лимфоидных маркеров (СD45, CD20, CD3) отсутствует [11, 15].
Лечение СЮ мультимодальное; оно включает в себя максимальное удаление опухоли с последующей лучевой и химиотерапией [1, 22]. Лучевая терапия − актуальный метод лечения метастазов основания черепа, т.к. радикальное удаление практически невозможно ввиду вовлечения важных структур и высокой частоты осложнений агрессивной хирургии. В послеоперационном периоде радиотерапию проводят также при рецидивирующем течении опухоли. Рекомендуемая схема лучевой терапии: 1,5-2 Гр/день, 5 дней в неделю, с СОД 40-50 Гр [12]. Некоторые авторы рекомендуют дополнительное облучение 10-20 Гр непосредственно на опухоль [10].
Результаты лечения больных СЮ со временем улучшаются. По данным клиники Mayo, с 1950 г. по 1968 г. 5-летняя выживаемость была только 21,8% [13, 21]. По данным от 2000 г., 5-летняя выживаемость при СЮ в данной клинике достигает 74%. В другой большой серии наблюдений сообщается о 2-летней выживаемости без признаков болезни после комплексного лечения в 50-80% [12].
Тем не менее, прогноз при церебральных метастазах СЮ, как правило, неблагоприятный, и общая выживаемость пациентов не превышает 5 лет вне зависимости от методов лечения [1].
Метастазы СЮ в пирамиде височной кости являются редкой и сложной патологией. Неврологически они проявляются общемозговой симптоматикой и грубым поражением лицевого и слухового нервов. КТ и МРТ исследования при данной патологии обладают высокой чувствительностью, но низкой специфичностью. Окончательный диагноз устанавливают на основе патоморфологического и ИГХ исследований.
Для метастазов СЮ характерно агрессивное течение заболевания. Наличие краниальных метастазов является неблагоприятным прогностическим фактором. Радикальное удаление метастаза невозможно ввиду вовлечения в патологический процесс сосудов и краниальных нервов, однако широкая субтотальная резекция опухоли в сочетании с лучевой терапией и химиотерапией позволяет добиться продолжительной ремиссии заболевания и улучшить качество жизни пациента.
- Kadar AA, Hearst MJ, Collins MH, Mangano FT, Samy RN. Ewing’s sarcoma of the petrous temporal bone: Case report and literature review. Skull Base. 2010; 20(3): 213-217.
- Pinto A, Dickman P, Parham D. Pathobiologic markers of the Ewing sarcoma family of tumors: State of the art and prediction of behavior. Hindawi Publishing Corporation. Sarcoma. Volume 2011. Article ID 856190, 15 pages, doi:10.1155/2011/856190.
- Alvarez-Berdecia A, Schut L, Bruce DA. Localized primary intracranial Ewing’s sarcoma of the orbital roof. Case report. J Neurosurge. 1979; 50(6): 811-813.
- Asif A, Khan AQ, Siddiqui YS, Hamid M. Metastasis from scapular Ewing’s sarcoma presenting as sutural diastasis. An unusual presentation. Int J Shoulder Surg. 2010; 4(1): 18-21.
- Colak A, Berker M, Ozcan OE, Erbengi A. CNS involvement in Ewing’s sarcoma. A report of 12 cases. Acta Neurochir (Wien). 1991; 113(1-2): 48-51.
- Eung Yeop Kim, Seung-Koo Lee, Dong Joon Kim, Jinna Kim, Kyu-Sung Lee, Woohee Jung, Dong Ik Kim. Intracranial dural metastasis of Ewing’s sarcoma: A case report. Korean J Radiol. 2008; 9(1): 76-79.
- Gaba RC, Cousins JP, Basil IS, Shadid H, Valyi-Nagy T, Mafee MF. Metastatic Ewing sarcoma masquerading as olfactory neuroblastoma. Eur Arch Otorhinolaryngol. 2006; 263(10): 960-962.
- Güzel A, Tatli M, Er U, Yilmaz F, Bavbek M. Multifocal Ewing’s sarcoma of the brain, calvarium, leptomeninges, spine and other bones in a child. J Clin Neurosci. 2008; 15(7): 813-817.
- Hattori T, Yamakawa H, Nakayama N, Kuroda T, Andoh T, Sakai N, Ohno T, Nishimoto Y, Takeuchi S, Shimizu K. Skull metastasis of Ewing’s sarcoma − three case reports. Neurol Med Chir (Tokyo). 1999; 39(13): 946-949.
- Mizushima H, Jinbo H, Shimazu M, Abe T, Kunii N, Matsumoto K. Central nervous system metastases from Ewing’s sarcoma. Neurol Med Chir (Tokyo). 1994; 34: 745-758.
- Kawaguchi K, Koike M. Neuron-specific enolase and Leu-7 immunoreactive small round-cell neoplasm: the relationship to Ewing’s sarcoma in bone and soft tissue. Am J Clin Pathol. 1986; 86: 79-83.
- Desai KI, Nadkarni TD, Goel A. Primary Ewings sarcoma of the cranium. Neurosurgery. 2000; 46: 62-69.
- Kim EY, Lee SK, Kim DJ, Kim J, Lee KS, Jung W, Kim DI. Intracranial dural metastasis of Ewing’s sarcoma: a case report. Korean J Radiol. 2008; 9(1): 76-79.
- Lipinski M, Braham K, Philip I. Neuroectodermassociated antigens on Ewing’s sarcoma cell lines. Cancer Research. 1987; 47: 183-187.
- Lipinski M, Hirsch M-R, Deagostini-Bazin H. Characterization of neural cell adhesion molecules (NCAM) expressed by Ewing and neuroblastoma cell lines. Internat J Cancer. 1987; 40: 81-86.
- Llombart-Bosch A, Lacombe MJ, Contesso G, Peydro-Olaya A. Small round blue cell sarcoma of bone mimicking atypical Ewing’s sarcoma with neuroectodermal features. An analysis of five cases with immunohistochemical and electron microscopic support. Cancer. 1987; 60: 7: 1570-1582.
- Moll R, Gould VE, Berndt R. Immunocytochemical analysis of Ewing’s tumors. Patterns of expression of intermediate filaments and desmosomal proteins indicate cell type heterogeneity and pluripotential differentiation. Am J Pathol. 1987; 127(2): 288-304.
- Fitzer PM, Steffey WR. Brain and bone scans in primary Ewing’s sarcoma of the petrous bone: case report. J Neurosurg. 1976; 44(5): 608-612.
- Chamoun RB, Suki D, DeMonte F. Surgical management of skull base metastases. Neurosurgery (published ahead of print).
- Stout P. A tumor of the ulnar nerve. Proc NY Pathol Soc. 1918; 18: 2-12.
- Singh P, Jain M, Singh DP, Kalra N, Khandelwal N, Suri S. MR findings of primary Ewing’s sarcoma of greater wing of sphenoid. Austral Radiol. 2002; 46(4): 409-411.
- Hattori T, Yamakawa H, Nakayama N, Kuroda T, Andoh T, Sakai N, Ohno T, Nishimoto Y, Takeuchi S, Shimizu K. Skull metastasis of Ewing’s sarcoma. Three case reports. Neurol Med Chir (Tokyo). 1999; 39: 946-949.
- Turgut M, Colak A, Gürçay O. Multiple intracranial metastases with skull and scalp involvement in Ewing’s sarcoma. Cent Afr J Med. 1994; 40(4): 104-106.
- Turner JL, Sweeney P, Hardy R. Ewing’s tumor metastatic to the clivus, simulating meningitis: Case report. Neurosurgery. 1980; 7(6): 619-620.
- Velche-Haag B, Proust F, Laquerrière A, Dehesdin D, Fréger P. Ewing’s sarcoma of the ethmoid bone: Case report. Neurochirurgie. 2002; 48(1): 25-29.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
Читайте также:

