Определение рецепторов стероидных гормонов при раке молочной железы что это
Часть опухолей молочной железы состоит из клеток, для которых характерно присутствие рецепторов эстрогенов и других стероидных гормонов, включая прогестоген. Эти рецепторы находятся как в ядре, так и в цитоплазме клеток. Они обнаружены в 65% опухолей, возникающих в период постменопаузы. В то же время лишь 30% опухолей, развивающихся в пременопаузе и связанных с геном BRCA1, обычно не содержат рецепторов эстрогенов и прогестерона (PR).
Однако эти рецепторы присутствуют в опухолях, связанных с геном BRCA2. Гормональная зависимость некоторых опухолей подтверждается клиническими наблюдениями при изменении в организме гормонального фона. В настоящее время показано, что наличие рецепторов эстрогенов (ER) в опухолевых клетках коррелирует с чувствительностью индивидуальной опухоли к гормонам. Это позволяет прогнозировать ее чувствительность к гормональным препаратам, что имеет важное клиническое значение.
Эстрогеновый рецептор
При этом к положительным обычно относят опухоли, значение ER для которых находится выше определенного уровня, обычно составляющего 5 фмоль/мг цитоплазматического белка, или 25 фмоль/мг ядерной ДНК.
Наличие эстрогеновых рецепторов характерно для хорошо дифференцированных опухолей (особенно трубчатого, дольчатого, лобулярного или сосочкового типа), а также для опухолей с микроскопическими признаками эластоза. Согласно клиническим наблюдениям, медленно растущие опухоли в основном являются ER-положительными. Первичная опухоль и ее метастазы обладают близкими значениями ER, хотя от положительных опухолей иногда наблюдаются ER-отрицательные метастазы. Обратная картина встречается редко.
Насколько успешно измерения ER позволяют прогнозировать чувствительность опухолей к гормонам? Лишь 5-7% ER-отрицательных опухолей проявляют чувствительность к гормонам. Напротив, гормональной чувствительностью характеризуются 55% ER-положительных опухолей. Хотя больных с такими опухолями можно лечить гормональными препаратами, уровень ER нельзя считать достаточно надежным показателем.
Однако существует клиническая закономерность, выявленная эмпирически: опухоли с высоким значением ER в 90% случаев являются гормонально зависимыми. Наряду с этим показано, что опухоли с высокими значениями PR, более чем в 80% случаев также чувствительны к гормонам.
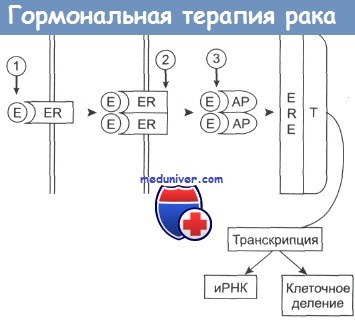
Эстроген (Е) связывается с рецептором (ER), который димеризуется.
Комплекс приобретает активность (АР) и присоединяется к эстроген-зависимым структурам (ERE) клеточного ядра.
Происходит активация таких белков, участвующих в транскрипции (Т), как РНК-полимераза II, что приводит к синтезу белка и делению клетки.
Гозерелин вызывает снижение уровня эстрогенов в плазме крови (1); фульвестран (2) предотвращает процесс димеризации рецептора и его активацию; тамоксифен (3) связывается с активным комплексом, подавляя его способность инициировать транскрипцию.

Диагностика рака молочной железы не обходится без определения содержания в опухоли рецепторов эстрогенов (РЭ), прогестерона (РП). Знание того, какой гормональный статус вашей опухоли, имеет важное значение, поскольку это помогает определить – нужна или нет гормонотерапия, а также спрогнозировать течение заболевания. Этот анализ выполняется сразу же после биопсии молочной железы или после хирургического вмешательства (мастэктомии или лампэктомии).
Независимо от того, позитивный гормональный рецепторный статус (имеется в виду, что у вас гормонозависимая опухоль – эстроген и/или прогестерон стимулируют рост раковых клеток) или негативный (имеется в виду, что это не так), это будет влиять на то, какие шаги будут предприняты в дальнейшем в плане диагностики и лечения вашей опухоли.

Гормональные рецепторы и тесты по определению гормон-рецепторного статуса
Вне всякого сомнения, все первичные опухоли после биопсии или операции должены проверяться на наличие рецепторов эстрогена (РЭ, англ. ER) и прогестерона (ПР, англ. PR). С этой целью врач-морфолог осматривает ткань опухоли под микроскопом, чтобы определить, сколько клеток содержат гормональные рецепторы.
Гормонозависимые опухоли молочной железы (то есть на поверхности злокачественных клеток присутствуют рецепторы к эстрогенам и прогестерону) выявляются примерно в 70% случаев.
Положительный статус ER (ER+): рак грудной железы, который имеет рецепторы эстрогена. Положительный статус PR (PR+): клетки опухоли на своей поверхности содержат рецепторы прогестерона.
Гормон выступает в качестве ключа, а рецептор – замка. Когда ключ открывает замок, клетка получает приказ о выполнении определенного действия. В случае эстрогена и прогестерона клеткам молочной железы через рецепторы передается приказ на рост и размножение.
Все клетки молочной железы содержат рецепторы. Однако их количество в раковых клетках намного превышает норму. Такой избыток рецепторов обуславливает гормонозависимость опухоли, то есть её драйверами роста являются эстрогены и прогестерон.
Гормонозависимые опухоли имеют тенденцию протекать менее агрессивно, в отличие от гормононезависимых, они лучше поддаются лечению, и в целом у них выше показатели выживаемости. Если гормонозависимый рак молочной железы выявляется на ранних стадиях (1 и 2 стадии), пятилетняя выживаемость составляет 85%, на второй стадии данный показатель снижается до 76%. При 4 стадии заболевания этот показатель не превышает 18%.
Чтобы остановить рост опухоли, необходимо прервать сигнал, передаваемый от гормона к рецептору, что достигается двумя способами:
- Снижением уровня гормонов в организме.
- Блокировкой рецептора, то есть создаются условие, при котором гормон не может с ним связаться.
В ходе опухолевой прогрессии рецепторы эстрогена могут появляться и исчезать, что не характерно для рецепторов прогестерона – если они отсутствуют, то и в дальнейшем никогда не будут выявляться.
Шкала оценки статуса гормональных рецепторов
Оценка производится от 0 баллов до 3 баллов. Этот показатель можно найти в патморфологическом заключении.
| Баллы | Что означает |
| 0 | Рецепторы не обнаружены |
| 1+ | Выявлено небольшое количество рецептов |
| 2+ | Обнаружено умеренное количество рецепторов |
| 3+ | Рецепторов очень много |
Иногда вместо баллов указывается процент клеток, которые дали положительный результат на рецепторы. Если вы увидите число 0%, то это означает, что ни в одной клетке не было обнаружено рецепторов, а 100% – они присутствуют во всех клетках.
Ваш статус гормональных рецепторов – почему это важно
Кроме того, возможен вариант, когда опухоль может содержать как гормональные рецепторы (гормонозависимая), так и HER2-рецептор (HER2-положительная), что означает – эстроген, прогестерон и факторы роста могут стимулировать деление клеток. Это так называемый трижды позитивный рак груди.
Узнайте больше: Экзогенный и эндогенный эстроген при раке груди
Если ваша опухоль – ER+ или PR+, то это означает, что гормоны стимулируют её рост, и тактика гормонального подавления (то есть использование препаратов гормонотерапии), вероятно, будет работать. Если опухоль отрицательна по гормональным рецепторам (ER- или PR-), то гормоны не оказывает никакого влияния на её клетки, соответственно, гормонотерапия не даст никакого эффекта. Чтобы определиться с оптимальным вариантом лечения, необходимо выяснить и другие параметры опухоли, например, статус по HER2 рецептору.
Если вы узнали, что ваша опухоль имеет негативный гормональный рецепторный статус, то попросите доктора сообщить вам числовое измерение это показателя (в процентах или баллах). Даже если он невелик, гормонотерапия может быть эффективной.
Тактика дальнейшего лечения в зависимости от полученного результата
Как вы уже поняли, если у вас опухоль ER+ и/или PR+ (позитивный гормональный рецепторный статус), то вам будет рекомендована гормонотерапия (эндокринотерапия). Выбор антигормонального препарата будет определять ваш менопаузальный статус.
После наступления менопаузы ситуация другая, в организме женщины не так много эстрогенов, как было ранее. В постменопаузе он в основном синтезируются из андрогенов. Это превращение осуществляется с помощью фермента ароматазы. Для подавления этого фермента используются препараты, называемые ингибиторами ароматазы. Блокировка фермента приводит к тому, что в организме начинает вырабатываться мало эстрогенов, соответственно, стимуляция опухолевого роста снижается.
Врач может назначить следующие ингибиторы ароматазы:
- Фемара (Femara, летрозол)
- Аромазин (Aromasin, экземестан)
- Аримидекс (Arimidex, анастрозол)
Перечисленные препараты могут быть назначены и в пременопаузе, но только после подавления яичников. Для подавления яичников используется либо лекарственные средства, либо удаляют яичники (в последнее время этого применяется редко). После этого, тамоксифен отменяется и назначается один из ингибиторов ароматазы. Данная стратегия, как показывает проведённое совсем недавно клиническое исследование, имеет преимущество в плане выживаемости.
При ранних стадия рака груди (в случае ER + и постменопауза) совместно с ингибитором ароматазы может быть использован бисфосфонат. По-видимому, такой подход снижает риск рецидивов (особенно риск возникновения костных метастазов).
Применение гормональной терапии при ранних стадиях рака груди, когда у опухоли положительный статус гормональных рецепторов, снижает риск рецидива примерно вдвое.
Иногда можно использовать и другие антигормональные средства. Например, такой препарат как Фазлодекс (фулвестрант), который является селективным супрессором эстрогеновых рецепторов. Обычно его применяют при лечении рака молочной железы, который прогрессирует на фоне приема тамоксифена или ингибитора ароматазы. Существуют и другие виды гормональной терапии, применяемые при лечении 4 стади заболевания.
Статьи по теме:
До последнего времени Тамоксифен или ингибиторы ароматазы рекомендовали принимать на протяжении 5 лет. Тем не менее, появляется все больше данных, свидетельствующих о том, что для женщин с высоким риском рецидива более длительный прием этих препаратов может нести выгоду. Ввиду этого, вам следует акцентировать на этом внимание. Обязательно поговорите с вашим доктором от текущих рекомендациях относительно продолжительности приема антигормональных средств.
Список использованных источников:
Стандартизованное иммуногистохимическое исследование: рецепторный статус при раке молочной железы (PR, ER, ki67, Her2 neu). Выполняется только при наличии готового микропрепарата на предметном стекле и образца ткани в парафиновом блоке.
ИГХ-исследование (РЭ, РП, Her2/neu, Ki-67), иммуногистохимический анализ рецепторного статуса рака молочной железы.
IHC (ImmunoHistoChemistry) Test for Breast Cancer Receptor Status (ER, PR, HER2, Ki67), HER2 Overexpression by IHC, Estrogen Receptors, Progesterone Receptors, ER and PR Status, Estrogen and Progesterone Receptor Status.
Какой биоматериал можно использовать для исследования?
Парафиновый блок с биоптатом образования молочной железы. Ткань первичной опухоли может быть получена с помощью толстоигольной биопсии, а также инцизионных и эксцизионных хирургических вмешательств. Для выявления метастазов на биопсию могут быть взяты ткани из стенки грудной клетки, регионарных лимфоузлов или отдаленных органов.
Общая информация об исследовании
Современные принципы и стратегии лечения рака молочной железы основываются, в том числе, на результатах оценки рецепторного статуса и пролиферативного потенциала опухолевых клеток. Клетки опухоли обладают способностью вырабатывать и располагать на своей поверхности специальные белки – рецепторы, стимуляция которых приводит к запуску клеточного деления и росту опухоли. Подобные рецепторы способны связываться с веществами, присутствующими в организме в норме и исходно никак не связанными с развитием злокачественного новообразования. Согласно актуальным клиническим рекомендациям, для рака молочной железы имеет значение наличие на опухолевых клетках следующих рецепторов, различные комбинации которых называются рецепторным статусом:
Рецепторы к гормонам – эстрогенам и прогестерону (ER, PR). Значительная часть опухолей молочной железы является гормонально-зависимыми, то есть их рост поддерживается и стимулируется эстрогенами и прогестероном. Опухоли с положительным гормональным рецепторным статусом хорошо отвечают на терапию аналогами гормонов (тамоксифен), которые блокируют соответствующие рецепторы – связываются с ними, но не вызывают активации внутриклеточных процессов и не дают рецептору впоследствии связаться с гормоном. Таким образом, исследование продукции опухолью ER и PR позволяет определить ее чувствительность к этим препаратам.
Рецептор второго типа к человеческому эпидермальному фактору роста (human epidermal growth factor receptor 2 – HER2/neu). В клетках некоторых опухолей молочной железы имеет место повышенная выработка данного рецепторного белка, который, соединяясь с естественным фактором роста, запускает в опухолевой клетке процесс деления. Общее число пациенток с HER2-положительным раком молочной железы составляет от 15% до 20%. Определение HER2/neu имеет не только прогностическое значение (такие опухоли обычно прогрессируют быстрее и имеют более агрессивное клиническое развитие), но и позволяет оценить возможность применения таргетных лекарственных препаратов – моноклональных антител к рецептору HER2 – трастузумаб (герцептин), лапатиниб, пертузумаб. Кроме того, HER2-позитивные опухоли резистентны к тамоксифену.
Пролиферативная активность – показатель способности опухолевых клеток к неограниченному делению, которое является основным фактором биологической агрессивности опухоли. Процесс деления сопровождается появлением в клетке определенных белков, один из которых – Ki-67. Он не продуцируется в клетках в состоянии покоя, что позволяет использовать его как маркер пролиферативной активности опухоли. Определение уровня Ki-67 имеет важное прогностическое значение, так как наибольшей пролиферативной активностью обладают опухоли из наименее зрелых и дифференцированных клеток.
Все указанные выше маркеры могут быть выявлены при иммуногистохимическом исследовании биоптата или операционного материала опухоли. Для анализа из готового парафинового блока с помощью специального микроножа нарезают тончайшие срезы, которые затем прикрепляют к предметным стеклам и красят рутинными красителями, чтобы было возможно отличить клетки друг от друга и от межклеточного вещества. Затем срезы на стеклах окрашиваются растворами антител, меченных флюоресцирующими метками, специфичных к одному из исследуемых рецепторов. Если в опухолевой клетке присутствует искомый рецептор, антитела связываются с ним и при просмотре стекла под специальным микроскопом можно увидеть флюоресценцию, что будет свидетельствовать о положительном результате теста. Кроме того, при просмотре среза врач-морфолог сможет увидеть, что окрашенный маркер располагается в ядре, клеточном веществе или на оболочке опухолевых клеток. Количество применяемых растворов с антителами соответствует количеству маркеров, которые исследуются в образце. Степень флюоресценции и процент клеток, в которых она есть, лежат в основе интерпретации результатов иммуногистохимического анализа и подробнее описаны в соответствующем разделе.
Для чего используется исследование?
- Для определения гормонорецепторного статуса и степени пролиферативной активности рака молочной железы для оценки прогноза и индивидуализации лечения, в том числе определения показаний для назначения таргетной терапии.
- По результатам детекции гормональных рецепторов определяется целесообразность использования антиэстрогенов, а рецептора HER2 – таргетных анти-HER2 препаратов. Выявленное отсутствие этих маркеров позволяет избежать назначения заведомо неэффективной терапии. Высокий индекс пролиферативной активности, а также негативность по рецепторному статусу по большей части являются показанием для добавления к лечению цитостатических препаратов.
Когда назначается исследование?
- При наличии гистологически верифицированного рака молочной железы - впервые выявленные, рецидивирующие и метастатические опухоли.
Что означают результаты?
При интерпретации результатов иммуногистохимического определения рецепторного статуса стероидных гормонов (эстрогенов и прогестерона) в опухолях молочной железы следует оценивать не только процент окрашенных антителами клеток, но и интенсивность окрашивания. Оба эти параметра учитываются в шкале Allred, где процент позитивных клеток оценивается от 0 до 5 баллов, а интенсивность окрашивания от 0 до 3. Сумма двух показателей является итоговым баллом, по которому определяется позитивность опухоли по рецепторному статусу: 0-2 негативная, 3-8 позитивная. Общий балл 3 по этой шкале соответствует 1-10% окрашенных клеток и является минимальным позитивным результатом, когда назначение гормональной терапии может иметь эффективность.
Иногда рецепторный статус определяется исключительно по проценту клеток с окрашенными ядрами. В таких случаях NCCN рекомендует считать позитивными все опухоли, где есть более 1% позитивных клеток.
При интерпретации окраски на рецептор HER2/neu учитывают только мембранное окрашивание (окрашивание клеточной оболочки), которое оценивают по шкале от 0 до +3:
результат 0 и +1 считается HER2-негативным;
+2 – пограничный результат, при нем по данным иммуногистохимического исследования нельзя судить о наличии на поверхности клеток рецептора HER2-neu, необходимо проведение FISH- или CISH-исследования;
+3 – положительный результат – таргетная терапия анти-HER2 препаратами будет эффективна.
Согласно классификации St. Gallen Consensus (2009), низким индексом пролиферативной активности считается уровень Ki-67 менее 15%, средним – 16-30%, а высоким – более 30%.
Что может влиять на результат?
- Качество предоставленных парафиновых блоков, опыт и квалификация врача-патоморфолога, так как иммуногистохимический метод не в полной мере стандартизирован и оценка его результатов в некоторой степени субъективна.
- Интерпретация результатов исследования должна проводиться исключительно врачом соответствующей специальности, приведенные данные об эффективности и целесообразности назначения определенных лекарственных средств в зависимости от результатов исследования носят исключительно рекомендательный характер и могут быть пересмотрены с учетом индивидуальных особенностей пациентки.
- При неопределенном HER2/neu-рецепторном статусе (результат иммуногистохимического исследования 2+) рекомендуется выполнение FISH- или CISH-исследования, которые позволят выявить гиперактивацию гена, кодирующего этот рецептор. При недоступности этих исследований допускается повторное иммуногистохимическое исследование, но на другом образце опухолевой ткани.
- Существует несколько шкал оценки рецепторного статуса рака молочной железы, в лабораторном отчете должно быть указано, по какой именно проводилась оценка позитивности опухоли в данном исследовании, а также дана описательная характеристика количества позитивных клеток, особенностей окрашивания клеточных структур и морфологических особенностей клеток.
Гистологическое исследование биопсийного материала образования молочной железы
Цитологическое исследование пунктатов молочной железы
Определение HER2 статуса опухоли методом FISH
Определение HER2 статуса опухоли методом CISH
Кто назначает исследование?
Онколог, маммолог, онкогинеколог.
Литература
Dana Carmen Zaha. Significance of immunohistochemistry in breast cancer. World Journal of Clinical Oncology, 2014; 5(3): 382-392.
Клиническая лабораторная диагностика: национальное руководство: в 2 т. – T. I / Под ред. В. В. Долгова, В. В. Меньшикова. – М.: ГЭОТАР-Медиа, 2012. С. 658-660.
В. Ф. Семиглазов, Р. М. Палтуев, В. В. Семиглазов, Г. А. Дашян, Т. Ю. Семиглазова, П. В. Криворотько, К. С. Николаев. Общие рекомендации по лечению раннего рака молочной железы St. Galle- 2015, адаптированные экспертами Российского общества онкомаммологов. Опухоли женской репродуктивной системы, 2015; 3: 43-60.
Аннотация научной статьи по клинической медицине, автор научной работы — Невожай В. И., Мюллер Е. С.
The authors have analyzed 240 observations of breast cancer in efforts to identify expression of estrogen and progesterone receptors in malignant cells. As reported, receptor-negative status dominated in observations of patients of young age. The receptor-positive status was frequently met in observations of patients of premenopausal age. At the age of 50 to 59, the situation was similar. In the postmenopausal age, most tumors had receptor-positive status.
Похожие темы научных работ по клинической медицине , автор научной работы — Невожай В. И., Мюллер Е. С.
Immunohistochemical Study of Steroid Hormone Receptors in Case of Breast Cancer
The authors have analyzed 240 observations of breast cancer in efforts to identify expression of estrogen and progesterone receptors in malignant cells. As reported, receptor-negative status dominated in observations of patients of young age. The receptor-positive status was frequently met in observations of patients of premenopausal age. At the age of 50 to 59, the situation was similar. In the postmenopausal age, most tumors had receptor-positive status.
7. Жебровский В.В. Ранние и поздние послеоперационные осложнения в хирургии органов брюшной полости. - Симферополь : КГМУ, 2000.
8. Кравцов Ю.А., Белых С.И., Деркач Г.М. // Хирургия. - 1995. - № 4. - С. 16-19.
9. Лещенко И.Г. Релапаротомия при повреждении живота - Куйбышев : КМИ, 1991.
10. Микуляк Р.В. // Клин. хирургия. - 1984. - № 1. -С. 25-27.
11. Смирнов А.М., Арлаудов Д., Иванчев Н. и др. //Хирургическая коррекция и интенсивная терапия тяжелых патологических состояний у детей : сб. науч. тр. - М., 1987. - С. 35-39.
12. Тоскин К.Д., Жебровский В.В. Грыжи брюшной стенки. - М. : Медицина, 1990.
13. Шапкина А.П., Кравцов Ю.А // Вестник хирургии. -1984. - № 11. - С. 100-103.
14. Янов В.Н. Аутодермальная пластика больших и гигантских послеоперационных и пупочных грыж : ав-тореф. дис. . д-ра мед наук. - М., 1978.
УДК 618.19-006.6-07:611.018:577.171 В.И. Невожай, Е.С. Мюллер
ИММУНОГИСТОХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ РЕЦЕПТОРОВ СТЕРОИДНЫХ ГОРМОНОВ ПРИ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ
Владивостокский государственный медицинский университет
Ключевые слова: рак молочной железы, рецепторы опухолевых клеток, стероиды.
В настоящее время иммуногистохимический метод широко распространен в онкологической практике. Применяется он в первую очередь для диагностики гематопоэтических, лимфопролиферативных новообразований, анапластических опухолей, мягкотканных сарком. Естественно, разработан целый арсенал им-муногистохимических маркеров и для такого распространенного заболевания, как рак молочной железы (РМЖ). Используются такие маркеры, как егЬВ-2/ HER-2/neu, Ьс1-2, р53, рецепторы стероидных гормонов, Ю-67, отражающие разные стороны и уровни функционирования опухолевой клетки, позволяющие определять прогноз заболевания, предсказывать эффективность лечебных мероприятий. Особенно часто используется определение рецепторов эстрогена (ER) и прогестерона (PR), без данных о которых невозможно правильное назначение гормонотерапии [3, 7—9].
Рецепторы стероидных гормонов — это белки, специфически и избирательно связывающие стероиды после их проникновения в клетку и опосредующие их биологические эффекты. Определение рецепторов эс-традиола и прогестинов в опухолях молочной железы позволяет достоверно высказаться о предполагаемой чувствительности к гормонотерапии. По данным ли-
15. Matsumoto T., Nemhauser M., Soloway H. et al. //Milit. Med. - 1969. - Vol. 134, No. 4. - P. 247-252.
Поступила в редакцию 18.01.2007.
MEDICAL GLUE MK-7M IN ABDOMINAL HERNIA SURGERY: EXPERIMENTAL AND CLINICAL INVESTIGATION
A.A. Grigoryuk, Yu.A. Kravtsov, V.A. Kovalev, A.M. Cheyshvili Vladivostok State Medical University, Far-Eastern State Medical University (Khabarovsk)
Summary — The authors have performed experimental work in efforts to model frontal abdominal wall hernias on 90 white nonpedigree rats. This defect was closed via: 1) closure with silk interrupted suture; 2) Sapezhko’s plasty; and 3) sutural glue duplica-ture. The sutural glue connection had some advantages over the other methods. These were: acceleration of surgery procedure, decreased number of suture material to be left in wound, and adequate connection strength. No suppuration was observed near the glue application area. The postoperative course of 32 patients undergone sutural glue plastic surgery for frontal abdominal wall was favourable. The late fates had been studied during 10 years, and no recurrence of hernias was diagnosed.
Pacific Medical Journal, 2007, No. 4, p. 76-79.
тературы, у рецепторно-негативных больных эффект может быть отмечен от любых видов гормонального лечения лишь в 5—10% случаев, а среди больных с положительными рецепторами — в 60—81% наблюдений. И лишь 41% больных с одним видом рецепторов реагируют на то же лечение [1, 4—6].
Целью нашего исследования стало сравнительное изучение возраста пациенток и различного сочетания рецепторов эстрогенов и прогестерона при РМЖ.
Были проанализированы уровни рецепторов эстрогенов и прогестерона, изученные иммуногисто-химическим способом в биоптатах, полученных при
Тихоокеанский медицинский журнал, 2007, № 4
Распределение стероидных рецепторов у больных раком молочной железы в различных возрастных группах
Возрастные группы, лет
Ситуация 20- -39 40- -49 50- -59 > 60
абс. % абс. % абс. % абс. %
ER+ PR+ 10 35,7±9,1 46 56,1±5,5 35 51,5±6,1 33 53,2±6,3
ER+ PR- 3 10,7±5,8 11 13,4±3,8 9 13,2±4,1 10 16,2±4,7
ER- PR+ 3 10,7±5,8 4 4,9±2,3 1 1,5±1,5 3 4,8±2,7
R- P R- E 12 42,9±9,4 21 25,6±4,8 23 33,8±5,7 16 25,8±5,6
Всего: 28 100 82 100 68 100 62 100
оперативных вмешательствах и проведении соок-биопсии у 240 больных РМЖ со 2-го полугодия 2004 по 2006 г. Больные проходили обследование и/или лечение на базе Приморского краевого онкологического диспансера, городского онкологического отделения Городской клинической больницы № 2 и маммологического центра. Иммуногистохимическое исследование проводилось в геномном отделении краевого бюро судебно-медицинской экспертизы под руководством В.Б. Кожемяко.
Наличие или отсутствие стероидных рецепторов стало не только фактором, определяющим показан-ность эндокринной терапии у больных РМЖ, но и
прогностическим показателем в отношении жизни у больных с операбельными опухолями. Итак, что может дать клиницисту информация об эстрогенных и прогестероновых рецепторах у больных раком молочной железы:
1) предсказание ответа на эндокринную терапию;
2) информацию о риске рецидива болезни;
3) вероятность метастазирования по органам.
1. Гарин А.М. Эндокринная терапия и гормонозависимые опухоли. - М. - Тверь : Триада, 2005.
2. Гарин А.М., Базин И.С. Десять наиболее распространенных злокачественных опухолей. - М.,
3. Диагностическая иммуноцитохимия опухолей / Д.Ф. Глузман, Л.М. Скляренко, В.А. Надгорная, И.А. Крячок. - Киев : Морион, 2003.
4. Летягин В.П. Первичные опухоли молочной железы: практическое руководство. - М.: Миклош, 2005.
5. Нейштадт Э.Л., Воробьева О.А. Патология молочной железы. - СПб.: Фолиант, 2003.
6. Пожарский К.М., Леенман Е.Е. // Арх. патол. -2000. - Вып. 3. - С. 3-11.
7. Руководство по иммуногистохимической диагностике опухолей человека / под ред. С.В. Петрова, Н.Т. Райхлина. - Казань : Титул, 2004.
8. Цыплаков Д.Э., Петров С.В.//Арх. патол. - 1997. — Вып. 1. - С. 12-19.
9. Шацева Т.А., Мухина М.С. // Вопросы онкологии. -2004. - Т. 50, № 2. - С. 157-163.
10. Эллиниди В.Н., Аникеева Н.В., Гончарова О.А. и др. // Вопросы онкологии. - 2004. - Т. 50, № 2. - С. 234-236.
Поступила в редакцию 15.05.2007.
IMMUNOHISTOCHEMICAL STUDY OF STEROID HORMONE RECEPTORS IN CASE OF BREAST CANCER V.I.Nevozhay, E.S. Muller Vladivostok State Medical University
Summary — The authors have analyzed 240 observations ofbreast cancer in efforts to identify expression of estrogen and progesterone receptors in malignant cells. As reported, receptor-negative status dominated in observations of patients of young age. The receptor-positive status was frequently met in observations of patients of premenopausal age. At the age of 50 to 59, the situation was similar. In the postmenopausal age, most tumors had receptor-positive status.
Pacific Medical Journal, 2007, No. 4, p. 79-80.
IV РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ПРИНЦИПЫ ЭНДОКРИННОЙ ТЕРАПИИ ОПУХОЛЕЙ
Представления о гормональной чувствительности опухолей были значительно расширены в связи с открытием стероидных рецепторов в опухолевых клетках разного происхождения. Гормоны не могут "завести" деление опухолевых клеток иначе как от взаимодействия с соответствующим рецептором. Открытие рецепторов привело к новому, весьма продуктивному в онкологии направлению - созданию антигормонов (антиэстрогенов, антиандрогенов, антипрогестинов).
Гормоны могут стимулировать рост опухолей или вызывать их регрессию. Гормональная зависимость опухолевых клеток разных органов не одинакова. Почти 100% опухолей предстательной железы чувствительны к антиандрогенной терапии, но лишь одна треть больных раком молочной железы чувствительна к антиэстрогенному лечению.
Эндогенные эстрогены - основная мишень эндокринной терапии рака молочной железы. Разнообразны лишь пути контроля их действия: либо это антиэстрогены, которые прерывают связь циркулирующих эстрогенов с рецепторами, либо это ароматазные ингибиторы, которые мешают синтезу эстрогенов из андростендиона, либо это манипуляции на гипофизе или группа LH-RH аналогов, опосредованно угнетающих функцию яичников, либо это хирургическое или лучевое выключение яичников или надпочечников, также имеющих целью снизить биосинтез эстрогенов в этих железах, либо это применение андрогенов, являющихся прямыми антагонистами эстрогенов, или прогестинов, подавляющих уровень эстрогенов.
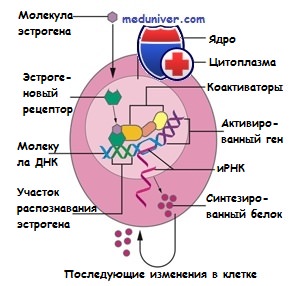
Эстрогены, диффундируя через плазменную мембрану, соединяются с ядерным эстрадиоловым рецептором, внося в белок, из которого он состоит, стероидную структуру; затем происходит димеризация 2-х комплексов и соединение с элементом эстрогенного ответа в ДНК. Эти события являются причиной мобилизации других белков, называемых коактиваторами, которые формируют транскрипционный комплекс в ДНК. Таким образом, эстроген-индуцированные белки регулируют пролиферацию опухолевых клеток молочной железы. Под влиянием эстрогенного контроля сами клетки синтезируют и секретируют свои собственные факторы роста, которые оказывают стимулирующее аутокринное или паракринное действие. В регуляторном "оркестре" пролиферации опухолевых клеток, дирижером которого являются эндогенные эстрогены, участвуют трансформирующие факторы роста a и b , инсулиноподобные факторы роста 1 и 2, фактор роста тромбоцитарного происхождения катепсин D, фибробластный фактор роста, циклины и т.д.
Наличие или отсутствие стероидных рецепторов стало не только фактором, определяющим показания к эндокринной терапии у больных раком молочной железы; этот феномен является прогностическим в отношении жизни у больных с операбельным РМЖ наряду с констатацией регионарных метастазов в лимфоузлах.
Всех больных делят на 4 группы в порядке возрастания риска неблагоприятных исходов болезни:
- стероидные рецепторы положительны, подмышечных метастазов нет;
- стероидные рецепторы отрицательны, подмышечных метастазов нет;
- стероидные рецепторы положительны, в регионарных лимфоузлах метастазы;
- стероидные рецепторы отрицательны, в регионарных лимфоузлах метастазы.
Назначать гормоны без определения рецепторов гораздо дороже для онкоучреждений и даже вредно больным с низкой и не известной врачам гормоночувствительностью опухоли.
Андрогены в развитии рака предстательной железы играют роль, похожую на ту, что приписывается эстрогенам при раке молочной железы.
Дигидротестостерон соединяется с андрогенными рецепторами, находящимися в ядрах простатических клеток. В норме генная регуляция, связанная с андрогенами, характеризуется тремя процессами.
После образования комплекса андрогена, андрогенного рецептора и зоны андрогенного ответа ДНК инициируется благодаря транскрипционному влиянию позитивных генов новый раунд синтеза ДНК и пролиферации недифференцированных и инволютивных клеток простаты (инициация).
Когда простата приобретает нормальный размер в присутствии высокого уровня андрогенов, вступает в "игру" транскрипция тормозных генов, приводящая к сохранению определенного лимита клеток и синтеза ДНК. Этот вид регуляции называется негативным.
Когда секреция андрогенов прекращается или уменьшается, начинают функционировать так называемые андроген-репрессированные гены, вследствие чего наблюдается физиологическая гибель клеток - апоптоз. Клинически это проявляется атрофией ткани.
Опухолевая трансформация эпителиальных клеток простаты связана с извращением андрогенного контроля со стороны позитивных, негативных и андроген-репрессорных генов. Когда отмечается делеция негативного типа генной регуляции (нет механизма ограничения числа клеток и их физиологической смерти), в опухоли есть клоны клеток андроген-чувствительные и андроген-независимые. При дальнейшем прогрессировании отмечается нарушение генов позитивной регуляции (инициация клеточного деления). В этой ситуации опухоль становится андроген-независимой.
Принятые в клинической практике лечения рака простаты гормональные воздействия направлены на подавление эндогенных андрогенов: антиандрогены, связывающие андрогенные рецепторы и мешающие их взаимодействию с зоной андрогенного ответа ДНК, орхэктомия или RH-LH аналоги, прерывающие синтез андрогенов в яичках, эстрогены, прямые антагонисты андрогенов, и т.д. Поэтому при прогрессировании опухолей на фоне кастрационного уровня тестостерона бессмысленно менять эндокринные препараты - опухоль простаты превратилась в андрогеннезависимую.
Эталонным антиэстрогеном остается тамоксифен. Остановимся кратко на его адъювантной и лечебной роли.
Адъювантное применение тамоксифена в течение 5 лет у больных РМЖ с положительными рецепторами в менопаузе уменьшает число смертей на 17-21% по сравнению с контролем. "Соревнуются" за первое место для адъювантной терапии у больных в менопаузе другие антиэстрогены - ралоксифен, идоксифен, фазлодекс, а также ингибиторы ароматазы - аримидекс, летрозол и экземестан.
Адъювантная терапия тамоксифеном у менструирующих больных с положительными рецепторами менее активна, чем у пациенток в менопаузе: смертность по сравнению с контролем уменьшается на 6%. Для адъювантной терапии менструирующих больных прибегают одновременно с назначением тамоксифена к кастрации или использованию его совместно с аналогами RH-LH.
У диссеминированных больных РМЖ в менопаузе эффектом или длительной стабилизацией отвечают от 33 до 50% больных. Тамоксифен - незаменимый препарат у пациенток РМЖ в возрасте старше 80 лет. Отягощенные многими неопухолевыми болезнями, такие женщины часто не могут перенести ни операцию, ни облучение, ни химиотерапию. Тамоксифен может продлить их жизнь, привести к ремиссии, даже полной, и при наличии только первичной опухоли и при диссеминации.
Тамоксифен применяют также для лечения РМЖ у мужчин, а также больных раком тела матки, раком яичников, меланомой, раком поджелудочной железы, карциноидными опухолями, мезотелиомой, раком почки, раком предстательной железы, глиальными опухолями, астрацитомами. Описан эффект тамоксифена при десмоидах и гемангиоэндотелиомах.
Перспективными новыми антиэстрогенами являются: а) ралоксифен, примененный в программах профилактики остеопорозов у здоровых женщин в менопаузе; препарат сократил заболеваемость РМЖ на 50%; б) идоксифен, проявляющий активность при РМЖ при резистентности к тамоксифену; в) фазлодекс - стероидный антиэстроген, захватывающий большее число рецепторов, чем тамоксифен.
Относительно новым направлением в эндокринной терапии рака является ингибиция ароматазы - фермента, отвечающего за синтез эстрона из андростендиона. Основное место синтеза эстрогенов у менструирующих женщин - яичники. При менопаузе функция яичников прекращена, и главным источником эстрона становятся жировая клетчатка, печень, мышцы и раковые опухоли молочной железы. У менструирующих женщин и в менопаузе синтез эстрона катализируется ароматазой. Но у менструирующих он контролируется по законам обратной связи LH и FSH. Эти гормоны гипофиза "работают" синхронно и отвечают за постоянный баланс "сырья " (андростендиона) и "наработчика" (ароматазы).
Низкий уровень эстрогенов стимулирует экспрессию гипофизом гонадотропинов, которые подстегивают синтез андростендиона в тека клетках и ароматазы в гранулярных клетках. Таким образом, ингибиторы ароматазы не активны у менструирующих больных РМЖ. У пациентов в менопаузе ось гипоталамус-гипофиз-яичники разорвана, и подавление ароматазы прерывает предпоследнюю стадию эстрогенного синтеза и значительно снижает циркуляцию эндогенных эстрогенов (более чем на 80%) и их пагубное влияние на рост РМЖ.. К ингибиторам ароматазы последнего поколения, селективным и мало токсичным, относят нестероидные летрозол и аримидекс и стероидный экземестан или аромазин.
Летрозол подавляет ароматазную активность во много раз сильнее, чем другие ингибиторы. Например, эта активность подавляется летрозолом в 170 раз выше, чем от наиболее доступного по ценам и не очень селективного аминоглютетимида. Вместе с тем, показатели степени ароматазного подавления не могут считаться надежными прогностическими критериями клинической противоопухолевой активности, которая от аминоглютетимида всего на 7% ниже, чем от летрозола. Тем не менее, ремиссии от летрозола дольше, чем от аминоглютетимида, смертность на 16% меньше, а сроки жизни на 8 месяцев больше. Летрозол вытеснил прогестины на 3 линию лечения диссеминированного РМЖ у женщин в менопаузе и по показателям непосредственного эффекта, и по меньшей токсичности.
Летрозол нашел применение и как неоадъювантное средство 1-й линии эндокринной терапии у больных с относительно небольшим опухолевым процессом. При первичной опухоли >3 см и отсутствии отдаленных метастазов удалось добиться уменьшения объема опухоли на 87%.
Для аримидекса также доказаны преимущества по сравнению с мегейсом при лечении РМЖ в менопаузе. На 10% больше от первого препарата была 2-х летняя выживаемость, на 5 месяцев длительнее была медиана выживаемости при меньшей токсичности. Аримидекс оказался активным при резистентности к тамоксифену и аминоглютетимиду. Известны также исследования роли неоадъювантного применения аримидекса. Первичная опухоль уменьшается в среднем на 80-88%.
Проводятся широкие сравнительные исследования 1-й линии адъювантной роли аримидекса и тамоксифена. Пока установлена большая токсичность тамоксифена.
Следует остановиться еще на одном вопросе, касающемся сравнения летрозола и аримидекса. Завершенных прямых сравнительных клинических исследований нет. Сравнение летрозола с мегейсом выявило разницу в непосредственной эффективности в пользу летрозола и его лучшую переносимость и не установило различий в выживаемости больных. Сравнение аримидекса с мегейсом выявило разницу в средней продолжительности жизни и выживаемости в пользу аримидекса, а также его лучшую переносимость, чем мегейса, и не установило различий в непосредственной эффективности 2-х препаратов.
В онкологии есть трудные вопросы, связанные с близкими эффектами в отношении опухоли таксола и таксотера, тамоксифена и торемифена, доксорубицина и эпирубицина и т.д. Будущее, возможно, более рельефно покажет преимущества того или иного ингибитора ароматазы.
Антиандрогены касодекс, флутамид, андрокур, анандрон связывают андрогенные рецепторы в ядрах клеток мишеней, прерывая взаимодействие андрогенов с рецепторами и комплекса андроген-рецептор с ДНК. Комплекс антиандроген-андрогенный рецептор не способен, в отличие от комплекса андроген-андрогенный рецептор, стимулировать транскрипцию андроген регулируемых генов.
Антиандрогены + орхэктомия или + применение аналогов LH-RH гормонов обуславливает полную андрогенную блокаду - метод выбора для лечения больных с диссеминированным раком простаты. Результаты применения гормонов на более ранних этапах болезни пока противоречивы.
Оригинальной является концепция прерывистой эндокринной терапии. Тактика сохранения чувствительных к андрогенам клонов опухолевых клеток позволяет сделать болезнь хронической, более продолжительной и менее злокачественной, более длительное время чувствительной к гормонам.
Особое место в эндокринотерапии опухолей принадлежит аналогу соматостатина - сандостатину. Этот пептидный гормон подавляет секрецию многих гормонов и ферментов и в результате способен оказывать противоопухолевый эффект при опухолях островкового аппарата поджелудочной железы, раке этого органа, карциноидах, медуллярном раке щитовидной железы.
БИБЛИОГРАФИЯ
1. Гарин А.М. Принципы и возможности современной эндокринной терапии опухолей.
2. Stewart A.J., Westley B.R., May F.E.B. Modulation of the proliferative response of breast cancer cells to growth factors by estrogen. Br.j.Canc. 1992; 66:640-648.
3. Герштейн Е.С., Кушлинский Н.Е. Молекулярные маркеры прогноза и лекарственной чувствительности рака молочной железы. В кн. "Новое в терапии рака молочной железы". Ред. Переводчикова Н.И., 1998, стр. 19-23.
4. Osborne C.K., Arteaga C.L. Autocrine and paracrine growth regulation of breast cancer: clinical implication. Br. Canc. Res. Treat. 1990,158:3-11.
5. Osborne K. Recent changes in the adjuvant treatment of breast cancer. In "Breast Cancer Perspectives on Data and Developments" San Antonio 1999, 31-34.
6. Gershanovich M., Chandri H.A., Campos D., et.al. Letrоzol a new oral aromatase inhibitor: randomized trial comparing 2,5 mg daily, 0,5 mg daily and aminoglutethimide in postmenopausal women with advanced breast cancer. Ann. Oncol. 1998(9):639-645.
7. Dixon J.M., Love G.D.B., Tucher S., et.al. Letrоzole as primary medical therapy for locally advanced and large operable breast cancer. Proc. ASCO 1998, ab. 104.
8. Jonat W., Howell A., Blomqist C. et.al. A randomized trial comparing two doses of the new selective aromatase inhibitor anastrazole with megestrol acetate in postmenopausal patients with advanced breast cancer. Eur. J.Canc. 1996, 32:A:404-412.
9. Dixon M.J., Renshow L., Bellamy C., et.al. Arimidex as neoadjuvant therapy causes large reduction in tumor volume in postmenopausal women with large operable breast cancer. Proc. ASCO 1999, ab. 345.
10. Nabholtz J.M. Results of a North American first-line trial comparing "Arimidex" with tamoxifen in postmenopausal women with advanced breast cancer. Satel. Symp. Astra Zeneca ECCO 10, 1999.
11. Матвеев Б.П., Бухаркин Б.В., Матвеев В.Б. Рак предстательной железы. М., 1999.
12. Горбунова В.А., Орел Р.Ф., Егоров Г.Н. Редкие опухоли АПУД системы (карциноиды) и нейроэндокринные опухоли поджелудочной железы (клиника, диагностика, лечение). М., 1999.
Читайте также:

