Онкология кишечника сердечная недостаточность
Распространенность сердечной недостаточности (СН) постоянно увеличивается, особенно среди пожилой популяции. В этом возрасте чаще возникают сердечно-сосудистые заболевания с последующим развитием СН [1, 2]. Успехи, достигнутые в лечении инфаркта миокарда (ИМ), привели к значительному сокращению смертности вследствие этого события, однако результаты борьбы с указанным заболеванием с последующим ремоделированием миокарда остаются весьма скромными, что часто становится причиной СН со сниженной фракцией выброса левого желудочка (ФВ ЛЖ) [3].
Частота встречаемости большинства видов рака также увеличивается с возрастом. Согласно последним оценкам Американского онкологического общества риск развития инвазивного рака любой локализации в возрасте до 49 лет составляет 1:19 и 1:29 для женщин и мужчин соответственно; этот показатель увеличивается до 1:17 и 1:15 в период от 50 до 60 лет; вероятность развития рака на седьмом десятке жизни составляет 1:10 и 1:7, а после 70 лет – 1:4 и 1:3 соответственно. У пациентов с СН нередко выявляются онкологические заболевания, при этом частота встречаемости злокачественных опухолей в этой группе пациентов выше, чем в общей популяции [4, 5].
В этом году Pietro Ameri, Marco Canepa и соавт. опубликовали обзор, посвященный эпидемиологии, диагностике рака у пациентов с СН и клиническим последствиям подобного сочетания.
Авторы статьи отмечают, что проблеме злокачественных новообразований у пациентов с ранее диагностированной СН уделяется меньше внимания, чем проблеме СН, развившейся на фоне применения кардиотоксичных противоопухолевых препаратов. Рак часто не учитывается как сопутствующее заболевание при СН [6], частично из-за того, что онкобольные, как правило, исключаются из рандомизированных контролируемых исследований СН. Кардиоонкологическая исследовательская группа Ассоциации сердечной недостаточности (АСН) Европейского общества кардиологов (ЕОК) призывает к координации усилий для комплексного решения указанной проблемы. Будущие инициативы должны включать хорошо спланированные исследования, в которых особое внимание будет уделено возникновению злокачественных новообразований при СН с целью получения достоверных данных для разработки терапевтических рекомендаций (в настоящее время рекомендации создаются на основе экспертных заключений, опирающихся на клинический опыт). Данный обзор получил одобрение Исследовательской группы кардиоонкологии, а его идея возникла во время совещания, состоявшегося в ходе Конгресса АСН в 2016 г. во Флоренции (Италия). В частности, наиболее актуальными были признаны следующие вопросы:
- Какова частота рака среди пациентов с уже имеющейся СН?
- Позволяет ли онкологический диагноз прогнозировать СН, и наоборот?
- Как с наименьшим риском проводить онкологическую терапию пациентам с СН?
- Изменяются ли варианты лечения СН после установления онкологического диагноза, прежде всего у пациентов с далеко зашедшей СН?
В ретроспективном анализе распространенность рака среди пациентов с установленной СН была оценена в диапазоне 18,9-33,7 на 1000 человеко-лет 4.
Связь между СН и онкопатологией может быть обусловлена общими факторами риска: помимо старения предрасполагающими как к СН, так и к развитию злокачественных новообразований факторами могут стать некоторые особенности образа жизни пациента (курение, гиподинамия, ожирение) [8, 9]. Также было высказано предположение, что СН сама по себе может способствовать канцерогенезу посредством механизмов, которые еще предстоит изучить. Например, была предложена теория, основанная на туморогенной роли СН-ассоциированного воспаления 4, а также гиперактивности симпатической нервной системы и системы ренин-ангиотензина [10, 11].
Метаанализ рандомизированных контролируемых испытаний и популяционных исследований выявил положительную корреляцию между лечением препаратами, которые могут быть использованы при СН (в первую очередь блокаторами рецепторов ангиотензина и дигоксином [12, 13]), и риском развития рака, однако эти результаты были опровергнуты другими исследователями [14, 15]. Основная загвоздка в интерпретации этих данных заключается в проблеме так называемого конкурирующего риска: если пациенты с СН получают жизненно важную терапию, риск развития злокачественных новообразований возрастает [16]. В то же время согласно другим теориям специфические СН-препараты могут оказывать противоопухолевое действие. К примеру, при метастатической карциноме почек наблюдалась более высокая выживаемость без прогрессирования на фоне приема ингибиторов ангиотензинпревращающего фермента (иАПФ) (по поводу ранее существовавшей или спровоцированной противоопухолевым лечением артериальной гипертензии) по сравнению с другими антигипертензивными препаратами. Также получены экспериментальные данные о том, что иАПФ могут потенцировать активность ингибиторов тирозинкиназы эндотелиального фактора роста (ТЭФР) против клеток карциномы почек [17].
Недавний анализ базы данных 1,75 млн пациентов (50 тыс. из них имели СН), получавших первичную медико-санитарную помощь в Шотландии, показал, что 5-летняя выживаемость у больных с СН ниже, чем у пациентов с такими распространенными злокачественными новообразованиями, как рак ПЖ и мочевого пузыря (у мужчин) и РМЖ (у женщин) [22]. Прогноз может ухудшаться, если рак развивается на фоне ранее существовавшей СН: эпидемиологические данные указывают на то, что у больных с СН, у которых диагностирован рак, выше уровень смертности от всех причин по сравнению с пациентами с СН без злокачественных новообразований [4] и онкобольными без сопутствующей СН [5]. Вероятно, высокий риск летального исхода является в том числе результатом негативного взаимного воздействия этих состояний и проводимой терапии (аналогично коморбидности при хронических заболеваниях почек или сахарном диабете – СД) [23].
СН характеризуется снижением сердечно-сосудистого резерва, который может дополнительно уменьшаться при развитии онкопатологии, вероятно, вследствие усиления активации системного воспаления и усугубления эндотелиальной дисфункции. Сообщается, что у лиц с колоректальным раком, но без установленного сердечно-сосудистого заболевания отмечаются начальные функциональные нарушения в работе сердца и вегетативной нервной системы, что приводит к снижению физической выносливости и работоспособности [24]. Кроме того, распространенные осложнения злокачественных новообразований, такие как потеря воды и электролитов, а также гормональный дисбаланс могут оказывать влияние на сердечно-сосудистый гомеостаз [25].
Установлено, что увеличение частоты сердечных сокращений ассоциируется с плохой выживаемостью пациентов с манифестирующими злокачественными новообразованиями [26]. В результате пациенты с СН обладают ограниченной способностью переносить хирургические вмешательства по поводу онкопатологии, медикаментозную и лучевую терапию, что может иметь решающее значение в случае необходимости агрессивного воздействия на опухоль. Анализ 100 тыс. случаев немелкоклеточного рака легкого показал увеличение смертности при сопутствующей СН для любой комбинации оперативного вмешательства, химио- или лучевой терапии [27]. Примечательно, что СН была диагностирована у 14-22% пациентов в момент диагностики рака легкого, подтверждая тот факт, что возникновение рака у лиц с ранее существовавшей СН не является редкостью.
Многие онкологические методы лечения являются кардиотоксичными, поэтому перед назначением терапии следует тщательно оценивать соотношение польза/риск (противоопухолевая активность / кардиотоксичные побочные эффекты) у пациентов с установленной СН [28]. У некоторых препаратов (антрациклины, 5-фторурацил и капецитабин, ингибиторы тирозинкиназы) потенциал сердечного повреждения особенно высок [29]. Эти лекарственные средства могут вызывать (или усугублять) систолическую или диастолическую дисфункцию ЛЖ, аритмии и ишемию миокарда [30, 31]. Следовательно, их использование у пациентов с уже имеющейся СН должно быть чрезвычайно осторожным и оправданным с точки зрения воздействия на рак и отсутствия альтернативных онкологических методов лечения. Лечение должно сопровождаться соответствующим информированным согласием пациентов и клиническим наблюдением с использованием биомаркеров.
Увеличить риск сердечно-сосудистых событий и негативно влиять на течение СН могут также агонисты гонадотропин-рилизинг-гормона (ГРЛГ) и антиандрогены, используемые для лечения локального и метастатического рака ПЖ; ингибиторы тирозинкиназы для различных солидных опухолей и хронического миелоидного лейкоза. Накопленные данные свидетельствуют о том, что агонисты ГРЛГ увеличивают риск ишемической болезни сердца и госпитализации при СН [32, 33]. Онкологи, кардиологи и урологи должны знать о побочных эффектах терапии андрогенной депривации, которая часто рассматривается как безопасное лечение по сравнению с химиотерапией, поскольку многие вторичные эндокринные и метаболические изменения развиваются медленно. Традиционная терапия СН (в частности, блокаторами ренин-ангиотензин-альдостероновой системы (РААС) и β-блокаторами) была предложена в качестве стратегии сохранения ФВ ЛЖ у пациентов без СН, получающих антрациклины и/или трастузумаб, но на сегодня в этой области отсутствуют согласованные результаты рандомизированных клинических исследований [34, 35]. Отдельные представители β-блокаторов или блокаторов РААС могут обладать более высокой эффективностью в отношении уменьшения выраженности кардиотоксичных эффектов противоопухолевых средств: в исследованиях in vitro показано, что карведилол более эффективно, чем селективные β-блокаторы противостоит оксидативному стрессу кардиомиоцитов, индуцируемому противоопухолевыми препаратами [36]. Однако клинические данные, подтверждающие эти результаты, отсутствуют.
После составления протокола лечения рака для пациента с СН перед началом противоопухолевой терапии важное значение имеют общие кардиопротекторные мероприятия. Первоочередной задачей является устранение или уменьшение модифицируемых факторов сердечно-сосудистого риска, таких как курение, дислипидемия, артериальная гипертензия и СД. Некоторые сопутствующие заболевания, включая хроническое обструктивное заболевание легких и СД, могут эффективно лечиться в случае, если они своевременно диагностированы [37, 38]. Нельзя пренебрегать и фактами, свидетельствующими о наличии у пациента депрессии, поскольку последняя не только ухудшает качество жизни пациентов, но и снижает приверженность к терапии СН [39].
Шкала депрессии Бека и шкала кардиологической депрессии (Cardiac Depression Scale) формально валидированы как надежные инструменты для оценки депрессии у пациентов с СН [40].
В контексте оптимизации управления СН перед началом противоопухолевой терапии рекомендуется провести повторную оценку состояния пациента и определить основную причину СН. Детальная базовая оценка, основанная на результатах электрокардиографии (ЭКГ), изучении кардиологических биомаркеров и использовании визуализационных методик, может помочь в определении тактики лечения. При СН ишемического характера может потребоваться проведение нагрузочных тестов; в отдельных случаях – миокардиальной сцинтиграфии, но, как правило, более предпочтительна стресс-эхокардиография, чтобы избежать облучения. Если причиной СН является клапанная болезнь сердца, нужно оценить степень клапанного стеноза или регургитации; рекомендуется междисциплинарное обсуждение относительно того, каким образом пациент будет получать противоопухолевую терапию 41.
Время, необходимое для достижения максимальных доз иАПФ и β-блокаторов у пациентов с СН и сниженной ФВ ЛЖ, а также выбор современных методов лечения злокачественного образования, также являются предметом обсуждения кардиологов и онкологов. Стратегию быстрого титрования доз необходимо рассматривать с осторожностью, если лечение рака не может быть отложено по прогностическим причинам. Однако сегодня нет данных, подтверждающих, что врачи сталкиваются с этими проблемами, поэтому необходимы дополнительные исследования для заполнения существующих пробелов в наших знаниях.
Настоятельно рекомендуется регулярный сердечно-сосудистый мониторинг пациентов с СН, получающих противоопухолевое лечение. Это необходимо для выявления ранних признаков декомпенсации или кардиотоксичности с последующим введением дополнительных мероприятий и, при необходимости, прекращении терапии рака. Также может потребоваться более частый мониторинг с использованием визуализирующих методов и биомаркеров, таких как натрийуретические пептиды [44]. Особое внимание следует уделять конкретным сердечно-сосудистым побочным эффектам онкологических препаратов, например гипертонии или ишемии у пациентов, получающих ингибиторы тирозинкиназы [45]. Применение многих системных противоопухолевых препаратов (как кардиотоксичных, так и некардиотоксичных) часто требует большого количества сопутствующей внутривенной жидкости для минимизации нефротоксичности.
Следует проявлять особую осторожность у пациентов с СН, склонных к задержке жидкости. По возможности общий объем вводимого противоопухолевого препарата должен быть уменьшен, время инфузии пролонгировано, а диуретики следует добавить для улучшения диуреза и снижения риска перегрузки. Клиническое наблюдение должно также включать оценку кардиальных имплантируемых электронных устройств (КИЭУ) до и после лучевой терапии из-за риска дисфункции или повреждения рассеянной радиацией [46]. Следует избегать прямого облучения КИЭУ, при этом предполагаемая суммарная доза КИЭУ должна быть ограничена. Мониторинг ЭКГ должен быть доступен во время сеансов лучевой терапии пациентов с кардиостимулятором. Кардиографическая визуализация необходима после облучения груди, например при лимфоме или РМЖ [47]. В то же время осведомленность о возможных проблемах при применении противоопухолевых препаратов у пациентов с СН не должна приводить к врачебной инертности или отказу от спасающих жизнь лекарственных средств. Последствия такой позиции были продемонстрированы при наблюдении более 5 тыс. пациентов с локальным колоректальным раком, среди которых больные с СН на 50% реже получали адъювантную химиотерапию, чем те, у которых СН не было. В этом исследовании у больных, получавших химиотерапию, уровень выживаемости был выше в обеих подгруппах – с и без СН [48].
Опыт показывает, что сложное лечение СН часто упрощается путем уменьшения доз или даже прекращения приема лекарственных средств из-за ухудшения состояния здоровья на фоне применения противоопухолевых препаратов. Существует несколько объяснений этой тактики: гипотония, истощение электролитов и острое ухудшение функции почек, вызванное рвотой и/или диареей у пациентов с манифестацией рака или получающих химиотерапию.
Безопасность спиронолактона при гормонально-чувствительных злокачественных новообразованиях не была четко установлена, поэтому у таких пациентов разумной альтернативой является эплеренон [49].
Фибрилляция предсердий (ФП) – распространенное осложнение СН [50], а также кардиотоксической химиотерапии, что следует учитывать при появлении симптомов декомпенсации. Прямые пероральные антикоагулянты рекомендуются для профилактики артериальной тромбоэмболии, связанной с ФП, с учетом более благоприятного профиля польза/риск по сравнению с варфарином [51]. Это справедливо для пациентов с СН, у которых эффективность применения антикоагулянтов сопоставима или превосходит таковую варфарина при лучшем профиле безопасности [52]. У пациентов с СН и онкологическим заболеванием также существует значительный риск тромбоза глубоких вен, эмболии легочной артерии и тромбоза, связанного с центральным венозным катетером, который в совокупности определяется как венозная тромбоэмболия. В этом контексте долгосрочная безопасность и эффективность прямых пероральных антикоагулянтов остаются неизвестными и в настоящее время изучаются в нескольких рандомизированных контролируемых исследованиях. До получения результатов этих исследований низкомолекулярный гепарин остается предпочтительным лекарственным средством для профилактики и лечения ассоциированной с раком венозной тромбоэмболии [53]. Кроме того, вызывают озабоченность последствия возможного взаимодействия прямых антикоагулянтов и противоопухолевых препаратов, поскольку пациенты, принимающие последние, не были включены ни в клинические испытания, ни в наблюдательные реестры [53].
При СН и онкопатологии имплантация кардиовертера-дефибриллятора (ИКД) может быть противопоказана. Сегодня эта возможность является темой для дискуссий, в результате которых будет сделан вывод – будет ли полезна пациентам ИКД в качестве метода первичной профилактики [54].
Иммуносупрессия после трансплантации также представляет риск в плане развития рецидива злокачественных новообразований [55]. Наличие онкопатологии в анамнезе не обязательно служит препятствием для кардиальной трансплантации [56, 57]. И напротив, текущая малигнизация, в отличие от локализованного немеланомного рака кожи, служит абсолютным противопоказанием для применения указанного метода [57].
Диагностика рака не является необычным событием у пациентов с СН и влечет за собой важные последствия с точки зрения исходов заболеваний и результатов сердечно-сосудистого и противоопухолевого лечения. Тесное сотрудничество между кардиологами и онкологами имеет огромное значение при ведении таких пациентов.
Научные доказательства, на которых могут основываться клинические решения, весьма ограничены, однако эпидемиологические данные показывают, что проблема возникновения рака при СН приобретает все большую актуальность и все большее распространение вследствие постарения мировой популяции и увеличения выживаемости после инфаркта и онкологических заболеваний. Для изучения эффектов анти-ЭФР2-препаратов у пациентов с умеренно сниженной сердечной функцией было организовано исследование SAFE-HEaRt [58]. Для уточнения пороговых значений, при которых лечение онкопатологии не следует назначать пациентам с уже существующей СН, необходима разработка оптимальных кардиопротекторных и эпиднадзорных стратегий.
Статья подготовлена по материалам обзора Pietro Ameri, Marco Canepa и соавт.; European Journal of Heart Failure (2018), doi:10.1002/ejhf.1165
Подготовила Александра Демецкая

Каждый год у примерно десяти человек из 100 тысяч врачи диагностируют страшное онкологическое заболевание – рак кишечника. При этой болезни в стенках слизистой данного органа образуются злокачественные новообразования, характеризующиеся быстрым ростом и появлением метастаз. В России, по данным медицинской статистики, патологии онкологического характера именно этого органа находятся на третьем месте среди раковых заболеваний.
Опасность болезни заключается в том, что ее на ранних стадиях обычно не диагностируют, так как больные не обращаются к врачам с жалобами. Часто выявляется онкология кишечника случайно, во время какого-либо обследования.
Онкология кишечника: симптомы и признаки болезни
В случае раковых заболеваний своевременное выявление тревожных симптомов очень важно. В яркости проявления симптоматики большое значение имеют локализация опухолевого образования и стадия болезни. Существует несколько типов проявления онкологии кишечника, которые имеют отличительные черты:
- Стеноз – из-за роста опухоли просвет прямой кишки сужается и может быть полностью перекрыт, что создает препятствие для опорожнения. Из-за этого больного мучают хронические запоры, метеоризм, кишечные колики, вздутие живота и постоянные боли.
- Энтероколит – когда опухоль расположена с левой стороны, то этим самым провоцируется разжижение каловых масс и их брожение, в результате больного мучает диарея, консистенция стула жидкая, понос периодически сменяется запором.
- Диспепсия – при этом типе заболевания боли или нет, или она выражена слабо, может чувствоваться некоторый дискомфорт. Яркий симптом – изменение вкусовых ощущений, во рту чувствуется горечь или кислота, часто больного мучают отрыжка или изжога.
- Анемия – из-за ухудшения всасывания необходимых организму микроэлементов и микрокровотечений в крови снижается уровень гемоглобина.
- Псевдовоспаление – повышенная температура, больного тошнит или мучает рвота, знобит, при этом ощущается сильная боль.
- Цистит – выделение крови из мочеполовых органов после процесса мочеиспускания, боли во время этого процесса.
Среди других признаков онкологических заболеваний в этой области нужно выделить следующие:
- У больных постоянно есть ощущение, будто кишечник наполнен, несмотря на то, что они только недавно его опорожнили.
- Похудение без видимых причин, когда питание полноценно, и физических перегрузок нет.
- В кале могут обнаруживаться сгустки или следы крови.
- Физическая слабость, постоянное желание поспать.
- Человек быстро утомляется.
В зависимости от места локализации опухоли симптомы заболевания могут несколько отличаться. Поэтому при любой тревожной симптоматике необходимо как можно скорее обращаться к врачу для обследования и постановки диагноза. Только после этого можно гарантировать, что лечение будет назначено адекватное и эффективное.
Диагностика онкологических заболеваний кишечника

При диагнозе онкология кишечника симптомы и признаки болезни могут проявиться не сразу, так как заболевания зачастую на начальных стадиях протекают бессимптомно. Но анализы крови и кала, а также специальные диагностические методы могут выявить онкологию кишечника на раннем этапе.
Следует обратить внимание на такие особенности результатов анализов:
- гемоглобин и эритроциты – ниже нормы;
- лейкоциты – количество повышено;
- СОЭ – высокая;
- свертываемость – высокая;
- копрограмма – обнаружена скрытая кровь;
- онкомаркеры – обнаружены в крови.
Также широко применяются такие аппаратные методы диагностики, как ретроманоскопия, колоноскопия, ирригоскопия, компьютерная и магнитно-резонансная томография. Они позволяют визуализировать состояние органов ЖКТ во всех отделах, внимательно исследовать место локализации новообразования.
Причины онкологии кишечника
Симптомы и признаки болезни свидетельствуют о наличии серьезных проблем со здоровьем, которые не появляются просто так, а имеют свои причины. Что касается рака кишечника, то можно выделить следующие факторы, способствующие появлению этого онкологического заболевания:
- курение – эта вредная привычка вызывает не только рак легких, но и онкологию в других органах;
- особенности современного рациона, отличительными чертами которого является малое количество грубых волокон и большое количество животных белков;
- употребление большого количества мяса, которое обладает канцерогенными свойствами;
- использование продуктов питания с различными вредными добавками (эмульгаторы, консерванты, красители, усилители вкуса), пряностями, жареного, копченого и т.д.;
- наследственная предрасположенность к онкологическим заболеваниям, в том числе раку в области ЖКТ;
- наличие в кишечнике полипов – несмотря на свою доброкачественность при некоторых факторах эти новообразования могут перейти в злокачественную форму;
- болезни желудочно-кишечного тракта (Крона, язвы и др.);
- непереносимость глютена и др.
Лечение онкологических заболеваний кишечника

Терапия рака органов ЖКТ может быть во многих случаях успешной, особенно если болезнь была выявлена на первой или второй стадии. Тогда процент излечений достигает 50%. На более поздних стадиях шансы на выздоровление резко снижаются. В нашей стране каждый год от онкологии кишечника летальный исход настигает свыше 35 тысяч человек различного возраста.
При лечении этого вида рака применяются такие методы: хирургический, химиотерапия и лучевая терапия. При небольших поражениях органа посредством операции можно полностью восстановить его функциональность, в других же случаях приходится накладывать колостому и пользоваться калоприемниками. Когда операцию провести невозможно, то онкологи предлагают методики химио- или лучевой терапии, благодаря чему останавливается разрастание опухолей и распространение метастаз. Эти же методики используются и после хирургического вмешательства.
Обязательно посмотрите это интересное видео посвященное онкологии кишечника
Кишечник человека можно условно разделить на три части:
- Тонкая кишка состоит из двенадцатиперстной (начинается от желудка), тощей и подвздошной.
- Толстая кишка состоит из слепой, восходящей, поперечной и нисходящей ободочной, сигмовидной кишки.
- Прямая кишка — конечный отдел кишечника, который служит для накопления и выведения каловых масс.
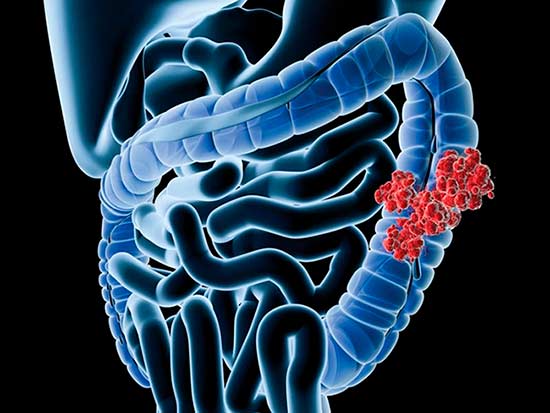
Некоторые цифры и факты:
- Рак кишечника — одно из самых распространенных онкологических заболеваний во многих странах.
- Чаще всего (в 94% случаев) заболевание диагностируется у людей старше 50 лет. До 59% случаев диагностируются у людей старше 70 лет.
- Раком называют злокачественные опухоли, которые развиваются из слизистой оболочки. В кишечнике им чаще всего предшествуют полипы.
- В течение жизни колоректальным раком заболеет примерно каждый 14-й мужчина и каждая 19-я женщина.
- В настоящее время рак кишечника достаточно хорошо поддается лечению. Если опухоль диагностирована на ранней стадии, высоки шансы на наступление ремиссии.
Типы и классификация рака толстой кишки
Большинство злокачественных опухолей толстой кишки (примерно в 96% случаев) представлено аденокарциномами. Они происходят из железистых клеток слизистой оболочки, которые продуцируют слизь. В зависимости от микроскопического строения, аденокарциномы делятся на муцинозные и перстневидно-клеточные.
Выделяют 5 стадий колоректального рака:
- Стадия 0: опухоль находится в верхних слоях слизистой оболочки. Это так называемый рак на месте (in situ).
- СтадияI: опухоль врастает глубже в стенку кишки, но не прорастает ее насквозь.
- СтадияII: опухоль проросла сквозь толщу стенки кишки, но не распространилась на близлежащие (регионарные) лимфоузлы.
- СтадияIII: опухолевые клетки распространились в регионарные лимфоузлы.
- СтадияIV: опухоль, которая метастазировала. При колоректальном раке метастазы чаще всего обнаруживают в печени, брюшине, яичниках, легких.
Причины, факторы риска колоректального рака
Невозможно назвать точную однозначную причину, из-за которой в клетке возникла мутация, и она начала бесконтрольно размножаться. Но известны многочисленные факторы риска, которые повышают вероятность развития рака кишечника:
- Возраст. Риски заболеть наиболее высоки после 70 лет. Среди людей младше 50 лет заболевание встречается очень редко.
- Отягощенный семейный анализ. Вероятность заболеть выше среди людей, у которых есть близкие родственники с диагностированным раком кишечника.
- Некоторые наследственные состояния. Например, семейный аденоматозный полипоз ответственен примерно за 1% случаев колоректального рака. У человека, страдающего от этого состояния и не получающего лечения, к 40 годам практически наверняка разовьется злокачественная опухоль.
- Доброкачественные полипы. В большинстве случаев злокачественные опухоли в кишке развиваются именно из полипов, которые обнаруживаются к 60 годам у каждого третьего человека. Не каждый полип трансформируется в рак, это достаточно сложный, длительный процесс.
- Хроническое воспаление в кишке. Болезнь Крона и неспецифический язвенный колит повышают риски примерно на 70%.
- Некоторые заболевания. По неизвестным причинам сахарный диабет, желчнокаменная болезнь, акромегалия повышают риск колоректального рака.
- Избыточная масса тела. Примерно в 13% случаев в развитии рака кишечника определенную роль сыграли лишние килограммы.
- Нездоровое питание. Рацион многих современных людей содержит большое количество мяса, полуфабрикатов, очень мало овощей, фруктов, бобовых, злаков. Это повышает риск некоторых онкологических и других заболеваний.
- Вредные привычки. Люди, которые курят и часто употребляют алкоголь, чаще страдают раком кишечника.
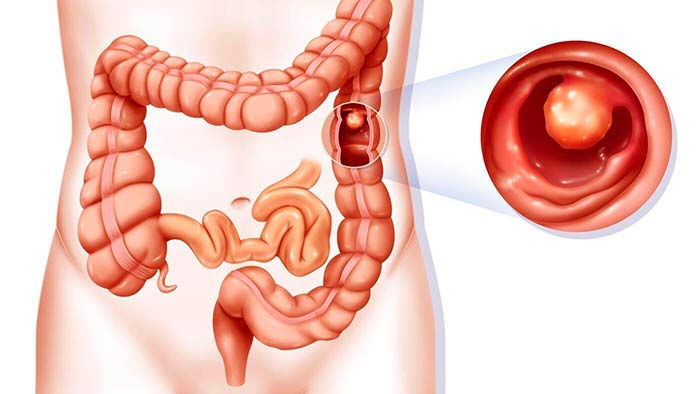
Симптомы рака кишечника
- Боль, периодические болезненные спазмы в животе.
- Изменение характера стула, появление в нем примесей крови, слизи.
- Частые запоры, диарея.
- Повышенное газообразование, вздутие живота.
- Снижение аппетита.
- Потеря веса без видимой причины.
Методы диагностики
При подозрении на рак кишечника в первую очередь назначают колоноскопию. Во время процедуры в толстый кишечник вводят через задний проход специальный инструмент в виде тонкой длинной гибкой трубки — колоноскоп. На конце колоноскопа находится миниатюрная видеокамера и источник света. Увеличенное изображение транслируется на экран аппарата, таким образом, врач имеет возможность осмотреть слизистую оболочку кишки изнутри.
Колоноскопия помогает обнаружить любые патологические образования на слизистой толстого кишечника: злокачественные опухоли, полипы, язвы, участки воспаления. Во время исследования можно получить фрагмент ткани и отправить его на анализ в лабораторию.
После того как во время колоноскопии обнаружена злокачественная опухоль, зачастую необходимо уточнить некоторые подробности. Врачу нужно выяснить, насколько сильно новообразование проросло за пределы кишки, распространилось ли оно в регионарные лимфоузлы, есть ли отдаленные метастазы. Для этого используют дополнительные методы диагностики: КТ, МРТ, ПЭТ, рентгенографию костей и грудной клетки, УЗИ органов брюшной полости.
Общий анализ крови помогает выявить анемию. Кишечное кровотечение диагностируют с помощью анализа кала на скрытую кровь. При раке кишки в крови могут повышаться уровни некоторых онкомаркеров, но в целях диагностики злокачественной опухоли такое исследование неинформативно. Уровни онкомаркеров проверяют в динамике, чтобы оценить эффективность лечения.
Что такое скрининг? Насколько он эффективен при раке кишечника?
Так как на ранних стадиях рак кишечника не имеет симптомов, зачастую диагноз устанавливают слишком поздно, когда опухоль уже успела распространиться в организме. Из-за этого ухудшается прогноз. В ранней диагностике помогает скрининг — исследования, которые регулярно проводят у всех людей из группы риска.
Основной метод скрининга при колоректальном раке — колоноскопия. Ее рекомендуется проходить раз в 10 лет всем людям старше 50 лет. Если у человека есть дополнительные факторы риска, например, болезнь Крона, семейный аденоматозный полипоз, врач порекомендует начинать скрининг в более раннем возрасте.
Методы лечения рака кишечника
Лечением пациента, у которого диагностирован колоректальный рак, занимается команда врачей-специалистов. В нее могут входить: онколог, онколог-хирург, химиотерапевт, врач лучевой диагностики, гастроэнтеролог, психоонколог. Выбор лечебной тактики осуществляется с учетом некоторых факторов:
- Стадия и тип рака.
- Расположение опухоли в кишечнике.
- Возраст, состояние здоровья пациента.
- Сопутствующие заболевания, осложнения, к которым привела опухоль.
Зачастую приходится выполнять резекцию (колэктомию) — удалять часть кишечника, содержащую опухоль. Оставшиеся части кишки соединяют — накладывают анастомоз. Иногда наложить анастомоз сразу не удается. В таких случаях выполняют колостомию или илеостомию: на поверхность кожи выводят, соответственно, конец ободочной или подвздошной кишки. Через сформированное отверстие будут временно отходить каловые массы. Спустя некоторые время проводят повторную операцию: колостому или илеостому закрывают, концы кишки соединяют.
В случаях, когда радикальная операция невозможна, и опухоль перекрывает просвет кишечника, прибегают к паллиативным вмешательствам. Их цель — обеспечить нормальное прохождение каловых масс и улучшить состояние пациента:
- Стентирование кишечника. В просвет кишки устанавливают стент — полый цилиндрический каркас с сетчатой стенкой.
- Постоянная колостома. Если нижний отдел толстой кишки заблокирован опухолью, на поверхность кожи выводят колостому для отхождения стула.
Химиотерапия при колоректальном раке бывает разных видов:
- Адъювантная: после хирургического лечения, с целью предотвращения рецидива.
- Неоадъювантная: назначается до хирургического вмешательства. Помогает сократить размеры опухоли, упростить ее удаление, перевести неоперабельный рак в операбельный, снизить риск рецидива после операции.
- Паллиативная: назначается в качестве самостоятельного, основного метода лечения, на поздних стадиях, когда радикальное хирургическое лечение невозможно. Такая химиотерапия помогает улучшить состояние больного, уменьшить симптомы, повысить продолжительность жизни.
При раке толстого кишечника применяются такие химиопрепараты, как капецитабин, 5-фторурацил, оксалиплатин, иринотекан. Как правило, лечение проводят комбинацией 2–3 препаратов.
В последние десятилетия стало многое известно о процессах, которые происходят в злокачественных опухолях на молекулярном уровне. Ученые идентифицировали многие гены, мутации в которых ответственны за возникновение рака. Известны молекулы, благодаря которым раковые клетки выживают и бесконтрольно размножаются. Созданы препараты, которые могут заблокировать эти молекулы — они называются таргетными препаратами.
При раке толстого кишечника эффективны три группы таргетных препаратов:
- Блокаторы VEGF — вещества, которое раковые клетки вырабатывают, чтобы стимулировать рост кровеносных сосудов и обеспечить себя кислородом, питательными веществами. К этой группе относятся препараты: бевацизумаб, рамуцирумаб, зив-афлиберцепт.
- Блокаторы EGFR — белка-рецептора, который в большом количестве представлен на поверхности раковых клеток и при активации стимулирует их рост. К этой группе препаратов относятся: цетуксимаб, панитумумаб.
- Ингибиторы киназ — сигнальных белков-ферментов. К этой группе относится регорафениб.
Таргетные препараты применяют при колоректальном раке на поздних стадиях.
Иммунотерапия — еще одно современное направление в лечении злокачественных опухолей. Она использует ресурсы иммунной системы для борьбы с раковыми клетками.
В настоящее время существует особый класс иммунопрепаратов — ингибиторы контрольных точек. Они вновь активируют иммунитет, в результате чего тот атакует опухолевую ткань.
При раке кишечника применяют препараты из группы ингибиторов контрольных точек: ниволумаб (Опдиво) и пембролизумаб (Кейтруда).
Лучевую терапию, как и химиотерапию, при раке толстой кишки применяют до, после операции, в паллиативных целях на поздних стадиях. Кроме того, облучение опухоли можно проводить прямо во время хирургического вмешательства.
Иногда лучевую терапию назначают в сочетании с химиотерапией — это так называемая химиолучевая терапия. Она отличается высокой эффективностью, но сопровождается более серьезными побочными эффектами.
Прогноз выживаемости после лечения рака толстой кишки
Прогноз для онкологических больных оценивают по пятилетней выживаемости — показателю, который обозначает количество пациентов, оставшихся в живых в течение 5 лет. Этот показатель зависит от стадии, при раке толстой кишки он составляет:
- На стадии I — 92–95%.
- На стадии II — 63–87%.
- На стадии III — 53–69%.
- На стадии IV — 11%.
Читайте также:

