Оксид меди 2 реагирует с хлором
Химические свойства меди
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400 о С образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400 о С образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 о С может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d 10 4s 2 . Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900 o C (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Химические свойства хрома
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Раскаленный до температуры более 600 o С порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 o C соответственно):
С бромом же хром реагирует при температуре красного каления (850-900 o C):
С азотом металлический хром взаимодействует при температурах более 1000 o С:
С серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
С водородом хром не реагирует.
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N2:
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы:
Химические свойства железа
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Либо же при избытке серы дисульфид железа:
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =t o => 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =t o => 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =t o => 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
На влажном воздухе железо весьма быстро подвергается ржавлению:
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 о С). т.е.:
Задание 6.1
Из предложенного перечня выберите два вещества, с каждым из которых железо реагирует без нагревания.
1) хлорид кальция (р-р)
2) сульфат меди (II) (р-р)
3) концентрированная азотная кислота
4) разбавленная соляная кислота
5) оксид алюминия
Запишите в поле ответа номера выбранных веществ.
Источник - Демонстрационный вариант КИМ ЕГЭ по химии 2019 года
Железо будет реагировать с раствором сульфата меди (II). Данная реакция обусловлена тем, что железо в ряду активностей металлов (в электрохимическом ряду напряжений) стоит левее меди (следовательно, железо активнее меди). В связи с этим железо способно вытеснять медь из ее соли:
Fe + CuSO4 = FeSO4 + Cu
В случае хлорида кальция железо реагировать не будет, так как кальций находится в указанном ряду левее железа, следовательно, является более активным металлом.
Также железо реагирует без нагревания с разбавленной соляной кислотой с образованием хлорида железа (II):
Fe + 2HCl = FeCl2 + H2↑ (без доступа воздуха).
Также напомним, что в концентрированной азотной кислоте железо пассивируется.
Ответ: 24
Задание 6.2
Из предложенного перечня выберите два вещества, с каждым из которых реагирует углерод.
1) оксид свинца (IV)
2) сульфат меди (II) (р-р)
3) разбавленная соляная кислота
4) концентрированная серная кислота
5) хлорид хрома (III) (р-р)
Запишите в поле ответа номера выбранных веществ.
Углерод будет восстанавливать оксид свинца (IV):
2C + PbO2 = Pb + 2CO
Углерод будет взаимодействовать с концентрированной серной кислотой при нагревании:
C + 2H2SO4 (конц.) = CO2↑ + 2SO2↑ + 2H2O
Ответ: 14
Задание 6.3
Из предложенного перечня выберите два вещества, с каждым из которых реагирует медь.
1) гидроксид калия (р-р)
2) хлор
3) сульфат цинка (р-р)
4) хлорид натрия (р-р)
5) нитрат серебра (р-р)
Запишите в поле ответа номера выбранных веществ.
Медь будет реагировать с хлором:
Cu + Cl2 = CuCl2
Медь будет реагировать с раствором нитрата серебра, так как медь находится в ряду активности металлов левее серебра, следовательно, является более активным металлом:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Ответ: 25
Задание 6.4
Из предложенного перечня выберите два вещества, с каждым из которых алюминий реагирует без нагревания.
1) сера
2) нитрат меди (II) (р-р)
3) хлорид калия (р-р)
4) концентрированная серная кислота
5) разбавленная соляная кислота
Запишите в поле ответа номера выбранных веществ.
Алюминий будет реагировать с раствором нитрата меди (II), так как алюминий находится в ряду активностей металлов (в электрохимическом ряду напряжений) левее меди, следовательно, является более активным металлом и способен вытеснять медь из ее соли:
2Al + 3Cu(NO3)2 = 2Al(NO3)3 + 3Cu
Алюминий также реагирует без нагревания с разбавленной соляной кислотой с образованием хлорида алюминия:
2Al + 6HCl = 2AlCl3 + 3H2↑.
Для реакций с серой и концентрированной серной кислотой требуется нагревание.
С хлоридом калия алюминий реагировать не будет.
Ответ: 25
Задание 6.5
Из предложенного перечня выберите два вещества, с каждым из которых реагирует кремний.
1) бром
2) хлорид калия (р-р)
3) оксид магния
4) концентрированная азотная кислота
5) сульфат меди (II) (р-р)
Запишите в поле ответа номера выбранных веществ.
Кремний, проявляя восстановительные свойства, реагирует с бромом:
Si + 2Br2 = SiBr4
Кремний, являясь восстановителем, также взаимодействует с оксидом магния:
Si + 2MgO = SiO2 + 2Mg
Ответ: 13
Задание 6.6
Из предложенного перечня выберите два вещества, с каждым из которых реагирует хлор.
1) вода
2) концентрированная серная кислота
3) кислород
4) иодид натрия
5) фторид калия
Запишите в поле ответа номера выбранных веществ.
Хлор взаимодействует с водой:
Cl2 + H2O ⇔ HCl + HClO
Хлор реагирует с иодидом натрия, так как окислительная способность хлора выше окислительной способности иода:
Cl2 + 2NaI = 2NaCl + I2
Ответ: 14
Задание 6.7
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует кальций.
1) гидроксид калия
2) серная кислота
3) вода
4) хлорид калия
5) карбонат кальция
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Кальций реагирует с серной кислотой:
Ca + H2SO4 = CaSO4 + H2↑
Кальций взаимодействует с водой:
Ca + 2H2O = Ca(OH)2↓ + H2↑
Ответ: 23
Задание 6.8
Из предложенного перечня выберите два вещества, которые реагируют с оксидом цинка.
1) вода
2) оксид азота (II)
3) гидроксид натрия
4) оксид серы (VI)
5) сульфат калия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Оксид цинка ZnO взаимодействует с гидроксидом натрия:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Оксид цинка ZnO реагирует с оксидом серы (VI):
ZnO + SO3 = ZnSO4
Ответ: 34
Задание 6.9
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует водород.
1) оксид железа (III)
2) серная кислота
3) хлорид кальция
4) азот
5) гидроксид натрия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Водород взаимодействует с оксидом железа (III):
3H2 + Fe2O3 = 2Fe + 3H2O
Водород реагирует с азотом:
3H2 + N2 = 2NH3
Ответ: 14
Задание 6.10
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует кальций.
1) метан
2) вода
3) оксид калия
4) сера
5) сульфат натрия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Кальций взаимодействует с водой:
Ca + 2H2O = Ca(OH)2↓ + H2↑
Кальций реагирует с серой:
Ca + S = CaS
Ответ: 24
Задание 6.11
Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует азот.
1) литий
2) водород
3) вода
4) соляная кислота
5) хлорид калия
Запишите в поле ответа номера выбранных веществ.
Источник - Открытый банк заданий ЕГЭ
Азот взаимодействует с литием с образованием нитрида лития:
N2 + 6Li = 2Li3N
Азот реагирует с водородом:
N2 + 3H2 = 2NH3

Определения и формулы основных, амфотерных и кислотных оксидов были приведены ранее в уроке 6.
Характерные химические свойства основных оксидов: реакции с кислотными оксидами с образованием солей и с кислотами с образованием солей и воды, например:
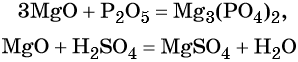
Некоторые основные оксиды реагируют с водой с образованием оснований. Эта реакция проходит в том случае, если продукт реакции растворим в воде:
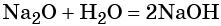
В аналогичных условиях, например, оксид железа (II) с водой реагировать не будет, так как гидроксид железа (II) в воде нерастворим.
Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей и воды или комплексных соединений:
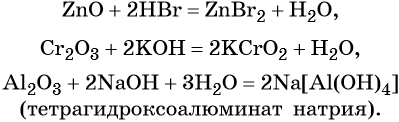
Кроме того, амфотерные оксиды могут взаимодействовать как с кислотными, так и с основными оксидами, например:
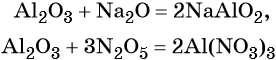
С водой амфотерные оксиды не взаимодействуют.
Кислотные оксиды реагируют с основными оксидами с образованием солей; с основаниями, с образованием солей и воды или кислых солей, а также с водой, в том случае если образующаяся в ходе такой реакции кислота растворима в воде:
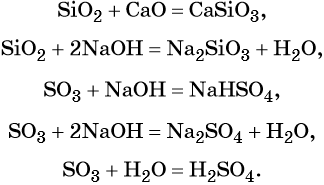
Кроме того, кислотные оксиды вступают в окислительно-восстановительные и обменные реакции:
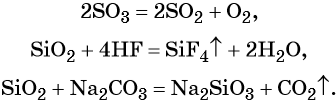
Тренировочные задания
1. Оксид натрия взаимодействует с каждым из двух веществ:
1) серная кислота и вода
2) уксусная кислота и азот
3) оксид лития и фосфор
4) оксид бария и серная кислота
2. Оксид калия взаимодействует с
1) азотом и фосфором
2) водой и сульфатом натрия
3) серной кислотой и оксидом фосфора (V)
4) литием и хлоридом натрия
3. Оксид кальция взаимодействует с
1) оксидом кремния
2) оксидом углерода (II)
3) оксидом азота (II)
4) оксидом азота (I)
4. Оксид бария взаимодействует с каждым из двух веществ:
1) азотной кислотой и водой
2) уксусной кислотой и хлором
3) оксидом натрия и азотом
4) оксидом серы (IV) и кремнием
5. Оксид магния не взаимодействует с
1) соляной кислотой
2) серной кислотой
3) оксидом лития
4) оксидом кремния
6. Оксид кальция взаимодействует с каждым из двух веществ:
1) оксидом фосфора (V), водой
2) оксидом углерода (IV) и сульфидом натрия
3) оксидом магния и азот
4) кислородом и сульфатом натрия
7. Оксид кальция реагирует с
1) медью
2) фосфором
3) оксидом углерода (IV)
4) оксидом магния
8. Оксид натрия реагирует с
1) водой
2) сульфатом калия
3) нитратом железа (II)
4) оксидом азота (II)
9. Оксид бария реагирует с каждым из двух веществ:
1) оксидом азота (II) и хлором
2) азотной кислотой и водой
3) оксидом углерода (II) и железом
4) серой и хлоридом кальция
10. Оксид магния реагирует с каждым из двух веществ:
1) оксидом кальция и оксидом железа (II)
2) оксидом алюминия и оксидом хрома (II)
3) соляной кислотой и оксидом кремния (VI)
4) оксидом фосфора (V) и цинком
11. Оксид цинка
1) растворяется в кислотах, но не реагирует с основаниями
2) растворяется в щелочах, но не реагирует с кислотами
3) реагирует с оксидом натрия, но не реагирует с водой
4) реагирует с оксидом калия и водой
12. Оксид хрома (III) реагирует с
1) оксидом калия
2) водой
3) оксидом серы (VI)
4) оксидом азота (I)
13. Оксид алюминия амфотерен, поскольку он способен взаимодействовать
1) как с азотной, так и серной кислотой
2) с водой и кислотами
3) с водой и щелочами
4) как с кислотами, так и со щелочами
14. Оксид алюминия реагирует с
1) сульфатом калия
2) оксидом калия
3) оксидом азота (II)
4) оксидом углерода (IV)
15. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) оксидом лития и углекислым газом
2) водой и углекислым газом
3) водой и гидроксидом калия
4) кислородом и натрием
16. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) кислородом и водородом
2) водой и углекислым газом
3) водой и гидроксидом натрия
4) водой и оксидом углерода (II)
17. Оксид серы (VI) не взаимодействует с
1) водой
2) хлоридом калия
3) гидроксидом натрия
4) оксидом бария
18. Оксид серы (IV) взаимодействует с
1) оксидом углерода (IV) и водой
2) оксидом фосфора (V) и водой
3) сульфатом калия и водой
4) оксидом кальция и гидроксидом натрия
19. Оксид серы (IV) не взаимодействует с
1) водой
2) фосфатом кальция
3) раствором гидроксида натрия
4) гидроксидом кальция
20. Оксид хлора (VII) взаимодействует с каждым из двух веществ:
1) кальцием и углекислым газом
2) водой и углеродом
3) водой и оксидом калия
4) кислородом и азотом
21. Установите соответствие между реагирующими веществами и продуктами реакций.
22. Установите соответствие между реагирующими веществами и продуктами реакций.
23. Установите соответствие между реагирующими веществами и продуктами реакций.
24. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) CaO + SiO2 →
Б) CaO + H3PO4 (разб.) →
В) CaO + HCl →
25. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + HCl →
Б) ZnO + NaOH ⎯⎯ H2O →
В) ZnO + Na2O ⎯⎯ сплавление →
26. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) ZnO + H3PO4 →
Б) ZnO + NaOH + H2O →
В) ZnO + C →
27. Установите соответствие между реагирующими веществами и продуктами реакций.
28. Установите соответствие между реагирующими веществами и продуктами реакций.
29. Установите соответствие между реагирующими веществами и продуктами реакций.
30. Установите соответствие между реагирующими веществами и продуктами реакций.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) SO2 + H2S →
Б) SO2 (изб.) + NaOH →
В) SO2 + NaOH (изб.) →
31. Дана схема превращений:
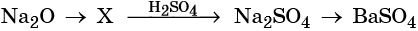
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
32. Дана схема превращений:
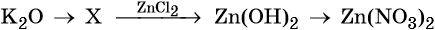
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
33. Дана схема превращений:
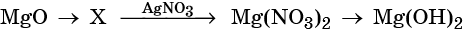
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
34. Дана схема превращений:
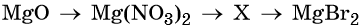
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
35. Дана схема превращений:
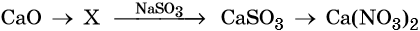
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
36. Дана схема превращений:
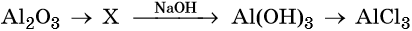
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
37. Дана схема превращений:
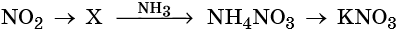
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
38. Дана схема превращений:
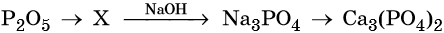
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
39. Дана схема превращений:
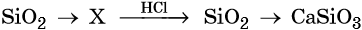
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
40. Дана схема превращений:
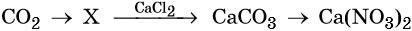
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
41. Дана схема превращений:
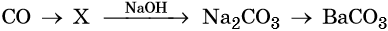
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
42. Дана схема превращений:
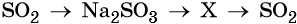
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
43. Дана схема превращений:
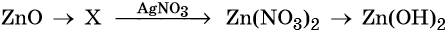
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
44. Дана схема превращений:
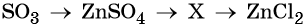
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
45. Дана схема превращений:
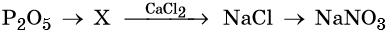
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
46. Дана схема превращений:
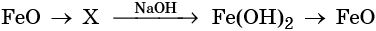
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
47. Дана схема превращений:
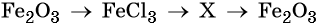
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
48. Дана схема превращений:
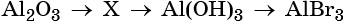
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
49. Дана схема превращений:
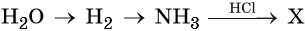
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
50. Дана схема превращений:
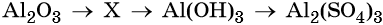
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
Читайте также:

