Окисление сточных вод хлором
Окислительный метод очистки применяют для обезвреживания производственных сточных вод, содержащих токсичные примеси (цианиды, комплексные цианиды меди и цинка) или соединения, которые нецелесообразно извлекать из сточных вод, а также очищать другими методами (сероводород, сульфиды).
Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорат кальция, гипохлориты кальция и натрия, перманганат калия, бихромат калия, пероксид водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переходят в менее токсичные, которые удаляют из воды.
Активность вещества как окислителя определяется величиной окислительного потенциала. Первое место среди окислителей занимает фтор, который из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона - 2,07; для хлора - 0,94; для пероксида водорода - 0,68; для перманганата калия - 0,59.
Окисление активным хлором. Хлор и вещества, содержащие активный хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений, фенолов, цианидов и др.
При введении хлора в воду образуется хлорноватистая и соляная кислоты:
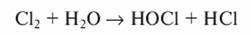
Окисление цианидов хлором можно проводить только в щелочной среде (pH >9. 10)
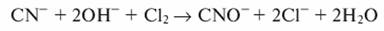
Образующиеся цианаты можно окислить до элементарного азота и диоксида углерода:
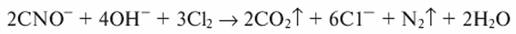
При наличии в сточной воде аммиака, аммонийных солей или органических веществ, содержащих аминогруппы, хлор, хлорноватистая кислота и гипохлориты вступают с ними в реакцию, образуя моно- и дихлорамины, а также треххлористый азот:
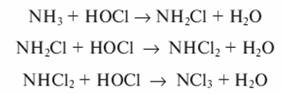
Окисление кислородом воздуха. Реакция окисления кислородом идет в жидкой фазе при повышенных температуре и давлении. При окислении сточных вод целлюлозных, нефтеперерабатывающих и нефтехимических производств протекают следующие реакции:
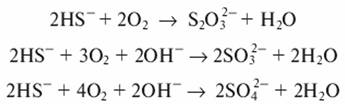
С повышением температуры и давления скорость реакции и глубина окисления сульфидов и гидросульфидов увеличиваются.
Кислород воздуха используют также при очистке воды от железа. В этом случае реакция окисления в водном растворе протекает по схеме
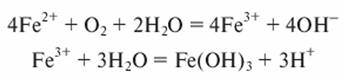
Осуществить процесс разрушения сульфидных соединений можно также диоксидом углерода, содержащимся в отходящих дымовых газах. Образование карбонатов происходит по следующим уравнениям:
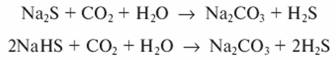
Выделяющийся сероводород, выносимый дымовыми газами и паром, направляется на сжигание, а при использовании диоксида углерода он служит сырьем для получения серной кислоты.
Озонирование. Озон - сильный окислитель, обладающий способностью разрушать в водных растворах при нормальной температуре многие органические вещества и примеси. Окисление озоном позволяет одновременно обеспечить обесцвечивание воды, устранение привкусов и запахов и обеззараживание. Озон окисляет как неорганические, так и органические вещества, растворенные в сточной воде. Озонированием можно очищать сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др. При обработке воды озоном происходит разложение органических веществ и обеззараживание воды; бактерии погибают в несколько тысяч раз быстрее, чем при обработке воды хлором.
При проведении реакции окисления сероводорода на первой стадии наблюдается выделение серы, а на второй - окисление непосредственно до H2SO4:
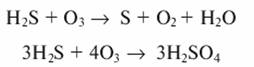
Реакции протекают одновременно, но при избытке озона преобладает вторая.
При окислении цианидов протекают следующие реакции:
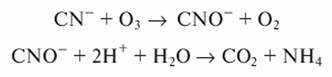
Действие озона в процессах окисления может происходить в трех различных направлениях: непосредственное окисление с участием одного атома кислорода; присоединение целой молекулы озона к окисляемому веществу с образованием озонидов; каталитическое усиление окисляющего воздействия кислорода, присутствующего в озонированном воздухе. Окисление веществ может быть прямое и непрямое, а также осуществляться катализом и озонолизом.
Кинетика прямых реакций окисления может быть выражена уравнением
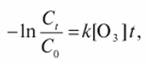
(12.2)
где С0, Сt - начальная и конечная концентрация вещества, мг/л; к - константа скорости реакции, л/(моль·с); [O3] - средняя концентрация озона во время прохождения реакции, мг/л; t - продолжительность озонирования, с.
Непрямое окисление - это окисление радикалами, образующимися в результате перехода озона из газовой фазы в жидкость и его саморазложения.
Озонолиз представляет собой процесс фиксации озона на двойной или тройной углеродной связи с последующим ее разрывом и образованием озонидов, которые, как и озон, являются нестойкими соединениями и быстро разлагаются.
Озонирование представляет собой процесс абсорбции, сопровождаемый химической реакцией в жидкой фазе. Расход озона M, кг/с, необходимого для окисления загрязнений, может быть определен по уравнению массообмена:
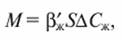
(12.3)
где 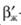
- коэффициент массоотдачи в жидкой фазе при протекании в ней химической реакции, м/с; S - поверхность контакта фаз, м 2 ; ΔСЖ - движущая сила процесса, кг/м 3 .
Процесс очистки сточных вод значительно увеличивается при совместном использовании ультразвука и озона, ультрафиолетового облучения и озона. Ультрафиолетовое облучение ускоряет окисление в 10 2 . 10 4 раз.
Электрохимическое окисление. Электрохимические методы очистки основаны на электролизе производственных сточных вод. Химические превращения при электролизе могут быть весьма различными в зависимости от вида электролита, а также материала электродов и присутствия различных веществ в растворе. Основу электролиза составляют два процесса: анодное окисление и катодное восстановление.
Электрохимическую обработку целесообразно применять при очистке концентрированных органических и неорганических загрязнений и небольших расходах сточных вод.
В качестве анода используют электролитически нерастворимые материалы (уголь, графит, магнетит, диоксиды свинца, магния, рутения), нанесенные на титановую основу, в качестве катода - свинец, цинк и легированную сталь. Большое значение при электрохимическом окислении имеет плотность тока.
Чтобы предотвратить смешение продуктов электролиза, особенно газов (водорода и кислорода), которые могут образовать взрывоопасные смеси, применяют керамические, полиэтиленовые, асбестовые и стеклянные диафрагмы, разделяющие анодное и катодное пространство.
В процессе анодного окисления происходит деструкция органических веществе получением промежуточных или конечных продуктов окисления (органических кислот, СO2, Н2O).
При электролизе щелочных сточных вод, содержащих цианиды, на аноде происходит окисление цианид-ионов с образованием цианат-ионов и дальнейшим их электрохимическим окислением до конечных продуктов:
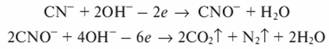
В целях повышения электропроводимости сточных вод, снижения расхода электроэнергии и интенсификации процесса окисления веточные воды добавляют минеральные соли. Наиболее эффективно добавление хлорида натрия, который разлагается с выделением на аноде атомов хлора, участвующих в процессе окисления:
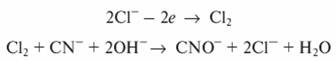
Радиационное окисление. При действии излучений высоких энергий на водные среды, содержащие различные органические вещества, возникает большое число окислительных частиц, обусловливающих процессы окисления. Радиационно-химические превращения протекают не за счет радиолиза загрязняющих воду веществ, а за счет реакции этих веществ с продуктами радиолиза воды: ОН - , НO2 - (в присутствии кислорода), Н2O2, Н + и егидр (гидратированный электрон), первые три из которых являются окислителями. В качестве источников излучения могут быть использованы радиоактивные кобальт и цезий, тепловыделяющие элементы, радиационные контуры, ускорители электронов.
| | | следующая лекция ==> | |
| Нейтрализация сточных вод | | | УДАЛЕНИЕ РАСТВОРЕННЫХ ВЕЩЕСТВ МЕТОДОМ СОРБЦИИ |
Дата добавления: 2017-06-02 ; просмотров: 2320 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Химические методы очистки сточных вод
К химическим методам очистки сточных вод относят нейтрализацию, окисление и восстановление. Все эти методы связаны с расходом различных реагентов, поэтому дороги. Их применяют для удаления растворимых веществ и в замкнутых системах водоснабжения. Химическую очистку проводят иногда как предварительную перед биологической очисткой или после нее как метод доочистки сточных вод.
Нейтрализация
Практически нейтральными считаются воды, имеющие рН=6,5-8,5.
Нейтрализацию можно проводить различным путем: смешиванием кислых и щелочных сточных вод, добавлением реагентов, фильтрованием кислых вод через нейтрализующие материалы, абсорбцией кислых газов щелочными водами или абсорбцией аммиака кислыми водами.
Нейтрализация смешиванием.Метод применяют, если имеются кислые и щелочные воды, не загрязненные другими компонентами. Кислые и щелочные воды смешивают в емкости с мешалкой и без мешалки.
Нейтрализация путем добавления реагентов.В качестве реагентов используют NаОН, КОН, Nа2СО3, NН4ОН (аммиачная вода), СаСО3, МgСО3, доломит (СаСО3∙МgСО3), цемент. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту. Наиболее дешевым реагентом является гидроксид кальция с содержанием активной извести Са(ОН)2 5-10 %.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Принципиальная схема установки приведена на рис. 15.
Различают три вида кислотосодержащих сточных вод:
1) воды, содержащие слабые кислоты (Н2СO3, СН3СООН);
2) воды, содержащие сильные кислоты (НС1, НNO3);
3) воды, содержащие серную и сернистую кислоты.

Рис. 15. Схема станции реагентной нейтрализации: 1 — песколовки; 2 — усреднители; 3 — склад реагентов; 4 — растворный бак; 5 — дозатор; 6 — смеситель; 7 — нейтрализатор; 8 — отстойник; 9 — осадкоуплотнитель; 10 — вакуум-фильтр; 11 — накопитель обезвоженных осадков; 12 — шламовая площадка
Для нейтрализации вод 1 и 2 групп может быть использован любой названный выше реагент. Соли этих кислот хорошо растворимы в воде. Кальциевые соли серной и сернистой кислот (3 тип) плохо растворимы в воде и выпадают в осадок. При нейтрализации вод, содержащих серную кислоту, известковым молоком в осадок выпадает гипс СаSО4∙2Н2O. Происходит отложение гипса на стенках трубопроводов и их забивка. Для устранения забивки трубопровода необходимо промывать их чистой водой или добавлять в сточные воды специальные умягчители, например гексаметафосфат. Для нейтрализации щелочных сточных вод используют различные кислоты или кислые газы.
Нейтрализация фильтрованием кислых вод через нейтрализующие материалы. В этом случае для нейтрализации кислых вод проводят фильтрование их через слой магнезита, доломита, известняка, твердых отходов (шлак, зола). Процесс ведут в фильтрах-нейтрализаторах, которые могут быть горизонтальными или вертикальными. Для вертикальных фильтров используют куски известняка или доломита размером 30-80 мм с продолжительностью контакта не менее 10 мин.
Нейтрализация кислыми газами.Для нейтрализации щелочных сточных вод в последнее время начинают использовать отходящие газы, содержащие СО2, SO2, NO2, N2O3 и др. Применение кислых газов позволяет не только нейтрализовать сточные воды, но и одновременно производить высокоэффективную очистку самих газов от вредных компонентов. Это пример ресурсосберегающей технологии, позволяющей исключить использование кислот, создать бессточную схему водопотребления.
Очистка сточных вод методом окисления примесей
Окислительный метод очистки применяют для обезвреживания производственных сточных вод, содержащих токсичные примеси (цианиды) или соединения, которые нецелесообразно извлекать из сточных вод, а также очищать другими методами (сероводород, сульфиды).
Такие виды сточных вод встречаются в машиностроительной (цехи гальванических покрытий), горнодобывающей (обогатительные фабрики свинцово-цинковых и медных руд), нефтехимической и целлюлозно-бумажной (цехи варки целлюлозы) промышленностях.
В качестве окислителей используют хлор, гипохлорит кальция, гипохлорит натрия, хлорную известь, диоксид хлора, озон, технический кислород, кислород воздуха. В ряде случаев (для окисления фенолов, крезолов, циансодержащих примесей) могут быть использованы пероксид водорода, оксиды марганца, перманганат и бихромат калия.
Окисление активным хлором– один из самых распространенных способов очистки сточных вод от фенола, крезола, цианидов, сероводорода, гидросульфида, метилмеркаптана, а также против биологического обрастания сооружений.
Хлор поступает в производство в жидком виде, содержит не менее 99,5 % Cl2. В состав хлорной извести входят различные вещества: CaCl2∙Ca(OH)2∙H2O; хлорат кальция CaClO2; гипохлорит кальция Ca(ClO)2. В зависимости от соотношения указанных веществ хлорная известь выпускается марок А, Б, В. Гипохлорит кальция Ca(ClO)2 выпускается трех сортов.
При введении в воду хлор гидролизуется с образованием хлорноватистой и соляной кислот: Cl2 + H2O ↔ HOCl + HCl. Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от pH среды. При значениях pH>4 молекулярный хлор в воде практически отсутствует. Образовавшаяся в результате гидролиза хлора хлорноватистая кислота диссоциирует на ион гипохлорита OCl - и ион водорода H + .
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Трубопроводы установки изготавливают из антикоррозионных материалов. Жидкий хлор перед подачей в установку испаряют.
При обезвреживании цианидов процесс проводят в щелочной среде pH=9. Цианиды можно окислить до элементарного азота и диоксида углерода по уравнениям:
CN - + 2OH - + Cl2 → CNO - + 2Cl - + H2O,
Окисление ионов CN - может осуществляться путем перевода их в цианаты CNO - , которые затем гидролизуются с образованием ионов аммония и карбонатов:
CN - + OCl - → CNO - + Cl - ,
Пероксид водорода разлагает нитриты, нитрилы, альдегиды, фенолы, сульфаты. Одновременно происходит обесцвечивание сточных вод. Процесс обесцвечивания ускоряется в присутствии катализаторов FeSO4 и CuSO4. Промышленность выпускает 85-95 % пероксид водорода и пергидроль, содержащий 30 % H2O2. Пероксид водорода в кислой и щелочной средах разлагается по следующим схемам
В кислой среде более отчетливо выражена окислительная функция, а в щелочной – восстановительная. В кислой среде пероксид водорода переводит соли двухвалентного железа в соли трехвалентного, азотистую кислоту – в азотную, сульфиды – в сульфаты. Цианиды в цианаты окисляются в щелочной среде.
Окисление кислородом воздухапроводят для удаления из сточных вод железа, окисления сульфидных стоков целлюлозных, нефтеперерабатывающих, нефтехимических заводов. Соединения двухвалентного железа окисляются в трехвалентные и, затем, в виде гидроксида трехвалентного железа удаляются. Процесс проводят при аэрировании воздуха через сточные воды в башне с насадкой. Образующийся гидроксид железа отстаивается, а затем отфильтровывается.
При окислении сульфидных стоков процесс окисления гидросульфидной и сульфидной серы протекает через ряд стадий при изменении валентности серы с -2 до +6. Принципиальная схема установки окисления сульфидов приведена на рис. 16.

Рис. 16. Схема установки окисления сульфидов:
1 – приемный резервуар; 2 – насос; 3 – теплообменник; 4 – окислительная колонна; 5 – воздухораспределительное устройство; 6 – сепаратор; 7 – холодильник
Окисление пиролюзитом. Пиролюзит является природным материалом, состоящим, в основном из диоксида марганца, формула MnO2∙H2O. Сточные воды фильтруют через этот материал с целью окисления трехвалентного мышьяка в пятивалентный.
Повышение температуры способствует увеличению степени окисления, поэтому окисление пиролюзитом проводят при температуре 70-80 о С.
Озонирование.Окисление озоном позволяет одновременно обесцветить сточные воды, устранить запахи и привкусы, провести обеззараживание. Озонированием можно очищать сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, красителей, канцерогенных веществ, ароматических углеводородов, пестицидов и др. Кроме того, соединения металлов окисляются озоном до высшей валентности.
Озон подают в сточные воды в виде озоно-воздушной или озоно-кислородной смеси, в которой его содержание составляет 3 %. Установки для очистки сточных вод состоят из аппаратов для очистки и осушки воздуха, озонаторов, камер контакта сточных вод с озоном, оборудования для утилизации остаточного озона. В обрабатываемую воду озон вводят различными способами: барботирование воздуха, содержащего озон, через слой воды; смешение воды с озоновоздушной смесью в инжекторах или роторно-механических смесителях, в абсорберах различной конструкции.
Процесс озонирования интенсифицируется, если одновременно с озоном использовать ультразвук или УФ-облучение. Например, в последнем случае окисление ускоряется до 10000 раз.
Обезвреживание сточных вод хлором или его соединениями – один из самых распространенных способов очистки от ядовитых цианинов, а также от таких органических и неорганических соединений, как сероводород, гидросульфит, сульфид, метилмеркаптан и др.
Сточные воды, содержащие ядовитые цианиды, образуются на машиностроительных и металлообрабатывающих заводах в гальванических цехах. Значительное количество цианидсодержащих сточных вод получается при промывке изделий после закалки их в расплавах цианидов. Обычно содержание цианидов в таких сточных водах колеблется от 20 до 100 мг/л, но бывает и выше.
Окисление ядовитых цианид-ионов CN– осуществляется путем перевода их в нетоксичные цианаты СNO–, которые затем гидролизуются с преобразованием ионов аммония и карбонатов:
СN– + 2ОН– – 2е → CNO– + НО;
CNO– + 2Н2О→ NH4+ + СО32–.
Возможен также перевод токсичных соединений в нетоксичный комплекс или в осадок (в виде нерастворимых цианидов) с последующим удалением его из сточных вод отстаиванием или фильтрованием.
При введении в воду хлор гидролизуется, образуя хлорноватистую и соляную кислоты:
В сильнокислой среде равновесие этой реакции сдвинуто влево, в воде присутствует молекулярный хлор; при значениях рН > 4 молекулярный хлор в воде практически отсутствует.
Образовавшаяся в растворе гидролиза хлора хлорноватистая кислота диссоциирует на ион гипохлорита ОСl– и ион водорода Н+.
Степень диссоциации хлорноватистой кислоты которой зависит от рН среды. При рН = 4 молекулярный хлор практически отсутствует:
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. 1.52. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
При обезвреживании вод от цианидов процесс проводят в щелочной среде (рН = 9). Цианиды можно окислить до элементного азота и диоксида углерода по уравнениям
При снижении рН возможно протекание реакции прямого хлорирования цианида с образованием токсичного хлорциана.
Реакция протекает быстро (1-3 мин.) и полно. Окисление цианидов до цианатов происходит за счет атомного кислорода в момент его выделения из окислителя. Образующиеся цианаты CNO– легко гидролизуются до карбонатов:
Скорость гидролиза зависит от рН среды. При рН = 5,3 за сутки гидролизуется около 80 % цианатов. В двухступенчатом процессе цианиды окисляются до N2 и СО2. На первой ступени процесс протекает по уравнению реакции (1) окисления до получения цианатов. На второй ступени вводят дополнительное количество окислителя, и реакция протекает по уравнению
При окислении ядовитого комплекса цианида цинка происходит следующая реакция:
Для определения расходов гипохлоритов кальция или натрия, а также хлорной извести на окисление цианидсодержащих сточных вод можно воспользоваться формулой:
где X – требуемое количество реагента, кг/сутки; k – коэффициент запаса реагента, принимаемый равным 1,2-1,3; Q – количество цианидсодержащих сточных вод, м3/сутки; а – содержание активного хлора в реагенте, равной в товарной хлорной извести 30-35 %, в гипохлорите кальция 30-45 %; x1 – теоретическое количество активного хлора, необходимого для окисления цианидов, г/м3:
где n – стехиометрический коэффициент (по активному хлору); С – концентрация цианидов в сточных водах (в пересчете на цианидион), г/м3.
Для определения коэффициента и подсчитывается количество активного хлора в гипохлорите. Активный хлор определяется по количеству грамм-атомов йода, выделенных данным реагентом из йодистого калия в кислой среде. Запишем реакцию окисления простых цианидов гипохлоритом в ионно-электронном виде
Это значит, что при взаимодействии гипохлорита с КI (калий йодистый) наблюдались следующие реакции
При наличии в сточной воде аммиака, аммониевых солей или органических веществ, содержащих аминогруппы, хлор, хлорноватистая кислота и гипохлориты вступают с ними в реакцию, образуя моно - и дихлорамины, а также трихлористый азот
Обработка цианидсодержащих сточных вод диоксидом хлора СlО2 имеет ряд преимуществ:
- высокая окислительная способность СlО2 по сравнению с другими окислителями (кроме фтора и озона);
- водные растворы СlО2 устойчивы в течение длительного времени;
- при обработке сточных вод диоксидом хлора не образуется высокотоксичных продуктов прямого хлорирования (хлорциана, хлорфенола и др.) в любом диапазоне величие рН.
Окисление цианида диоксидом хлора протекает по уравнению
При начальном содержании цианидов 25 мг/л и продолжительности окисления 1 мин – эффективность составляет 95 %, а через 10 мин реакция окисления практически заканчивается.
Хлорирование применяется для дезодорации сточных вод, образующихся при варке сульфатной целлюлозы и при выпаривании тарного щелока на целлюлозно-бумажных комбинатах. Эти сточные воды содержат сероводород, сульфиды, метил-меркаптан и др.
В щелочной среде хлор окисляет сульфиды до сульфатов:
В кислой и нейтральной среде возможно образование сульфитов:
При избытке хлора окисление всегда идет до сульфатов. Метилмеркаптан окисляется хлором несколько медленнее, чем сероводородом, но значительно быстрее, чем сульфиды и дисульфиды. В зависимости от расхода хлора окисление метилмеркаптана может протекать с образованием различных продуктов:
Поскольку метилмеркаптан окисляется хлором сравнительно быстро, продолжительность контакта сточных вод выпарной станции (загрязненных в основном сероводородом и метилмеркаптаном) с хлором составляет 5 мин.
В зависимости от агрегатного состояния вводимых в воду хлора или хлорсодержащих реагентов определяется технология обработки сточных вод. Если эту воду обрабатывают газообразным хлором или диоксидом хлора, то процесс окисления осуществляется в абсорберах; если хлор или диоксид хлора находятся в растворе, то их подают в смеситель и далее в контрольный резервуар, в них обеспечивается эффективнее их смешивание и требуемая продолжительность контакта со сточной водой.
Гипохлорит (оксохлорат) натрия образуется при пропускании газообразного хлора через раствор щелочи:
Гипохлорит кальция приготовляют хлорированием гидроксида кальция при температуре 25-30 °С:
Промышленность выпускает двухосновную соль
Сильным окислителем является хлорат натрия NaClO2, который разлагается с выделением ClO2. Диоксид хлора ядовитый зеленовато-желтый газ, обладающий более интенсивным запахом, чем хлор. Для его получения проводят следующие реакции:

Хлорирование проводится в емкости, включенной с систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
16. Очистка сточных вод окислением пероксида водорода.
Пероксид водорода используется для окисления нитритов, альдегидов, фенолов, цианидов, серосодержащих отходов и активных красителей.
17. Озонирование сточных вод. Оборудование. Принцип действия аппаратов.
Используют при очистке сточной воды от Fe +2 . Кислородом воздуха также окисляют сульфидные стоки целлюлозных заводов.

В озонаторе под действием электрического разряда протекает реакция 3О2→2О3
Пиролиз – нужен для того, что бы озон, не успевший прореагировать, разлагался О3→О2+О
Преимущества озонирования: дезинфекция, окисление неорганических соединений, окисление органических соединений (удаляет запах и вкус, разрушает фенолы, пестициды, ПАВ), насыщение кислородом воды, что способствует развитию аэробных микроорганизмов, съедающих органику в воде.
18. Удаление ионов тяжелых металлов. Очистка от соединений ртути.
Восстановление. Используется в тех случаях, когда сточные воды содержат легковосстанавливающие вещества (соединения ртути, хрома, мышьяка). В процессе очистки сточной воды неорганические соединения ртути восстанавливают до металлической ртути, которую отделяют от воды фильтрованием, отстаиванием или флотацией. Органические соединения ртути сначала окисляют с разрушением соединения, а затем катионы ртути восстанавливают до металлической ртути.
Удаляют на вакуум-фильтрах и угольных фильтрах.
19. Удаление ионов тяжелых металлов. Очистка от соединений цинка, меди, никеля, свинца, кадмия и кобальта.
В качестве восстановителей используют NaOH, Ca(OH)2, CaO
ZnSO4+NaOH → ZnSO4*3Zn(OH)2↓ (гидрооксидсульфат цинка)
При pH=12 образуется комплекс, растворимый в воде
Zn(OH)2+ 
→[Zn(OH)4] 2- (Растворим)
Очистка от никеля.
Ni 2+ +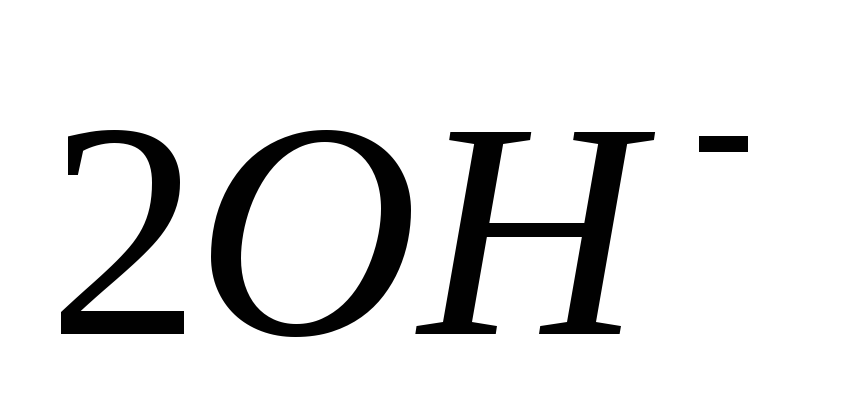
→ Ni(OH)2↓
CaCO3 – осаждает Ni, Pb
Ni 2+ +
→NiCO3↓
Pb 2+ +
→PbCO3↓
20. Очистка сточных вод от солей железа. Схема установки химической флотации.
Хим. флотация применяется для очистки от тяжелых металлов. В процессе протекают тяжелые реакции с выделением газов. Пузырьки газов прилипают к нерастворимым веществам и выносят на поверхность в пенный слой.

Помимо химической флотации существует ионная флотация. В сточную воду вводят воздух, разбивая на пузырьки, и вводится собиратель (ПАВ). ПАВ образует ионы, которые имеют заряд противоположный заряду извлекаемого иона. Ионы ПАВ и загрязнений концентрируются на поверхности газовых пузырьков и выносятся в пену. Этот процесс используется при химической концентрации ионов таких металлов, как Мо, W, Pt, Ce, Re.
21. Ионообменная очистка сточных вод. Сущность ионного обмена.
Ионная флотация. В сточную воду вводят воздух, разбивая на пузырьки, и вводится собиратель (ПАВ). ПАВ образует ионы, которые имеют заряд противоположный заряду извлекаемого иона. Ионы ПАВ и загрязнений концентрируются на поверхности газовых пузырьков и выносятся в пену. Этот процесс используется при химической концентрации ионов таких металлов, как Мо, W, Pt, Ce, Re.
Читайте также:

