Объективный ответ опухоли это
а) Терминология:
1. Сокращения:
• Критерии оценки ответа солидных опухолей на лечение (RECIST)
2. Определение:
• Новая версия критериев была опубликована в 2009 г.
• Используются модифицированные критерии RECIST
3. Ключевые принципы:
• Критерии включения пациентов:
о Пациенты с наличием измеряемых проявлений заболевания при первичном исследовании
- Наличие как минимум одного измеряемого очага
о Первичной конечной точкой является оценка объективного ответа опухоли на лечение
• Оценка опухоли при первичном исследовании:
о Обнаружение измеряемых проявлений заболевания
о Выбор целевых и нецелевых очагов
о Измерение целевых очагов
о Опухолевая нагрузка: сумма размеров целевых очагов
• Оценка опухоли при повторном исследовании:
о Измерение целевых очагов
о Оценка нецелевых очагов
о Обнаружение новых очагов
о Расчет ответа опухоли на лечение в данной временной точке
4. Существенные различия между RECIST и RECIST 1.1:
• Внесены изменения в определения следующих понятий:
о Опухолевая нагрузка
о Размер лимфатических узлов
о Прогрессирование заболевания
о Прогрессирование неизмеряемых проявлений заболевания о Подтверждение ответа о Новые очаги




б) Лучевая анатомия:
1. Измеряемые и неизмеряемые проявления заболевания:
• Измеряемые проявления:
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным при КТ или МРТ в аксиальной плоскости с интервалом реконструкции 5 мм LD должен превышать толщину среза как минимум в два раза
о Опухоль с наибольшим диаметром (LD) >20 мм, измеренным при рентгенографии органов грудной клетки (если очаг имеет четкий контур и окружен воздушной легочной тканью)
- Предпочтительнее проводить КТ
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным клинически (по фотографии) электронным штангенциркулем:
- На фотографиях на кожных покровах следует располагать линейку
- Образования, размер которых не удается с точностью определить с помощью штангенциркуля, следует считать неизмеряемыми
о Размер лимфатических узлов по короткой оси при КТ должен составлять > 15 мм (толщина среза 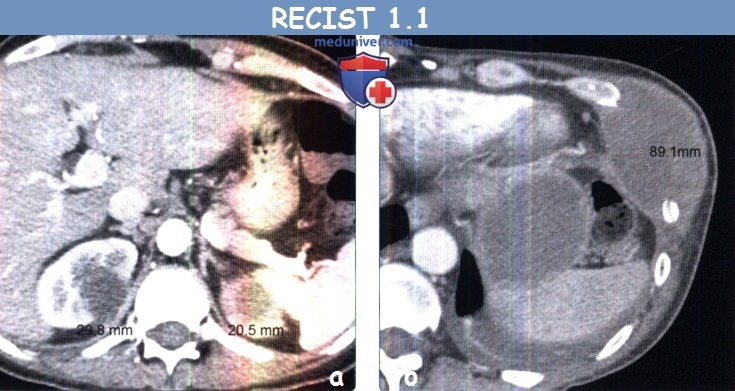
(а) Женщина 27 лет с метастазами EGFR-позитивной аденокарциномы легкого. При КТ с контрастным усилением в почках определяются метастазы. Поскольку ранее они не выявлялись, эта картина соответствует прогрессированию заболевания.
(б) Мужчина 47 лет с метастазами немелкоклеточного рака легкого. При КТ с контрастным усилением в грудной стенке визуализируется метастаз. В соответствии с RECIST 1.1 метастазы в костях считаются целевыми очагами только в том случае, если содержат мягкотканный компонент, отвечающий критериям размера. 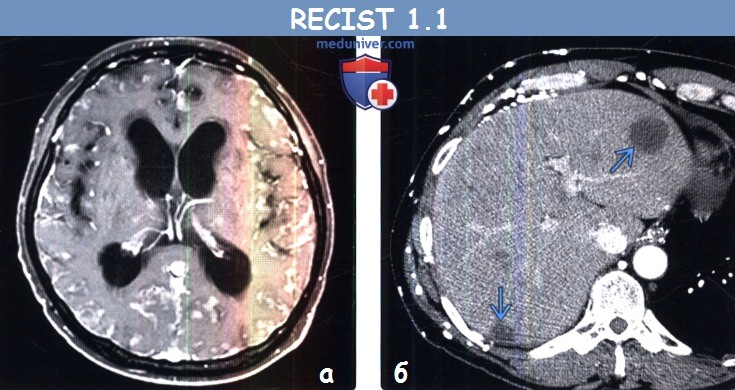
(а) Мужчина 37 года с метастазами аденокарциномы легкого. При МРТ на Т1ВИ с контрастным усилением определяется контрастирование мягкой мозговой оболочки на большом протяжении. Образования, не соответствующие критериям размера целевых очагов, а также такие патологические процессы, как контрастирование мягкой мозговой оболочки, считают неизмеряемыми проявлениями заболевания.
(б) Мужчина 4 7 года с метастазами муцинозной аденокарциномы легкого. При КТ с контрастным усилением в печени визуализируется гиподенсный кистозный метастаз, расцененный как измеряемый очаг. 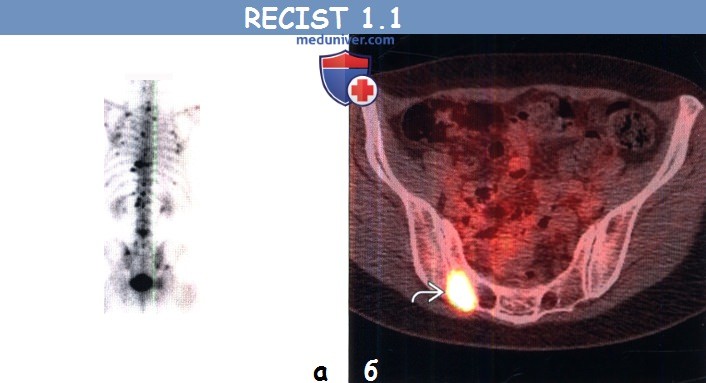
(а) Пациент, страдающий немелкоклеточным раком легкого. При остеосцинтиграфии всего тела в задней проекции определяются множественные очаги повышенного накопления РФП, соответствующие метастазам.
(б) Пациент, страдающий немелкоклеточным раком легкого. При ФДГ-ПЭТ/КТ в правой половине крестца визуализируется очаг с повышенным уровнем поглощения ФДГ. При КТ в данной области патологический участок не выявлен. Остеосцинтиграфия и ПЭТ/КТ могут быть использованы для обнаружения метастазов в костях, но не для их измерения.
в) Оценка ответа:
1. Ключевые принципы:
• Измерение ранее выбранных целевых очагов (даже если их размер перестал быть наибольшим)
• Оценка всех ранее выбранных нецелевых очагов
• Оценка новых очагов
2. Оценка целевых очагов:
• Расчет SLD:
о Измерение LD каждого целевого очага
о Измерение размера целевых лимфатических узлов по короткой оси
о Если размер образования слишком мал для того, чтобы быть измеренным, считают, что его размер составляет 5 мм (величина по умолчанию)
о Если образование исчезло, считают его размер равным 0
о Распадающиеся или сливающиеся очаги:
- Если целевой очаг распадается на множество меньших по размеру фрагментов, то суммируются LD всех фрагментов
- Если целевые очаги сливаются, то используется LD конгломерата
3. Новые очаги:
• Новые очаги должны быть исключительно опухолевой этиологии:
о Сомнительные очаги, возникновение которых обусловлено разницей в методиках исследования или потенциально неопухолевым процессом, не учитывают
о Не обязательно должны быть измеряемыми
• Сомнительные очаги:
о Оценивают повторно при исследовании в следующей временной точке
о Если наличие очага подтверждается при повторном исследовании, то регистрируется прогрессирование заболевания по дате первого выявления такого очага
• Очаги, обнаруженные за пределами зоны первичного исследования, считают новыми
• Наличие новых очагов, выявленных при УЗИ, следует подтвердить с помощью КТ или МРТ
4. Общий ответ:
• Категории:
о Полный ответ (CR)
о Частичный ответ (PR) о Стабилизация заболевания (SD)
о Оценка невозможна (NE) о Прогрессирование заболевания (PD)
6. Ошибочная оценка и случаи, когда оценка невозможна:
• NE: все очаги не могут быть оценены в определенной временной точке:
о Обычно причиной служит потеря данных или низкое качество изображений
о Также данная категория ответа соответствует невозможности оценки некоторой части очагов:
- Исключение: если данные очаги не повлияют на оценку ответа на лечение в определенной временной точке
7. Рецидивирование очагов:
• Влияние рецидивирования очагов зависит от общего ответа:
о Стабилизация заболевания/частичный ответ:
- Образование, подвергшееся обратному развитию, а затем рецидивировавшее, продолжает учитываться
- Категория ответа зависит от состояния других очагов
о Полный ответ
- Рецидивирования образования свидетельствует о прогрессировании заболевания
8. Подтверждение ответа на лечение:
• Частичный ответ/полный ответ:
о Подтверждение необходимо в случае нерандомизированных клинических исследований, в которых эффективность лечения является первичной конечной точкой
о В случае стабилизации заболевания в первой промежуточной точке допускается последующее подтверждение частичного ответа
г) Видео RECIST 1.1 - критерии ответа рака легкого на лечение находится здесь.
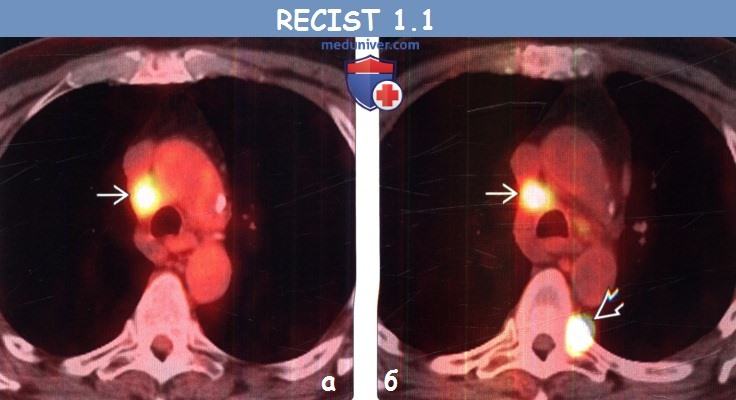
(а) Мужчина 58 лет, немелкоклеточный рак легкого (не показано). При первичной ФДГ-ПЭТ/КТ определяется интенсивный уровень поглощения ФДГ правым паратрахеальным лимфатическим узлом, что соответствует его метастатическому поражению.
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ уровень поглощения ФДГ правым паратрахеальным лимфатическим узлом остался без изменений, однако в грудном позвонке возник новый интенсивно накапливающий ФДГ метастаз, что соответствует прогрессированию заболевания. 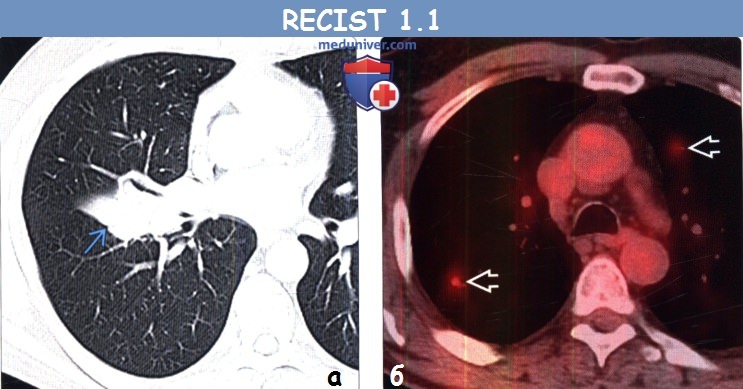
(а) Мужчина 49 лет, немелкоклеточный рак легкого. При первичной КТ с контрастным усилением в нижней доле правого легкого определяется первичная злокачественная опухоль
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ в легких визуализируются новые интенсивно поглощающие ФДГ узелки, соответствующие метастазам. Поскольку данные метастазы при первичной КТ не выявлялись, а при последующей КТ их наличие было подтверждено, то картина соответствует прогрессированию заболевания. 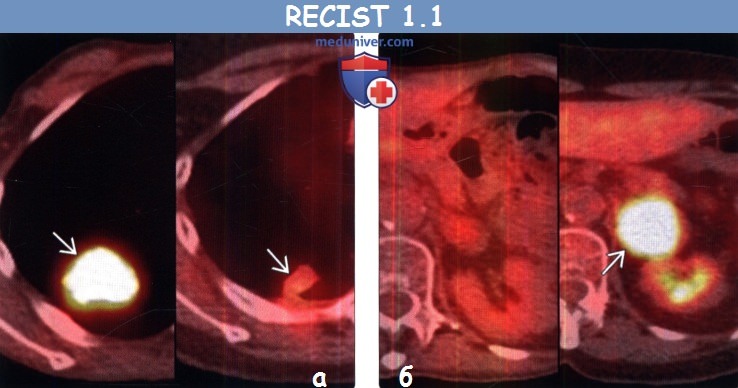
(а) Пациент, страдающий немелкоклеточным раком легкого. На совмещенных изображениях при первичной ФДГ-ПЭТ/КТ (слева) и после курса химиотерапии (справа) определяется выраженное уменьшение размера единственного целевого очага, соответствующего первичной злокачественной опухоли. Интенсивность поглощения ФДГ данным очагом также снизилась.
(б) У этого же пациента на совмещенных изображениях при первичной ФДГ-ПЭТ/КТ (слева) и после курса химиотерапии (справа) визуализируется возникновение интенсивно поглощающего ФДГ метастаза в левом надпочечнике, что соответствует прогрессированию заболевания.
в) Список литературы:
1. Litiere S et al: The components of progression as explanatory variables for overall survival in the Response Evaluation Criteria in Solid Tumours 1.1 database. Eur J Cancer. 50(10)4847-53, 2014
2. Nishino M et al: Revised RECIST guideline version 1,1: What oncologists want to know and what radiologists need to know. AJR Am J Roentgenol. 195(2):281-9, 2010
3. van Persijn van Meerten EL et al: RECIST revised: implications for the radiologist. A review article on the modified RECIST guideline. Eur Radiol. 20(6)4 456-67, 2010
4. Eisenhauer EA et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer, 45(2):228-47, 2009
5. Eisenhauer EA et al: Response assessment in solid tumours (RECIST) and supporting papers (version 14). Eur J. Cancer. 45(2):225-310, 2009
Редактор: Искандер Милевски. Дата публикации: 24.2.2019
В.Ф. Семиглазов, В.В. Семиглазов, А.Е. Клецель, Е.К. Жильцова,
В.Г. Иванов, А.А. Божок, Р.В. Донских, С.Г. Петровский, Р.М. Палтуев,
Г.А. Дашян, К.Ю. Зернов, А.В. Ефименко, И.А. Кочетова
НИИ онкологии им. проф. Н.Н. Петрова, Санкт-Петербург, Россия
Хотя неоадъювантное системное лечение РМЖ имеет уже 15-летнюю историю, оно пока не вошло в стандарт лечения этих опухолей. Достаточно сказать, что в мире имеется лишь 6 опубликованных рандомизированных испытаний неоадъювантной химиотерапии и четыре рандомизированных испытания неоадъювантной гормонотерапии (два с участием НИИ онкологии им.проф. Н.Н.Петрова). Многие врачи, опираясь на "персональный опыт" полагают, что неоадъювантная химиотерапия эффективнее и безопаснее гормонотерапии, т.к. позволяет в относительно короткие сроки (9-12 недель) добиться заметного регресса опухоли для выполнения хирургического этапа (от мастэктомии до органосохраняющей операции в зависимости от остаточного размера опухоли).
В последние годы - в связи с большим вниманием к сохранным методам хирургического вмешательства, а также из-за накопления дополнительных данных о механизмах эстрогенозависимости РМЖ и гормонального канцерогенеза, все чаще делаются попытки проведения неоадъювантной гормонотерапии рака молочной железы, прежде всего, на основе применения антиэстрогенов и ингибиторов ароматазы. Неоадъювантная терапия рассматривается, прежде всего, как уникальная модель тестирования активности нового терапевтического подхода или как способ определения потенциального значения биологических факторов в оценке дальнейшего клинического течения и исхода заболевания. В этих случаях больные РМЖ получают лечение de novo; результаты оцениваются быстро и вся перечисленная информация получается на относительно небольшом числе пациентов и в кратчайшие сроки, исчисляемыми месяцами, а не годами (как при проведении адъювантной терапии). К преимуществам неоадъювантного лекарственного лечения относят следующие моменты: воздействие на микрометастазы; уменьшение массы опухоли и уменьшение объема выполнения оперативного этапа (до функционально выгодных и органосохранных вариантов); определение индивидуальной чувствитель-ности опухоли к использованным противоопухолевым агентам. Клиническая регрессия опухоли коррелирует со степенью терапевтического патоморфоза в опухолях и является важным прогно-стическим фактором, отражающим чувствительность опухоли к проводимой терапии. Важность данного факта состоит в том, что позволяет в случаях резистентности опухоли определить оптимальный подход в назначении адъювантного лечения. Эффективность предоперационной терапии может служить одним из критериев прогноза при местнораспространенном РМЖ. При выраженном клиническом эффекте рецидивы и метастазы возникают реже и сроки их появления удлиняются.
В НИИ онкологии с 1997 по 2004г. было проведено четыре рандомизированных испытаний неоадъювантной эндокринотерапии РМЖ. Первое из них выполнено в рамках Международного многоцентрового протокола 024 "Неоадъювантная гормонотерапия летрозолом против тамоксифена у женщин с РМЖ ЭР+/ПР+ в постменопаузе" (спонсор компания "Новартис" (Швейцария)).
Результаты исследования 024, включавшего 377 больных ЭР+ доказали что частота клинических ответов значительно выше при лечении летрозолом, в сравнении с тамоксифеном (55% против 36%; Р 2 N 1 М 0 ,T 3 N 0-1 М 0 ,Т 4 N 0 М 0 . До начала лечения у всех пациентов проведена трепан-биопсия опухоли с помощью биопсийного пистолета системы Бард-Магнум (игла 14 калибра).
Дизайн исследования и схема рандомизации представлены на рис.1.
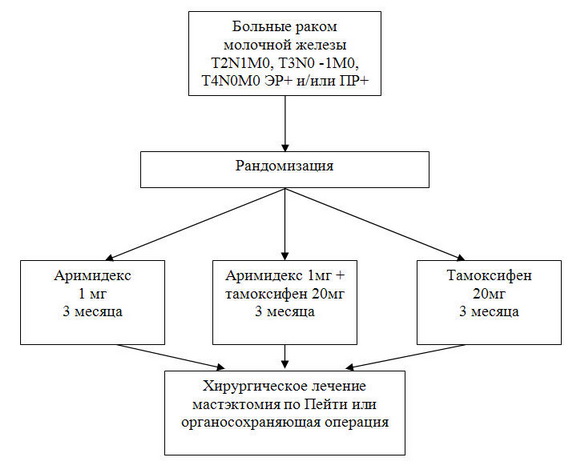
Рис. 1. Дизайн клинических испытаний неоадъювантной эндокринотерапии в НИИ онкологии им.проф. Н.Н.Петрова.
Основной целью исследования было сравнение величины объективных ответов опухоли на лечение (частичный или полный регресс опухоли) определяемый с помощью клинического метода (пальпация), рентгеномаммографии и ультразвукового исследования (до начала и после окончания неоадъювантной эндокринотерапии). Одной из целей исследования было также определение частоты выполнения органосохраняющих операций в различных лечебных группах.
Для оценки величины ответа опухоли на лечение в работе использованы стандартные критерии ВОЗ с двухмерным измерением наибольших диаметров.
Полный ответ (регресс) - 100% исчезновение опухоли
Частичный ответ - уменьшение размера на 50% и более.
Стабилизация - уменьшение размера опухоли менее чем на 50%.
Прогрессирование - увеличение размера опухоли более чем на 25%.
При клинической оценке (пальпация) полный ответ опухоли наблюдался у 13,3% больных 1-й группы (получавших лечение аримидексом), 10,3% больных 3-й группы (получавших тамоксифен) и ни разу во 2-й группе (получавших комбинированное лечение аримидексом и тамоксифеном (табл.1). Частичный ответ достоверно чаще наблюдался в группе больных, получавших один аримидекс по сравнению с леченными тамоксифеном или получавшими комбинированное лечение (тамоксифен + аримидекс) (80% против 48% против 42%, Р=0,048). При оценке лечебного эффекта с помощью маммографии объективный ответ (частичный или полный регресс опухоли) наблюдался у 55,5% больных, получавших аримидекс, 40% больных, получавших комбинированное лечение (А+Т) и 36% больных, получавших тамоксифен (Р=0,058). При изучении лечебного эффекта с помощью динамического ультразвукового исследования молочных желез объективный ответ зарегистрирован у 44% больных, получавших аримидекс, 32% больных, получавших комбинированную эндокринотерапию (А+Т) и 30% больных, получавших один тамоксифен.
При патоморфологическом изучении операционных препаратов полное исчезновение инвазивных опухолевых клеток (РСР) наблюдалось у двух больных после лечения аримидексом, одной больной - после комбинированного лечения и у одной больной - после терапии тамоксифеном.
Органосохраняющие операции (сегментарная резекция + подмышечная диссекция) были выполнены у 42% больных 1-й группы (получавших один аримидекс), у 30% больных, получавших комбинированную эндокринотерапию (А+Т) и 30% больных, получавших один тамоксифен, р=0,056.
Ответ на любой вид неоадъювантной эндокринотерапии оказался наиболее высоким и значимым при высоком уровне экспресс рецепторов эстрогенов. В работе было также показано явное уменьшение уровня рецепторов прогестерона (РП) в группе больных, получавших один аримидекс. У 14 из 30 больных получавших тамоксифен (т.е. в 46,6% случаев) после лечения не определялись рецепторы прогестерона. Средний уровень рецепторов прогестерона до лечения аримидексом достигал 106 fmol/mg, а после окончания лечения - лишь 11,3 fmol/mg. Экспрессия РП эффективно подавлялась аримидексом, но не тамоксифеном.
Любой вариант эндокринотерапии легко переносился пациентами. Наиболее частым побочным эффектом лечения оказались приливы, встретившиеся соответственно по группам в 21%, 24%, 25% случаев (р>0,5). При наблюдении за больными в течение 38 месяцев не отмечалось смертельных исходов из-за осложнений лечения.
В клиническое испытание "Неоадъювантная эндокринотерапия экземестаном (аромазином) против тамоксифена" с 1997 г по 2004 г вошли 127 больных PMЖ T 2 N 1-2 , T 3 N 0-1 , T 4 N 0 M 0 (исключая воспалительные формы РМЖ) с положительными гормональными рецепторами (ЭР+ и /или ПР+). Ежедневная доза тамоксифена 20 мг, доза экземестана - 25 мг, длительность лечения до операции - 3 месяца. Основной целью испытания была оценка величины объективного ответа опухоли (частичный и полный ответ) на проводимое предоперационное лечение, определяемая клиническим методом (пальпацией) и с помощью динамической маммографии (до начала лечения и сразу же после завершения). У всех включенных в исследование больных до начала лечения была выполнена трепан-биопсия первичной опухоли (система Бард-Магнум, трепан-игла 14-го калибра) с определением гистологического типа опухоли, содержания рецепторов эстрогенов и прогестерона иммуногистохимическим методом.
Вторичной целью исследования было определение частоты выполнения органосохраняющих операций в различных лечебных группах.
Как видно из таблицы 3 предоперационная (неоадъювантная) терапия экземестаном (аромазином) оказалась значительно более эффективной, чем лечение тамоксифеном. При клинической оценке величина общего объективного ответа опухоли на терапию аромазином оказалась почти в два раза выше, чем на лечение тамоксифеном (90.5% против 48.4%, Р=0.049). При рентгеномаммографической оценке абсолютные показатели ниже, чем при клинической оценке, но тенденция превосходства аромазина над тамоксифеном сохраняется, особенно по частоте частичного ответа опухоли (58% против 20%).
Число больных с прогрессированием заболевания во время эндокринотерапии оказалось выше в группе "тамоксифен" (10% против 3.4%, P=0.076) [табл. 4]. Важным критерием эффективности неоадъювантного лечения оказалась частота выполнения органосохраняющих операций у больных, которым до неоадъювантной эндокринотерапии планировалась радикальная мастэктомия. После завершения предоперационного лечения органосохраняющие операции (сегментарная резекция, квадрантэктомия + подмышечная диссекция) выполнены у 31,6% больных, получавших лечение экземестаном, и у 13.3% больных, леченных тамоксифеном (Р=0.048).
Таблица 3. Клиническая оценка величины ответа опухоли на неоадъювантную эндокринотерапию экземестаном (аромазином) против тамоксифена у постменопаузальных больных РМЖ с ЭР+/ПР+ опухолями (НИИ онкологии им. проф. Н.Н.Петрова, 1997-2004)
В настоящее время объективная оценка по единым критериям лечебных и побочных эффектов лекарственной терапии у больных злокачественными опухолями является обязательным условием лечения, проведения клинических испытаний новых препаратов или их комбинаций, а также сравнения результатов лечения в различных медицинских учреждениях.
Необходимо отметить, что с точки зрения оценки эффективности лечения в цепом предпочтение отдается не критериям непосредственной эффективности, а показателям выживаемости и качества жизни.
Тем не менее, на начальных этапах исследования противоопухолевой активности непосредственный эффект играет очень важную роль.
Принципы и методология оценки эффективности лекарственной терапии у больных солидными опухолями отражены в рекомендациях ВОЗ и в опубликованных в 2000 г. новых единых подходах — RECIST [Response Evaluation Criteria In Solid Tumors]. В настоящее время при проведении международных, кооперированных, рандомизированных исследований по оценке эффективности новых лекарственных средств используются критерии RECIST, в клинической практике — критерии ВОЗ.
В цепом для обеих схем характерны общие методологические подходы. Оценка эффективности лечения предусматривает изучение динамики размеров опухолевых очагов, частоты и продолжительности общего объективного терапевтического ответа, изучение динамики лабораторных показателей и биологических маркеров как критериев прогрессирования заболевания и выживаемость больных.
Кроме того, дополнительно оцениваются частота и степень выраженности побочных эффектов, а также качество жизни больных. Оптимальным сроком после окончания курса лечения цитостатиками, необходимым для определения вышеперечисленных критериев, считают 4 недели.
Очевидно, что своевременная объективная оценка противоопухолевого действия химиопрепаратов дает основание либо изменить программу лечения, либо прекратить химиотерапию при ее неэффективности.
Оценка опухолевых очагов
Оценка опухолевых очагов осуществляется перед началом терапии на основании данных осмотра и результатов проведенных исследований. В связи с этим, все опухолевые очаги делятся на измеримые (величина может быть определена хотя бы в одном измерении) и неизмеримые, но оцениваемые: метастазы в кости и лимфоузлы, асцит, плевральный выпот, диффузная форма рака молочной железе и т д.
Оценка в динамике измеримых и неизмеримых опухолей проводится по данным тех же исследований, что и перед началом терапии. Все измерения выполняются при помощи линейки или циркуля.
Размеры опухоли определяются как произведение длины максимального диаметра и диаметра ему перпендикулярного и обозначаются в см2 (мм2) или могут определяться измерением только одного, наибольшего диаметра.
Неизмеримые оцениваются по количеству выпота, метастатических очагов и т.д. Непосредственный (объективный) эффект оценивается на основании изменений размеров и в зависимости от степени регресса опухолевых очагов может соответствовать следующим категориям: полная регрессия, частичная регрессия, стабилизация и прогрессирование заболевания (табл. 9.9).
Таблица 9.9. Критерии оценки результатов лекарственного лечения новообразований. 
Оценка эффективности лечения
Оценка эффективности лечения производится на основании оценки изменений опухолевых очагов после проведенного лечения. Основным критерием оценки противоопухолевой терапии, при которой лечение считается эффективным, является общий объективный ответ.
Он включает все случаи полной и частичной регрессии опухолей (ПР+ЧР), подтвержденные при двух последовательных осмотрах, выполненных с интервалом не менее четырех недель. Дополнительно учитывается лечебный эффект, включающий, кроме полной и частичной регрессии, стабилизацию процесса (ПР+ЧР+Ст).
Пациент отвечает на вопросы, после чего полученные данные анализируются в динамике по специально разработанным методикам. Стандартными опросниками в онкологической практике являются: FAGT — для функциональной оценки противоопухолевой терапии; EORTC QLQ — С3О — опросник Европейской организации исследований и лечения рака (содержит 30 вопросов, 5 параметров и параметры общего качества жизни); CARES-SF — система оценки реабилитации онкологических больных (59 вопросов, 5 параметров и параметры общего качества жизни).
Оценка побочных эффектов
Об эффективности лекарственной терапии позволяют судить также степень и частота побочных эффектов. Безопасность лекарственной терапии оценивается на основании регистрации побочных реакций, изменений лабораторных тестов и жизненно важных показателей.
Выявление и оценка побочных эффектов осуществляется в сравнении с исходными данными при каждом осмотре пациента, как во время, так и после завершения терапии и прослеживаются до их разрешения, либо возвращения к исходному уровню.
К побочным реакциям относят любое изменение (по отношению к исходным данным) в самочувствии или состоянии пациента, включая клинически значимые отклонения от нормы лабораторных и функциональных показателей, массы тела, которые могут и не иметь причинно-следственной связи с проводимым лечением.
В группу побочных эффектов относят также обострение существующего хронического заболевания или рецидив отмечавшегося ранее заболевания: значительное или неожиданное ухудшение течения основного заболевания; подозрение на взаимодействие с другими препаратами; интеркуррентные заболевания; клинически значимые отклонения лабораторных показателей.
Оценка побочных эффектов включает также выявление характера взаимосвязи вышеперечисленных факторов с лекарственной терапией (связь отсутствует, маловероятна, возможна, вероятна, высоко вероятна) и определение степени их выраженности (табл 9.10). Частота возникновения побочных эффектов является основным критерием безопасности лечения.
Таблица 9.10. Степень выраженности побочных эффектов [NCI Common Toxicity Criteria v. 2]. 
Угляница К.Н., Луд Н.Г., Угляница Н.К.
III РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
НЕОАДЪЮВАНТНОЕ ЛЕЧЕНИЕ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ.
Э.К. Возный, Н.Ю. Добровольская, С.Н. Гуров, С.А. Большакова.
Научно-исследовательский центр рентгенорадиологии МЗ РФ, Москва
Более 100 лет тому назад родилась концепция радикализма в лечении опухолевых заболеваний. Впервые об этом упоминает William Holsted, когда описывает метод удаления молочной железы, впоследствии названный его именем. Он считал, что рак молочной железы является локо-региональным заболеванием, поэтому радикальное хирургическое вмешательство может способствовать удалению всех опухолевых клеток и "излечению" больного.
На протяжении всего ХХ века с помощью открытий в области физики, химии, биологии и других фундаментальных наук, мы все больше проникаем в механизмы функционирования опухолевых клеток, их распространения в организме, выявления факторов, влияющих на эти процессы.
При изучении процессов метастазирования было показано, что отдаленные микрометастазы могут присутствовать у 30%-90% пациентов с первичным раком молочной железы (РМЖ), даже на ранних его стадиях.
Все эти открытия способствовали развитию системных методов воздействия на злокачественный процесс с целью элиминации отдаленных опухолевых отсевов и, таким образом, достижения максимального радикализма в лечении. Полученные позитивные результаты позволили рекомендовать химиотерапию как дополнительное лечение после радикальных операций, для профилактики развития отдаленных метастазов и местных рецидивов.
Этому способствовали результаты преклинических исследований доктора B. Fisher и его коллег, которые показали, что удаление первичного очага повышает скорость роста метастазов. Как оказалось это происходит за счет стимуляции влияния сывороточного фактора роста на опухолевые клетки. В это же время в опытах in vivo было продемонстрировано, что введение циклофосфана или тамоксифена предотвращает это воздействие, и чем раньше начата адъювантная терапия, тем лучше результаты лечения.
Совсем недавно вошла в практику неоадъювантная (первичная, индукционная) химиотерапия. Первоначально ее применение ограничивалось местно-распространенными неоперабельными формами РМЖ, но по мере накопления и анализа клинических данных она стала использоваться и при операбельных формах заболевания.
Какие же цели ставят перед собой врачи проводя неоадъювантную химиотерапию?
- уменьшение объема первичной опухоли;
- уменьшение размеров и количества пораженных лимфатических узлов;
- увеличение числа консервативных хирургических вмешательств;
- элиминация отдаленных микрометастазов;
- увеличение безрецидивной и общей выживаемости;
- изучение факторов прогноза (патоморфоза опухоли, индекса апоптоза, Bcl-2; Ki-67) и в зависимости от этого планирование адъювантного лечения.
При проведении неоадъювантной химиотерапии мы имеем возможность in vivo оценить ее эффективность и, соответственно, при отсутствии ответа опухоли на проводимую терапию применить альтернативные схемы. Первичная опухоль является неспецифическим индикатором ответа микрометастазов на проведение предоперационного лечения. В некоторых работах получены данные о корреляции ответа первичной опухоли, отдаленных микрометастазов и выживаемости больных.
В данной ситуации мы можем термин адъювантная заменить на "слепая" терапия, так как все видимые проявления заболевания уже убраны и у нас отсутствует возможность оценивать эффективность лечения и, соответственно, изменять его, при необходимости.
Конечно же, исследователей интересуют и факторы прогноза при проведении предоперационной терапии, чтобы основываясь на них строить дальнейшую стратегию лечения.
В исследованиях Royal Marsden (количество больных=185), в работах Миланской и Эдинбургской групп было показано, что наиболее важными прогностическими факторами безрецидивной и общей выживаемости является объективный ответ опухоли на лечение и статус аксиллярных лимфатических узлов после проведенной терапии. В тех случаях, когда мы достигаем полного клинического и патоморфологического эффекта в опухоли и аксилярных лимфатических узлах, получены и наилучшие отдаленные результаты. В работах Эдинбургской группы получены интересные данные: 10-тилетняя выживаемость пациентов с отсутствием пораженных лимфатических узлов при патоморфологическом исследовании составляет 90%, при метастатической инвазии 1-3 лимфатических узлов - 52% и при инвазии 4-9 лимфатических узла - 18%.
Нам кажется, что здесь важно упомянуть о значении патоморфоза опухоли. В определенной степени он связан с уровнем объективного ответа и, следовательно, является одним из слагаемых, влияющих на выживаемость пациентов. Степень патоморфоза можно считать индикатором ответа опухоли на лечение, что также помогает врачам в выборе дальнейшей тактики лечения. Так, например, при 0-I степени патоморфоза опухоли, возможно, следует применить какие-то альтернативные схемы химиотерапии при проведении адъювантного лечения.
Работа по оценке значения неоадъювантного лечения проведена в нашем институте. До сих пор еще остается спорным вопрос о количестве курсов предоперационной химиотерапии. Для нас было важным выяснить, какое количество курсов необходимо провести, чтобы получить наибольший эффект и выяснить как влияют полученные результаты на эффективность лекарственной терапии, какова взаимосвязь объективного эффекта и степени лекарственного патоморфоза. В исследование включена группа в количестве 89 человек, получавших неоадъювантную химиотерапию по схеме CAF. Максимальное число курсов было 6, но так как количество больных с каждым разом уменьшалось, то мы оценили только 4 курса. В таблице 1 представлены результаты неоадъювантной химиотерапии в зависимости от количества курсов.
Таблица 1.
Влияние количества курсов неоадъювантной химиотерапии на эффективность лечения.
| Количество курсов | 2 | 3 | 4 |
| Число больных | 89 | 47 | 29 |
| Общий эффект (ПР+ЧР) | 47 (52,8%) | 29 (32,5%) | 14 (15,7%) |
| Полная регрессия | 17 (19,1%) | 9 (10,1%) | 6(6,7%) |
| Частичная регрессия | 30(33,7%) | 20 (22,4%) | 8 (8,9%) |
| Стабилизация | 41(46,0%) | 18 (20,2%) | 15 (16,8%) |
| Прогрессирование | 1 (1,1%) | - | - |
При анализе полученных результатов видно, что после двух курсов химиотерапии полный эффект зарегистрирован у 17 (19,1%) больных, после трех курсов он проявился еще у 9 (10,1%), а после проведения четырех курсов - у 6 (6,7%) пациентов, таким образом была выявлена группа пациенток, чувствительных к лекарственному лечению. Общий эффект после проведения всех 4 курсов химиотерапии составил - 35,9%.
В нашей работе была проанализирована зависимость степени лекарственного патоморфоза от количества курсов. Стабилизация заболевания после 2 курсов терапии была получена у 41 (46,0%) больной, после радикального хирургического лечения выявлен патоморфоз I и II степени у 18 (20,2%) и 23 (25,8%) пациенток, соответственно. Далее 47 женщинам был проведен 3курс лечения, у 18 (20,2%) из них не отмечено нарастания эффекта, поэтому им был проведен 2 этап лечения - хирургический. Патоморфоз I степени проявился у 1 (1,1%), II степени - у 9 (10,1%), III степени - у 7 (7,8%), IV степени - у 1 (1,1%) пациентки.
После 4 курсов химиотерапии у 29 больных была выполнена мастэктомия, в этой группе также был прослежен патоморфоз: II степени - у 3 (3,3%), III степени - у 11 (12,3%), IV степени - у 1 (1,1%). Итак можно сделать вывод, что при нарастании объективного эффекта лечения увеличивается и количество больных с более высокой степенью лекарственного патоморфоза.
В таблице 2 представлены данные влияния количества проведенных курсов неоадъювантной химиотерапии на общую и безрецидивную выживаемость.
Таблица 2.
Влияние количества курсов на общую и безрецидивную выживаемость.
| Количество курсов | 2 | 3 | 4 |
| Число больных | 89 | 47 | 29 |
| Общая выживаемость: | |||
|---|---|---|---|
| 3 года | 88,6 +/- 8,5% | 89,0 +/- 6,5% | 90,0 +/- 1,7% |
| 5 лет | 51,1 +/- 9,9% | 54,0 +\- 7,3% | 57,7 +/- 7,3% |
| 10 лет | 33,0 +/- 13,0% | 39,6 +/- 9,8% | 37,5 +/- 11,3% |
| Безрецидивная выживаемость | |||
| 3 года | 87,6 +/- 6,2% | 88,0 +/- 6,5% | 90,0 +/- 2,7% |
| 5 лет | 44,2 +/- 6,7% | 45,0 +/- 7,3% | 46,7 +/- 7,3% |
| 10 лет | 25,0 +/- 11,8% | 29,6 +/- 9,8% | 28,5 +/- 1,3% |
При анализе общей выживаемости трехлетние результаты практически не отличаются во всех трех группах, при пятилетнем сроке наблюдения отмечается незначительное увеличение выживаемости у больных с 4 курсами химиотерапии, при десятилетнем сроке наблюдения прослеживается нарастание увеличения общей выживаемости от курса к курсу, если после 3 курсов она составила 33%, то после 4 курсов - 37,5% (р=0,023).
При сравнении безрецидивной выживаемости можно также констатировать зависимость ее продолжительности от количества проведенных курсов лекарственной терапии, здесь также получены статистически достоверные результаты (р=0,032).
Из всего вышесказанного можно сделать вывод, что увеличение количества курсов неоадъювантной химиотерапии в группе больных с нарастанием объективного эффекта лечения и, соответственно, степени лекарственного патоморфоза способствует увеличению общей и безрецидивной выживаемости.
Важными факторами прогноза ответа опухоли на лечение являются следующие биологические параметры - индекс апоптоза (АИ), индекс пролиферации (Ki-67), и Bcl-2 (экспрессия белков). Работа по оценке биологических параметров ответа опухоли на лечение была также проведена в госпитале Royal Marsden. Полученные результаты подтверждают гипотезу о том, что апоптоз и пролиферация клеток зависимы друг от друга: снижение уровня апоптоза и пролиферации при повышении значения Bcl-2можно трактовать как появление резистентности клеток рака молочной железы к цитостатикам. В этом же исследовании проводили сравнение значений индекса апоптоза до и через 24 часа после проведения химиотерапии. Если эти результаты подтвердятся при проведении большого рандомизированного исследования, то мы получим уникальную возможность прогнозирования ответа опухоли на проводимое системное лечение сразу же после его начала, что даст нам возможность скорректировать план и схемы терапии.
Переходя от факторов прогноза к причинам, побудившим ученых начать рандомизированные исследования по изучению роли индукционной химио и гормональной терапии, следует отметить, что в работах на животных, перед хирургическим вмешательством проводилась системная терапия цитостатиками и тамоксифеном. Результатом данной работы стало увеличение общей выживаемости. Предположили, что удлинение продолжительности жизни явилось следствием уменьшения опухолевой диссеминации во время операции. Успех более раннего проведения системной терапии согласуется с гипотезой Goldie-Goldman, которая обосновывает необходимость более раннего воздействия на метастазы, учитывая возможность образования химиорезистентных мутантных клеток.
Интерес представляют данные одного из основополагающих исследований В-18, проведенное по эгидой NSABP (National Surgical Adjuvant Breast and Bowel Project), целью которого было сравнить безрецидивный промежуток и выживаемость в группах с неоадъювантной и адъювантной химиотерапией. Также перед учеными стояла задача определить насколько уменьшение размеров первичной опухоли или пальпируемых лимфатических узлов коррелирует с удлинением безрецидивной и общей выживаемости, а также насколько такой подход к лечению способствует увеличению уровня консервативных хирургических вмешательств.
В исследование было включено 1523 пациентки с первично-операбельными формами РМЖ и ожидаемой продолжительностью жизни - 10 лет. Набор больных производился в течение 5 лет с 1988 по 1993 годы. Для проведения химиотерапии как в неоадъювантном, так и в адъювантном режимах была выбрана схема АС (доксорубицин 60мг/кв.м и циклофосфан 600мг/кв.м) каждые 3 недели, всего планировалось провести 4 курса . Все женщины старше 50 лет принимали тамоксифен в дозе 20мг в день. Лучевую терапию начинали в течение 4 недель после проведения консервативной операции в группе с предоперационной химиотерапией (1), в группе в адъювантной химиотерапией (2) лучевая терапия проводилась в течение 4 недель после её окончания.
В первую группу было набрано 747, во первую -759 пациенток. Объективный эффект получен у 80% больных, полная регрессия опухоли (ПР) - у 36%, патоморфологическая полная регрессия (ППР) - у 26%. Уменьшение размеров лимфатических узлов отмечено у 89%, при этом ПР получена у 73% женщин. Количество консервативных хирургических вмешательств в первой группе увеличилось на 12% от планируемого уровня, при этом следует отметить, что у пациенток с размером опухоли > 5,1см - число органосохраняющих операций увеличилось до 175%.
Оценивая результаты этого исследования можно сказать, что наиболее важными факторами, влияющими на выбор тактики хирургического вмешательства является размер опухоли и статус лимфатических узлов. Чаще всего такой объем операции предполагалось выполнить пациенткам без поражения лимфатических узлов, возраст в данной ситуации не играл роли.
При анализе данных по безрецидивной и общей выживаемости в этих двух группах выяснилось, что значительных различий по этим двум параметрам в течение 5 лет наблюдения получено не было. В первой группе безрецидивная выживаемость составила 67,3% и 66,7%, соответственно, во второй. Также значительных различий не было получено при сравнении результатов отдаленной безрецидивной выживаемости - 73,2% и 73,3%, соответственно.
Конечно же, многих интересует вопрос об уровне местных рецидивов. За время наблюдения процент локо-региональных рецидивов составил 5,8% в послеоперационной группе и 7,9% в предоперационной группе. При этом полученные различия недостоверны.
Оказалось, что в развитии местных рецидивов наиболее значимую роль играет возраст (р 49 лет), то есть там, где женщины принимали тамоксифен. Аналогичные данные получены и в других работах. Поэтому одним из перспективных направлений в развитии стратегии неоадъювантной терапии является внедрение различных эндокринных препаратов. Например, в Великобритании уже начато рандомизированное исследование, где больные набираются в 3 группы, в одной пациентам предлагается прием только тамоксифена, в другой - аримидекса, в третьей - комбинации тамоксифен + аримидекс. Его целью является определить клинические и/или биологические различия (уровень пролиферации) при трех методах лечения.
Подводя итоги проведенных клинических исследований, мы можем сказать, что неоадъювантная химиотерапия может способствовать уменьшению размеров первичной опухоли, размеров и количества пораженных лимфатических узлов, что дает нам возможность увеличить число выполняемых органосохраняющих операций. Кроме того, она позволяет элиминировать отдаленные микрометастазы и помогает спланировать адъювантное лечение в зависимости от полученного патоморфоза опухоли и таких факторов прогноза, как экспрессия Bcl-2, индекса апоптоза и индекса пролиферации опухолевых клеток - Ki-67.
Единственным контраргументом для проведения предоперационной химиотерапии является проблема местного контроля за заболеванием. Исследования, в которых пациентам проводилось хирургическое лечение и лучевая терапия показали, что риск развития местного рецидива возрастает при увеличении объема пораженных тканей. Например, выявлено, что иногда две разные формы опухоли - внутрипротоковый рак и инвазивный рак могут занимать одинаковые объемы в молочной железе при обследовании на предоперационном этапе, хотя, обычно, внутрипротоковый рак имеет значительно меньшие размеры. Существует опасность, что какое-то число опухолевых клеток может оказаться за границей резекции. Весь вопрос в том, сколько их осталось в молочной железе? На данном этапе ответом могут служить данные, полученные при микроскопическом изучении краев резекции.
Во Франции, была проведена работа, где в одной группе на первом этапе лечения проводилась химиотерапия и лучевая терапия с последующей туморэктомией (она выполнена 47 пациенткам с остаточной опухолью Поделиться |
Читайте также:

