Нейроэндокринная карцинома легкого гистология
Карциномы легкого чаще развиваются в области ворот легких. Около 75% поражений локализуются в бронхах 1, 2 и 3-го порядка. Все большее количество первичных карцином легкого возникает на периферии легких в альвеолярных стенках или в терминальных бронхиолах. Это преимущественно аденокарциномы, в т.ч. бронхиолоальвеолярные.
Инвазивной плоскоклеточной карциноме, как правило, сопутствуют предраковые поражения. Плоскоклеточной карциноме часто предшествует плоскоклеточная метаплазия или дисплазия эпителия бронхов, которая затем прогрессирует в карциному in situ. Карцинома in situ может находиться в стабильном состоянии несколько лет. К этому времени атипические клетки уже можно определить цитологически в мокроте, бронхиальных смывах и скарификатах, хотя опухоль может быть еще бессимптомной и не обнаруживаться на рентгенограмме.
Симптомы появляются, когда опухолевая ткань перекрывает просветы крупных бронхов, что часто осложняется дистальным ателектазом и инфекцией. Затем развитие опухоли идет по одному из двух путей: она может продолжить свой рост в просвете бронха и образовать грибовидную эндобронхиальную опухоль либо прорастать в стенки бронха, инфильтрируя перибронхиальную ткань вплоть до бифуркации трахеи или средостения. В других случаях опухоль растет широким фронтом вглубь легочной паренхимы, смещая ткань легких кпереди.
Почти во всех вариантах рака легкого опухолевая ткань имеет серо-белый цвет и плотную консистенцию. В ткани, особенно в случае крупной опухоли, обнаруживаются участки красного или желто-белого цвета в виде пятен и очагов размягчения, возникающие в результате кровоизлияний и некроза. Иногда очаги некроза подвергаются кавитации. Часто такая опухоль разрушает эпителий бронхов.
Карциному легкого диагностируют с помощью цитологического исследования мокроты, бронхоальвеолярного лаважа или тонкоигольной аспирационной биопсии.
Злокачественный процесс может распространиться в плевру, а затем в плевральную полость или перикард. В большинстве случаев обнаруживаются метастазы в трахеальные лимфоузлы, бронхиальные лимфоузлы и лимфоузлы средостения. Частота поражения лимфоузлов в среднем составляет более 50% и мало зависит от гистологического типа плоскоклеточного рака.
Распространение карциномы легкого происходит как по лимфатическим, так и по кровеносным сосудам. Обычно эти опухоли быстро распространяются по всему организму. Исключение составляет плоскоклеточная карцинома, которая метастазирует за пределы грудной полости достаточно поздно. Метастазы могут быть первым проявлением оккультного (скрытого) рака легкого и поражать любой орган или ткань: надпочечники (по непонятным причинам являются мишенью метастазов более чем в 50% случаев), печень (30—50%), головной мозг (20%) и кости (20%).
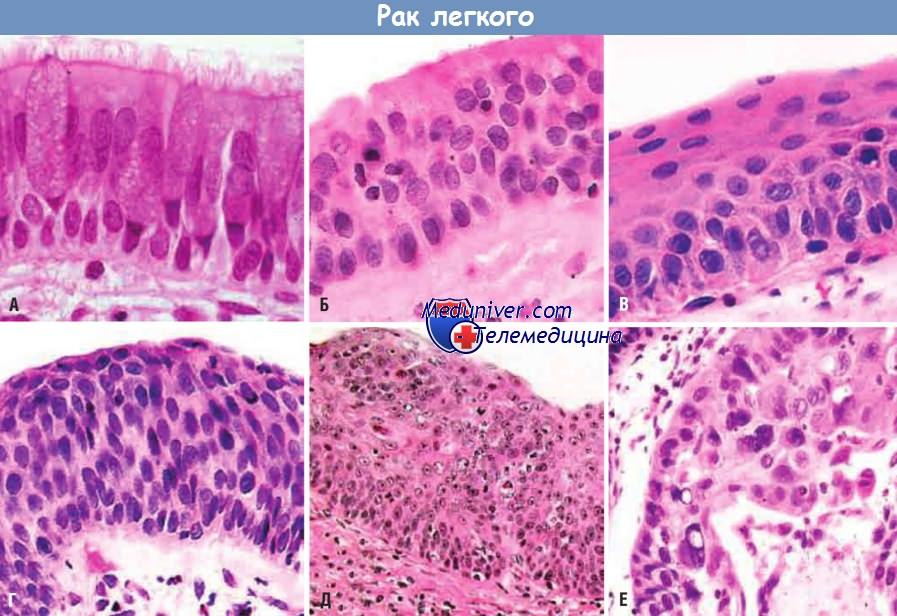
К ранним предраковым изменениям, предшествующим развитию плоскоклеточной карциномы легкого у курящих лиц,
относятся гиперплазия бокаловидных клеток (А), базально-клеточная (или резервно-клеточная) гиперплазия (Б) и плоскоклеточная метаплазия (В).
К более серьезным изменениям относится плоскоклеточная дисплазия (Г),
характеризующаяся наличием дезорганизованного эпителия с потерей полярности клеточных ядер, полиморфизмом, гиперхромией и наличием фигур митоза.
Плоскоклеточная дисплазия проходит стадии легкой, умеренной и выраженной дисплазии.
Карцинома in situ (Д) — это злокачественная опухоль, которая непосредственно предшествует инвазивной плоскоклеточной карциноме (Е)
и отличается от нее отсутствием разрушения базальной мембраны, хотя имеет те же цитологические признаки, что и инвазивная карцинома,
и без лечения будет прогрессировать до нее.
а) Аденокарцинома — это злокачественная эпителиальная опухоль с железистой дифференцировкой или продукцией слизи опухолевыми клетками, образующими различные структуры. Аденокарциномы подразделяют на ацинарные, папиллярные, бронхиолоальвеолярные и солидные с образованием слизи. Из них только бронхиолоальвеолярная аденокарцинома имеет четкие макроскопические, микроскопические и клинические признаки и будет описана отдельно.
Аденокарцинома — наиболее распространенный тип рака легкого среди женщин и среди всех некурящих. Как правило, аденокарцинома локализуется в периферических отделах легких и имеет меньшие по сравнению с плоскоклеточным раком размеры. Гистологическое строение аденокарцином вариабельно: от хорошо дифференцированной опухоли с явными элементами железистой дифференцировки, формирования папиллярных структур, напоминающих таковые у других папиллярных карцином, до солидных опухолей с незначительным количеством муцинпродуцирующих желез и клеток.
Большинство аденокарцином экспрессируют тиреоидный фактор транскрипции 1, а — 80% опухолей содержат муцин. В периферических отделах легкого часто развивается бронхиолоальвеолярная карцинома. Аденокарциномы растут медленнее, чем плоскоклеточные карциномы, но, как правило, ме-тастазируют раньше и более широко. Периферические аденокарциномы вокруг зоны фиброза с небольшим центральным инвазивным компонентом, как правило, являются бронхиолоальвеолярными и прогностически более благоприятны по сравнению с другими инвазивными карциномами того же размера. Аденокарциномы, в т.ч. бронхиолоальвеолярные, не так часто ассоциируются с курением (около 80% опухолей наблюдаются у курящих лиц) по сравнению с плоскоклеточной или мелкоклеточной карциномами (> 98% больных курят).
Мутации KRAS наблюдаются в основном при аденокарциноме и значительно реже обнаруживаются у некурящих (5%), чем у курящих лиц (30%). Мутации и инактивация генов р53, RB1, р16 имеют одинаковую частоту как при аденокарциноме, так и при плоскоклеточной карциноме. У пациентов с аденокарциномой обнаруживают мутации и амплификации гена ECFR, в основном у некурящих женщин азиатского происхождения. Результаты проспективного исследования показали, что у пациентов с мутацией ECFR после лечения ингибитором EGFR выживаемость увеличилась. Мутации KRAS коррелируют с плохим прогнозом из-за резистентности к ингибитору EGFR. Кроме того, при раке легкого может подвергаться амплификации или мутировать ген с-МЕТ (другой объект таргетной терапии рака легкого).
Бронхиолоальвеолярная карцинома развивается в терминальных участках легочной паренхимы и составляет, по данным разных авторов, от 1 до 9% всех случаев рака легкого. Макроскопически опухоль почти всегда локализуется в периферических отделах легких в виде одного или нескольких (чаще) диффузно расположенных узлов, которые иногда сливаются с образованием пневмониоподобного участка уплотнения. Паренхиматозные узелки серо-белого цвета и плотной консистенции имеют муцинозный вид в случае секреторной активности злокачественной опухоли и могут быть приняты при макроскопическом исследовании за очаги пневмонии.
Гистологически опухоль характеризуется ростом по стенкам альвеол и бронхиол без признаков стромальной, сосудистой или плевральной инвазии. Характерной особенностью бронхиолоальвеолярных карцином является их рост вдоль уже существующих структур без разрушения альвеол. Такой тип опухолевого роста был назван стелющимся. Бронхиолоальвеолярная карцинома может быть немуцинозной или муцинозной. В обоих случаях злокачественная опухоль состоит из цилиндрических, стержнеобразных и кубических клеток, растущих вдоль альвеолярных стенок, однако во втором случае есть цитоплазматические и внутриальвеолярные скопления муцина. Ультраструктурно бронхиолоальвеолярные карциномы представляют собой гетерогенную группу, состоящую из муцинсекретирующих клеток, клеток Клара и пневмоцитов II типа (реже).
Немуцинозная бронхиолоальвеолярная карцинома легкого распространяется только по дыхательным путям и часто представляет собой периферический узел, резекция которого обеспечивает высокую 5-летнюю выживаемость. Муцинозная бронхиолоальвеолярная карцинома имеет тенденцию к распространению по дыхательным путям с образованием одного опухолевого узла или множественных узлов, которые, сливаясь, могут занимать всю долю легкого, как и долевая пневмония, поэтому хирургическое излечение такой опухоли менее вероятно.
Предполагают, что аденокарцинома легкого проходит те же стадии развития, что и аденокарцинома толстой кишки: атипическая аденоматозная гиперплазия прогрессирует до бронхиолоальвеолярной карциномы, которая затем трансформируется в инвазивную аденокарциному. Это подтверждается тем фактом, что атипическая аденоматозная гиперплазия является моноклональной и имеет многие молекулярные аберрации, например мутации ECFR, характерные для немуцинозной бронхиолоальвеолярной карциномы и инвазивных аденокарцином. Микроскопически атипическая аденоматозная гиперплазия — это хорошо очерченный очаг из пролиферирующего кубического и низкого цилиндрического эпителия. Эти клетки имеют некоторые признаки атипии, но не такой степени, как опухолевые клетки аденокарциномы.
Следует, однако, отметить, что не все аденокарциномы развиваются в соответствии с описанным механизмом и не всегда бронхиолоальвеолярные карциномы без лечения становятся инвазивными.

Карцинома легкого. Большая серовато-белая опухоль инфильтрирует ткань легкого.
Гистологически это плоскоклеточная карцинома.
В прошлом большинство случаев плоскоклеточной карциномы были связаны с центральной локализацией и развитием опухоли из сегментарных или субсегментарных бронхов, в настоящее время все больше наблюдений периферической плоскоклеточной карциномы легкого. Плоскоклеточную метаплазию и дисплазию, а также очаги карциномы in situ можно увидеть в бронхиальном эпителии, прилегающем к опухолевой массе.
Плоскоклеточная карцинома характеризуется самой высокой частотой мутаций р53 среди всех гистологических типов карциномы легкого. Усиление экспрессии белка р53 и, реже, мутации гена р53 могут предшествовать метастазированию. Накопление в клетках белка р53 описано в 10-50% случаев дисплазий. При иммуногистохимическом исследовании в очагах дисплазии высокой степени и карциномы in situ в 60-90% случаев выявляется увеличение частоты и интенсивности накопления белка р53. По данным иммуногистохимических исследований в 15% случаев плоскоклеточной карциномы обнаруживают потерю экспрессии белка гена-супрессора опухолей RB1. Инактивация ингибитора циклин-зависимой киназы гена pl16/INK4a приводит к потере его белкового продукта в 65% опухолей.
При плоскоклеточной карциноме в локусах, несущих гены-супрессоры опухолей, наблюдается утрата многих аллелей. Утраты в локусах, особенно на хромосомах 3р, 9р и 17р, обнаруживаются в гистологически нормальных клетках бронхиального эпителия у курящих лиц и могут предшествовать метастазированию. В 80% случаев плоскоклеточной карциномы была обнаружена избыточная экспрессия EGFR, но мутация ECFR происходит редко. В 30% этих видов рака отмечается высокая экспрессия HER2/NEU, но в отличие от рака молочной железы экспрессия, как правило, не связана с амплификацией гена.
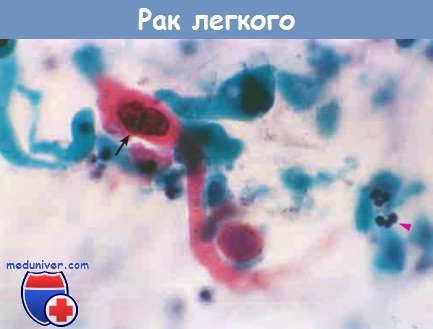
Цитологическое исследование при раке легкого.
В мазках мокроты видна клетка ороговевающей плоскоклеточной карциномы с крупным гиперхромным ядром (стрелка).
Обратите внимание на размер опухолевых клеток по сравнению с нормальными полиморфно-ядерными лейкоцитами (острие стрелки).
в) Мелкоклеточная карцинома. Эта опухоль состоит из клеток характерного вида: клетки имеют относительно небольшие размеры, узкий ободок цитоплазмы, плохо определяемые границы, мелкогранулированный ядерный хроматин, ядрышки могут отсутствовать или быть незаметными. Клетки круглые, овальные или веретенообразные, с относительно выраженными ядрами. Не существует критериев абсолютных размеров опухолевых клеток, в целом клетки меньше, чем диаметр трех малых лимфоцитов. Митотическая активность ядер высокая, они образуют кластеры и не имеют признаков ни железистой, ни плоскоклеточной дифференцировки. Часто развивается обширный некроз. Сосудистые стенки нередко базофильно окрашены вследствие накопления в них ДНК, высвобождающейся из некротизированных опухолевых клеток (эффект Аццопарди).
Все мелкоклеточные карциномы относят к карциномам высокой степени злокачественности. Отдельно выделяют комбинированную мелкоклеточную карциному: сочетание мелкоклеточной карциномы с немелкоклеточной карциномой, в т.ч. с крупноклеточной нейроэндокринной карциномой и саркомой.
Электронная микроскопия в 65% случаев позволяет выявлять в цитоплазме опухолевых клеток нейросекреторные гранулы с плотной сердцевиной (100 нм в диаметре). Гранулы аналогичны тем, которые содержатся в нейроэндокринных клетках, присутствующих среди эпителиальных клеток в стенках бронхов, особенно у плодов и новорожденных.
Установлена тесная связь мелкоклеточной карциномы с курением, лишь 1% случаев опухоль возникает у некурящих лиц. Мелкоклеточная карцинома может локализоваться в крупных бронхах или на периферии легких. Неизвестно, существует ли у мелкоклеточной карциномы легкого преинвазивная фаза— карцинома in situ. Мелкоклеточная карцинома — самая агрессивная опухоль легкого, которая характеризуется обширным метастазированием и практически не излечима хирургическим путем.
Часто в ткани опухоли обнаруживают мутации генов-супрессоров р53 и RB1 (50-80 и 80-100% соответственно). Иммуногистохимическое исследование демонстрирует высокий уровень экспрессии антиапоптотического белка BCL2 в 90% опухолей и низкий уровень экспрессии проапоптотического белка ВАХ.
г) Крупноклеточная карцинома. Это недифференцированная злокачественная эпителиальная опухоль, которая не имеет цитологических признаков мелкоклеточной, плоскоклеточной и железистой карцином. Клетки, как правило, имеют большие ядра, видимые ядрышки и умеренное количество цитоплазмы.
К крупноклеточной карциноме относят крайне низко дифференцированные плоскоклеточные карциномы и аденокарциномы, которые не удается диагностировать при световой микроскопии. Однако ультраструктурно минимальная железистая или плоскоклеточная диффе-ренцировка довольно распространена. Одним из гистологических типов крупноклеточной карциномы является крупноклеточная нейроэндокринная карцинома, при которой на уровне органелл образуются трабекулярные, розеткообразные и палисадные структуры. Эти особенности строения предполагают нейроэндокринную дифференцировку, которую можно подтвердить с помощью иммуногистохимического исследования или электронной микроскопии. Крупноклеточная нейроэндокринная карцинома имеет те же молекулярные изменения, что и мелкоклеточная карцинома.
д) Комбинированная карцинома. Встречается в 10% всех карцином легкого и характеризуется сочетанием двух или более из указанных ранее гистологических типов рака легкого.
Вторичные изменения. Карцинома легкого может вызвать анатомические изменения в легком дистальнее пораженного бронха. Частичная обструкция бронха опухолью может привести к значительной очаговой эмфиземе, а полная обструкция — стать причиной ателектаза. Нарушение дренажа дыхательных путей является частой причиной тяжелого гнойного или язвенного бронхита либо бронхоэктазов. Латентные карциномы иногда иногда могут манифестировать абсцессами легких. Сдавление или прорастание опухоли в верхнюю полую вену может индуцировать венозный застой и отек тканей головы и верхних конечностей и в результате — синдром верхней полой вены. Распространение рака в перикард и плевру может вызвать перикардит или плеврит с накоплением значительного количества экссудата.
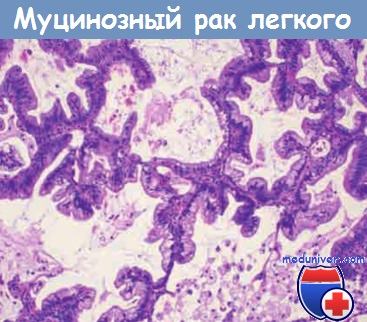
Муцинозная бронхиолоальвеолярная карцинома с характерным ростом клеток
вдоль альвеолярных стенок без признаков инвазии. 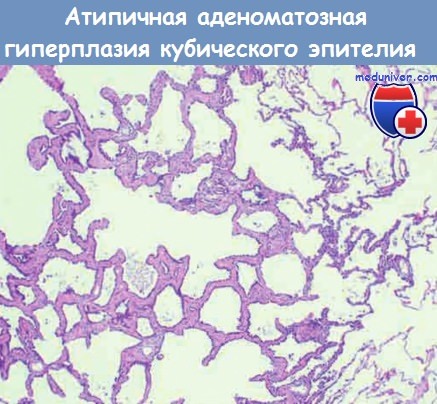
Атипическая аденоматозная гиперплазия кубического эпителия на фоне слабо выраженного интерстициального фиброза. 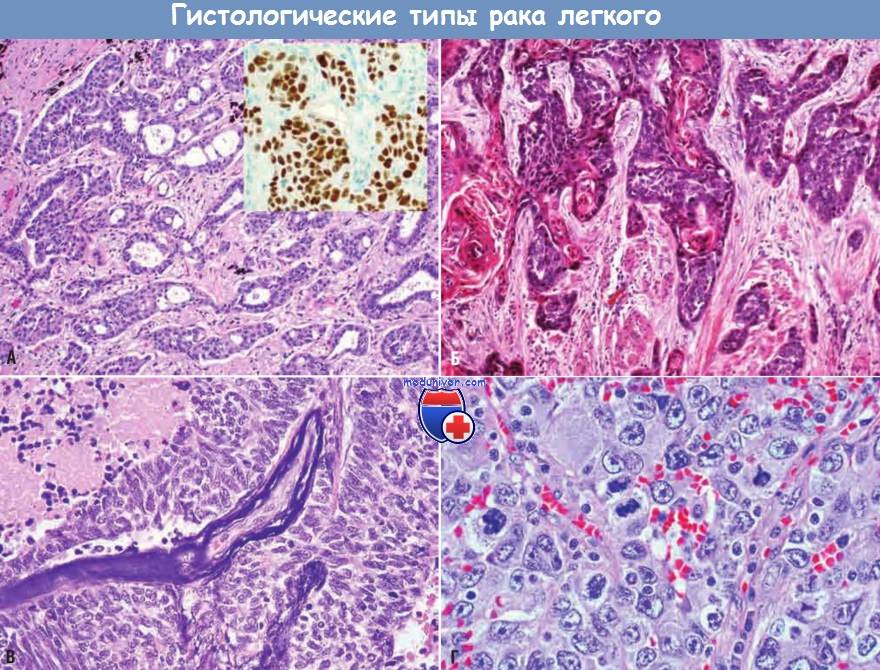
Гистологические типы карциномы легкого:
(А) Аденокарцинома с железистыми структурами и экспрессией тиреоидного фактора транскрипции 1 (врезка).
(Б) Высокодифференцированная ороговевающая плоскоклеточная карцинома.
(В) Мелкоклеточная карцинома из мелких базофильных опухолевых клеток с очагами некроза.
(Г) Крупноклеточная карцинома из плеоморфных анапластических опухолевых клеток без признаков плоскоклеточной или железистой дифференцировки.
- Рекомендуем ознакомиться со следующей статьей "Определение стадии рака легкого"
- Причины развития
- Особенности нейроэндокринных опухолей
- Классификация нейроэндокринных опухолей
- Виды нейроэндокринных опухолей и их симптоматика
- Диагностика заболевания
- Лечение
- Прогноз выживаемости
Нейроэндокринные опухоли (НЭО) образуются из апудоцитов, или APUD-клеток. Эти клетки разбросаны по всему организму и составляют самую древнюю часть эндокринной системы. Они одновременно похожи на нервные клетки и клетки желез внутренней секреции, так как могут реагировать на сигналы извне или изменения состояния организма, способны производить гормоны, выполняющие разные функции.
Опухоли APUD-системы встречаются редко, и их бывает сложно диагностировать. Чаще всего они возникают в желудочно-кишечном тракте, но могут поражать и другие органы. Особенность нейроэндокринных новообразований в том, что опухолевые клетки производят повышенное количество гормонов, и из-за этого могут возникать определенные симптомы.
Согласно данным американского реестра SEER, в 2004 году заболеваемость нейроэндокринными опухолями в США составила 5 случаев на 100 тысяч населения. В России статистика, к сожалению, отсутствует, но, вероятно, заболеваемость находится на аналогичном уровне.
По данным американских экспертов, распространенность нейроэндокринных опухолей ежегодно растет. В первую очередь это связывают с изменениями в характере питания, неблагоприятной экологической обстановкой.
По данным все того же реестра SEER, новообразования APUD-системы часто диагностируются на поздних стадиях: в 50% случаев опухоль успевает распространиться на окружающие ткани, в регионарные лимфоузлы, дать отдаленные метастазы.
Причины развития
У некоторых людей нейроэндокринные опухоли возникают в результате генетических заболеваний:
- Множественная эндокринная неоплазия (МЭН, MEN) вызвана мутацией в гене MEN, RET или CDKN1B. У больных может развиваться множество нейроэндокринных новообразований и опухолей в железах внутренней секреции. Некоторые из этих опухолей доброкачественные, некоторые — злокачественные. Выделяют четыре типа множественной эндокринной неоплазии: MEN1, MEN2A, MEN2B и MEN4. При MEN1 чаще всего возникают нейроэндокринные опухоли в паращитовидных железах, поджелудочной железе, гипофизе, иногда в пищеварительном тракте и легких. У большинства пациентов с MEN2A и MEN2B обнаруживают медуллярные карциномы (разновидность опухоли щитовидной железы), в некоторых случаях — аденомы паращитовидных желез, феохромоцитому. При MEN4 чаще всего встречаются аденомы гипофиза и паращитовидных желез.
- Болезнь Гиппеля-Линдау возникает при мутации в гене VHL. У больных в разных частях тела развиваются кисты и опухоли. Среди этих опухолей встречаются нейроэндокринные, в том числе НЭО поджелудочной железы, феохромоцитома.
- Нейрофиброматоз I типа вызван мутацией в гене NF1. Некоторые люди получают эту мутацию от родителей, у других она возникает спонтанно. Основное проявление заболевания — множество доброкачественных новообразований нервов и кожи. Повышен риск развития опухолей APUD-системы в желудочно-кишечном тракте, поджелудочной железе, феохромоцитомы.
- Туберозный склероз приводит к возникновению доброкачественных новообразований в разных органах, включая кожу, глаза, головной мозг, сердце, легкие, почки. Повышен риск развития НЭО.
У людей, которые не являются носителями этих мутаций, нейроэндокринные новообразования тоже могут возникать. Причины до конца не известны. Многие исследования показали, что одним из важнейших факторов риска является наследственность. Если в семье есть люди, у которых была обнаружена нейроэндокринная опухоль, то у остальных членов риски тоже повышены, особенно у ближайших родственников больных (родителей, детей, сестер и братьев). Кроме того, риск опухолей APUD-системы повышен в семьях с отягощенным анамнезом по раку толстой кишки, молочной железы, легкого.
Известны и другие факторы риска, но их роль нельзя считать полностью доказанной:
- Курение может способствовать развитию нейроэндокринных опухолей в легких, желудке, тонкой кишке и поджелудочной железе.
- Хронический атрофический гастрит, как показали некоторые исследования, способствует развитию НЕО в желудке.
- Сахарный диабет связывают с возникновением новообразований APUD-системы в поджелудочной железе, желудке.
Ученые пока не могут сказать, повышаются ли риски при частом употреблении алкоголя, нездоровом питании (много животных жиров), у людей с лишним весом. Нужны дополнительные исследования.
Особенности нейроэндокринных опухолей
Нейроэндокринные клетки не привязаны к какому-либо конкретному органу. Они разбросаны по всему организму. Хотя опухоли чаще всего и возникают в пищеварительном тракте, в более редких случаях они обнаруживаются и в других местах. В 15% случаев найти первичную опухоль не удается.
Нейроэндокринные опухоли могут производить гормоны, которые вызывают в органах определенные эффекты, и из-за этого пациент испытывает те или иные симптомы. Такие новообразования называют функционирующими. Если гормоны не вырабатываются — это нефункционирующая опухоль.
Классификация нейроэндокринных опухолей
Существуют разные классификации нейроэндокринных опухолей. Ниже в таблице представлены основные группы:
Стадию нейроэндокринных опухолей определяют в соответствии с общепринятой системой TNM:
- T — размер первичной опухоли, ее прорастание в окружающие ткани.
- N — поражение регионарных (близлежащих по отношению к опухоли) лимфатических узлов.
- M — наличие отдаленных метастазов.
Классификация по стадиям различается в зависимости от того, в каком органе находится нейроэндокринное новообразование. Например, стадию опухоли APUD-системы в легком определяют так же, как для немелкоклеточного рака легкого. Для нейроэндокринных новообразований в желудке, тонкой кишке, червеобразном отростке, ободочной, прямой кишке и поджелудочной железе разработаны собственные системы классификации по стадиям.
Виды нейроэндокринных опухолей и их симптоматика
Так как существуют разные типы нейроэндокринных опухолей, и они могут находиться в разных органах, то и симптомы различаются. Можно выделить три основные группы проявлений. Первая — это общие симптомы, характерные для любого типа рака: слабость, повышенная утомляемость, снижение аппетита, потеря веса без видимой причины.

Вторая группа симптомов связана с локализацией опухоли и ее размерами, сдавлением анатомических структур и нарушением функции пораженного органа. Беспокоят боли в определенной части тела, тошнота, упорный хронический кашель, расстройства стула, мочеиспусканий, кровотечения, необычные выделения. При поражении печени, желчных протоков, поджелудочной железы развивается механическая желтуха.
Третья группа симптомов вызвана гормонами, которые продуцируют нейроэндокринные клетки:
- диарея — жидкий стул более трех раз в сутки;
- постоянная жажда, голод, частые мочеиспускания, — признаки повышения уровня глюкозы в крови;
- повышенная утомляемость, раздражительность, дрожь, головокружение, судороги, потери сознания — признаки снижения уровня глюкозы в крови;
- язвенная болезнь, которая не поддается лечению;
- тревожность;
- сыпь на коже.
Желудочно-кишечный тракт — наиболее распространенное место локализации нейроэндокринных опухолей. Такие новообразования часто называют карциноидными опухолями. Частота поражения разных отделов пищеварительного тракта:
- тонкая кишка — 39%;
- прямая кишка — 15%;
- червеобразный отросток (аппендикс) — 7%;
- толстая кишка — 5–7%;
- желудок — 2–4%.
Опухоли в пищеварительном тракте вызывают классический карциноидный синдром. Он проявляется в виде покраснения и ощущения тепла в области лица, диареей, одышкой, симптомами, напоминающими бронхиальную астму, слабостью, учащенным сердцебиением, увеличением веса без видимой причины, высоким артериальным давлением, его частыми колебаниями.
Вторым по частоте местом локализации опухолей APUD-системы после НЭО ЖКТ являются легкие. Примерно в 30% случаев нейроэндокринное новообразование возникает в бронхиальной системе.
Феохромоцитома — опухоль надпочечников (иногда в других частях тела), которая вырабатывает гормоны стресса: адреналин и норадреналин. В результате избыточного уровня гормонов возникают приступы (кризы), во время которых человек испытывает беспокойство, страх, озноб, дрожь, головную боль и боль в грудной клетке, его кожа становится бледной, учащается сердцебиение, возникают экстрасистолы, тошнота, рвота.
Рак из клеток Меркеля — злокачественная опухоль кожи. Она встречается очень редко, но отличается высокой агрессивностью, рано распространяется в лимфатические узлы, метастазирует. Патология проявляется в виде одного или нескольких узелков на коже красного и синюшного цвета. Они могут изъязвляться. Рак из клеток Меркеля сложно диагностировать, зачастую его выявляют уже на поздних стадиях.
Диагностика заболевания
В большинстве случаев нейроэндокринные новообразования обнаруживаются случайно, когда человек проходит обследование по другому поводу. Опухоль можно обнаружить с помощью таких методов диагностики, как:
- Ультразвуковое исследование.
- Эндоскопические исследования: гастроскопия, колоноскопия, бронхоскопия.
- Рентгенография с контрастным усилением. Перед исследованием пациенту дают выпить раствор, который помогает четко увидеть контуры желудка, кишечника.
Диагноз подтверждается с помощью биопсии. Обнаружив патологическое образование, врач удаляет из него фрагмент ткани и отправляет в лабораторию для исследования под микроскопом. Если опухоль предположительно является феохромоцитомой, к биопсии прибегают только в крайних случаях, так как она сопряжена с серьезными рисками.
Компьютерная томография и МРТ помогают обнаружить опухоль, оценить ее размеры, локализацию, степень распространения в организме, обнаружить метастатические очаги. Для поиска метастазов применяют ПЭТ-сканирование. Врач может назначить анализы, которые помогают обнаружить гормоны, вырабатываемые опухолью, например, исследование мочи на 5-HIAA — продукт обмена серотонина. Определение уровня хромогранина А в крови помогает контролировать эффективность лечения.
Лечение
Выбор лечения зависит от типа опухоли, ее локализации, степени злокачественности, стадии. В некоторых случаях, если нейроэндокринное новообразование является высокодифференцированным и практически не растет, врач назначает активное наблюдение. Нужно периодически являться на осмотры, проходить КТ, МРТ, сдавать анализы крови. Как только появляются признаки роста или распространения в организме, начинают активное лечение.
В большинстве случаев нейроэндокринные новообразования успешно лечатся хирургическим путем. Во время операции удаляют саму опухоль и некоторое количество окружающих тканей. Затем удаленный материал изучают в лаборатории. Если получен негативный край резекции, это означает, что опухолевая ткань удалена полностью.
Если радикальное вмешательство невозможно, может быть выполнена циторедуктивная операция, во время которой стараются удалить как можно большее количество опухолевой ткани.
Если у пациента имеются признаки карциноидного синдрома, есть риск, что его состояние во время операции может сильно ухудшиться. Врач-анестезиолог должен быть осведомлен о такой возможности и принять необходимые меры.
При неоперабельных опухолях назначают медикаментозное лечение, лучевую терапию. Применяют различные виды химиопрепаратов, таргетные препараты, иммунотерапию. Терапия аналогами соматостатина помогает справиться с симптомами и замедлить рост опухоли.
Если нейроэндокринные опухолевые очаги имеются в печени, может быть проведена радиочастотная аблация, эмболизация артерии, питающей опухоль. Врачи Европейской клиники обладают большим опытом в проведении таких вмешательств.
Прогноз выживаемости
Прогноз зависит от того, какой вид опухоли был диагностирован, насколько она агрессивна, на какой стадии находится. Лечение преследует одну из двух целей:
- Полностью удалить опухолевые очаги. Если по результатам обследований не выявляются признаки присутствия опухоли в организме, констатируют ремиссию.
- Избавить пациента от симптомов и сдержать рост новообразования. При этом больной может прожить довольно долго.
Стоит поговорить с врачом перед началом лечения, спросить, какой будет цель, какого результата можно ожидать, и что планируется делать в случае, если ситуация ухудшится, опухоль рецидивирует.
Заболеваемость
Ежегодная заболеваемость типичными и атипичными карциноидными опухолями легких составляет 0,6/100 тыс. чел. в год, а стандартизованный показатель заболеваемости опухолями тимуса ― 0,01/100 тыс.чел. в год. 25% всех карциноидных опухолей локализуются в дыхательных путях. Карциноиды легких составляют 1-2% от всех опухолей легких. Карциноидные опухоли легких и тимуса могут являться составной частью сложного синдрома множественной нейроэндокринной неоплазии I типа (MEN-1).
Диагноз
Около 70% всех карциноидов локализуются в главных бронхах и 1/3 в периферических отделах легких. Чаще всего они развиваются в правом легком, преимущественно в средней доле. У 92% пациентов в клинической картине имеются кровохарканье, кашель, рецидивирующая легочная инфекция, лихорадка, дискомфорт в груди и локализованные хрипы.
У пациентов с карциноидами легких и тимуса карциноидный синдром встречается очень редко, до 2%. Серотонин является наиболее часто определяемым пептидом, вызывающим карциноидный синдром. Порой, карциноидный криз может случиться у изначально бессимптомных пациентов после бронхоскопической биопсии или хирургической манипуляции. Приблизительно у 2% пациентов с карциноидами легких и тимуса есть синдром Кушинга, обусловленный эктопической выработкой адренокортикотропного гормона (АКТГ).
Диагностические процедуры включают в себя рентгенограмму органов грудной клетки, компьютерную томографию, бронхоскопию, в отдельных случаях сцинтиграфию с использованием изотопов к рецепторам соматостатина, в то время как позитронно-эмиссионная томография (ПЭТ) с флюородеоксиглюкозой (ФДГ) часто дает ложно ― отрицательные результаты и не рекомендована к использованию.
Диагноз устанавливается на основании гистологического исследования и определения нейроэндокринных маркеров иммуногистохимическими методами. Для диагностики опухолей тимуса может потребоваться торакотомия. При легочной локализации у пациентов с центрально расположенными карциноидами во время бронхоскопического исследования выполняется биопсия. Использование ригидного бронхоскопа имеет преимущество в заборе большего объема материала, более достоверного для исследования. Для снижения риска кровотечения перед выполнением биопсии через бронхоскоп вводят раствор эпинефрина. “Brush” цитология не имеет значения для диагностики нейроэндокринных опухолей.
Гистологическая классификация нейроэндокринных опухолей легкого:
- типичный карциноид, характеризующийся высокой степенью дифференцировки и низким митотическим индексом.
- атипичный карциноид, характеризующийся более высоким митотическим индексом, меньше 10/10HPF, и отдельными участками очагового некроза.
- Крупноклеточная нейроэндокринная карцинома, которую бывает сложно отличить от атипичного карциноида; характеризуется большим митотическим индексом (>10/10HPF) и более распространенными некрозами.
- Мелкоклеточный рак легких (МКРЛ) ― самая низкодифференцированная нейроэндокринная опухоль легких, называемая также классической “овсяноклеточной карциномой”. Митотический индекс очень высокий (больше 80/10 HPF) с обширными зонами некроза. МКРЛ рассматривается в отдельной главе Клинических рекомендаций ESMO.
Как типичный, так и атипичный карциноиды легких могут экспрессировать нейроэндокринные маркеры, выявляемые иммуногистохимическими методами (хромогранин-А, синаптофизин и нейронспецифическая энолаза) и рецепторы к соматостатину. Тоже касается карциноидов тимуса, которые экспрессируют нейронспецифическую энолазу в 73%, соматостатин в 36% и АКТГ в 27% случаев. Крупноклеточная карцинома и мелкоклеточный рак легких мало экспрессируют синаптофизин и нейронспецифическая энолазу и редко экспрессируют хромогранин-А. При последних двух гистологических вариантах также обнаруживаются мутации хромосомы p53.
Нейроэндокринные опухоли тимуса могут иметь разные степени дифференцировки от типичного высоко дифференцированного карциноида до мелкоклеточного рака.
Стадирование и факторы риска
Для нейроэндокринных опухолей легких не существует какого-либо особого стадирования по системе TNM. TNM стадирование осуществляется по критериям, применимым к немелкоклеточному раку легких. Классификация по системе TNM и стадирование карциноидов тимуса следует общим правилам, применимым к опухолям тимуса, и представлена в таблице №1.
Рентгенограмма органов грудной клетки позволяет предположить диагноз, но лучшими методами для диагностики нейроэндокринных опухолей легких являются КТ и бронхоскопия с ультрасонографией и биопсией [III, B].
В связи с тем, что 80% типичных карциноидов легких экспрессируют рецепторы соматостатина, сцинтиграфия с использованием изотопов к рецепторам соматостатина может быть высоко информативной [III, B].
Для выявления первичных очагов и метастазов карциноидов тимуса рекомендуется выполнять КТ или МРТ с внутривенным контрастированием.
Сцинтиграфия с использованием изотопов к рецепторам соматостатина является дополнительным методом.
Биохимические показатели зависят от гистологического типа нейроэндокринной опухоли легких. Типичный карциноид характеризуется повышенным уровнем хромогранина-A [III, B] в плазме крови. При наличии симптомов, обусловленных гормональной активностью, может отмечаться повышение уровня АКТГ в плазме, соматолиберина, инсулиноподобного фактора роста, 5-гидроксиуксусной кислоты или метаболитов гистамина, а также уровня кортизола в моче [III, B]. Биохимический профиль карциноида тимуса обычно похож на профиль при карциноидной опухоли легких.
Типичный карциноид ― вяло текущая опухоль с низкой вероятностью возникновения рецидива. После радикального удаления метастазы возникают редко (7% случаев). 5-летняя выживаемость составляет 80%, в то время как уровень 5-летней выживаемости при атипичном карциноиде составляет 60%.
Как крупноклеточная нейроэндокринная карцинома, так и МКРЛ характеризуются плохим прогнозом с 5-летним уровнем выживаемости меньше 10 %.
Карциноиды тимуса, при большей выживаемости в отдельных случаях, имеют низкий процент излечиваемости (в среднем 10-15%); поэтому в целом имеют общий прогноз хуже, чем карциноиды легких.
Лечение
Хирургический метод является основным методом лечения всех локализованных типичных и атипичных карциноидов, как легких, так и тимуса с уровнем 5-летней выживаемости от 80 до 100%. Оперативное вмешательство не является ведущим при крупноклеточной карциноме и МКРЛ, за исключением опухолей небольшого размера, например при T1-2 N0; гистологическая верификация периферически расположенных опухолей небольшого размера позволяет их радикально удалить.
Хирургический доступ зависит от размера, локализации и типа ткани. Удаление пристеночного типичного карциноида легких можно выполнить бронхоскопическим методом (когда бронхоскопия должна выполняться под контролем КТ), который может привести к полному излечению значительного количества пациентов. Опухоли, не соответствующие критериям эндобронхиальной резекции, можно удалить методами краевой резекции легкого, сегментэктомии, лобэктомии или пневмонэктомии.
При локализованных формах [III, B] возможно дистанционное облучение очага, особенно если не планируется проведение хирургического вмешательства. Эндобронхиальное лазерное лечение, хоть и не является патогенетическим, можно использовать в определенных случаях для лечения обструкции дыхательных путей.
Метастатические и рецидивные опухоли
Стандартным методом лечения метастатических карциноидов легких и тимуса является химиотерапия в сочетании с хирургией, когда это возможно, хотя существующие режимы химиотерапии являются гораздо менее эффективными. Химиотерапия МКРЛ, являющегося чувствительным к химиопрепаратам, но не излечиваемым, обсуждена в соответствующих разделах. В случае симптомных гормонопродуцирующих низкодифференцированных опухолей [III, B] возможно применение аналогов соматостатина и альфа-интерферона.
При гормонально-неактивных опухолях целесообразность применения аналогов соматостатина находится под вопросом. При высоком уровне экспрессии рецепторов соматостатина клетками опухоли одним из возможных методов лечения является лучевая терапия [III, B].
Оптимальными режимами химиотерапии типичного и атипичного карциноидов и крупноклеточной нейроэндокринной карциномы являются комбинация 5 ФУ и альфа-интерферона; комбинации на основе стрептозооцина; химиотерапия, включающая этопозид/цисплатин или химиотерапия, включающая циклофосфамид, доксорубицин и винкристин. В целом, результаты химиотерапевтического лечения сомнительны, и данные по выживаемости следует интепретировать с осторожностью.
Метастатическое заболевание с клиническими проявлениями требует паллиативной терапии с использованием таких способов лечения как эмболизация метастазов в печени и лучевая терапия метастазов в головной мозг и кости.
После радикального хирургического лечения больные с типичным и атипичным карциноидом должны наблюдаться ежегодно в течение 10 лет [III,C] с целью выявления возможных рецидивов в зоне хирургического вмешательства.
Каждые 3-6 месяцев следует определять уровень биохимических маркеров, таких как хромогранин-А (в случае, когда они изначально были повышены); КТ или МРТ следует повторять ежегодно.
Пациенты с метастазами или рецидивом опухоли должны обследоваться во время проведения химио- и биотерапии чаще, каждые 3 месяца, с мониторингом (предпочтительно КТ) и определением уровня биологических маркеров с целью оценки результатов проведенного лечения.
Классификация TNM и стадирование злокачественных опухолей тимуса.
pТ1 Полностью инкапсулированная опухоль
pТ2 Опухоль с прорастанием капсулы, инвазией в тимус или жировую клетчатку
pТ3 Инвазия в медиастинальную плевру или перикард или инвазия в соседние органы, такие как крупные сосуды или легкие
pТ4 Опухоль с имплантацией в плевру или перикард
pN0 Отсутствие метастазов в лимфатические узлы
pN1 Метастазы в лимфатические узлы переднего средостения
pN2 Метастазы во внутригрудные лимфатические узлы, за исключением метастазов в лимфатические узлы переднего средостения
pN3 Метастазы в отдаленные лимфатические узлы
М0 Отсутствие отдаленных органных метастазов
М1 Наличие отдаленных метастазов
Группировка по стадиям
Стадия I T1, T2 N0 M0
Стадия II T1,T2 N1 M0
Стадия III T3 N0,N1 M0
Стадия IV a T4 N0,N1 M0
Стадия IV b любая T N3 M0
Стадия IV c любая T любая N M1
Читайте также:

