Научные исследования в онкологии
Как снизить риск возникновения рака толстой кишки
Все последние исследования указывают на то, что развитие рака толстой кишки связано в первую очередь с воздействием факторов внешней среды. Это хорошая новость, ведь внешние факторы мы можем устранить или хотя бы минимизировать. В настоящее время полностью доказана связь злокачественных новообразований желудочно-кишечного тракта с особенностями диеты.
В странах, где люди традиционно употребляют много красного мяса (США, Аргентина, Новая Зеландия), регистрируется самый высокий уровень смертности от рака прямой кишки. Мясо и продукты, богатые жиром, повышая уровень желчной кислоты и продуктов обмена холестерина, увеличивают активность и количество микробной флоры в кишечнике. Микроорганизмы же превращают частицы пищи (особенно в этом отношении опасны, опять же, продукты распада белка) и собственные секреторные вещества в канцерогены. Также в ходе исследований было замечено, что возникновению рака толстой кишки способствуют курение, употребление спиртных напитков, лишний вес и сидячий образ жизни.
Таким образом, если вы хотите снизить риск развития этого серьезного заболевания, вам необходимо:
- сократить употребление красного мяса и животного жира;
- поддерживать нормальный вес и адекватный уровень физической активности;
- отказаться от вредных привычек — табака и алкоголя.
Рак молочной железы: всегда ли маммография верна?
Как пиво влияет на рак предстательной железы
Американские ученые завершили масштабное исследование, посвященное изучению связи между злоупотреблением алкоголем, в частности пивом, и развитием агрессивной формы рака предстательной железы. И опубликованные результаты вряд ли понравятся любителям золотистого хмельного напитка.
Доказано, что любой алкоголь значительно снижает эффективность лекарств, предназначенных для лечения рака простаты. В исследовании приняли участие 10 000 мужчин. У тех, кто принимал алкоголь (в большинстве случаев это было пиво) пять или более дней в неделю, агрессивная форма рака простаты встречалась в 2 раза чаще по сравнению с теми, кто пил умеренно или не пил вовсе. Как правило, рак предстательной железы развивается довольно медленно, и даже без оперативного лечения больные с таким диагнозом живут около 10 лет. Агрессивная форма в тот же срок приводит к летальному исходу в 30-40% случаев. Таким образом, становится понятно, что во время курса медикаментозного лечения от обильных возлияний лучше отказаться.
Развитие глиобластомы связано с генетическими аномалиями
Ученые из США установили, что развитие глиобластомы, наиболее агрессивной формы опухоли мозга, каким-то образом связано с изменениями ДНК в девятой хромосоме. Риск возникновения глиобластомы у человека с измененной хромосомой — 1 к 7 000, с нормальной — 1 к 10 000. В ходе исследования ученые обнаружили, что наличие определенных форм полиморфизма увеличивает вероятность развития опухоли в полтора раза. При этом спусковым крючком для генетических аномалий являются факторы внешней среды.
Исследователи детально изучили более 250 тысяч вариантов генетического кода у почти 700 пациентов с опухолью. Полученные сведения сравнили с данными 4 тысяч здоровых участников контрольной группы. Тщательный анализ позволил выявить четкую закономерность между присутствием некоторых аномалий в девятой хромосоме и развитием глиобластомы. Данные исследования будут использованы для разработки новых методов выявления опухоли на ранних стадиях и предупреждения ее развития.
Мобильные телефоны и рак: есть ли между ними связь
Эта информация особенно актуально для тех, кто любит вести долгие беседы по мобильному телефону. Исследования израильских ученых указывают на возможную связь между частым и длительным использованием сотового и развитием рака околоушной слюнной железы. В Израиле отмечается высокий уровень смертности от этой злокачественной опухоли. Жители страны отличаются особой любовью к разговорам по мобильному телефону, многие пользуются сразу несколькими аппаратами. Проанализировав тысячи случаев рака в Израиле за период с 1976 по 2006 годы, ученые выяснили, что в последние годы резко вырос уровень заболеваемости раком околоушной железы, т. е. опухоли, локализованной в месте, к которому прикладывается мобильный телефон. При этом частота случаев рака другой локализации, в том числе опухолей полости рта, осталась на прежнем уровне.
Онкологи отмечают, что среди заболевших особенно велика доля молодых людей. Следует упомянуть, что никаких прямых доказательств того, что между сотовыми телефонами и злокачественными опухолями существует связь, пока не получено. Но не доказана и полная безвредность мобильной связи, так что задуматься все же стоит.

вместе создадим единую базу клинических исследований в онкологии
- Руководства ESMO
- Помощь пациентам в период пандемии COVID-19
- Руководства RUSSCO
- Школа жизни онкологического пациента во время коронавируса (интервью члена Правления RUSSCO, проф. Н.В. Жукова)
Клинические исследования, которые проходят в данный момент
Многоцентровое, рандомизированное, открытое клиническое исследование фазы 3 в трех группах применения препаратов энкорафениб, цетуксимаб совместно с биниметинибом или без него, по сравнению с применением препаратов иринотекан/цетуксимаб или инфузионной терапии с применением 5-фторурацила (5-ФУ)/ фолиновой кислоты (ФК)/ иринотекана (FOLFIRI)/ цетуксимаба с определением безопасной дозы введения комбинации препаратов энкорафениб, бениметиниб, цетуксимаб для лечения пациентов с метастатическим коларектальным раком с мутацией BRAF V600E
Рандомизированное двойное слепое плацебо-контролируемое исследование для сравнения двух гуманизированных моноклональных антител направленного специфического действия против фактора роста эндотелия сосудов, применяемых в сочетании с химиотерапией по модифицированной схеме FOLFOX6 у пациентов с нерезектабельной метастатической колоректальной опухолью
TASCO1
Открытое рандомизированное исследование II фазы по оценке эффективности комбинации препарата TAS-102 с бевацизумабом и комбинации капецитабина с бевацизумабом у пациентов с метастатическим колоректальным раком, ранее не получавших лечение по поводу распространенного опухолевого процесса и которым не показано проведение интенсивной химиотерапии
Двойное слепое рандомизированное плацебо-контролируемое исследование III фазы препарата нинтеданиб в комбинации с оптимальной поддерживающий терапией (ОПТ), по сравнению с плацебо в комбинации с ОПТ, у пациентов с колоректальным раком, устойчивым к стандартному лечению
Рандомизированное двойное слепое плацебо-контролируемое многоцентровое международное исследование III фазы дурвалумаба или комбинации дурвалумаба с тремелимумабом в качестве консолидирующей терапии у пациентов с локализованным мелкоклеточным раком легкого I-III стадии, у которых не произошло прогрессирование после одновременной химиолучевой терапии (ADRIATIC)
Рандомизированное двойное слепое плацебо-контролируемое многоцентровое международное исследование III фазы дурвалумаба или комбинации дурвалумаба с тремелимумабом в качестве консолидирующей терапии у пациентов с локализованным мелкоклеточным раком легкого I-III стадии, у которых не произошло прогрессирование после одновременной химиолучевой терапии (ADRIATIC)
База, на которой проводится исследование:
Международное, рандомизированное, открытое исследование 3 фазы препарата REGN2810 (анти-PD 1 антитело) по сравнению с химиотерапией препаратами платины в качестве первой линии терапии у пациентов с распространенным или метастатическим PD-L1-положительным немелкоклеточным раком легких
Рандомизированное, открытое исследование 3 фазы комбинации препарата REGN2810 (анти-PD 1 антитело), ипилимумаба и двухкомпонентной схемы химиотерапии производными платины в терапии первой линии пациентам с распространенным или метастатическим немелкоклеточным раком легкого и уровнем экспрессии в опухоли PD-L1 менее или равно 50%
Открытое многоцентровое исследование III фазы, проводимое для сравнения действия препарата авелумаб с действием двухкомпонентной химиотерапией препаратами платины при их применением в качестве первой линией терапии рецидивирующего или PD-L1-положительного немелкоклеточного рака легкого IV стадии
Протокол № EMR 100070-005
Многоцентровое исследование 2 фазы с целью изучения пероральной терапии ингибитором cMET, препаратом INC280 у взрослых пациентов с распространенным немелкоклеточным раком легкого при немутантном статусе EGFR (WT)
2) Аболмасов Александр Евгеньевич
+7 (925) 928-51-59
Открытое многоцентровое рандомизированное исследование 3 фазы по изучению эффективности и безопасности препарата BGB-A317 (анти-PD1 антитела) по сравнению с доцетакселом у пациентов с немелкоклеточным раком легкого и прогрессированием заболевания после курса платиносодержащей химиотерапии
Рандомизированное открытое исследование фазы 3 применения Бригатиниба (Алунбриг™) в сравнении с Алектинибом (Алеценса ® ) у пациентов с распространенным ALK-позитивным немелкоклеточным раком легких, у которых возникла прогрессия заболевания на фоне применения Кризотиниба (Ксалкори ® )
Многоцентровое рандомизированное, двойное слепое, плацебо-контролируемое исследование III фазы, проводимое с целью оценки эффективности и безопасности анаморелина гидрохлорида, применяемого для восполнения дефицита массы тела и лечения анорексии, развившихся на фоне распространенного немелкоклеточного рака легкого у взрослых пациентов
Двойное слепое, рандомизированное, проводимое в параллельных группах исследование 3-й фазы с использованием активного препарата в качестве контроля с целью сравнения эффективности и безопасности препарата CT-P16 и разрешенного в ЕС препарата Авастин, применяемых в качестве первой линии терапии метастатического или рецидивирующего неплоскоклеточного немелкоклеточного рака легкого
Протокол № CT-P16 3.1
Рандомизированное, двойное слепое, многоцентровое исследование III фазы для оценки эффективности, безопасности, фармакокинетики и иммуногенности исследуемого препарата SB8 (предлагаемого биоаналога бевацизумаба) в сравнении с препаратом Авастин ® у пациентов с метастатическим или рецидивирующим неплоскоклеточным немелкоклеточным раком легкого
2) Козлов Вадим Викторович
+7 (913) 463-828-6
2) Бабина Ксения Геннадьевна
+7 (968) 267-77-76
Открытое исследование препарата афатиниб у пациентов с местнораспространенным или метастатическим немелкоклеточным раком легкого с мутацией рецептора эпидермального фактора роста, ранее не получавших лечение или предварительно получавших химиотерапию
Рандомизированное, двойное-слепое, плацебо-контролируемое исследование III фазы по изучению ARQ 197 плюс эрлотиниб vs эрлотиниб у ранее леченых пациентов с местно-распространенным или метастатическим неплоскоклеточным немелкоклеточным раком легкого
Программа расширенного доступа к ИПИЛИМУМАБУ для больных глиобластомой и глиомой
Mногоцентровое, рандомизированное, открытое исследование III фазы Атезолизумаба (антитело к PD-L1) в комбинации с адъювантной химиотерапией на основе антрациклина/таксана в сравнении только с химиотерапией у пациентов с операбельным трижды негативным раком молочной железы
Двойное слепое рандомизированное исследование III фазы, проводимое в параллельных группах, по сравнению эффективности, безопасности и иммуногенности TX05 и препарата Герцептин ® у пациентов с ранней стадией HER2-положительного рака молочной железы
Двойное слепое продолженное исследование для проведения адъювантной монотерапии препаратом Герцептин ® или препаратом TX05 для продолжения оценки безопасности и иммуногенности у пациентов с ранней стадией HER2-положительного рака молочной железы после проведения неоадъювантной терапии и хирургической резекции в рамках протокола TX05-03
Рандомизированное открытое исследование 3 фазы по оценке препарата абемациклиб в комбинации со стандартной адъювантной эндокринной терапией по сравнению с применением только стандартной адъювантной эндокринной терапии у больных раком молочной железы на ранней стадии, с высоким риском развития рецидива, поражением регионарных лимфатических узлов, с положительным статусом гормональных рецепторов и отрицательным статусом рецептора эпидермального фактора роста человека 2-го типа
Рандомизированное, многоцентровое, открытое, III фазы исследование лапатиниба плюс капецитабин или трастузумаб плюс капецитабин упациенток с Her2/neu позитивным метастатическим раком молочной железы ранее получавших антрациклины и таксаны
Международное проспективное открытое многоцентровое неинтервенционное исследование OPTIMIS.
Изучение результатов лечения больных гепатоцеллюлярным раком, получавших или не получавших сорафениб после трансартериальной химиоэмболизации (ТАХЭ), и влияние времени начала терапии сорафенибом
Многоцентровое открытое исследование 1b фазы с эскалацией дозы по изучению безопасности и переносимости препарата квинакрин у пациентов с опухолевыми заболеваниями печени различного происхождения
Многоцентровое рандомизированное открытое исследование (3 фаза) эффективности и безопасности Ленватиниба (E7080) в сравнении с Сорафенибом в первой линии лечения больных неоперабельным печеночно-клеточным раком
Рандомизированное многоцентровое двойное слепое исследование III фазы препарата регорафениб у больных ГЦР, ранее получавших сорафениб
Рандомизированное, двойное-слепое исследование II фазы по сравнительной оценке режимов рамуцирумаба в комбинации с цисплатином и гемцитабином; мерестиниба в комбинации с цисплатином и гемцитабином или плацебо в комбинации с цисплатином и гемцитабином в качестве первой линии терапии у пациентов с распространенным или метастатическим раком желчевыводящих путей
JAVELIN BLADDER 100
Многоцентровое, международное, открытое, рандомизированное, проводимое в параллельных группах исследование 3-й фазы, в котором Авелумаб (MSB0010718C) в комбинации с наилучшей симптоматической терапией сравнивается с наилучшей симптоматической терапией в качестве поддерживающего лечения у пациентов с местно-распространённым или метастатическим уротелиальным раком, который не прогрессировал после завершения первой линии химиотерапии на основе препаратов платины
2) Аболмасов Александр Евгеньевич
+7 (925) 928-51-59
Многоцентровое, рандомизированное, двойное слепое исследование III фазы для оценки эффективности и безопасности препарата BIBIF 1120 в комбинации с карбоплатином и паклитакселом в сравнении сплацебо в комбинации с карбопалином и паклитакселом у пациентов с распространенным раком яичников
Многоцентровое, двойное слепое, плацебо-контролируемое, рандомизированное исследование II фазы по изучению омрабулина у больных с чувствительным к препаратом платины рецидивирующим раком яичников, получающих карбоплатин/паклитаксел
MK1775 в сочетании с карбоплатином и паклитакселом при платиночувствительном раке яичников
Эффективность и безопасность Пембролизумаба у пациентов с прогрессией распространенного рака яичников (KEYNOTE 100)
Рандомизированное двойное слепое плацебо-контролируемое исследование III фазы эффективности и безопасности копанлесиба в комбинации с ритуксимабом у пациентов с рецедивами индолетных В-клеточных лимфом (иНХЛ) – CHRONOS-3
Исследование II/III фазы по оценке продолжительности тяжелой нейтропении при лечении плинабулином в сравнении с пэгфилграстимом у пациентов с солидными опухолями, получающих миелосупрессивную химиотерапию доцетакселом
Мультинозологичное исследование: анализ предиктивных биомаркеров для применения пембролизумаба при распространенных солидных опухолях (KEYNOTE 158)
* Критерии включения и исключения представлены не в полном объёме
Лечение онкологии – самая острая проблема современной медицины. Злокачественные новообразования ежегодно уносят миллионы жизней, лечение онкологии в ведущих клиниках мира не дает желаемого результата. Стандартные методы лечения рака у больных, закрепленные в клинических протоколах, – это хирургическое удаление новообразования, химиотерапия и лучевая терапия. На поздних стадиях заболевания они бессильны и часто носят паллиативный характер. Онкология, или рак, лечение которого невозможно, – это приговор для многих людей и вызов для ученых, находящихся в поиске новых методов борьбы со злокачественными опухолями.
Инновационный метод виротерапии в лечении рака
Старые методы лечения в онкологии во многих случаях позволяют лишь незначительно продлить жизнь пациенту и улучшить ее качество, но не победить заболевание. Но благодаря совместным усилиям ученых были открыты новые методы лечения рака, которые помогут победить это заболевание. Один из способов современного лечения рака – это виротерапия.
Благодаря открытию онколитических вирусов лечение рака 3 и 4 стадии стало возможным. Вирус проникает в опухолевые клетки и разрушает их, а также активирует противораковый иммунитет организма. Для неизмененных клеток онколитический вирус Сендай не представляет опасности. Этот альтернативный метод лечения рака находится на стадии исследования, но уже есть научное подтверждение его эффективности, доказанное на практике.
Виротерапия показана при опухолях небольших размеров, имеющих метастазы, то есть в случаях, когда традиционное медикаментозное лечение рака в комплексе с удалением опухоли и лучевой терапией неэффективно. Виротерапия на сегодняшний день официально не внедрена в клинические протоколы по онкологии, эта новая медицинская технология лечения рака показана больным с 4-й стадией заболевания.
Виротерапия эффективна при злокачественных новообразованиях печени, поджелудочной железы, простаты, кишечника, легких, костей, молочной железы, крови, а также дает положительный результат при распространенной метастатической меланоме. Там, где химиотерапевтические препараты для лечения рака бессильны, виротерапия дает больному шанс на выздоровление. Кроме того, в отличие от химиотерапии, она хорошо переносится организмом.
Клинические исследования в Петербурге, Москве и других городах
Отечественные ученые принимают активное участие во внедрении нового метода лечения рака в России. Сегодня в Москве, Санкт-Петербурге, Новосибирске и г. Рига (Латвия) проводят экспериментальное лечение рака по новой методике. Пациенты с последней стадией заболевания могут получить консультацию и принять участие в клинических исследованиях.
Результат лечения рака
Опыт лечения рака с помощью персонализированной иммуновиротерапии доказывает, что победить опухоли с отдаленными метастазами возможно. Исследования показали, что персонализированная иммуновиротерапия на основе комбинированного применения онколитических вирусов, лазерных, биологических и ядерных технологий в 3-5 раз эффективнее, чем изолированное применение только онколитических вирусов. Ученые доказали, что эффективность применения онколитических вирусов значительно повышается при их комбинированном применении с иммунотерапией под контролем динамики показателей иммунологического обследования пациента. Это подтверждено научными исследованиями и отзывами пациентов, которым помогла персонализированная комбинированная иммуновиротерапия рака.
Благодаря современным достижениям медицинских наук раковые опухоли с отдаленными метастазами поддаются лечению. Персонализированная иммуновиротерапия находится в стадии клинических испытаний и дает шанс на выздоровление пациентам с распространенным метастатическим раком.
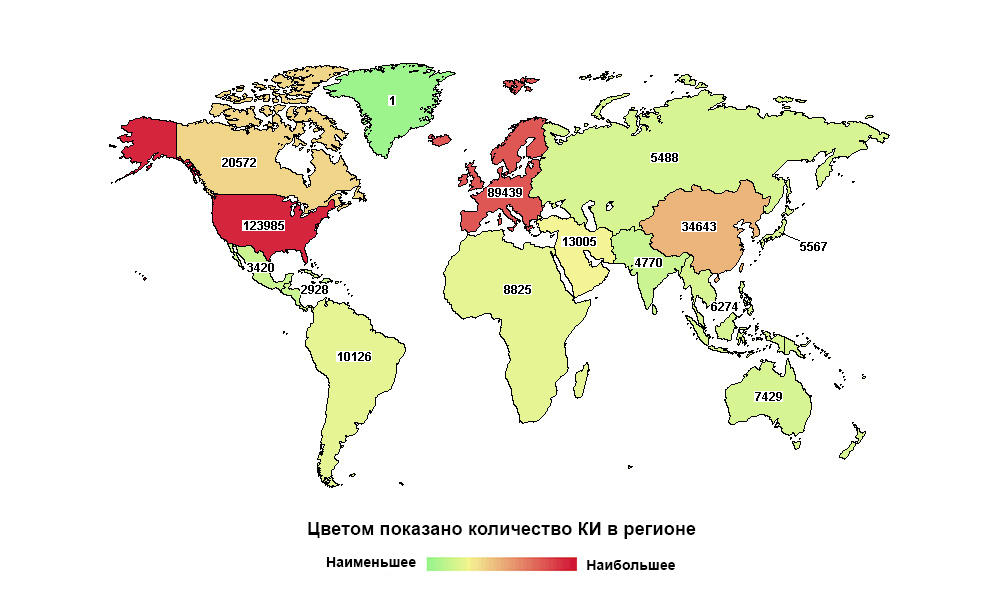
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата – единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Клиническое исследование/испытание (далее – КИ)– научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
И именно клинические исследования – основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996-97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Весь процесс создания препарата можно поделить на 3 крупных фазы.
1. Поиск идеи и доклинические исследования – в пробирках и на животных.
2. Если на этом все не закончилось – то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
3. Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
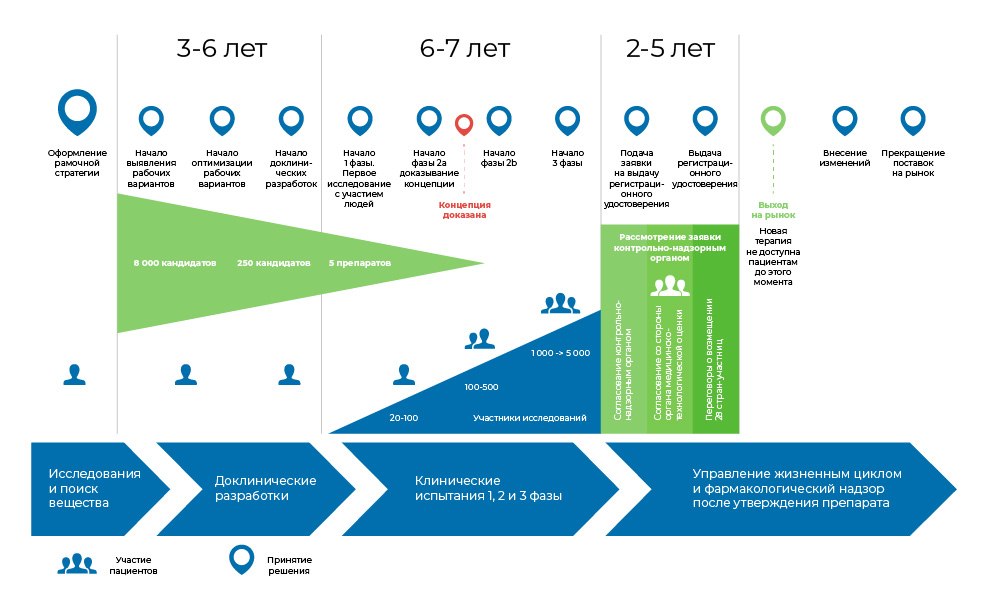
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это кому-нибудь нужно? Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности в лекарствах. По данным Всемирной организации здравоохранения, в 2018 году онкологические заболевания убили 9,6 миллиона человек. Часто опухоли обнаруживают на поздних стадиях, когда остается лишь паллиативное лечение.
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов – одно из самых наукоемких и востребованных направлений медицины.
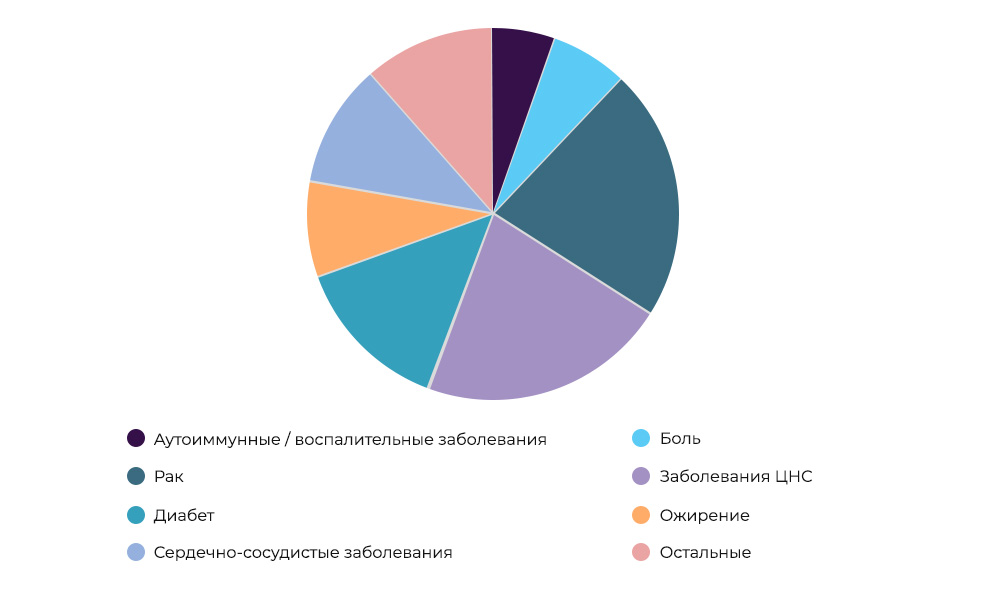
Исследования противораковых препаратов – 23% всех КИ в мире
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.

Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio – то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве – производят по специальным правилам (в России это ГОСТ Р 52249-2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь – двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий – нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
И до сих пор в медицине без опытов на животных – не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода и т.п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма, и т.п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да – то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях – пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности и т.п.
- Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста – получить оценку и заключение комитета по этике.
Комитет по этике – это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний – на людях.
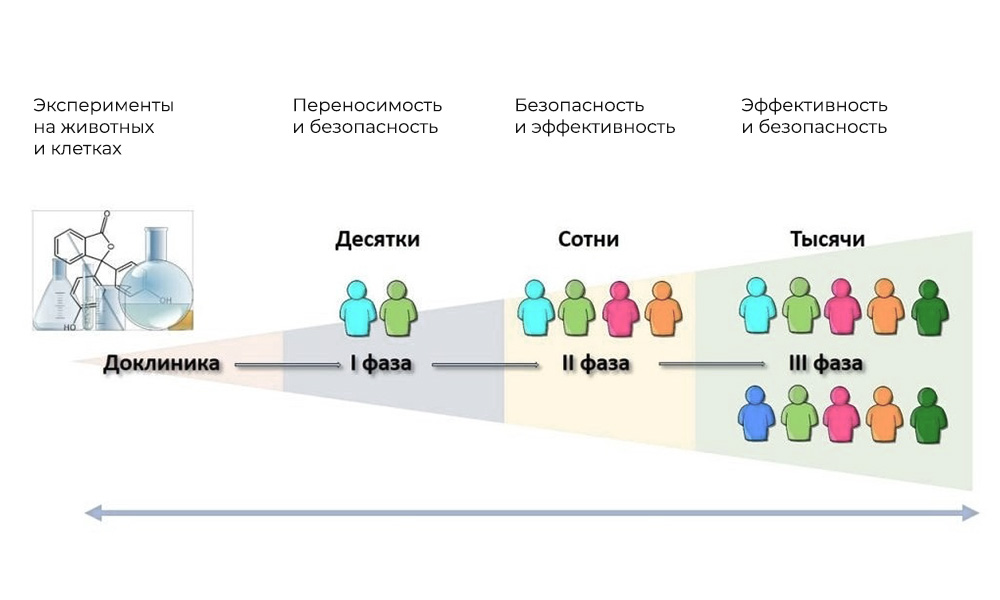
Основные фазы клинических исследований – на людях
Участники: 20 – 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Участники: 100 – 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто – плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом – с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.

Всем – одинаковые на вид, вкус и запах лекарства.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Количество участников: 300 – 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку – и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12-18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25-30% случаев от всех, что были на старте третьей фазы.
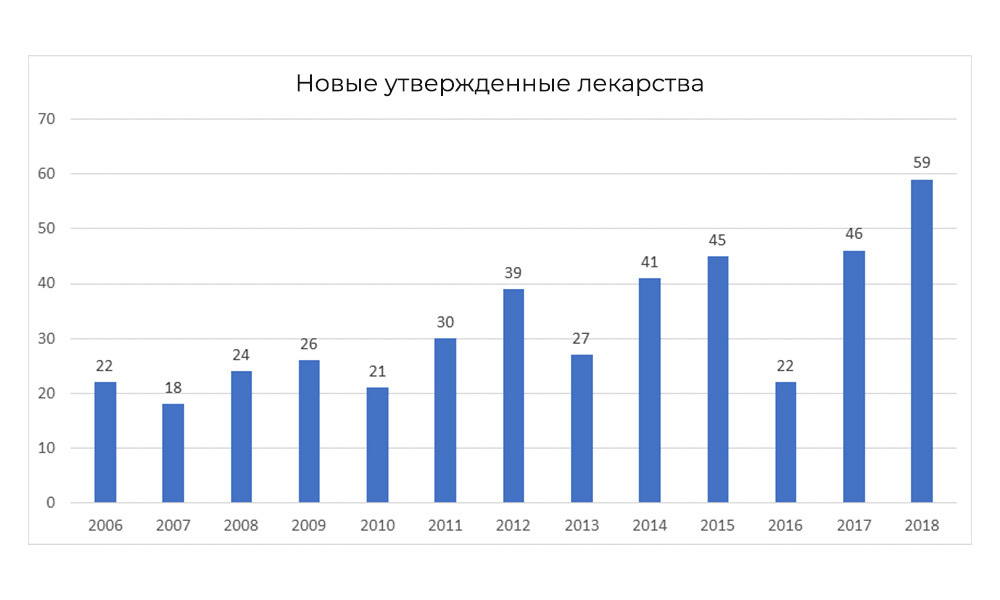
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний – 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2-3 года замедляет пациентам доступ к новым лекарствам.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер – для пациентов. Чтобы запуститься в первый раз – пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.

Для разных препаратов – разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т.п. Все это отражено в особом документе —информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались – для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет – мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике – совсем не то, что в большом НИИ, но обычно 3-4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение – бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике – если это не запрещено дизайном КИ и пациент чувствует себя хорошо – он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами – расширенной возможностью применения новых препаратов – будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
Читайте также:

