Мыши меланома b16 f10 паспорт опухоли

В16 меланома представляет собой мышиная опухоль клеточной линия используется для проведения исследований в качестве модели для человека рака кожи . B16 клетки являются полезными моделями для изучения метастазирования и образования твердых опухолей, и были одним из первых эффективных мышиных инструментов для исследования метастазов.
содержание
- 1 История
- 2 Характеристики
- 3 Использование в научных исследованиях
- 4 Ссылки
- 5 Внешние ссылки
история
В16 клетки были обнаружены и поддерживаются в Jackson Laboratories в штате Мэн в 1954 году , когда опухоль формировалась естественным за ухо / 6 C57BL мыши. Клетки резекция, пересадили, и поддерживается в естественных условиях, и до сих пор сегодня.
B16 модели были в использовании до такой степени, в 1970-е годы, но это был доктор Исайя J. Фидлер, иерусалимского происхождения, штата Оклахома обученный ветеринарный и Университет Пенсильвании обученной биологического исследователя, в настоящее время на MD Anderson Cancer Center в Хьюстоне , штат Техас, который установил прочные протоколы для использования модели B16. Одним из его первых крупных исследований с участием В16 был в 1970 г. д-р Фидлер окрашивал B16s, будучи культивируют их в пробирке, с 125I-5-иод-2'-дезоксиуридином для отслеживания, и имплантировали клетки в мышей C57BL / 6J, общие хозяин, пожертвовали мышей в разное время, и измерили клетки в крови и в различных органах. Он установил, что 99% исходной популяции клеток погибли в течение дня, и что когорта около 400 клеток колонизировали легких. Исследование было семенным, поскольку он установил наличие надежного метастазирования пути, который был осложняемым возмутить и просмотреть изменения. Он также показал, что метастазы не гарантируется просто наличием опухолевых клеток. Только определенная немногие из них способны циркулировать и защелку на право органа и начинают формировать опухоли.
В 1980-х годах было установлено, что В16 клетки экспрессируют очень низкие уровни класса мыши I главного комплекса гистосовместимости гликопротеинов, H-2Kb и Н-2 дБ, и что в пробирке лечение с помощью гамма-интерферона одновременно индуцирует высокий уровень экспрессии H-2 и увеличением в метастатического потенциала клеток В16.
Характеристики
B16 клетки берут свое начало в меланин-продуцирующие эпителии мышей, и легко отслеживать в естественных условиях после трансплантации. Их верность метастазирования от кожи до легких, печени, селезенки и сделать их полезные и предсказуемые инструменты для изучения метастатических путей.
В 1962 издании Руководства по Генетически Стандартизированному мышею Jax, клетки были описаны следующим образом:
Брутто: мягкая серая ткань, часто геморрагический. Микроскопические: опухолевые клетки многогранный или веретенообразные, расположенные в периваскулярных накидках и диффузных массах; некоторые клетки содержат мелкие пигментные гранулы, несколько затенены большими, очень темных глобулы пигмента; стомы тонкий и сосудистый. Пигмент значительно снизился по сравнению с ранней генерацией трансплантата.
Различные поверхностные белки были показаны, чтобы играть важную роль в судьбе локативной клеток, на которых они прикреплены. Наличие большого числа отдельных белков соответствует сродству Клетки для конкретных органов были выбраны во многих линиях увековечены в лабораториях в семидесятых и восьмидесятых годах. Опухолевые клетки из легких, например, будут собраны от умершей мыши и пересадили в кожу другой мыши, и мышь, после смерти, будет иметь свои результирующие опухоли легких пересаживают в следующую мыши, и так далее. Со временем клетки в этой линии вводят в кожу почти всегда становятся опухоли легких. То же направлена этиология, кроме того, была предпринята для многих других органов, что приводит к отдельным суб-линию с такими названиями, как В16-F10, В16-НД6, B164A5, B16GMCSF и B16FLT3.
Использование в научных исследованиях
Сегодня, В16 меланома остается незаменимой для исследований метастазирования. Текущие исследовательские проекты сосредоточены на иммунологической реакцию клеток к вакцинам, микроРНК , опосредованным метастатическим свойства, особенно MIR-21 , Отмеченному агрессор опухолевых супрессоров и антипролиферативных факторов. B16 также используется в качестве доклинической модели для изучения иммунотерапии . Это всего лишь несколько примеров, но обвязывать идея заключается в том, что модель B16 меланома является мощным инструментом исследования, и основным продуктом для исследований метастазирования, а его развитие как таковое может рассматриваться как огромная польза для исследований рака сообщества.
Меланома является наиболее серьезной формой рака кожи. Аберрантная активация Wnt / β-катенинового сигнального каскада наблюдается примерно в одной трети случаев меланомы, что указывает на то, что модуляция Wnt/β-катениновой активации может представлять новую стратегию в лечении меланомы. Нижестоящие мишени Wnt/β-катенинового сигнального пути, в том числе с-Мус, cyclinD1, ММР и сурвивин, которые регулируют большое количество разнообразных клеточных функций, например, пролиферацию, дифференцировку, выживаемость и апоптоз. Antrodia camphorata, известный в Тайване лекарственный гриб, который использовался в качестве китайской народной медицине в течение многих лет.
Предыдущие исследования показали, что А. camphorata (AC) обладает значительной противоопухолевой активностью в отношении различных опухолевых клеток. Тем не менее, механизм противоопухолевой активности А. camphorata в отношении меланомы изучен недостаточно хорошо. Кроме того, в настоящее время поиск оптимальных методов лечения меланомы является актуальным темой научно-исследовательских исследований в связи с высокой устойчивостью данной опухоли к лучевой и химиотерапии, а также к большинству синтетических химиотерапевтических препаратов, от действия которых больше страдают немеланомные клетки кожи. По этой причине в настоящем исследовании мы нацелились на изучении противоопухолевой эффективности ферментированного культурального экстракта А. camphorata (AC-10) и полученного из него чистого соединения (AC-0) на клетках меланомы мыши. В первом ряду экспериментов мы сделали наблюдение, что лечение AC-10 значительно снизило жизнеспособность клеток мышиной меланомы B16F10 и B16F1, при этом значение IC 50 составило 80 мкг/мл. Снижение жизнеспособности клеток было непосредственно связано с ингибированием β-катенина и подавлением экспрессии относящегося к нему белка.
Иммунофлуоресцентный анализ подтвердил, что лечение AC-10 заметно снижает транслокацию β-катенина в ядрышко, а также подавляет β-катенин-опосредованную транскрипционную активность. Кроме того, протеасомальный ингибитор MG132, который предотвращает протеасомальную деградацию β-катенина, т.е., наоборот, GSK3β ингибитор SB216312 также подавляет деградацию β-катенина, что явно подразумевает GSK3β зависимый путь деградации β-катенина. Аналогичным образом, лечение при помощи AC-10 подавляет экспрессию GSK3β, что дает основания предположить, что АС-10 может регулировать протеосомную деградацию β-катенина по GSK3β-зависимому механизму. Кроме того, анализ с применением проточной цитометрии показал, что лечение AC-10 существенно ограничивает переход G1 в S-фазу с последующим подавлением циклина D1 (мишенью является ген wnt / β-катенин), экспрессии CDK4 и увеличении уровней p27, p21.
Кроме того, анализ TUNEL показал, что лечение препаратом AC-10 индуцирует апоптоз в дозозависимой форме, с последующим нарушением соотношения BAX/BCL-2 и механизма регуляции про-каспазы-9, про-каспазы-3 и про-PARP. Анализ миграции и инвазии показывает, что АС-10 может уменьшать способность меланомы к метастазированию посредством ингибирования экспрессии ММР-9, ММР-2, VEGF, которые являются также генами-мишенями Wnt/β-катенинов. Во второй части испытания также было обнаружено, что AC-0 эффективно ингибировал Wnt/β-катениновый каскадный путь и подавлял β-катенин-опосредованную транскрипционную активность.
Как и в случае с АС-10, было обнаружено, что в клетках, обработанных АС-0, уменьшался процесс метастазирования меланомы, а также усиливалась индукция апоптоза. Лечение MG132 и AC-0 предотвращает экспрессию β-катенина, однако тот факт, что SB216312 не смог предотвратить экспрессию GSK3β предполагает, что лечение AC-0 может регулировать протеосомную деградацию β-катенина посредством GSK3β-независимого механизма. Это явление наблюдается и при помощи анализа иммунопреципитации, подтверждающем, что обработка клеток AC-0 снижает взаимодействие между β-катенином и GSK3β.
Поэтому мы считаем, что AC-10/AC-0 может быть потенциальным химиопрофилактическим средством для лечения меланомы.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Хроническая боль – патологический процесс, изменяющий метаболизм всего организма.
Цель: определение регуляторов плазминогена в ткани меланомы кожи и участков кожи, не связанных с опухолью, мышей-самок в динамике роста экспериментальной меланомы, воспроизведенной на фоне хронической нейрогенной боли.
Материалы и методы. Меланома в16/F10 воспроизведена на фоне модели хронической нейрогенной боли на самках мышей С57ВL/6. Определяли содержание плазмина, связанного с α-2-антиплазмином (рар), урокиназного (pro-uPA и uPA) и тканевого (pro-tPA и tPA) активаторов плазминогена, рецептор uPA (uPAR), серпин-1 (PAI-1) методами ИФА на стандартных тест-системах. Статистика: программа Statistica 10.
Результаты. При хронизации нейрогенного болевого синдрома установлены значимые изменения компонентов фибринолиза в коже самок мышей С57ВL/6. После перевивки меланомы в16/F10 (1-3 недели), в коже и опухоли найдены: достоверно более высокое содержание РАР, рецептора uPAR (р
Кит Олег Иванович - член-корр. РАН, доктор медицинских наук, профессор, заслуженный врач РФ, генеральный директор.
Котиева Инга Мавликиевна - кандидат медицинских наук, старший научный сотрудник.
Каплиева Ирина Викторовна - кандидат медицинских наук, старший научный сотрудник.
Трепитаки Лидия Константиновна - научный сотрудник.
Бандовкина Валерия Ахтямовна – кандидат биологических наук, старший научный сотрудник.
Козлова Лариса Степановна – кандидат биологических наук, старший научный сотрудник.
14-я линия, д.63, Ростов-на-Дону, 344037, SPIN-код РИНЦ 5299-5451
Погорелова Юлия Александровна - кандидат биологических наук, старший научный сотрудник.
Розенко Людмила Яковлевна - доктор медицинских наук, профессор, главный научный сотрудник.
Черярина Наталья Дмитриевна - врач-лаборант.
1. Kumar A, Kaur H, Singh A. Neuropathic Pain models caused by damage to central or peripheral nervous system. Pharmacol Rep. 2018; 70(2): 206-216.
2. Yamanaka H, Obata K, Fukuoka T., et al. Tissue plasminogen activator in primary afferents induces dorsal horn excitability and pain response after peripheral nerve injury. Eur J Neurosci. 2004; 19: 93-102.
3. Yamanaka H, Obata K, Fukuoka T., et al. Induction of plasminogen activator inhibitor-1 and -2 in dorsal root ganglion neurons after peripheral nerve injury. Neuroscience. 2005; 132:183-191.
4. Kozai T, Yamanaka H, Dai Y., et al. Tissue type plasminogen activator induced in rat dorsal horn astrocytes contributes to mechanical hypersensitivity following dorsal root injury. Glia. 2007; 55: 595-603.
5. Berta T, Liu YC, Xu ZZ, Ji RR. Tissue plasminogen activator contributes to morphine tolerance and induces mechanical allodynia via astrocytic IL-1β and ERK signaling in the spinal cord of mice. Neuroscience. 2013;247:376385.
6. Chlebowski RT, Col N. Bisphosphonates and breast cancer prevention. Anticancer Agents Med. Chem. 2012; 12(2): 144-150.
7. Yamanaka H, Kobayashi K, Okubo M., et al. Annexin A2 in primary afferents contributes to neuropathic pain associated with tissue type plasminogen activator. Neuroscience. 2016; 314: 189-199. 8. Nishioka N, Matsuoka T, Yashiro M., et al. Plasminogen activator inhibitor 1 RNAi suppresses gastric cancer metastasis in vivo. Cancer Sci. 2012; 103(2): 228-232.
8. Valiente M, Obenauf AC, Jin X., et al. Serpins promote cancer cell survival and vascular co-option in brain metastasis. Cell. 2014; 156(5): 1002-1016.
9. Sato M, Kawana K, Adachi K., et al. Decreased expression of the plasminogen activator inhibitor type 1 is involved in degradation of extracellular matrix surrounding cervical cancer stem cells. Int J Oncol. 2016; 48(2): 829835.
10. Кит О.И., Франциянц Е.М., Котиева И.М. и др. некоторые механизмы повышения злокачественности меланомы. Российский журнал боли. 2017; 53 (2): 14-20.
11. Кит О.И., Франциянц Е.М., Котиева И.М. и др. Влияние хронической боли на динамику некоторых ростовых факторов в интактной и патологически измененной коже самок мышей с меланомой в16/F10. Российский журнал боли. 2017; (3-4): 37-44].
12. Dingemanе KP. B-16 melanoma metastasis in mouse liver and lung. Inv. Metast. 1985; (5): 50-60.
13. Ji RR, Berta T, Nedergaard M. Glia and pain: is chronic pain a gliopathy? Pain. 2013;154 Suppl 1:S10-28.
14. Wu F, Catano M, Echeverry R, et al. Urokinase-type plasminogen activator promotes dendritic spine recovery and improves neurological outcome following ischemic stroke. J Neurosci. 2014;34(43):14219-14232.
15. Mahmood N, Mihalcioiu C, Rabbani SA. Multifaceted Role of the Urokinase-Type Plasminogen Activator (uPA) and Its Receptor (uPAR): Diagnostic, Prognostic, and Therapeutic Applications. Front Oncol. 2018;8:24.
16. Merino P, Diaz A, Jeanneret V, et al. Urokinase-type Plasminogen Activator (uPA) Binding to the uPA Receptor (uPAR) Promotes Axonal Regeneration in the Central Nervous System. J Biol Chem. 2017;292(7):2741-2753.
17. Mazzieri R, Pietrogrande G, Gerasi L, et al. Urokinase Receptor Promotes Skin Tumor Formation by Preventing Epithelial Cell Activation of Notch1. Cancer Res. 2015; 75(22):4895-4909. 19. Gonias SL, Hu J. Urokinase receptor and resistance to targeted anticancer agents. Front Pharmacol. 2015; (6): 154.
18. Pavón MA, Arroyo-Solera I, Céspedes MV, et al. uPA/uPAR and SERPINE1 in head and neck cancer: role in tumor resistance, metastasis, prognosis and therapy. Oncotarget. 2016;7(35):57351-57366.
19. Chen JS, Chang LC, Wu CZ, et al. Significance of the urokinase-type plasminogen activator and its receptor in the progression of focal segmental glomerulosclerosis in clinical and mouse models. J Biomed Sci. 2016; 23: 24.
20. Schuliga M. The inflammatory actions of coagulant and fibrinolytic proteases in disease. Mediators Inflamm. 2015; 2015: 437695.
21. Santibanez JF, Obradović H, Kukolj T, Krstić J. Transforming growth factor-β, matrix metalloproteinases, and urokinase-type plasminogen activator interaction in the cancer epithelial to mesenchymal transition. Dev Dyn. 2018; 247(3): 382-395.
22. Santibanez JF. Transforming growth factor-Beta and urokinase-type plasminogen activator: dangerous partners in tumorigenesis-implications in skin cancer. ISRN Dermatol. 2013; 2013: 597927.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.

В норме ген BRAF вместе с факторами роста и гормонами участвует в регуляции деления клеток за счет активации специфического сигнального пути. Если же его структура изменяется, то процесс деления выходит из-под контроля. Мутации в гене BRAF выявляются при различных видах рака, однако на первом месте в списке онкологических заболеваний стоит меланома. Определить статус гена при данной болезни крайне важно, так как от этого будет зависеть дальнейшая тактика лечения.
Частота и виды мутаций BRAF
Методы диагностики
Выявить мутации BRAF можно при помощи молекулярно-генетических методов диагностики. Для проведения исследования необходим образец тканей меланомы кожи, в которых содержится не менее 20% опухолевых клеток. Как правило, такой материал поступает в лабораторию после удаления, после чего он фиксируется в формалине и заключается в парафиновые блоки. Перед определением мутаций необходимо выполнить пробоподготовку. Материал извлекается из парафина, затем выполняется процесс экстракции ДНК, которая исследуется.
Базовым методом, который позволяет выявить мутации в гене BRAF, является полимеразная цепная реакция (ПЦР). Это исследование является относительно простым и дешевым, обладает хорошей чувствительностью и специфичностью, однако имеет существенный недостаток. Один анализ позволяет определить только одну мутацию BRAF. Если же стоит задача выявить несколько мутаций, то исследование придется повторять.
Более совершенным считается секвенирование, при помощи которого можно установить точную последовательность ДНК целого гена. Данный метод более затратный и требует дорогостоящего оборудования, но при этом он позволяет одновременно выявить все мутации в гене BRAF за одно исследование. Среди недостатков секвенирования можно отметить риск получить ложноотрицательный результат (выявляется в 2%-10% случаев) из-за присутствия в материале большого количества нормальных клеток с неизмененной ДНК.
Зачем определять BRAF мутацию при меланоме
Определение мутации в гене BRAF имеет важное значение при подборе лечения меланомы. Одним из современных методов является таргетная терапия, которая направлена на устранение конкретного механизма образования опухолевых клеток. В случае с меланомой применяются ингибиторы мутированного фрагмента гена BRAF, которые прерывают цепочку биохимических реакций и не дают опухоли развиваться дальше. При назначении таких препаратов определение статуса гена BRAF должно проводиться в обязательном порядке. При отсутствии мутации дорогостоящее лечение окажется неэффективным, а в некоторых случаях может и ускорить прогрессирование опухолевого процесса.
Препараты из группы ингибиторов BRAF могут применяться только при лечении метастатической меланомы. При этом не изучена эффективность лечения в адъювантном режиме, поэтому такие препараты не назначают пациентам, у которых выполнялось хирургическое удаление опухоли или метастазов, а также химио- и лучевая терапия.
Первыми зарегистрированными препаратами из группы ингибиторов BRAF, которые начали применяться при лечении метастатической и неоперабельной меланомы, стали вемурафениб и дабрафениб. При проведении клинических испытаний, они показали очень хорошие результаты. В настоящее время применяется комбинированное лечение меланомы, при котором, кроме ингибиторов BRAF назначаются ингибиторы МЕК. Такое сочетание позволяет максимально замедлить прогрессирование заболевания и увеличить продолжительность жизни пациентов.
Несмотря на большие успехи в лечении меланомы, все еще остаются нерешенными несколько проблем. Во-первых, отсутствуют эффективные методы терапии, которые можно применять при отсутствии мутаций в гене BRAF. Во-вторых, при назначении ингибиторов BRAF у пациентов спустя некоторое время развивается устойчивость к такому лечению, и меланома начинает снова прогрессировать.
Из этой ультракороткой истории вы узнаете, зачем определяется митотический индекс, почему я всегда прошу от вас документы для своих публикаций и главное — для чего выполнять биопсию сторожевых лимфоузлов после удаления меланомы.
1.00 … ночь
Приветствую Вас. Случилась беда живу в ****. . В январе 2018 иссекли на животе меланому 6,7 Бреслоу , II по Кларку до 4 митозов. Наблюдался в онкоцентре. Февраль — ПЭТ в Воронеже без накопления ФДГ. Июль — ПЭТ в Ростове без накопления ФДГ.
23 сентября нащупал по левой подмышкой небольшой лимфоузел. Через пару дней на УЗИ 4 лимфоузла в той же зоне подозрительные. Еще через двое суток пункция и во всех 4 — х узлах наши клетки меланому. Назначили лимфодиссекцию в онкоцентре на первые числа октября и потом будут решать что дальше по результатам ПГИ удалённого материала. ПОСОВЕТУЙТЕ ЧТО ДЕЛАТЬ?
Здравствуйте!
Дальше анализ на BRAF, C-KIT, NRAS
Если кроме лимфоузлов ничего нет, то адъювантное лечение:
При наличии БРАФ мутации: Тафинлар+Мекинист
При отсутствии мутации: Опдиво (ниволумаб)
И НИКАКИХ ИНТЕРФЕРОНОВ!
Можно у вас попросить результат гистологии первичной?
Документ по Опдиво в адъювантном режиме можно посмотреть тут:
Описать могу по памяти Бреслоу 6.7 Кларк 2 митозы до 4-х с участками регресса со слабой лимфоцитарной инвазией. Классика жанра идите у вас все хорошо никуда ехать не надо. Кроме того наш ПЭТ это шоу. НИКОМУ ВЕРИТЬ НЕЛЬЗЯ НУЖНО все перепроверить. Если бы сам не полез по мышку ждал бы очередного УЗИ в ноябре. Предварительно предложили и Опдиво и Кейтруда это в Москве. Сказали нужно агрессивную тактику. Кроме лимфоузлов пока все чисто. НО понимаю что время ушло и может вылезти где угодно лишь бы не в голове. Поговорю по Вашему предложению с врачами. ГОВОРЯТ что Опдиво и Кейтруда работают независимо от мутации.
Кейтруда и Опдиво действительно действуют на всех, независимо от мутаций.
Далее мы немного пообсуждали лекарства и т.д.
вечер того же дня…
Ставили 1б стадию.
Вот по этому я и прошу ДОКУМЕНТЫ 🙂 !
Январь-Февраль 2018. Диагноз после выписки (даже врач не может толком перенести данные с гистологического исследования. 0,6 мм и 0,67 мм. Разница, вроде небольшая, но все равно):
Август 2018. Вот тут уже точнее.
Сентябрь 2018. Лимфоузлы. Только я не совсем понял, для чего было все 4 тыкать.
Итак, на счет документов, я думаю, все понятно вам, дорогие читатели?
Дык вот мне тоже хочется публиковать только реальные факты.
И теперь на счет митотического индекса.
Митотический индекс, особенно при очень тонких меланомах, играет колоссальную роль.
Пример 1: Меланома. Бреслоу 0,5, Кларк II, митозов нет, изъязвление отсутствует, фаза радиального роста. /vse/israel/lechenie-v-israele/lechenie-melanomy-diagnostika-v-izraile-xaim-gutman-otzyv/ — все нормально. БСЛУ не проводилась в связи с отсутствием показаний.
Пример 2: Меланома. Бреслоу 0,6мм, Кларк II, митозов нет, изъязвления нет. /vse/israel/lechenie-v-israele/lechenie-v-izraile-udalenie-rodinok-i-nesostoyavshayasya-bslu/ так же все в норме пока. БСЛУ не проводилась в связи с отсутствием показаний.
И теперь берем данный случай: Бреслоу 0,67мм, Кларк II, изъязвления нет, 4 митоза на кв/мм. БСЛУ не проводилась… просто не проводилась. Через 8 месяцев метастазы в 4х лимфоузлах.
И еще: Меланома, Бреслоу 0,65 мм, Кларк II , 2 митоза, фаза вертикального роста /vse/israel/lechenie-v-israele/lechenie-melanomy-v-izraile-biopsiya-storozhevyx-limfouzlov-otzyv/ . БСЛУ проведена в Израиле. Обнаружен микрометастаз в л/у.
З.Ы Вишенка на торт:
— И последний вопрос: тогда, в далеком январе 2018, про БСЛУ хоть кто-нибудь заикался?
— Я про БСЛУ читал. Но врач успокоил. Зачем везти деньги мошенникам из Израиля.
Мне вот интересно, лимфодиссекцию сейчас выполняет тот же специалист, или другой….
Добавочка от 08.10
Выполнена лимфодиссекция в левой подмышечной впадине. Удалено 6 л/у, в четырех из которых ожидаемо найдены метастазы.
Следующий этап — адъювантная терапия Опдиво.
14.10.2018
01.11.2018
Первая капельница Опдиво. УЗИ. В правой подмышке увеличенный лимфоузел. Пункция. Метастаз меланомы. Готовимся к лимфодиссекции…
Киевский НИИ Фармакологии и Токсикологии АМН Украины
Ниже представлен эксперимент на мишах по лечению меланомы
Также прочтите - лечение рака шейки матки
Начало работы: 09.1990. Окончание: 12.1990.
Препарат Флараксин был получен для проведения испытаний из Киевского НИИ фармакологии и токсикологии МЗ УССР в стерильных флаконах в виде порошка подлежащего растворению перед введением животным. Перевивка меланомы В-16 осуществлялась путем подкожного введения в правую заднюю лапку мыши 2х10 5 клеток опухоли в среде 199/в объеме 0,1 мл.
Рост опухоли оценивали путем ежедневного замера диаметров ее в трех взаимно перпендикулярных областях, с последующим расчетом объема опухоли как произведение трех ее замеров. Динамика опухоли по группам экспериментальных животных представлена в таблице 1 и на рис.1.
Флараксин вводили ежедневно начиная с 5 сут. После перевивки, в течение 10 дней (8 инъекций, внутримышечно в дозах 7,7; 15,0 и 30,0 массы тела соответственно 1/40, 1/20 и 1/10 ЛД50), суммарно соответственно 60,0; 120,0; 240,0. Препарат вводили в мышцу симметричной конечности мыши. Всего, таким образом, было 4 экспериментальных группы животных – контроль (мыши с меланомой В-16, но без введения препарата) и 3 опытные (получавшие соответственно 3 дозы препарата), по 8 животных в группе итого 32 мыши в группе. С учетом морфологических исследований всего использовано 90 мышей с меланомой В-16 и 10 интактных мышей С57ВL.
Животных для морфологического гистологического исследования быстро умерщвляли на 3, 7, 10, 14 сутки от начала исследования. На каждый срок - по 5-8 животных в двух повторениях. Обработку материалов для гистологических исследований проводили в основном по общепринятой методике (А.И. Кононский, 1976, А.Ф. Киселева и соавт., 1983) со следующими модификациями: фиксацию материала производили не в формалине, а в жидкости Карнуа (абс. Спирт : хлороформ : ледяная уксусная кислота - 6:3:1), которая является более щадящей для нежной ткани меланомы, легко проникает в толщу ткани, быстро осаждает белки, препятствует диффузии отдельных соединений в фиксатор; окраску производили гематоксилином Караччи, который адекватен в случае прокрашивания пигментных веществ. Остальные этапы проводили по классической методике.
При микроскопировании гистологических препаратов, наряду с качественным морфологическим описанием, рассчитывали индекс повреждения (ИП) по Г.А. Лавниковой и соавт. (1978) в итоге изучение 2 тыс. клеток в каждом стекле как объективный количественный тест для оценки степени терапевтического метаморфоза, по формуле:
где По - средний объем паренхимы в опытной группе, Пк – средний объем паренхимы в контрольной группе. По Г.А. Лавниковой, с помощью ИП можно объективно сравнивать эффективность схем лечения. Другим количественным критерием эффективности лечения опухолей является митотический индекс (МИ, определяемый как частное от деления числа делящихся-во всех фазах митоза) к неделящемся клеткам (в %) на 2 тыс. просчитанных клеток и характеризующей степени сохранения жизнеспособности опухолевой ткани и ее полиферативную активность (Н.М. Смирнов и соавт., 1973; Н.К. Дъяконова, В.А. Довбищенко, 1976 и др.).
В качестве современного критерия состояния иммунной системы использовали содержание тимусного сывороточного фактора (ТСФ) и тимозиноподобную сывороточную активность (ТСА), оцениваемые в тесте J.F. Bach (1973). Метод основан на способности гормонов вилочковой железы восстанавливать чувствительность спонтанно розеткообразующих клеток селезенки взрослых тимэктомированных мышей к антитимоцитарной сыворотке (АТС). АТС получали, вводя двукратно кроликам (с двухнедельным интервалом) по 5х10 8 живых тимоцитов мышей. Затем в цитотоксическом тесте определяли активность АТС и использовали ее при титрах 1:50 – 1:100. Высокомолекулярный ингибитор ТСФ удаляли из сыворотки путем ультрафильтрации (фильтр фирмы Amicon). В реакции использовали по 0,1 мл цельной и серийно разбавленной средой 199 сыворотки.
Среда 199 служила также контролем. Селезенку брали у мышей через 10-14 дней после тимэктомии. Клетки извлекали путем разволокнения ткани препаровальными иглами в среде 199, фильтровали через капроновое сито и двукратно отмывали центрифугированием при 400g. Осадок ресуспендировали в среде до концентрации 4х10 7 клеток/мл и взвесь в объеме 0,1 мл добавляли в пробирке с сывороткой и средой 199. Содержимое пробирок перемешивали пипетированием и инкубировали на 60 мин. При 37 0 *С после инкубации во все пробирки вносили по 0,1 мл АТС и комплемента морской свинки в разведении 1:1. Смесь инкубировали еще 30 мин. При 37 0 С. Затем к смеси дабавляли по 0,1 мл суспензии эритроцитов барана 10х10 7 клеток/мл, перемешивали, центрифугировали при 250g и инкубировали 60 мин. При 4-8 0 С. осадок ресуспендировали 5 мин., вращая пробирки со скоростью 10 об/мин подсчет розеток производили в камере Горяева. За розетку принимали лимфоцит присоединивший 4 и более эритроцитов. Титром ТСФ считали последнее разведение сыворотки, вызывающий 50 % редукцию числа розеткообразующих клеток по отношению к контролю. Результаты выражали в виде log2 титра.
Полученные результаты представлены в таблицах и на рисунках.
Установлено, что введение флараксина в дозе 30 мг/кг не оказало выраженного тормозящего влияния на скорость роста меланомы В-16. Более того, наблюдалась даже некоторая тенденция сокращения средней продолжительности мышей, подвергшихся лечению в этой дозе (см. табл.1, рис.1). Этот результат можно рассматривать как первое проявление токсичности препарата, которое свидетельствует о нецелесообразности увеличения разовой дозы препарата.
При снижении разовой дозы до 15 мг/кг наблюдали эффект торможения опухолевого роста на 18е и 20е сутки после перевивки. Однако в целом эффект препарата в этих условиях был минимальным.
Со снижением дозы препарата до 7,5 мг/кг в сутки торможение опухолевого роста оказалось более выраженным, приблизившись к 50%, а средняя продолжительность жизни мышей с меланомой В-16 возросла на 3,1 в сут. Этот эффект препарата свидетельствует о перспективности дальнейших исследований с его применением и, в частности, о необходимости анализа механизмов его специфической активности.
В морфологических исследованиях было установлено макроскопически, что в подопытных группах мышей плотность кусочков опухолевой ткани при фиксации была значительно ниже, чем в контроле: ткань была рыхлой, а цвет был красно-коричневым, в отличие от черно-коричневой и более плотной ткани опухоли из контрольной группы. Макроскопические различия между контрольными и опытными образцами не вызывали сомнений, тогда как между подопытными группами выраженных отличий не отмечено.
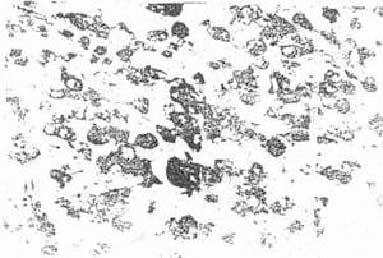
Патогистологически в препаратах интактной меланомы В-16 определялись преимущественно мелкие клетки овальной формы; встречаются также округлые и удлиненные клетки. Ядра чаще гиперхромны. Меланоциты располагаются сплошными полями, плотно прилегают друг к другу (рис.2). Некротические и некробиотические участки в интактных опухолях встречаются редко. Характерно для гистологического строения меланомы В-16 большое количество сосудов, испещряющих всю площадь среза. Зоны пролифорацин располагаются мозаично. В таких зонах митотический индекс достигает 3,9 %. Число клеток в состоянии некроза и некробиоза незначительно (менее 2 %),поэтому показателем индекса повреждения (ИП) в контроле можно пренебречь.
Результаты эксперимента.
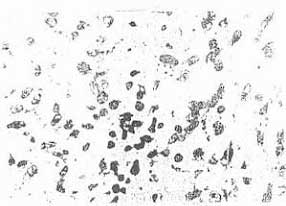
В препаратах опухолей мышей этой группы на 3 и 7 сут отмечалось повышенное, по сравнению с контролем, число клеток в поле зрения, находящихся в состоянии дистрофии и вакуолизации (рис.3). Однако обширные поля некроза встречались редко. Дегенеративно измеренные клетки, явления пикноза, кариорексиса и кариолизиса редки. Индекс повреждения ткани составил 38,7%, т.е. был невысоким, тем более, что полиферация клеток сохраняется на уровне контроля. Высокая репродуктивная способность опухолевой ткани на 3 и 7 сут лечения послужила причиной восстановления жизнеспособности и сохранения потенции к росту меланомы в условиях введения препарата в дозе 30 мг/кг массы мышей. На 14 сут ИП начал снижаться, составив 32,3%. В этот срок наблюдения характерен некробиоз отдельных клеток с образованием их теней, межклеточный сток.
 |
 |
 |
 |
 |
Патологические и морфологические изменения в этой группе животных на всем протяжении исследования более выражены, чем при введении флараксина в дозе 30 мг/кг. В препаратах отмечались явления лимфоидно-гистиоцитарной инфильтрации опухолевой ткани, очаговая клеточная пролиферация стромы.
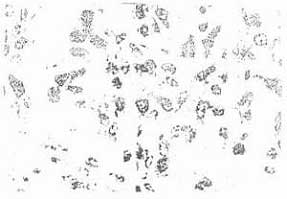
Паренхима в отдельных участках подвергалась частичной резорбции. ИП был существенно выше, чем в предыдущей группе, и равнялся 57,9%, т.е. был достаточно значительным. Однако пролиферативная активность ткани опухоли, составляющая потенциал ее ре-популяции и дальнейшего роста, снизилась незначительно. В препаратах, особенно на 10 – 14 сут., отмечено характерное возрастание фиброзной ткани, не наблюдавшееся в контроле в предыдущей, опытной группе животных. Суммируя результаты, полученные в этой серии экспериментов, мы можем отметить, что появление таких признаков, как лимфоидно-гистиоцитарная инфильтрация, пролиферация стромы и разрастание фиброзной ткани свидетельствует об активизации механизмов противоопухолевой резистентности организма под влиянием введения препарата в суточной дозе 15,0 мг/кг. Однако сохранение потенциала пролиферации, а также недостаточность деструкции ткани опухоли, выявившееся в этих экспериментах, свидетельствуют либо о неоптимальных условиях применения флараксина, либо о необходимости его комбинирования с другими противоопухолевыми воздействиями.
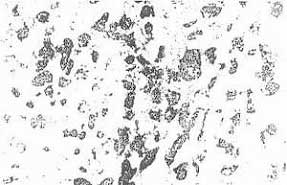
Патогистологические изменения в ткани опухоли в этой серии экспериментов выражены в еще большей степени, чем в предыдущей серии. В препаратах определялась активная лимфоидно-гистиоцитарная инфильтрация, а также пролиферация клеточных элементов стромы. Часто встречаются участки резорбции паренхимы опухоли. На 10е 14е сут характерны разрастания соединительной ткани, между фрагментами которой видны участки рассасывания опухолевой ткани и отдельные островки меланоцитов. Наблюдались также мелкие (по 10-12 клеток) участки опухолевой ткани, ограниченные мышечными волокнами (рис.4). Индекс повреждения (ИП) в этой серии экспериментов был наиболее высоким – 68,9%, характеризуя глубину изменений в опухолевой ткани. Однако пролиферативная активность клеток опухоли сохранена, что свидетельствует о высокой вероятности возобновления опухолевого роста.
Характер дозовой зависимости эффекта флараксина наводит на мысль о том, что механизм его противоопухолевого действия своеобразен и существенно отличается от эффекта классических препаратов (алкилирующих агентов). Изучение механизма действия препарата представляет самостоятельный интерес и может оказаться полезным в плане совершенствования методики его применения с целью получения более высокого противоопухолевого эффекта. В частности, представляет интерес изучение влияния препарата на биосинтез ДНК в клетках опухоли, на иммунологические механизмы. Некоторые результаты влияния флараксина на иммунную систему представлены ниже.
Результаты исследования динамики титра ТСФ, а также количества клеток в тимусе мышей и массы тимуса в процессе лечения мышей с меланомой В-16 представлены в таблицах 2, 3, 4.
Установлено, что у интактных мышей С57ВL нормальные значения log2 титра ТСФ составили 5,0±0,15 (n=36), а масса тимуса – 51,2 ± 2,16 мг (n=44). Под влиянием опухолевого процесса титр ТСФ закономерно снижается, вплоть до терминальной стадии, когда отмечено даже некоторое его повышение. Масса тимуса, как и количество клеток в нем, также резко снижается.
| Доза флараксина, мг/кг | До начала введения флараксина | Сроки после начала лечения, сут | |||
|---|---|---|---|---|---|
| 3 сут | 7 сут | 10 сут | 14 сут | ||
| 30 | 3,6±0,16 x | 2,7±0,22 x | 2,78±0,19 x | 3,0±0,24 x | 3,16±0,27 x |
| 15 | --------- | 3,0±0,17 x | 3,1±0,20 x | 3,3±0,17 x | 4,22±0,29 x |
| 7,5 | --------- | 3,5±0,15 x | 3,85±0,18 x | 3,3±0,17 x | 4,05±0,31 x |
Введение флараксина в дозах 15,0 и 30,0 мг/кг не оказало существенного влияния на эти показатели. Более того, можно говорить о некотором углублении опухолевого иммунодефицита под влиянием флараксина. Тот же препарат в дозе 7,5 мг/кг , в отличии от этих данных, оказывал умеренно выраженное стимулирующее действие на иммунологические показатели (см. таблицы). Таким образом, и эти данные свидетельствуют о своеобразии механизма противоопухолевого действия флараксина. Если алкилирующие препараты, а также другие классические цитостатики одновременно выступают как мощные иммунодепресанты, то флараксин в наиболее эффективной дозе иммунодепресивным действием не обладает, а в дозах, вызывающих некоторое угнетение иммунных механизмов, практически не оказывает тормозящего влияния на рост опухоли.
Резюмируя полученные данные, полагаем необходимым подчеркнуть, что противоопухолевый эффект флараксина умерен и что, ориентируясь на эти данные, нельзя расчитывать на полное излечение меланомы с помощью этого препарата. С другой стороны, своеобразие механизма действия флараксина позволяет предполагать, что он является полезным компонентом комбинированной и комплексной терапии меланобластомы.
Целесообразно продолжить анализ механизма противоопухолевого действия флараксина, обратив особое внимание на его влияние на нуклоиновый обмен (синтез ДНК в опухолевых нормальных клетках), а также на эндокринную регуляциию, в особенности на функцию коры надпочечников. Есть косвенные данные, позволяющие предполагать, что флараксин оказывает умеренное ингибирующее влияние на продукцию глюкокортикоидов, которая при опухолевом процессе обычно усилена. Возможно, что эта сторона действия флараксина (которую еще следует подтвердить экспериментально) вносит вклад в его противоопухолевай эффект.
Таким образом, проведенные эксперименты свидетельствуют о целесообразности клинического изучения эффективности флараксина при меланобластомах.
д-р.м.н., проф. -В.А.Барабой,
к.м.н. - В.А.Зинченко,
к.м.н. - С.В.Мартыненко.
Дата 28 января 1992 года
Читайте также:

