Мудунов опухоли головы и шеи
Специалист по опухолям головы и шеи

Доктор Мудунов является одним из ведущих специалистов страны, занимающихся лечением опухолей головы и шеи. Следует отметить его большую научную работу – он постоянный участник международных, общенациональных и региональных конференций и школ, посвященных лечению отдельных онкологических заболеваний органов головы и шеи. Руководит работой аспирантов и докторантов.
2007 - 2013 гг.- работал старшим и ведущим научным сотрудником того же отделения.
Автор 111 публикаций в российских и зарубежных научных изданиях, автор 3 монографий.
разработка высокотехнологичных хирургических вмешательств при злокачественных опухолях полости рта;
трансоральные органосохранные хирургические вмешательства при злокачественных опухолях ротоглотки и гортаноглотки;
эндоларингеальные органосохранные хирургические вмешательства при раке гортани с использованием СО2 лазера;
расширенно-комбинированные хирургические вмешательства при злокачественных опухолях поражающих основание черепа и краниофациальную зону;
хирургические вмешательства при злокачественных опухолях, поражающих наружное и среднее ухо, пирамиду височной кости и подвисочную ямку (латеральный отдел основания черепа);
реконструктивно-пластические хирургические вмешательства у пациентов с злокачественными опухолями головы и шеи;
эндоназальные хирургические вмешательства при опухолевой патологии полости носа и придаточных пазух, при поражении переднего отдела основания черепа (FESS-хирургия), хирургические вмешательства при раке щитовидной железы и т.д.

Специалист по опухолям головы и шеи
Доктор Мудунов является одним из ведущих специалистов страны, занимающихся лечением опухолей головы и шеи. Следует отметить его большую научную работу – он постоянный участник международных, общенациональных и региональных конференций и школ, посвященных лечению отдельных онкологических заболеваний органов головы и шеи. Руководит работой аспирантов и докторантов.
разработка высокотехнологичных хирургических вмешательств при злокачественных опухолях полости рта;
трансоральные органосохранные хирургические вмешательства при злокачественных опухолях ротоглотки и гортаноглотки;
эндоларингеальные органосохранные хирургические вмешательства при раке гортани с использованием СО2 лазера;
расширенно-комбинированные хирургические вмешательства при злокачественных опухолях поражающих основание черепа и краниофациальную зону;
хирургические вмешательства при злокачественных опухолях, поражающих наружное и среднее ухо, пирамиду височной кости и подвисочную ямку (латеральный отдел основания черепа);
реконструктивно-пластические хирургические вмешательства у пациентов с злокачественными опухолями головы и шеи;
эндоназальные хирургические вмешательства при опухолевой патологии полости носа и придаточных пазух, при поражении переднего отдела основания черепа (FESS-хирургия), хирургические вмешательства при раке щитовидной железы и т.д.
2007 - 2013 гг.- работал старшим и ведущим научным сотрудником того же отделения.
Автор 111 публикаций в российских и зарубежных научных изданиях, автор 3 монографий.


- VK
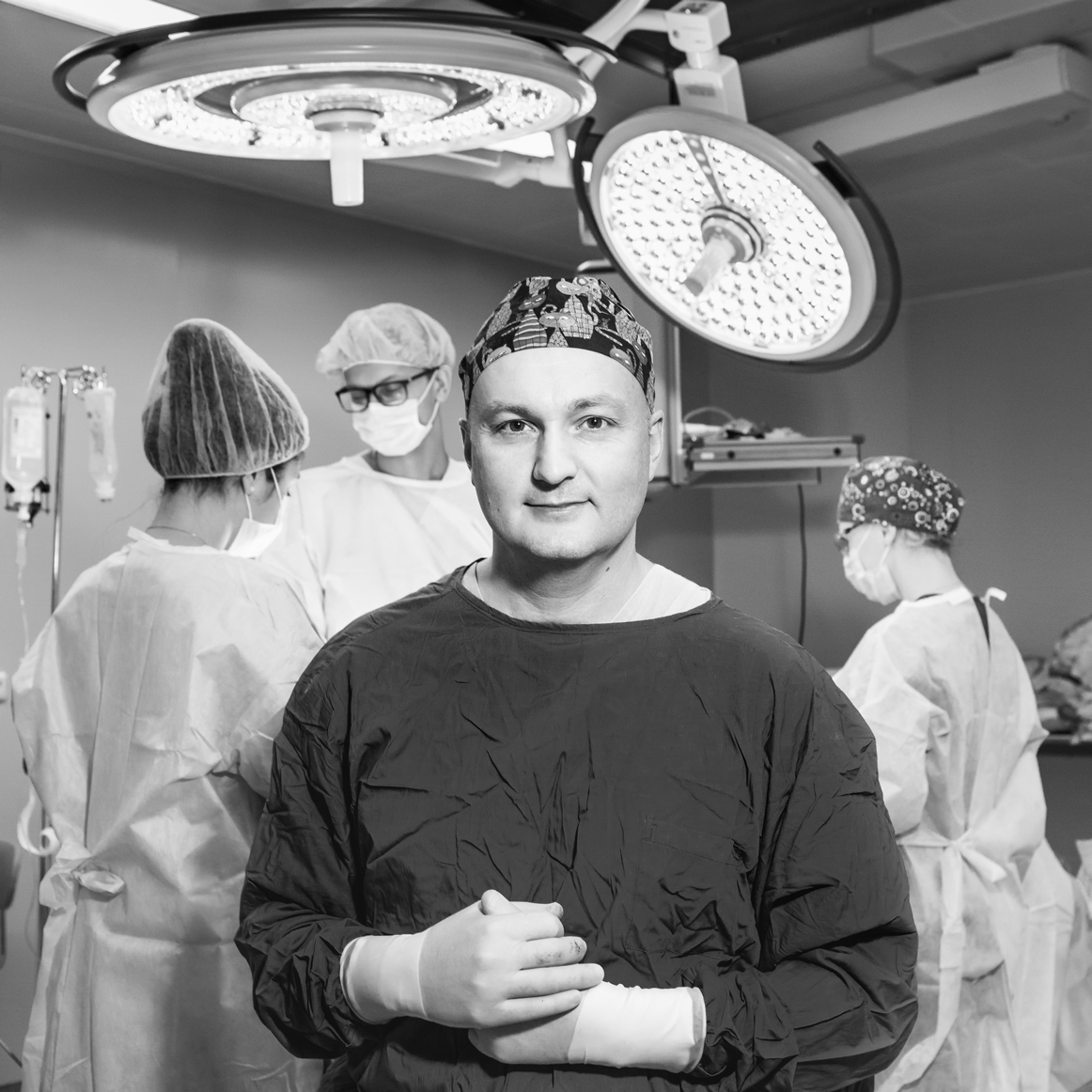
Онколог Али Мудунов — президент Российского общества специалистов по опухолям головы и шеи, заведующий отделением опухолей головы и шеи НМИЦ онкологии им. Н.Н. Блохина — считает, что москвичи заболевают раком не чаще других жителей планеты. Но все-таки жизнь в большом городе накладывает отпечаток.
Какая онкология в Москве встречается чаще всего?
Конечно, Москва как мегаполис более загрязнена, чем менее населенные города меньшего размера. Но больших различий по онкологической заболеваемости в мегаполисе и в небольшом городе где-то на удалении на самом деле нет. Бывают разве что небольшие изменения в сторону болезней, которые напрямую связаны с экологической обстановкой.
Известно, что в районах и регионах индустриально более развитых (в любой стране по всему миру) всегда преобладают такие заболевания, как рак легкого, рак желудка, рак почек — болезни, напрямую связанные с воздействием внешней среды. Москва тоже не исключение из этого правила.
Что в Москве влияет на заболеваемость помимо экологии? Стресс?
Стресс в определенной степени влияет даже не на появление рака, а на скорость его развития, потому что стрессовая ситуация истощает в первую очередь иммунную систему. Есть общая иммунная защита от инфекционных заболеваний, и есть такая же иммунная защита от развития или прогрессирования опухолевого заболевания. У человека, который не подвержен сильному стрессовому влиянию, этот период может длиться очень долго, и опухоль может и не развиться в развернутую, полноценную клиническую картину заболевания. Но есть риск у жителя, который постоянно находится в стрессе, не соблюдает режим сна, отдыха и бодрствования, сильно перегружается на работе, подвержен информационной перегрузке, которая истощает ресурсы организма. Если даже есть какая-то предрасположенность к развитию ракового заболевания или предрак, который достаточно хорошо сдерживается иммунной системой, то у таких людей он может прогрессировать в более развернутую клиническую картину или перейти из предракового заболевания в раковое. Такое возможно. Такие механизмы описаны. В принципе, теоретически это возможно, но опять-таки нет четкой статистики, то есть никто эту статистическую работу о том, как стресс влияет на развитие определенных онкологических заболеваний, не проводил не только в нашей стране, но и в мире.
Есть мнение, что стресс даже провоцирует рак.
С точки зрения обоснованных научных фактов таких данных нет. Я не беру крайние варианты (такое в повседневной жизни не встречается), когда человек находится в критической стрессовой ситуации и что-то угрожает его жизни. Такие маргинальные формы стресса, безусловно, могут приводить к развитию чего угодно, в том числе и онкологии. Если мы берем среднестатистического жителя такого города, как Москва, у нас нет таких экстремальных стрессовых ситуаций. Есть хроническое стрессовое воздействие на организм. Это приводит к переутомляемости, к развитию депрессий, которые сами по себе с течением времени, с десятилетиями могут увеличить риск развития такого заболевания, но не так, что какая-то стрессовая ситуация привела к развитию рака. Такого не бывает.
Каков процент раковых заболеваний, полученных по наследству?
Всего по статистике в мире около 5% злокачественных опухолей являются наследственными, то есть это опухоли, возникающие вследствие мутаций, которые закреплены в геноме и передаются через половые клетки. Это так называемые герминальные мутации. Чаще всего они обладают аутосомно-доминантным типом наследования — у каждого второго из наследников такого человека развивается аналогичное заболевание.
Кроме этого, есть еще так называемые семейные формы рака, для которых характерен аутосомно-рецессивный тип наследования — их примерно 15%. В данном случае передается определенная предрасположенность к развитию злокачественной опухоли, но степень этой предрасположенности на самом деле выражена в гораздо меньшей степени, чем при классических формах наследственного рака.
В целом перечень наследственных форм рака достаточно большой. Они делятся на так называемые синдромы и чаще связаны с мутацией какого-то одного определенного гена. Как правило, обладатели наследственных форм рака имеют риск развития нескольких типов опухолей.
Не согласен с этим утверждением по нескольким причинам. Во-первых, рак, или, как принято говорить, злокачественная опухоль, может развиться и в детском возрасте. Во-вторых, мы знаем много случаев отсутствия злокачественных опухолей у людей старшей возрастной группы. Если говорить правильно с точки зрения статистики, то есть науки, то существует определенное распределение по возрастным группам. Чаще раком заболевают люди старшей возрастной группы — в силу ряда причин, о которых я уже говорил ранее (длительное воздействие вредных факторов внешней среды, курение, алкоголизм, хронические инфекционные заболевания, например язвенная болезнь желудка, производства, связанные с вредными канцерогенными веществами, и многое другое). Почему люди старшей возрастной группы? Да потому что нужно время, чтобы воздействие этих факторов пробило брешь в обороне организма.
Кто ваши пациенты?
Я занимаюсь лечением злокачественных опухолей головы и шеи. Это определенная популяция людей из общей группы больных, которые заболевают раком. Среди моих пациентов преобладают люди зрелого возраста. Это 60–65 лет, потому что пик заболеваемости той патологией, которую мы лечим, приходится на эту возрастную группу, но в то же время среди моих пациентов сейчас достаточное количество лиц молодого и среднего возраста.
Те пациенты, которые не заболели раком ротоглотки из-за курения, стали замещаться пациентами, у которых рак вызван новым фактором риска — вирусом папилломы человека.
Есть еще одна интересная особенность: в последние 10–15 лет (это по всему миру происходит — такая тенденция) растет количество молодых пациентов, у которых развивается рак ротоглотки, ассоциированный с вирусом папилломы человека. В то время как традиционные формы рака верхних дыхательных и пищеварительных путей развиваются на фоне длительного курения и чрезмерного употребления алкоголя у людей старшего возраста. Это то, чем я занимаюсь. Например, это рак полости рта, рак ротоглотки, рак гортани.
То есть курение — превалирующий фактор?
Да. И злоупотребление крепкими спиртными напитками. Порядка 90% раков, с которыми мы встречаемся, как раз связаны с курением. В последнее время в нашей стране, как и во многих развитых странах мира, вводятся ограничительные меры по курению. И это дает свои плоды, так, наметилась выраженная тенденция к снижению заболеваемости раком гортани, вызванного именно курением. То же самое наблюдается для рака ротоглотки, при этом происходит интересное явление с точки зрения эпидемиологии — те пациенты, которые не заболели раком ротоглотки из-за курения, стали замещаться пациентами, у которых рак вызывается новым фактором риска — это вирус папилломы человека, который совсем недавно вышел на арену. Самое важное и интересное, что им страдают лица молодого возраста, то есть люди от 25 до 40 лет. Таким образом, одна возрастная группа пациентов стала замещаться другой, более молодой. А по полу среди моих пациентов преобладают мужчины, потому что меньшее количество женщин злоупотребляет курением и алкоголем.
Речь идет о злостных курильщиках, то есть о человеке, который курит пачку, две пачки в день. Нет, конечно, четкой градации, одна сигарета или десять сигарет, выкуренных в день, приводят к развитию какого-то онкологического заболевания, но чем больше человек курит, тем больше риск заболеть раком. Что касается плоскоклеточного рака, то есть рака, который развивается из слизистой оболочки дыхательно-пищеварительных путей, — это преобладающая морфологическая форма, которая бывает у наших больных, — соотношение примерно четыре к одному в сторону мужчин. Есть другая патология, которой мы тоже занимаемся, — это рак щитовидной железы. В этой группе преобладают женщины в обратной пропорции, то есть у женщин чаще бывает рак щитовидной железы. Он регистрируется чаще в группе людей, у которых есть узловые образования в щитовидной железе. Как раз в женской популяции чаще бывают различные аутоиммунные заболевания щитовидной железы, которые сопровождаются образованием узлов в щитовидной железе.
Вирус папилломы человека, о котором вы говорили раньше, есть у всех, разве нет?
Это грамотный вопрос. Есть определенные типы вируса. Вирус папилломы человека — это большая группа. Это семейство, внутри которого больше двухсот типов вируса. Из них есть наиболее опасные в канцерогенном плане, которые приводят к развитию рака. Для рака ротоглотки 95% — это вирусы 16-го и 18-го типа. Они чаще всего приводят к развитию рака, но это не значит, что у всех людей. Из всех носителей вируса папилломы человека в области полости рта и ротоглотки всего примерно у 1% людей развивается рак ротоглотки, то есть должно быть определенное стечение обстоятельств: и снижение локального иммунитета, и наличие носительства, низкие титры антител и так далее. Все это приводит к развитию заболевания. Кстати, этот риск намного выше в мужской популяции, чем в женской. Этому тоже есть объяснение.
Какое?
Эволюционно женский организм обладает гораздо большим иммунитетом и против бактерий, и против вирусов, чем мужской. Связано это с тем, что вообще организм женщины гораздо устойчивее в физиологическом плане, чем мужской. Это научный факт. Начнем с того, что организм женщины может выносить длительные кровопотери, то есть на тех уровнях гемоглобина, на которых может жить женский организм, мужской организм погибнет сразу же. То же касается защиты от различных инфекционных факторов, в том числе и вирусов. Это такое эволюционное приобретение женского организма. Иммунитет против вируса папилломы человека у женщин в разы выше, чем у мужчин, именно благодаря этой особенности женщины в разы реже заболевают ВПЧ-ассоциированным раком ротоглотки, чем мужчины.
Почему вы выбрали именно эту сферу онкологии?
В моем случае это нельзя объяснить научно-практическим интересом, хотя этот интерес у меня сейчас, безусловно, есть. Сейчас я понимаю, почему я этим занимаюсь, но когда человек приходит в эту профессию, он еще не руководствуется такими соображениями, то есть выбор фактически неосознанный. Знаете, чем он обоснован? Призванием лечить людей. Если говорить конкретно о специальности — почему я выбрал именно опухоли головы и шеи — у меня был жизненный пример, это мой учитель, которого я знал с детства, у меня был ориентир. Мне с детства нравилась эта специальность. Когда я повзрослел и уже учился на медицинском факультете, я готовился стать специалистом, который будет лечить пациентов с опухолями головы и шеи. У меня была такая, можно сказать, немножко предрешенная ситуация в жизни. Сейчас я получаю удовлетворение от своей работы. Я доволен тем, чем занимаюсь.
Расскажите, как заметить первые симптомы рака.
Какие?
Например, саркомы — вид злокачественной опухоли. Мягкотканная саркома не заметна до тех пор, пока она не достигнет больших размеров. Проявляется как шишка где-то на руке или ноге. Пока она не вырастет и не появится над поверхностью кожи, человек ее может просто не замечать.
А вы слышали о канцерофобии, боязни рака?
Обращаются ли к вам пациенты с канцерофобией?
Вы знаете, в общей численности пациентов, которые приходят ко мне на обследование, таких больных очень мало. Может быть, 1%, а может быть, меньше, но действительно такие люди есть. Как правило, канцерофобия у них развивается на фоне какого-то предшествующего столкновения с онкологическим больным. Часто это родственник, который умер от рака. Канцерофобия развивается на фоне таких подсознательных переживаний. Потом уже человек начинает проецировать на себя эту ситуацию и в любом своем симптоме находит проявления рака. Он начинает искать заболевание, которого на самом деле нет.
Конечно. Есть психологическая помощь. Причем есть психологи, которые специализируются только на онкологических пациентах, а канцерофобия может быть и у пациента, который не болеет раком и не болел никогда, и бывает у пациента, который уже прошел через это состояние и вылечился. Это состояние наложило отпечаток, и человек попадает в жутчайшую депрессию с проявлениями канцерофобии в том числе. Во всех очень серьезных больших онкологических клиниках всегда существует служба психологической помощи онкологическим пациентам. Это специально подготовленные люди, которые знают, как с ними работать, как выводить их из этого состояния, как осуществлять медикаментозное лечение и сопроводительные практики. В тяжелых случаях без медикаментов не обходится. На самом деле очень много примеров успешного исхода — вылеченных от этого состояния я знаю лично, они есть и среди моих пациентов.
Пять наиболее распространенных видов рака можно диагностировать на очень ранней стадии.
Расскажите о мифах о раке и о псевдолечении. Сейчас в интернете можно нагуглить не только симптомы, но и лекарства. Были ли у вас такие пациенты и как они собирались лечиться?
Таких пациентов много. Одна из самых распространенных групп — это пациенты, которые не находят помощь в системе здравоохранения, и у них развивается недоверие к врачам. Оно может складываться по разным причинам. Если рассматривать ситуацию с позиции медицины, правда это или неправда, что нетрадиционные методики помогают людям, вылечивают их от рака или нет, я могу отталкиваться только от своего опыта. Я в своей жизни видел много людей, которые занимались самолечением, в том числе и нетрадиционными методами. К большому сожалению, я не видел ни одного пациента, который нетрадиционными методами вылечился. Туда входят и различные травы, и биологические добавки — все что угодно. Если рассматривать этот вопрос в плане помощи пациенту перенести побочные эффекты, например от химиотерапии, то есть положительные примеры, когда прием правильно подобранных гомеопатических средств помогает снизить проявление побочных эффектов химиотерапии или лучевой терапии. Такие случаи описаны, они известны традиционной науке, но в плане излечения — нет, конечно, нет.
А были ли случаи, когда пациенты пытались излечиться магией — приворотом, отворотом?
Вот такие истории из жизни. Есть и приятные истории, когда ты видишь пациента, которому тебе удалось помочь. Знаете, специальность онколога очень своеобразная и интересная. В каком плане? Если ты один раз встречаешься с пациентом, то ты с ним знакомишься на всю жизнь. Потом ты общаешься с ним даже тогда, когда он вылечился. В онкологии не бывает бывших пациентов. Это сначала пациент, а потом это перерастает уже в знакомство и дружбу на всю жизнь. Любой онколог живет тем, что он вспоминает и видит тех людей, которых он вылечил, и это для него колоссальный источник жизненной силы (как это ни странно звучит для человека, который занимается лечением онкологических больных) и стимул для помощи другим людям. Это такая уникальная, очень интересная специальность.
Ваша профессия не вгоняет вас в депрессию?
Она может вогнать в депрессию людей, которые работают не по призванию. А в онкологии невозможно работать не по призванию. Человек, который пришел работать сюда ради денег, не задерживается в этой специальности. Никакие деньги, никакие стимулы не могут удержать его на этом месте, потому что это тяжелая специальность. Если человек не будет получать удовольствие от своей работы, он просто не сможет пропустить через себя этот объем эмоций, сопровождающий лечение любого пациента.
Дорого лечиться от рака?
Как ни странно, вопреки распространенному мнению в нашей стране система здравоохранения покрывает подавляющее большинство случаев лечения рака. Бывают редкие случаи, когда пациенту нужно какое-то дорогостоящее лекарство, которого просто нет в конкретном регионе, но даже из этой ситуации можно выйти. Лечение онкологического больного — это не какой-то один метод: это и операция, и лучевая терапия, и химиотерапия. Если говорить по каждой конкретной методике, вы и сами знаете, что лечение онкологических пациентов в нашей стране бесплатно, и оно покрывается действующей системой финансирования — это обязательное медицинское страхование или есть специальные разделы, так называемые квоты на высокотехнологичную медицинскую помощь. Если говорить вообще, виртуально о стоимости лечения онкологического больного, безусловно, это одна из самых финансово емких отраслей не только в нашей стране, но и во всем мире. Это дорогостоящее лечение из-за самых продолжительных операций, дорогого аппаратного обеспечения и самых дорогих лекарственных препаратов. Безусловно, это очень финансово затратная отрасль медицины, но в то же время она развивает всю медицину в целом, потому что производит огромное количество открытий и в фундаментальной медицинской науке, и в прикладной — очень много достижений из онкологической практики и исследований переходит в другие отрасли, и специалисты других, смежных специальностей ими пользуются.
Введение. В настоящее время отсутствуют методы лечения рецидивов плоскоклеточного рака головы и шеи, достоверно увеличивающие общую выживаемость (ОВ) пациентов, что обусловливает актуальность данной проблемы.
Цель исследования – анализ результатов лечения пациентов с рецидивами плоскоклеточного рака головы и шеи, оценка влияния факторов риска рецидива и различных вариантов лечения рецидива на показатели ОВ.
Материалы и методы. Проанализированы данные 182 больных с рецидивами плоскоклеточного рака гортани, полости рта и языка, находившихся на лечении в Челябинском областном клиническом центре онкологии и ядерной медицины в период с 2012 по 2016 г. В 1-ю группу вошли 66 пациентов, подвергшихся хирургическому лечению, во 2-ю – 25 пациентов, прошедших курс повторной лучевой терапии, в 3-ю – 46 пациентов, у которых проведена полихимиотерапия, в 4-ю – 9 пациентов, лечение которых было комбинированным, в 5-ю – 36 пациентов, которым специальное лечение не было назначено ввиду низкого индекса Karnofsky (
Введение. По рекомендациям российских и международных профессиональных ассоциаций лечение гермином можно начинать без обязательной гистологической верификации благодаря наличию биохимических опухолевых маркеров. Однако при первичных герминомах головного мозга уровень этих маркеров остается в пределах нормы, поэтому гистологическая верификация становится необходима. Стереотаксическая биопсия и биопсия с применением транскраниальных доступов в некоторых случаях связаны с риском повреждения критически важных структур. Сейчас провести биопсию и даже тотально удалить опухоль селлярной и параселлярной локализации возможно с использованием эндоскопического эндоназального доступа.
Цель исследования – продемонстрировать возможность использования эндоскопического транссфеноидального доступа для выполнения хирургического вмешательства в объеме от биопсии до тотального удаления первичных гермином хиазмально-селлярной локализации.
Результаты. Объем хирургического вмешательства варьировал от биопсии (n = 4) до частичного (n = 5) и тотального (n = 4) удаления опухоли. Во всех случаях диагноз был гистологически верифицирован. Ни у одного из пациентов в послеоперационном периоде не наблюдалась ликворея и / или менингит, что позволяет оценить эндоскопическое вмешательство как безопасное и эффективное.
Заключение. Использование эндоскопического эндоназального доступа для гистологической верификации и удаления гермином хиазмально-селлярной области безопасно и эффективно.
Цель исследования – проанализировать результаты комбинированного противоопухолевого лечения, включающего глоссэктомию, по поводу местно-распространенного и рецидивного плоскоклеточного орофарингеального рака.
Материалы и методы. Проведен ретроспективный анализ результатов комбинированного и комплексного противоопухолевого лечения 19 пациентов, прошедших лечение в Нижегородском областном клиническом онкологическом диспансере с 2009 по 2019 г. В ходе операции у всех пациентов осуществлена сегментарная резекция нижней челюсти в связи с массивной инвазией опухоли в надкостницу, для реконструкции дефекта после тотальной глоссэктомии применяли пекторальный кожно-мышечный лоскут. Ввиду широкой местной распространенности опухоли выполнено фасциально-футлярное иссечение клетчатки шеи (n = 7) или радикальная шейная лимфодиссекция (n = 12). В ходе профилактической операции у 2 пациентов обнаружены не выявленные до операции метастазы в 1 лимфатическом узле шеи.
Результаты. Местные гнойно-некротические послеоперационные осложнения зарегистрированы у 11 пациентов. Отмечено, что при выполнении операции у пациентов, не проходивших лучевую терапию, осложнения развились в меньшем числе случаев (n = 4), а степень их тяжести была ниже: I степени – у 3 больных, III степени – у 1. Если операции предшествовала лучевая терапия, гнойно-некротические осложнения развивались чаще – в 7 случаях, при этом они были более тяжелыми: I степени – у 2 пациентов, II степени – у 1, III степени – у 4. Летальность составила: 30-дневная – 10,5 %, 60-дневная – 21 %, 90-дневная – 37 %. Причинами смерти стали осложнение гастростомии – профузное кровотечение из стенки желудка (n = 1), острый психоз, осложненный отеком головного мозга (n = 1), нарастания сердечной недостаточности (n = 1), некроз передней брюшной стенки и кахексия, развившиеся после гастростомии (n = 1), продолженный опухолевый рост между курсами химиотерапии (n = 3). Живы более 90 дней после операции 12 пациентов, более 2 лет – 3 пациента. Ввиду невозможности глотания большинству пациентов вводили назогастральный зонд, так как одномоментная гастростомия увеличивает продолжительность травматичной операции и отягощает послеоперационный период.
Заключение. При проведении многокомпонентной операции после лучевой терапии местные гнойно-некротические послеоперационные осложнения регистрируются чаще, чем при отсутствии лучевой терапии. Высокая летальность в первые 90 дней после операции (n = 7) из-за местной распространенности обусловлена в целом тяжелым состоянием больных раком на поздней стадии и наличием сопутствующих заболеваний, однако обоснованным представляется отказ от гастростомии в пользу введения назогастрального зонда, поскольку летальные исходы в раннем послеоперационном периоде могут быть обусловлены связанными с ней осложнениями.
Введение. Пациенты с опухолями головы и шеи зачастую нуждаются в трахеостомии. Данная манипуляция – сложное хирургическое пособие, несущее риск осложнений, в том числе опасных для жизни.
Цель исследования – оценить результаты выполнения пункционной трахеостомии с использованием нового устройства SafeTrach.
Материалы и методы. В исследование включен 21 пациент. У всех пациентов была выполнена трахеостомия с использованием устройства SafeTrach.
Результаты. Среднее время, затрачиваемое на выполнение процедуры, составило 11,8 ± 3,4 мин и не коррелировало с индексом массы тела и видом предшествующего лечения (r = 0,08, p = 0,7 и r = 0,08, p = 0,73 соответственно). Из всех возможных осложнений трахеостомии лишь в 1 (4,7 %) случае развилось кровотечение в послеоперационном периоде.
Заключение. Описанная методика объединяет в себя все преимущества открытой и пункционной трахеостомии, характеризуется простотой выполнения, не требует эндоскопического контроля, что указывает на целесообразность ее широкого внедрения.
Цель исследования – изучение непосредственных и отдаленных результатов использования свободного лучевого лоскута для замещения сложных дефектов при комбинированном и комплексном лечении больных местно-распространенным плоскоклеточным раком слизистой оболочки полости рта.
Материалы и методы. В отделении опухолей головы и шеи Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина в 2010–2018 гг. у 28 больных местно-распространенным плоскоклеточным раком слизистой оболочки полости рта (20 женщин и 8 мужчин в возрасте от 23 лет до 71 года) выполнено хирургическое удаление опухоли с одномоментной пластической реконструкцией дефекта свободным реваскуляризированным лучевым лоскутом. У 10 пациентов был рак слизистой оболочки щеки, у 8 – языка, у 6 – дна полости рта, у 2 – ретромолярной области, у 1 – твердого неба, у 1 – альвеолярного отростка нижней челюсти. Первичные формы рака были у 17 больных, рецидивные – у 4, остаточные (после лучевого или химиолучевого лечения) – у 7.
Результаты. Полное приживление лучевого лоскута наблюдалось в 96,4 % случаев. При послеоперационном гистологическом исследовании установлено, что края резекции во всех случаях были свободными от опухоли. В послеоперационном периоде возникли следующие осложнения: полный некроз лоскута – у 1 пациента с тяжелыми сопутствующими заболеваниями, краевой некроз лоскута – у 2 пациентов (в обоих случаях раны, возникшие после отторжения некротических тканей, зажили вторичным натяжением), тромбоз суральных вен голеней – у 1 пациента, кровотечение из острой язвы желудка на 6-е сутки после операции – у 1 пациента, при этом экстренный гемостаз был выполнен эндоскопическим методом. Летальных исходов не зарегистрировано. Длительность послеоперационного периода составила в среднем 14 дней. При последующем наблюдении пациентов рецидивы опухоли в полости рта возникли у 4 (14,3 %) больных, рецидивы регионарных метастазов – у 2 (7,1 %). Отмечены хорошие эстетические и функциональные результаты. Адекватное восстановление функций дыхания, жевания, глотания и речи позволило обеспечить полноценную реабилитацию пациентов. Лучевой лоскут во всех случаях был хорошо адаптирован к органам полости рта и соответствовал по толщине и консистенции окружающим тканям.
Заключение. Использование свободного лучевого лоскута позволяет успешно выполнять реконструкцию обширных и сложных дефектов после хирургического удаления местно-распространенных первичных и рецидивных форм плоскоклеточного рака слизистой оболочки полости рта различной локализации. Благодаря хорошим регенераторным возможностям лоскута дооперационная лучевая терапия не влияет на частоту местных осложнений. Наблюдается полноценное восстановление жизненно важных функций полости рта, хорошие эстетические и функциональные результаты.
Введение. Внедрение в клиническую практику ингибиторов тирозинкиназы позволило улучшить результаты лечения пациентов с радиойодрезистентным дифференцированным раком щитовидной железы (РЙР ДРЩЖ). В качестве препарата 1-й линии у данной категории больных рекомендован ленватиниб.
Цель исследования – анализ обобщенного клинического опыта применения ленватиниба у пациентов с РЙР ДРЩЖ в Российской Федерации.
Материалы и методы. Проводился анализ данных, полученных в период с декабря 2015 г. по сентябрь 2019 г. в 18 медицинских учреждениях России. В исследование включены 77 клинических наблюдений гистологически верифицированного ДРЩЖ с доказанной резистентностью к терапии радиоактивным йодом и последующим прогрессированием опухоли по 1-й версии критериев RECIST (Response Evaluation Criteria in Solid Tumours 1.1, критерии оценки ответа солидных опухолей).
Результаты. Медиана выживаемости без прогрессирования у пациентов, включенных в анализ (n = 72), составила 26,1 мес. В подгруппе пациентов, ответивших на терапию (с полным и частичным ответом), выживаемость без прогрессирования достигла 36,2 мес, превысив аналогичный показатель, полученный при обновленном анализе в регистрационном исследовании SELECT (33,1 мес). При анализе безопасности терапии ленватинибом нежелательные явления были зарегистрированы у 87 % пациентов. При этом тяжелые нежелательные явления наблюдались лишь у 18,2 % пациентов. В 6,5 % случаев развитие нежелательных явлений стало причиной отмены препарата, в 74 % случаев доза ленватиниба была уменьшена.
Заключение. Полученные результаты свидетельствуют об эффективности и хорошей переносимости ленватиниба при РЙР ДРЩЖ в условиях клинической практики в Российской Федерации.
Введение. Базальноклеточный рак кожи (БКРК) составляет до 80 % всех немеланоцитарных форм рака кожи. В 97 % случаев БКР развивается на открытых участках кожи лица, особенно на границе носа и лба, в области крыльев носа, углов глаз и губ. Хирургическое лечение может приводить к грубым косметическим дефектам, в связи с чем все чаще врачи отдают предпочтение консервативным методам, особое место среди которых занимает локальная лекарственная терапия.
Цель исследования – оценить информативность биопсии сигнального лимфатического узла (ЛУ) при плоскоклеточном раке языка cT1–2N0.
Материалы и методы. В проспективное одноцентровое исследование включены 26 пациентов с морфологически верифицированным плоскоклеточным раком языка cT1–2 и отсутствием клинических и радиологических признаков метастатического поражения ЛУ шеи. У всех пациентов проведено радиоизотопное исследование для определения варианта лимфооттока от первичной опухоли и топографии сигнальных ЛУ. Информативность биопсии сигнальных ЛУ оценена при применении 2 диагностических моделей. При использовании 1-й диагностической модели сигнальными ЛУ считались все узлы, которые накапливают коллоид, меченный изотопом 99mTc. В рамках 2-й модели в качестве сигнальных ЛУ рассматривались только узлы, накапливающие радиоколлоид и находящиеся в непосредственной близости к первичной опухоли языка и / или связанные с первичной опухолью приносящими лимфатическими сосудами.
Результаты. При использовании 1-й диагностической модели чувствительность биопсии сигнальных ЛУ составила 66,6 % (95 % доверительный интервал (ДИ) 9,43–99,16 %), специфичность – 100 % (95 % ДИ 85,18–100,00 %), прогностическая ценность положительного результата – 100 %, прогностическая ценность отрицательного результата – 95,83 % (95 % ДИ 82,28–99,13 %), диагностическая точность – 96,15 % (95 % ДИ 80,36–99,90 %), а если вместе с сигнальными ЛУ были удалены все ЛУ, расположенные на одном с ними уровне, информативность биопсии приближалась к 100 %. При использовании 2-й диагностической модели чувствительность биопсии сигнальных ЛУ составила 33,3 % (95 % ДИ 0,84–90,57 %), специфичность – 100 % (95 % ДИ 85,18–100,00 %), прогностическая ценность положительного результата – 100 %, прогностическая ценность отрицательного результата – 92 % (95 % ДИ 83,78–96,24 %), диагностическая точность – 92,31 % (95 % ДИ 74,87–99,05 %).
Заключение. Данные об особенностях лимфооттока от первичной опухоли и топографии сигнальных ЛУ у пациентов с плоскоклеточным раком языка cT1–2N0M0 позволяют определить объем лимфодиссекции у каждого пациента индивидуально. В случае одностороннего лимфооттока односторонняя лимфодиссекция оправданна, а в случае двустороннего лимфооттока она сопряжена с достаточно высоким (до 10 %) риском метастатического поражения ЛУ на противоположной стороне шеи. Необходимо удаление всех ЛУ, накапливающих радиофармпрепарат, и регионарных ЛУ, расположенных на тех же уровнях.
Введение. Посттранскрипционные механизмы определяют биологическое течение и клинические проявления папиллярного рака щитовидной железы (ПРЩЖ). Последние исследования показывают, что увеличение содержания онкогенных микроРНК или снижение содержания онкосупрессорных микроРНК повышает агрессивность опухоли и коррелирует с неблагоприятным прогнозом лечения, что позволяет использовать их для индивидуализации лечения пациентов с ПРЩЖ. Цель исследования – сравнить уровень экспрессии 12 специфичных для ПРЩЖ микроРНК и частоту мутации V600E гена BRAF у пациентов с разным риском рецидива.
Материалы и методы. В исследование включены 175 пациентов с ПРЩЖ. Для количественного анализа экспрессии микроРНК использовали реакцию обратной транскрипции с последующей полимеразной цепной реакцией в реальном времени в фиксированных формалином парафиновых блоках. Вычисляли коэффициент корреляции между уровнем экспрессии 12 микроРНК и наличием мутации BRAF, различных клинико-анатомических особенностей ПРЩЖ, уровнем риска рецидива по системе стратификации риска (Risk Stratification System), разработанной Американской тиреоидологической ассоциацией (American Thyroid Association) в 2009 г.
Результаты. Экспрессия miR-146b, miR-221, miR-144, miR-451a и miR-7 коррелировала с такими признаками, как экстратиреоидный рост опухоли, больший размер, многоочаговость, метастазирование в лимфатические узлы и наличие отдаленных метастазов ПРЩЖ. Наиболее важно, что экспрессия miR-221, miR-144, miR-451a и miR-7 коррелировала с уровнями риска. Это позволяет предположить, что они могут служить критериями стратификации риска рецидива ПРЩЖ. Связи клинической картины ПРЩЖ и наличия мутации гена BRAF не установлено.
Заключение. Полученные в результате исследования данные будут способствовать индивидуальному подбору дооперационной лечебной тактики для пациентов с ПРЩЖ.
Цель исследования – оценка эффективности психологической помощи больным раком гортани после ларингэктомии.
Материалы и методы. В исследование включены 36 пациентов мужского пола в возрасте от 45 до 62 лет с морфологически верифицированным раком гортани II–IV стадий (Т3–4N0–2М0), проходивших лечение в отделении опухолей головы и шеи Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина в 2011–2016 гг. Больные случайным образом были поделены на 2 группы: в 1-ю вошли 14 пациентов, которые проходили только противоопухолевое лечение; во 2-ю – 22 пациента, которым дополнительно оказывалась психологическая помощь. Психическое состояние оценивали до лечения и через 6 мес после полного его завершения. На I этапе исследования были исключены 2 пациента 1-й группы и 1 пациент 2-й группы. Клинико-психологическое исследование проведено с использованием госпитальной шкалы тревоги и депрессии и опросника для определения выраженности психопатологической симптоматики (Simptom Check List-90 Revised).
Результаты. По результатам применения опросника через 6 мес после завершения лечения у больных обеих групп выявлена высокая выраженность психопатологической симптоматики: депрессивности, межличностной сензитивности, а также высокий индекс тяжести дистресса. Однако у больных, которым оказана психологическая помощь, уровень депрессии хотя и был выше, чем нормативные показатели, но оказался статистически значимо ниже, чем у больных, не получивших психологическую помощь. Аналогичные результаты дало применение госпитальной шкалы тревоги и депрессии: уровень депрессии у больных, которым оказана психологическая помощь, статистически значимо ниже, чем у больных без психологического сопровождения (8,3 ± 0,9 и 10,2 ± 0,6 балла
соответственно).
Заключение. Через 6 мес после завершения лечения у больных раком гортани, которым оказывалась психологическая помощь с использованием когнитивно-поведенческой психотерапии, статистически значимо снизился уровень депрессии в сравнении с таковым у больных, не получавших психологическую помощь.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:

