Замещение с хлором для пропана
В химии радикальным замещением называют реакции, в которых свободные радикалы атакуют молекулу вещества, замещая собой отдельные ее атомы. При реакции замещения образуются новые радикалы. Цепная реакция продолжается до момента, когда иссякнут все свободные радикалы.

Определение радикала
Радикал – это атом или молекула, имеющие на внешнем электронном слое один или более неспаренных электронов. То есть таких электронов, у которых нет пары. Радикал может образоваться, когда молекула приобретает один электрон или наоборот, теряет его. В своем большинстве свободные радикалы нестабильны, так как их внешний электронный слой не завершен. Поэтому радикалы легко вступают в реакции с некоторыми веществами, образуя при этом новые вещества и свободные радикалы.
Какими бывают радикалы?
Основные группы, по которым происходит классификация радикалов:
- стабильность: стабильные и нестабильные;
- заряженность: незаряженные, отрицательно заряженные и положительно заряженные;
- степень связанности: свободные и комплексные.
Стабильные радикалы
- углеводородные;
- гидразильные;
- нитроксильные;
- аминильные;
- ароксильные;
- вердазильные.

Механизм реакции радикального замещения
В механизме реакции выделяют три стадии:
- Инициирование. Посредством внешних факторов (нагревание, облучение, химические и электрические катализаторы) разрушается связь в молекуле вещества, образуя свободные радикалы.
- Развитие цепи или ее рост. Свободные элементы вступают во взаимодействие с молекулами, благодаря чему образуются новые вещества и радикалы.
- Обрыв цепи. На третьей стадии радикалы соединяются между собой. Происходит их рекомбинация (объединение неспаренных электронов, которые принадлежат разным частицам), благодаря чему появляются новые самостоятельные молекулы. Свободных радикалов не остается, и цепь реакции считается завершенной.
Типичные реакции замещения
Обычно реакцию радикального замещения показывают на примере галогенирования алканов. Самый простой алкан – метан – СН4, а самый распространенный галоген — хлор.
Алканы
Алканы – насыщенные углеводороды, содержащие только простые связи. Общая формула алканов – CnH2n+2. Насыщенными называются те углеводороды, которые содержат максимальное количество атомов водорода. Ранее алканы называли парафинами из-за того, что эти вещества не реагировали с кислотами, щелочами и т. д. На самом деле устойчивость к взаимодействию с сильными реагентами объясняется прочностью С-С и С-Н связей. Насыщенность алканов также говорит о том, что они не участвуют в реакциях присоединения. Для них характерны реакции разложения, замещения и прочие.

Галогены
Чтобы провести реакцию радикального замещения, нужно дать определение галогенам. Галогены – это элементы 17-й группы таблицы Менделеева. Галогенами являются Cl (хлор), I (йод), F (фтор), Br (бром) и At (астат). Все галогены являются неметаллами и сильными окислителями. Самую высокую окислительную активность имеет фтор, а самую низкую – астат. В процессе галогенирования алканов один или больше атомов водорода в веществе заменяется на галоген.
Механизм замещения на примере галогенирования метана
Простейшим алканом считается метан, поэтому реакции его галогенирования легко запомнить, и на этой основе проводить радикальное замещение других алканов. В качестве галогена обычно берется хлор. Он обладает средней силой реагирования. Реакция алканов с йодом не идет, так как он слабый галоген. Взаимодействие с фтором проходит со взрывом, потому что атомы фтора очень активны. Хотя при реакции замещения алканов с хлором тоже может произойти взрыв.
Зарождение цепи. Под воздействием солнечного, ультрафиолетового излучения или от нагревания молекула хлора Cl2 распадается на два свободных радикала. У каждого один неспаренный электрон на внешнем слое.
Развитие или рост цепи. Взаимодействуя с молекулами метана, свободные радикалы образуют новые и продолжают цепь превращений.
Далее реакция идет до тех пор, пока не исчезнут все свободные радикалы.
Обрыв цепи – заключительная стадия радикального замещения алканов. Радикалы соединяются друг с другом и образуют новые молекулы.
Хлорирование метана
Под действием солнечного света радикалы хлора замещают все атомы водорода в метане. Для полного замещения водорода доля хлора в смеси должна быть достаточной. Таким образом, из метана может получиться четыре его производных:
CHCl3 – трихлорметан (хлоформ).

Галогенирование других алканов
Начиная с пропана (С3Н8) у алканов появляются третичные и вторичные атомы углерода. Галогенирование разветвленных алканов может давать разные результаты. В результате реакции радикального замещения образуются изомеры алканов. Масса каждого получившегося вещества может сильно различаться в зависимости от температуры.
При термическом галогенировании состав получившегося продукта определяется исходя из соотношения количества С―Н–связей атомов углерода, которые в сложных алканах бывают первичными, вторичными и третичными. В результате фотохимического галогенирования состав получившихся продуктов будет зависеть от скорости, с которой атомы галогена сменяют атомы водорода. Галогенам легче всего встать на место третичного атома водорода. Сложнее заместить вторичный и первичный.
Хлорирование пропана
При хлорировании пропана с катализатором в виде повышения температуры до 450 ⁰С образуются 2-хлорпропан в количестве 25 % и 1-хлорпропан в количестве 75 %.
Если проводить реакцию радикального замещения алкана с помощью солнечного света, выходит 57 % 2-хлорпропана и 43 % 1-хлорпропана.
Разница в массе полученных веществ между первой и второй реакцией объясняется тем, что во втором случае скорость замещения на атом Н у вторичного атома выше в 4 раза, чем у первичного, хотя в молекуле пропана больше первичных С―Н -связей.

Реакции окисления
В реакциях окисления алканов опять же участвуют свободные радикалы. В этом случае радикал О2 присоединяется к молекуле алкана, и происходит реакция полного или неполного окисления. Полное окисление называется горением:
Реакция горения алканов по механизму радикального замещения широко используется в промышленности как топливо для ТЭЦ, для двигателей внутреннего сгорания. В такие машинные двигатели можно помещать только разветвленные алканы. Простые линейные алканы в ДВС взрываются. Из нелетучего осадка, образовавшегося в результате радикального замещения, производят смазки, асфальт, парафин и т. д.

Частичное окисление
В промышленности смеси, которые образуются при частичном окислении метана, используются для изготовления синтетических алканов. Из метана при неполном окислении воздухом можно получить метиловый спирт (СН3ОН), формальдегид (НСНО), муравьиную кислоту (НСООН). А при окислении бутана в промышленности вырабатывается уксусная кислота:
Для того чтобы алканы окислялись частично, используют катализаторы (Со 2+ , Mn 2+ и т. д.) при сравнительно невысоких температурах воздуха.
Несмотря на то, что алканы малоактивны, они способны на выделение большого количества энергии при взаимодействии с галогенами или другими свободными радикалами. Алканы и реакции с ними постоянно используют во многих сферах промышленности.
Факты об алканах
В органической химии алканы занимают важное место. Формула алканов в химии - CnH2n+2. В отличие от ароматических веществ, у которых есть бензольное кольцо, алканы считаются алифатическими (ациклическими).

Вам будет интересно: Чем отличается тушь от чернил: создание и применение в современном мире
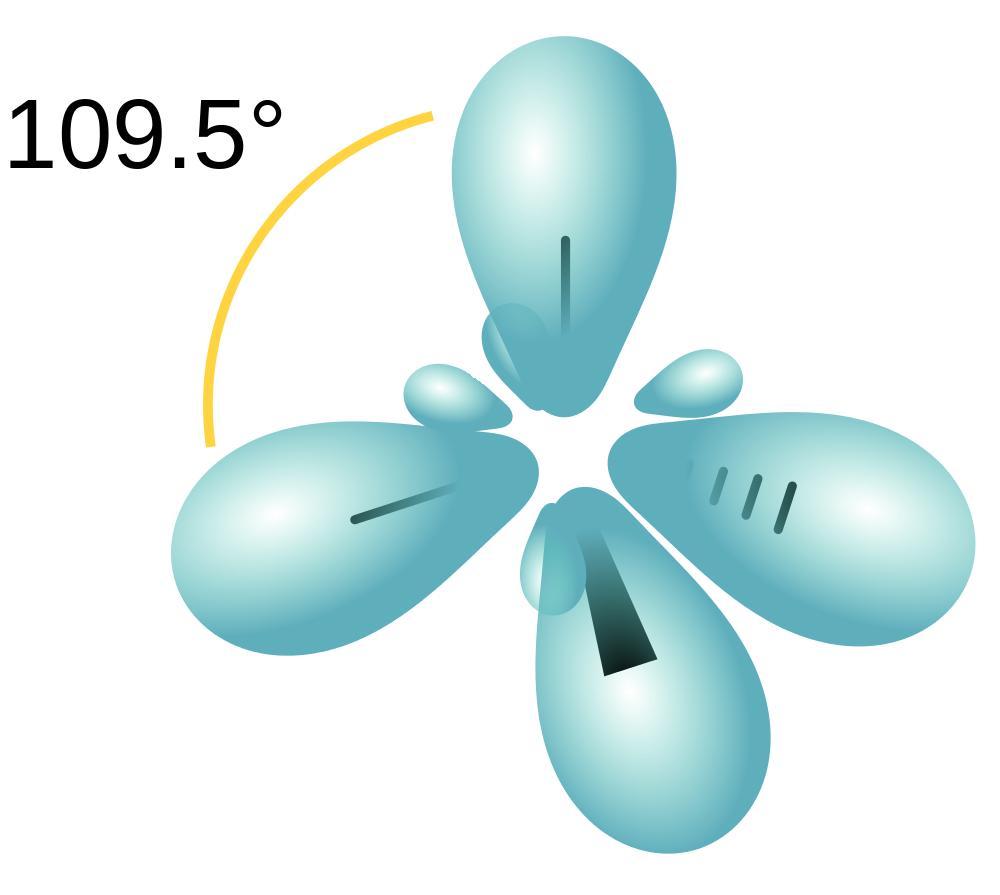
Алканы - насыщенные углеводороды. То есть в них находится максимальное количество атомов Н (водорода). Все атомы углерода в алкане состоят в положении sp3 – гибридизации. Это значит, что молекула алкана строится по правилу тетраэдра. Молекула метана (СН4) напоминает тетраэдр, а остальные алканы имеют зигзагообразную структуру.
Все атомы С в алканах соединены с помощью ơ – связи (сигма – связи). Связи С―С являются неполярными, связи С―Н – слабополярными.
Свойства алканов
Как уже говорилось выше, группа алканов обладает маленькой активностью. Связи между двумя атомами С и между атомами С и Н прочные, поэтому их сложно разрушить воздействием извне. Все связи в алканах являются ơ – связями, поэтому, если они разрываются, это обычно приводит к появлению радикалов.

Вам будет интересно: Что такое синтаксическое средство выразительности? Лексические и синтаксические средства выразительности
Галогенирование алканов
Ввиду особых свойств у связей атомов, алканам присущи реакции замещения и разложения. В реакциях замещения у алканов атомы водорода сменяют другие атомы или молекулы. Алканы хорошо реагируют с галогенами – веществами, находящимися в 17 группе периодической таблицы Менделеева. Являются галогенами фтор (F), бром (Br), хлор (Cl), йод (I), астат (At) и теннессин (Ts). Галогены очень сильные окислители. Они реагируют практически со всеми веществами из таблицы Д. И. Менделеева.
Реакции хлорирования алканов
На практике участие в галогенировании алканов принимают обычно бром и хлор. Фтор слишком активный элемент – с ним реакция будет взрывной. Йод - слабый, поэтому реакция замещения с ним идти не будет. А астата очень мало в природе, поэтому сложно собрать достаточное его количество для проведения экспериментов.
Стадии галогенирования
Все алканы проходят три стадии галогенирования:

Бромирование алканов
При галогенировании высших алканов, идущих после этана, сложность представляет образование изомеров. Из одного вещества под действием солнечного света могут образоваться разные изомеры. Происходит это в результате реакции замещения. Это доказательство того, что при галогенировании свободным радикалом может быть замещен любой атом Н в алкане. Сложный алкан распадается на два вещества, процентное содержание которых может сильно варьироваться в зависимости от условий реакции.

Бромирование пропана (2-бромпропан). При реакции галогенирования пропана молекулой Br2 под воздействием высоких температур и солнечного света выходят 1-бромпропан – 3 % и 2-бромпропан – 97 %.
Бромирование бутана. При бромировании бутана под действием освещения и высоких температур выходит 2 % 1-бромбутана и 98 % 2-бромбутана.
Различие хлорирования и бромирования алканов
Характер реакции хлорирования
При хлорировании алканов изомеры образуются примерно в равном количестве в своей массовой доле. Например, хлорирование пропана при катализаторе в виде повышения температуры до 454 градусов выдает нам 2–хлорпропан и 1-хлорпропан в соотношении 25 % и 75 % соответственно. Если реакция галогенирования проходит только при помощи ультрафиолетового излучения, 1–хлорпропана получается 43 %, а 2-хлорпропана – 57%. В зависимости от условий проведения реакции соотношение полученных изомеров может меняться.
Характер реакции бромирования
В результате реакций бромирования алканов легко выходит почти чистое вещество. Например, 1-бромпропан – 3 %, 2-бромпропан – 97% из молекулы н-пропана. Потому бромирование часто применяют в лабораториях для синтеза определенного вещества.
Сульфирование алканов
Алканы сульфируются также по механизму радикального замещения. Чтобы произошла реакция, на алкан одновременно воздействуют кислород и оксид серы SO2 (сернистый ангидрид). В итоге реакции алкан превращается в алкилсульфокислоту. Пример сульфирования бутана:
СН3СН2СН2СН3 + О2 + SO2 → CH3CH2CH2CH2SO2OH
Общая формула сульфоокисления алканов:
R―H + О2 + SO2 → R―SO2OH

Сульфохлорирование алканов
В случае сульфохлорирования вместо кислорода в качестве окислителя используется хлор. Таким способом получают алкансульфохлориды. Реакция сульфохлорирования привычна для всех углеводородов. Она происходит при комнатной температуре и солнечном освещении. Также в качестве катализатора применяют органические пероксиды. Такая реакция затрагивает только вторичные и первичные связи, относящиеся к атомам углерода и водорода. До третичных атомов дело не доходит, так как происходит обрыв цепи реакции.
Реакция Коновалова
Реакция нитрования, как и реакция галогенирования алканов, проходит по свободно-радикальному механизму. Проводят реакцию, используя сильно разбавленную (10 – 20 %) азотную кислоту (HNO3). Механизм реакции: в результате реакции алканы образуют смесь соединений. Для катализации реакции используют повышение температуры до 140⁰ и нормальное или повышенное давление окружающей среды. При нитровании разрушаются связи С―С, а не только С―Н в отличие от предыдущих реакций замещения. Это значит, что происходит крекинг. То есть реакция расщепления.
Реакции окисления и горения
По свободнорадикальному типу проходят и реакции окисления алканов. Для парафинов существует три вида переработки с помощью окислительной реакции.
В процессе окисления свободный радикал О2 полностью или частично замещает водородную составляющую. Полное окисление - это горение.

Хорошо сгорающие алканы используются как топливо для теплоэлектростанций и двигателей внутреннего сгорания. Горящие алканы производят очень много тепловой энергии. В двигатели внутреннего сгорания помещают сложные алканы. Взаимодействие с кислородом у простых алканов может привести к взрыву. Из продуктов отхода, образующихся в результате реакций с алканами, делают асфальт, парафин и различные смазки для промышленности.
Мы приступаем к новому разделу - органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций ;)

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp 3
- Валентный угол (между химическими связями) составляет 109°28'

Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.

В промышленности алканы получают путем:
-
Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
Гидрогенизацией угля (торфа, сланца)
Гидрированием оксида углерода II
В лабораторных условиях алканы получают следующими способами:
-
Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Алканы - насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
-
Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.

Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Задачи для практики
Установите соответствие между реагирующими с хлором веществами и преимущественно образующимся продуктом реакции и условиями осуществления этих реакций: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТ И ПРОДУКТ РЕАКЦИИ | УСЛОВИЯ ОСУЩЕСТВЛЕНИЯ РЕАКЦИИ |
| А) циклопропан → 1,3-дихлорпропан Б) пропен → 1,2-дихлорпропан В) пропан → 2-хлорпропан Г) бензол → хлорбензол | 1) ультрафиолетовое облучение 2) катализатор $FeCl_3$ 3) конц. $H_2SO_4$, нагревание 4) обычные условия 5) катализатор Pt 6) катализатор $Al_2O_3$ |
Запишите выбранные цифры под соответствующими буквами.
Хлорирование алкенов (разрыв двойной связи и присоединение атомов хлора) и хлорирование циклоалканов (разрыв цикла и присоединение атомов хлора) происходит не по радикальному механизму, а потому не требует жёстких условий - реакция идёт при обычных условиях.
Хлорирование алканов (замещение атомов водорода на хлор) идёт по радикальному механизму, для реакции необходимы жёсткие условия, такие как ультрафиолетовое облучение.
При галогенировании бензола применяют катализатор - соль соответствующего галогена, в частности хлорид железа 3.
Установите соответствие между реагирующими веществами и характеристикой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ХАРАКТЕРИСТИКА РЕАКЦИИ |
| А) $CH_4 + Cl_2 →$ Б) $CH_3–C≡CH + [Ag(NH_3)_2]OH →$ В) 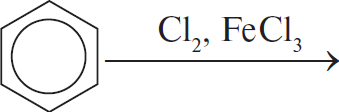 Г) $C_4H_6 →↖ | 1) ионная полимеризация 2) радикальное замещение 3) реакция обмена 4) электрофильное замещение 5) каталитическое дегидрирование 6) радикальная полимеризация |
Запишите выбранные цифры под соответствующими буквами.
А) В реакции происходит радикальное замещение атома H на атом хлора.
Б) Реакция алкина и реактива Толленса, протекает обмен с образованием аммиака.
В) Галогенирование бензола – реакция электрофильного замещения, реакция ароматического углеводорода и хлор.
Г) Реакция радикальной полимеризации, в которой инициатором является натрий.
Установите соответствие между названием исходного вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с хлором: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) пропан Б) изобутан В) циклобутан Г) циклогексан | 1) 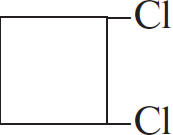 2) 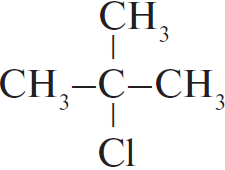 3) $ClCH_2–(CH_2)_2–CH_2Cl$ 4) 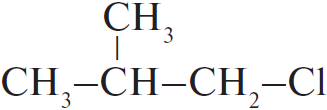 5) 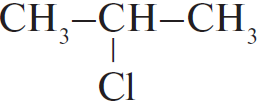 6) 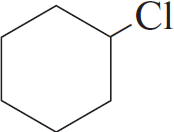 |
Запишите выбранные цифры под соответствующими буквами.
Чтобы понять, какое вещество образуется, нужно заменить один водород на атоме C с меньшим количеством водорода. В случае циклов: если цикл неустойчив (до 5), то разрывается одна из связей, а хлор идет на 2 образовавшиеся, если устойчив, то на любой из атомов вместо водорода.
Установите соответствие между химической реакцией и органическим веществом, которое преимущественно образуется в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКЦИЯ | ПРОДУКТ РЕАКЦИИ |
| А) гидратация этина Б) гидратация этилена В) гидратация бутина-1 Г) взаимодействие бутена-2 с перманганатом калия ($H_2SO_4$ р-р) | 1) 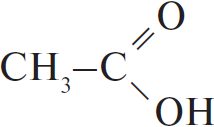 2) $CH_3–CH_2OH$ 3) 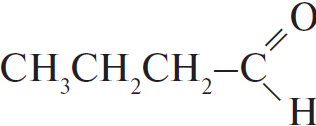 4) 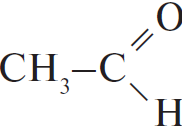 5) 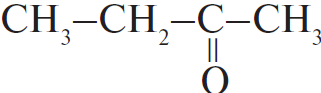 6) 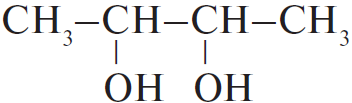 |
Запишите выбранные цифры под соответствующими буквами.
А) При гидратации этина сначала образуется виниловый спирт, но дальше вторая связь тоже рвется, образуется уксусный альдегид.
Б) Этилен имеет только двойную связь, поэтому просто образуется этиловый спирт.
В) Снова тройная связь, сначала образуется спирт, а затем образуется метилэтилкетон, потому что атом O остается не на краю цепочки.
Г) Окисление алкена в жёстких условиях, образуется уксусная кислота.
Установите соответствие между формулами исходных веществ и продуктом, который преимущественно образуется при взаимодействии этих веществ с водой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) $CH_3–CH=CH_2$ Б) $CH_3–C≡C–CH_3$ В) CH≡CH Г) $C_6H_5C_2H_5$ | 1) этанол 2) этаналь 3) изопропиловый спирт 4) бензиловый спирт 5) метилэтилкетон 6) не взаимодействует |
Запишите выбранные цифры под соответствующими буквами.
С водой способны взаимодействовать алкены и алкины - протекает реакция гидратации, в ходе которой кратная связь разрывается, а на освободившиеся валентности углерода присоединяются водород и гидроксогруппа, причём водород присоединяется к наиболее гидрогенизированному атому углерода. В случае алкинов получающиеся крайне неустойчивые спирты, в которых две группы -ОН присоединены к одному атому углерода, сразу же пререгруппировываются, образуя кетоны (из большинства спиртов) или этаналь - из ацетилена (реакция Кучерова). Таким образом, из пропена образуется изопропиловый спирт $СН_3-СН(ОН)-СН_3$, из бутина-2 - метилэтилкетон $CH_3-C(O)-CH_2-CH_3$, из ацетилена - этаналь, этилбензол не гидратируется.
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| А) $C_6H_6 + Cl_2 →↖ Б) $C_6H_5CH_3 + Cl_2 →↖ В) $C_6H_5CH_3 + Cl_2 →↖ Г) $C_6H_6 + Cl_2 →↖ | 1) м-хлортолуол 2) гексахлоран 3) хлорбензол 4) п-хлортолуол 5) фенилхлорметан 6) гексахлорбензол |
Запишите выбранные цифры под соответствующими буквами.
А) При хлорировании бензола в присутствии катализатора хлорида алюминия образуется хлорбензол.
Б) При хлорировании толуола (метилбензола) в присутствии катализатора хлорида алюминия хлор замещает водород бензольного кольца, метильный радикал является ориентантом первого порядка, поэтому замещение происходит в параположении, образуется п-хлортолуол.
В) При хлорировании толуола на свету хлор замещает водород метильного радикала (реакция идёт по радикальному механизму), образуется фенилхлорметан $С_6Н_5СН_2Cl$.
Г) Хлорирование бензола на свету запускает реакцию по радикальному механизму, бензольное кольцо разрушается, образуется гексахлоран $(СHCl)_6$.
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с водой в присутствии катализатора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) пропен Б) пропин В) бензол Г) пропан | 1) фенол 2) не взаимодействуют 3) пропанол-1 4) ацетон 5) пропанол-2 |
Запишите выбранные цифры под соответствующими буквами.
Составляем уравнения реакций гидратации. Присоединение воды к непредельным углеводородам происходит по правилу В. В. Марковникова: атом водорода преимущественно присоединяется к наиболее богатому водородом атому углерода, участвующему в образовании кратной связи.
А) $CH_3–CH=CH_2 + HOH → CH_3–CH(OH)–CH_3$ (ответ А — 5)
Б) $CH_3–C≡CH + H_2O → CH_3–CO–CH_3$ (ответ Б — 4)
В) $C_6H_6 + H_2O ≠$ (ответ В — 2)
Г) $CH_3CH_2CH_3 + H_2O ≠$ (ответ Г — 2)
Установите соответствие между химической реакцией и органическим веществом, которое преимущественно образуется в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАКЦИЯ | ПРОДУКТ РЕАКЦИИ |
| А) гидратация этина Б) гидратация этилена В) гидратация бутина-1 Г) взаимодействие бутена-2 с перманганатом калия ($H_2SO_4$ р-р) | 1) 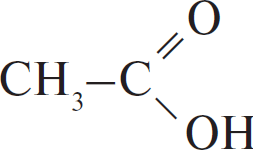 2) $CH_3–CH_2OH$ 3) 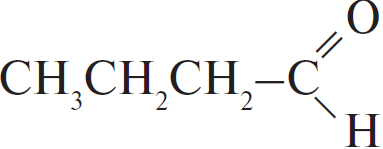 4) 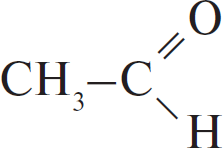 5) 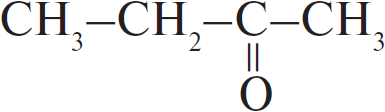 6) 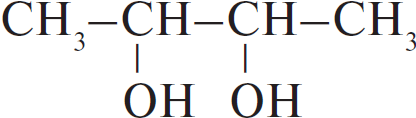 |
Запишите выбранные цифры под соответствующими буквами.
А: При гидратации этина сначала образуется неустойчивый виниловый спирт, но дальше вторая связь тоже рвется, образуется уксусный альдегид.
Б: Этилен имеет только двойную связь, поэтому образуется сразу этиловый спирт.
В: Снова тройная связь, сначала образуется неустойчивый непредельный спирт, а затем образуется метилэтилкетон (присоединение по правилу Морковникова).
Г: Окисление алкена в кислой среде, режется двойная связь, образуется уксусная кислота.
Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с избытком хлороводорода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) пропен Б) пропан В) 2-метилпропен Г) пропин | 1) 2-хлорпропан 2) 2-метил-2-хлорпропан 3) 1-метил-2-хлорпропан 4) не взаимодействует 5) 2,2-дихлорпропан 6) 1,2-дихлорпропан |
Запишите выбранные цифры под соответствующими буквами.
В реакциях присоединения хлороводорода к алкенам и алкинам действует правило Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода, а хлор - к наименее гидрогенизированному. Продукт гидрогалогенирования пропена $СН_3-СН=СН_2$ - 2-хлорпропан $СН_3-СCl- СН_3$, 2-метилпропена $СН_3-С(СН_3)=СН_2$ - 2-метил-2-хлорпропан $СН_3-С(СН_3)Cl-СН_3$, пропина $СН_3-С≡СН$ - 2,2- дихлорпропан $СН_3-CCl_2-CH_3$ (алкины присоединяют две молекулы хлороводорода). Пропан, как и все алканы, не взаимодействует с хлороводородом.
Установите соответствие между исходным веществом и продуктом, который преимущественно образуется при взаимодействии этого вещества с хлором при освещении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНОЕ ВЕЩЕСТВО | ПРОДУКТ РЕАКЦИИ |
| А) 2-метилбутан Б) циклогексан В) бензол Г) этилбензол | 1) хлорциклогексан 2) гексахлоран 3) 2-метил-2-хлорбутан 4) 2-метил-3-хлорбутан 5) 1-фенил-1-хлорэтан 6) 2-хлорэтилбензол |
Запишите выбранные цифры под соответствующими буквами.
А: Хлору проще присоединиться к третичному углероду, чем ко вторичному или первичному, поэтому он цепляется на тот атом углерода, где находится метил, получается 2-метил-2-хлорбутан.
Б: Из циклогексана получится хлорциклогексан.
В: В бензоле при хлорировании разрушается ароматическая система и образуется гексахлоран.
Г: Хлор присоединится к вторичному атому углерода, а не к первичному, поэтому получится 1-фенил-1-хлорэтан.
Установите соответствие между преимущественно образующимся продуктом реакции и веществом, которое взаимодействовало со спиртовым раствором гидроксида калия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОДУКТ РЕАКЦИИ | РЕАГИРУЮЩЕЕ ВЕЩЕСТВО |
| А) 2-метилпропен Б) пентен-2 В) пентин-2 Г) пентен-1 | 1) 1-бромпентан 2) 3-бромпентан 3) 1-бром-2-метилпропан 4) 1,2-дибром-2-метилпропан 5) 2,2-дибромпентан 6) 1,3-дибромпропан |
Запишите выбранные цифры под соответствующими буквами.
При взаимодействии галогеналканов со спиртовым раствором гидроксида калия образуются алкины или алкены - от галогеналкана отщепляется галоген и водород, причём водород отщепляется от наименее гидрогенизированного атома углерода, соседствующего с несущим галоген атомом углерода. Алкины образуются при отщеплении двух атомов галогена от одного атома углерода.
А) 2-метилпропен $СН_2=С(СН_3)-СН_3$ образуется из 1-бром-2-метилпропана $СН_2Br-СН(СН_3)-СН_3$
Б) Пентен-2 $СН_3-СН=СН-СН_2-СН_3$ образуется из 3-бромпентана $СН_3-СН_2-СНBr-СН_2-СН_3$
В) Пентин-2 $СН_3-С≡С-СН_2-СН_3$ образуется из 2,2-дибромпентана $СН_3-СBr_2-СН_2-СН_2-СН_3$
Г) Пентен-1 $СН_2=СН-СН_2-СН_2-СН_3$ образуется из 1-бромпентана $СН_2Br-СН_2-СН_2-СН_2-СН_3$
Установите соответствие между исходными веществами и продуктами их дегалогенирования: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ РЕАКЦИИ |
| А) 1,4-дибромбутан Б) 1,2-дибромбутан В) 2,3-дибромбутан Г) 1,3-дибромбутан | 1) циклобутан 2) бутен-2 3) бутен-1 4) бутан 5) бутин-2 6) метилциклопропан |
Запишите выбранные цифры под соответствующими буквами.
При дегалогенировании галогенпроизводных алканов образуются непредельные или цикличиеские соединения - алкены, алкины или циклоалканы. Освобождённые после отщепления галогенов валентности углерода образуют новые связи, положение которых зависит от положения галогена в исходном веществе. Дегалогенирование 1,4-дибромбутана $BrH_2C-CH_2-CH_2-CH_2Br$ даст циклобутан, так как атомы брома находятся на крайних атомах углерода. При дегалогенировании 1,2-дибромбутана образуется бутен-1, 2,3-дибромбутана - бутен-2, 1,3-дибромбутана - метилциклопропан (связи образуются между первым и третьим атомом углерода). Алкины образуются, если в исходные галогенпроизводные атомы галогенов присоединены к одному атому углерода.
Установите соответствие между реагирующими с хлором веществами и преимущественно образующимся продуктом реакции и условиями осуществления этих реакций: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГЕНТ И ПРОДУКТ РЕАКЦИИ | УСЛОВИЯ ПРОВЕДЕНИЯ РЕАКЦИИ |
| А) бензол → хлорбензол Б) толуол → фенилхлорметан В) бензол → гексахлоран Г) толуол → о-хлортолуол | 1) ультрафиолетовое облучение 2) катализатор FeCl3 3) конц. H2SO4, нагревание 4) обычные условия 5) катализатор Pt 6) катализатор Al2O3 |
Запишите выбранные цифры под соответствующими буквами.
А) При галогенировании аренов с целью заместить водород бензольного кольца на галоген в качестве катализатора применяют бескислородную соль используемого галогена, в данном случае - хлорид железа(III) $FeCl_3$.
Б) Галогенирование алканов, в том числе в составе радикалов аренов, как в случае с толуолом (метилбензолом), требует жёстких условий - ультрафиолетового облучения.
В) Чтобы разрушить устойчивое бензольное кольцо хлорированием и получить хлорпроизводное циклоалкана (гексахлоран C₆H₆Cl₆), необходимо ультрафиолетовое облучение.
Г) В о-хлортолуоле атом хлора присоединён не к метильному радикалу, как в фенилхлорметане, а к бензольному кольцу (в орто-положении). Это достигается использованием катализатора - хлорида железа(III) $FeCl_3$.
Читайте также:

