Мозаика на шейке матки это рак
Сдать анализы со скидкой в интернет-магазине
Несмотря на определенные успехи, достигнутые в области диагностики и лечения, рак шейки матки продолжает занимать одну из лидирующих позиций в структуре онкологической заболеваемости женской половой сферы. Основным и наиболее перспективным направлением борьбы с этим заболеванием является его профилактика, которая заключается в своевременном выявлении и адекватном лечении фоновых, предраковых процессов, а также начальных форм рака шейки матки.
К фоновым процессам относят эрозию, псевдоэрозию шейки матки, лейкоплакию, к предраковым ( предонкологическим ) - эпителиальные дисплазии трех степеней выраженности.
Признаки и симптомы рака шейки матки
У больных с фоновыми и предраковыми заболеваниями шейки матки жалобы, как правило, отсутствуют, и лишь изредка встречаются больные с незначительными болями внизу живота, пояснице, белями из половых органов, ациклическими кровянистыми выделениями. Однако, ни один из симптомов рака шейки матки, перечисленных выше, не является патогномоничным для данного вида патологии и поэтому не имеет большого практического значения.
Осмотр шейки матки
Макроскопическое изучение шейки матки в зеркалах также не позволяет в достаточной мере оценить степень и тяжесть заболевания, характер и объем поражения, а иногда и вообще диагностировать его. Это обстоятельство может быть обусловлено наличием дисплазии, сочетающейся с визуально неизмененной шейкой матки. В связи с тем, что микроскопические изменения в органе обычно опережают клинические проявления заболевания, решающая роль в диагностике отводится комплексному методу исследования, который включает в себя мазок на онкоцитологию с поверхности шейки матки ( ПАП-мазок ) и кольпоскопию. При необходимости обследование дополняется биопсией шейки матки с последующим гистологическим исследованием ткани.
Кольпоскопия
Кольпоскопическое исследование, впервые предложенное в 1924 г. H. Hinselmann, заключается в осмотре слизистой шейки матки с помощью бинокулярной лупы, оснащенной осветительной системой и цветными фильтрами. Совершенствование и развитие аппаратов и кольпоскопической техники привели к появлению множества ее разновидностей:
- Простая кольпоскопия - изучение с помощью кольпоскопа влагалищной части шейки матки;
- Расширенная кольпоскопия, связанная с использованием 3%-ного раствора уксусной кислоты (при обработке им происходит спазм подэпителиальных сосудов и набухание слизистой, способствующее лучшему обзору), а также раствора Люголя (патологические участки, эпителий которых лишен гликогена, не окрашиваются в коричневый цвет, что позволяет определить границы поражения).
Кольпоскопические картины влагалищной части шейки матки очень разнообразны. Для понимания сущности патологического процесса их делят на две большие группы: доброкачественные (чаще всего встречаются при фоновых процессах) и атипические (характерны для предрака и рака).
- эктопия - расположение цилиндрического эпителия на влагалищной части шейки матки;
- зона трансформации - участок слизистой шейки матки, где цилиндрический эпителий замещается многослойным плоским. Здесь можно обнаружить выводные протоки желез или ретенционные кисты;
- истинная эрозия - участок слизистой, лишенный эпителиального покрова;
- воспалительный процесс - рыхлость, отечность, гиперемия слизистой, сосуды с нормальной архитектоникой и выраженной реакцией на уксусную пробу;
- атрофия слизистой - состояние, связанное с возрастными изменениями. Эпителий атрофичный, истончен, поверхность его сухая, блестящая, под ним много мелкоточечных кровоизлияний;
- субэпителиальный эндометриоз - под эпителием определяются темно-фиолетовые образования различной формы и величины с гладким рельефом, перед месячными продуцирующие темно-красные выделения.
- лейкоплакия - белое пятно с перламутровым оттенком, несколько возвышающееся над окружающей слизистой, с гладким или мелкозернистым рельефом;
- пунктация, мозаика - это патологические изменения слизистой влагалищной части шейки матки, обусловленные нарушением процесса эпидермизации. Эти изменения эпителиального покрова выявляются только при кольпоскопическом исследовании;
- атипические сосуды - сосуды, расположенные хаотично, причудливой формы (в виде штрихов, точек, запятых), неанастомозирующие между собой в отличие от нормальных и не исчезающие после обработки уксусной кислотой.
Цитологическое исследование (ПАП-мазок)
Особое значение при диагностике патологических состояний шейки матки придается цитологическому методу исследования. Впервые предложенный E. Pachet в 1847 г. и усовершенствованный до возможности клинического применения С. Стокардом и Г.Н. Папаниколау в 1917 г., этот метод в настоящее время представлен различными модификациями. Цитологическая диагностика - морфологический метод исследования, основанный на микроскопическом изучении характера клеточных изменений в норме и патологии.
Образец результата анализа в лаборатории ЦИР (заключение выдается по международной системе Bethesda)
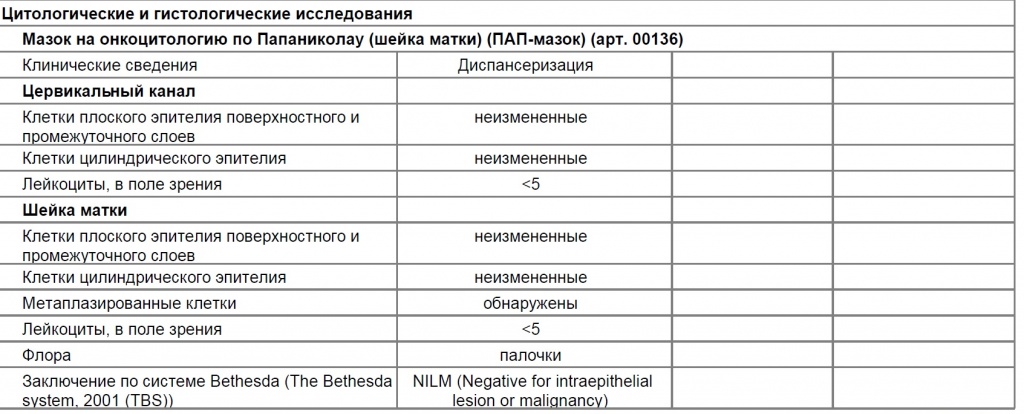
Онкоцитологическое исследование представляет собой изучение мазков скарификатов с влагалищной порции шейки матки и цервикального канала. Диагностика основана на делении мазков на 5 классов (по Папаниколау) или на выдаче заключения по международной системе Bethesda. Классификация по Папаниколау:
- Отсутствие атипических клеток.
- Клетки с признаками атипии в незначительном количестве.
- Клетки с выраженными признаками атипии.
- Подозрение на злокачественный процесс.
- Убедительные признаки злокачественности.
Основная цель цитологического исследования - выявление морфологических особенностей клеток, характеризующих конкретный процесс. Насчитывают до 80 признаков атипической клетки, при этом около 10 из них наиболее постоянные.
Биопсия шейки матки
Решающее значение в постановке окончательного диагноза принадлежит гистологическому методу исследования биопсийного материала, полученного под кольпоскопическим контролем. Это, как правило, заключительный этап в комплексной диагностике патологических состояний шейки матки. В данной связи необходимо отметить уверенную гистологическую диагностику рака и часто наблюдаемые трудности в распознавании эпителиальных дисплазий, особенно их начальных форм, а также невозможность многократного применения данного метода диагностики при обследовании одной и той же пациентки.
ЭПИДЕМИОЛОГИЯ РАКА ШЕЙКИ МАТКИ
Первые исследования, посвященные эпидемиологии рака шейки матки, появились еще в девятнадцатом веке. Rigoni-Stern в 1842 г. опубликовал данные, основанные на изучении регистра смертей в г.Вероне с 1760 по 1830 гг. Он заметил, что рак шейки матки значительно чаще был причиной смерти замужних женщин и вдов и не встречался у девственниц и монахинь. Это обстоятельство позволило ученому высказать гипотезу о раке шейки матки как инфекционном заболевании. При изучении 13000 историй болезни монахинь Монреаля и Квебека F. Gagnon (1950) отметил, что рак шейки матки не был обнаружен ни разу. Автор связывал подобные результаты с низкой частотой воспалительных заболеваний шейки матки у монахинь.
Опубликованы результаты эпидемиологических исследований, касающихся роли в возникновении рака шейки матки раннего начала половой жизни, ранней первой беременности, частой смены половых партнеров, а также инфекционных заболеваний, передающихся половым путем. В настоящее время имеются убедительные данные о повышенном риске развития рака шейки матки у курящих женщин. Одни авторы ( Hellbberg, Greenberg, Winkelstein, Brinton ) отмечают взаимосвязь курения с ранним началом половой жизни и частой сменой половых партнеров, другие (Hoffman, Sasson) указывают на канцерогенную роль содержащихся в табачном дыме никотина и котинина.
До настоящего времени дискутируется вопрос о роли травмы, связанной с родами и абортами. Достаточно долгое время господствовало утверждение R. Meyer (1910) о травме как этиологическом моменте метапластических процессов в эпителии шейки матки. Однако, впоследствии было установлено, что "не меньшее значение, чем механическая травма, в патогенезе рака шейки матки имеет местная инфекция, вернее, сочетание этих двух условий" (А.И. Серебров). В течение многих лет обсуждалась возможность связи дисплазий и рака шейки матки, отмечена более высокая частота выявления неспецифической микрофлоры, включая трихомонадные инфекции и гарднереллез. Примеры такого влияния обсуждались в отношении Treponema palliddum, Neisseria gonorrhoeae, Chlamydia trachomatis, вируса простого герпеса 2 типа, цитомегаловируса, вируса папилломы человека. Эпидемиологические исследования убедительно показали, что неоспоримым фактором риска возникновения предраковых изменений и рака шейки матки является генитальная папиллломавирусная инфекция.
Концепция вирусной природы рака шейки матки имеет длинную историю и неразрывно связана с исследованиями кондилом различных локализаций. Половые кондиломы описаны еще в трудах по античной медицине. На протяжении многих лет считалось, что вульгарные, ювенильные и генитальные бородавки вызываются одним типом папилломавируса, а различия в клиническом течении обусловлены различиями в локализации. Взгляды на патологию кондилом шейки матки были радикально пересмотрены после того, как Meiisseis, Fortin (1976), Purola, Savia (1976) описали генитальные плоские и инвертированные (эндофитные) кондиломы, определив их принципиальное отличие от кондилом других локализаций, и постулировали цитоморфологические признаки папилломавирусной инфекции: койлоцитоз или баллонирование клеток, характеризующееся увеличенными, гиперхромными ядрами, окруженными четкой зоной светлой цитоплазмы. Позже, с помощью электронно-микроскопических, иммуногистохимических и ДНК-гибридизационных исследований была подтверждена их папилломавирусная этиология.
В настоящее время идентифицировано более 100 типов вирусов папилломы человека (ВПЧ). Подробно описаны более 70 типов. Твердо установлен факт, что определенные типы ВПЧ могут инфицировать строго определенный вид эпителия и вызывать характерные изменения. Благодаря выявлению многовариантности генотипов ВПЧ, идентификации специфических типов ВПЧ, накоплению данных о злокачественной трансформации генитальных кондилом и об онкогенном потенциале различных типов ВПЧ, стало возможным рассматривать папилломавирус как этиологический фактор развития рака шейки матки. Вирусы папиллом инфицируют базальные слои эпителия. Наиболее "уязвимым" участком является зона перехода многослойного плоского эпителия в цилиндрический эпителий.
Из всех идентифицированных типов вирусов папиллом 34 ассоциированы с поражением аногенитальной области. Онкогенный потенциал папилломавирусов существенно варьирует. По способности инициировать диспластические (предраковые) изменения и рак папилломавирусы условно разделены на группы "высокого" и "низкого" риска возникновения опухолевой трансформации инфицированного эпителия. Типы ВПЧ 6, 11, 42, 43, 44 были классифицированы как типы низкого риск развития рака, типы 16, 18, 31, 33, 48, 56 - высокого риска. Так, ВПЧ 6/11 типов являются причиной остроконечных кондилом, часто идентифицируются при дисплазиях легкой и средней степеней тяжести и редко связаны с опухолями шейки матки. При раке шейки матки наиболее часто выявляются ВПЧ 16 и 18 типов (67-93% случаев). Вирус 18 типа обнаруживается примерно в 2 раза реже вируса 16 типа. Вирус папилломы 18 типа чаще определяется при аденокарциномах и низкодифференцированном плоскоклеточном раке шейки матки, имеет более высокий онкогенный потенциал, с ним связывают быстрый темп опухолевой прогрессии, низкий уровень дифференцировки инфицированного эпителия и неблагоприятный прогноз по сравнению с другими онкогенными типами ВПЧ. Однако, большинство авторов обращают внимание, что одного только инфицирования вирусом папилломы недостаточно для индукции опухолевого роста, и указывают на роль кофакторов в ВПЧ-зависимом канцерогенезе.
Существенная роль в патогенезе заболеваний шейки матки принадлежит системе иммунитета. Выраженная связь иммунологических реакций с атипической пролиферацией эпителия эктоцервикса указывает на влияние клеточного и гуморального иммунитета, на процессы, поддерживающие существование фоновых и предраковых заболеваний, а также провоцирующие их рецидивы.
Пунктация бывает нежная и грубая. Вы уже, наверняка, догадались - нежная это "хорошо", грубая - это "плохо". Однако, для оценки пунктации и мозаики необходимо учесть еще одну характеристику - равномерность.
Для нежной пунктации характерны мелкие ровненькие точки, картина соответствует L-SIL. Кольпоскопист обязательно оценивает расстояние между точками - межкапиллярную дистанцию. Если все точки расположены примерно на одинаковом расстоянии - это равномерная пунктация, и это хорошо. Если точки крупные, или разных размеров, или расстояние между точками различное - это H-SIL
Пример грубой пунктации встретить не так легко, поэтому картинка сканирована (не помню откуда - наш доктор готовился к защите, под это дело собирался материал)
Мозаика - отличное название. После обработки уксусом на белесом фоне появляются многоугольнички. Нежная мозаика встречается часто. Ее можно рассмотреть на периферии ацето-белых зон
Нежная мозаика очень светлая, бледная, не возвышается над поверхностью, проявляется медленно, исчезает быстро (помните, "не отрывая глаз!"). Нежная мозаика - даже не всегда L-SIL, часто сопровождает процессы метаплазии, поэтому выдам крамолу: нежная мозаика на нежнейшем АБЭ даже не всегда требует биопсии (особенно при хороших результатах цитологии и в отсутствии ВПЧ)
Грубая мозаика напоминает булыжную мостовую. Проявляется очень быстро, яркая, длительно сохраняется после обработки. Особенно скверно, если кусочки мозаики выглядят выпукло, как будто вздуваются.
Если кусочки мозаики мелкие и примерно одинакового размера - это регулярная или равномерная мозаика, это хорошо. Если фрагменты крупные и сильно отличаются размерами - этог нерегулярная мозаика, и это плохо.
Пунктация и мозаика часто встречаются вместе
Клинический пример
Кольпофотографии нашей пациентки с пунктацией и мозаикой на фоне АБЭ.


Проба Шиллера
Пунктация (П)
Гистологически пунктация представляет собой зону эпителия с удлиненными стромальными папиллами (выростами), в каждой из которых имеется сосудистая петля, доходящая почти до поверхности, пенетрирующая эпителий.
Определяются множественные красноватые точки на фоне белесоватых или желтоватых участков эпителия. Согласно классификации П подразделяется на нежную и грубую. Если точки мелкие, равномерно расположенные, одинаковые (нежная П), то, как правило, эта картина доброкачественная или соответствует легкой степени поражения. Рельефные, крупные, неравномерно расположенные, четко проявляющиеся после обработки уксусной кислотой точечные капилляры соответствуют выраженной степени поражения (грубая П).
Очень важно научиться правильно оценивать межкапиллярные расстояния. Если они небольшие и одинаковые (регулярная П), то это признак благоприятный. Если расстояния неравномерно увеличиваются (нерегулярная П), то это расценивается как неблагоприятный признак.
При большом увеличении можно увидеть капиллярные петли. Иногда эти точки выступают в виде сосочков. Иногда в участке П большое увеличение позволяет рассмотреть штопорообразные сосуды, пронизывающие эпителий, что всегда должно быть основанием для биопсии.
Поверхность П по отношению к окружающей ткани визуально может быть вдавленной, при контакте может легко кровоточить. Проба Шиллера при CIN отрицательная. Она помогает также в дифференциальной диагностике с очаговым цервицитом (при цервиците проба Шиллера положительная). Иногда участки линейной нежной пунктации появляются после лечения ШМ физиохирургическими методами и характеризуют процесс репарации.
Мозаика (М)
Картина мозаики до обработки раствором уксусной кислоты может быть очень неспецифичной и напоминать одну из васкуляризированных зон в ЗТ. Кольпоскопически мозаика представляет собой участки слизистой оболочки, разделенные на многоугольные или овальные желтовато-белые сегменты разного размера и формы, разграниченные непрерывными линиями красного цвета.
В практике КС чаще встречается нежная М. Она определяется на одном уровне с окружающими тканями и напоминает сетчатую мраморность, наиболее часто располагается по периферии зон трансформации. После обработки уксусной кислотой рисунок и границы М становятся более определенными в виде сети бледных красных линий. Аномальная М обычно йоднегативна. Йодпозитивной становится М, свойственная воспалению и папилломавирусной инфекции.
Нежная М очень светлая, проявляется ненадолго, неинтенсивная, часто сопровождает процессы метаплазии. Если поля мозаики не слишком бросаются в глаза своей яркостью, контрастностью, т.е. не возвышаются над поверхностью влагалищного участка ШМ, имеют приблизительно одинаковые мелкие размеры, то это явление не вызывает особого беспокойства и не всегда требует биопсии.
Грубая М напоминает булыжную мостовую. Мозаичные области могут принимать различную форму, они могут быть квадратными, ромбическими или изломанными. Поля М при этом резко ацетобелые и долго сохраняют эту реакцию. Грубая М представляет собой островки различной величины и формы, имеет более выраженные борозды интенсивно красного цвета. После обработки раствором уксусной кислоты грубая М проявляется более резко в отличие от нежной М, изменяющейся в меньшей мере, и сохраняет свою яркость длительное время.
Если же наблюдается вздутие, т.е. атипичные участки эпителия возвышаются над уровнем слизистой оболочки, то это состояние следует расценить как чрезвычайно подозрительное.
Как и при оценке пунктации, при изучении характера М следует обязательно обращать внимание на так называемую межкапиллярную дистанцию. Мелкие и одинаковые участки М (регулярная М) более прогностически благоприятны, чем более крупные и неодинаковые (нерегулярная М). Необходимо подчеркнуть, что при обычном кольпоскопическом обследовании при 10- и 15-кратном увеличении почти незаметна эта разница. Необходимо использовать большое увеличение. В таком случае также хорошо подходит зеленый фильтр. При большом увеличении под фильтром межкапиллярная дистанция становится более видима.
Таким образом, ПиМ могут быть проявлением различных состояний: воспаления, быстро растущего метапластического эпителия, CIN, РШМ, рецидива этих состояний.
Если П и М не локализуются в ареале АБЭ, то маловероятно, что они отражают наличие CIN.
Оценка состояния слизистой оболочки шейки матки при кольпоскопии основана на совокупности кольпоскопических признаков. Кольпоскопические признаки неспецифичны и определяются при различных клинико-морфологических состояниях.
Мозаика и пунктация являются частыми спутниками неопластически измененного эпителия, а также кольпоскопическими образами акантоза и папилломатоза слизистой оболочки. Е.В. Коханевич с соавт. (1997) четко разграничивают, на фоне какого эпителия происходит образование мозаики и пунктации: многослойного плоского или метаплазированного цилиндрического эпителия. Такая дифференцировка целесообразна не только при изучении предопухолевого состояния, но и при выборе адекватной терапии, определении прогноза заболевания. На основании многолетних наблюдений авторы пришли к выводу, что наличие метаплазированного цилиндрического эпителия с мозаикой и пунктацией прогностически менее опасно в отношении малигнизации, чем многослойного сквамозного эпителия с данными элементами.
Определяющими для томографической узнаваемости слизистой оболочки с начальными проявлениями неоплазии являются оптические признаки акантоза и папилломатоза, так как атипичные изменения клеток менее 1/3 эпителиального пласта не оказывают влияния на визуализацию.
При проведении кольпо-томогистологических сопоставлений было обнаружено, что если при кольпоскопии определяются участки грубой мозаики и пунктации, а при ОКТ вертикальные структуры низкой яркости не визуализируются, это является оптическим признаком тяжелого неопластического процесса. С помощью ОКТ возможно дифференцировать, на фоне какого эпителия визуализируются акантоз и папилломатоз слизистой оболочки шейки матки.
Атипичные кольпоскопические признаки являются составляющими атипичных кольпоскопических картин. Существует установка, что чем более грубый характер носят атипичные кольпоскопические признаки, тем больше вероятность диспластических и раковых изменений. Между тем атипичные кольпоскопические признаки имеют различный индекс малигнизации (табл. 4).
Индекс малигнизации кольпоскопических картин, %
(after E.H. Hopman et al., 1998; E. Burgharat., 1991)
| Кольпоскопические признаки | CIN или микроинвазивный рак |
| Лейкоплакия | 7,4 |
| Атипичные сосуды | 2,4 |
| Открытые протоки с ороговением | 1,3 |
| Ацето-белая реакция | 52,2 |
| Мозаика и пунктация | 18,6 |
| Лейкоплакия + мозаика + пунктация | 31,0 |
| Атипичная зона трансформации | 17,0 |
| Немая йоднегативная зона | 1,7 |
По данным D. Hellberg и S. Nilsson (1990), при диспластических изменениях пунктация обнаруживается в 20,3% случаев, мозаика — в 17,0%, атипичные сосуды — в 2,7%. Г.Н. Минкин с соавт. (2001) при анализе 2296 кольпоскопических картин установили, что при HSIL грубые кольпоскопические изменения могут быть обнаружены в 56% случаев, нежные — в 4%.
Очевидно, что обнаружение атипичных кольпоскопических признаков далеко не всегда свидетельствует о злокачественности морфологического процесса. В результате нередко производится необоснованный забор биопсии, что приводит к изменению естественного хода интраэпителиальных повреждений, к значительной ятрогенной стимуляции процессов пролиферации в ходе заживления постбиопсийных ран, к образованию рубцов, очагов эндометриоза и стриктур цервикального канала. Это осложняет последующее кольпоскопическое наблюдение и приводит к значительному повышению стоимости цервикального скрининга.
Включение метода ОКТ в комплексное обследование шейки матки наиболее целесообразно в следующих клинических ситуациях:
- получение сомнительных и атипичных кольпоскопических картин, требующих решения вопроса о необходимости биопсии и месте ее проведения;
- необходимость точной оценки боковых границ и размеров патологической зоны;
- необходимость интраоперационного контроля линии разреза и деструкции при органосохраняющих манипуляциях на шейке матки;
- необходимость динамического неинвазивного контроля процессов регенерации после органосохраняющих манипуляций;
- необходимость объективной, атравматичной оценки состояния сводов влагалища при распространенной стадии злокачественной опухоли.
В сомнительных кольпоскопических ситуациях получение контрастного двухслойного образа является надежным критерием доброкачественного состояния слизистой оболочки. В этих случаях можно воздержаться от проведения биопсии даже при наличии атипичных кольпоскопических признаков. При разнообразном характере атипичных кольпоскопических изменений проведение биопсии целесообразно производить из участков слизистой оболочки, в которых оптическая структура изображения полностью отсутствует.
При определении боковых границ, площади деструкции и линии разреза при органосохраняющих манипуляциях следует ориентироваться на оптические критерии здоровой ткани, уточняющие кольпоскопические признаки.
В настоящее время существует достаточное число методов лечения патологии шейки матки, однако ни один из них не является универсальным. Неверно выбранная методика может способствовать прогрессированию процесса, появлению различных осложнений, возникновению ятрогенных состояний, изменению социального статуса, обусловливает дополнительные материальные затраты. Иногда следует ограничиться только динамическим наблюдением и цитологическим контролем, а если процесс на шейке сочетается с патологией тела матки (миома, эндометриоз) — произвести гистерэктомию.
При лечении одной и той же патологии необходим дифференцированный подход с учетом анатомического строения шейки матки, наличия ее деформации, а также в зависимости от возраста пациентки, оценки микрофлоры влагалища, наличия воспалительных изменений. Так, если деформация шейки не будет устранена, то лечение приведет лишь к временному улучшению, а затем к рецидиву. В постменопаузальном периоде лечение будет более эффективным, если оно проводится в сочетании с заместительной гормонотерапией. Если патологический процесс на шейке матки сопровождается наличием инфекций, передающихся половым путем, воспалением матки и влагалища, бактериальным вагинозом, то сначала проводится терапия сопутствующей патологии с нормализацией микрофлоры влагалища и лишь затем приступают к лечению шейки. У пациенток с нарушенным менструальным циклом лечение лучше проводить на фоне коррекции цикла эстроген-гестагенными или гестагенными препаратами.
Выбор тактики лечения заболеваний шейки матки зависит:
- от правильно установленного диагноза;
- возможностей лечебного учреждения в выборе метода лечения и практической подготовки медицинского персонала;
- возраста пациентки;
- желания женщины сохранить репродуктивную функцию;
- наличия сопутствующей патологии (лекарственная аллергия, кардиостимулятор, стеноз влагалища, миома матки, эндометриоз и др.);
- фазы менструального цикла.
Лечение патологических процессов шейки матки включает:
1) терапию причин и сопутствующих факторов;
2) воздействие на патологический очаг либо удаление патологического очага.
В первую группу включают антибактериальную терапию (антибиотики, противовирусные препараты и др.), направленную на ликвидацию сопутствующего воспалительного процесса шейки матки и влагалища; физиотерапию (низкочастотный ультразвук, гелий-неоновый лазер) для стимуляции регенерации многослойного плоского эпителия; гормональное лечение при нарушениях функции яичников (эстроген-гестагенные, гестагенные препараты); стимуляцию иммунитета (иммуномодуляторы); ректальное введение виферона (рекомбинантный человеческий альфа-интерферон) лицам, инфицированным вирусом папилломы человека (ВПЧ); введение лечебной рекомбинантной вакцины против ВПЧ для подавления репликации ВПЧ и торможения пролиферации опухоли (у 50% больных с генитальными кондиломами достигалось излечение после одной вакцинации без наступления рецидива); применение профилактической вакцины против ВПЧ с целью защиты от инфицирования.
Для воздействия на патологический очаг можно использовать:
- химическую коагуляцию;
- электрохирургическое воздействие (диатермо- или электрокоагуляция);
- криогенное воздействие (поверхностная и трансцервикальная криодеструкция);
- воздействие высокоинтенсивным лазером (лазерная вапоризация).
При необходимости удаления патологического очага на современном этапе используются:
- ножевая хирургия (конизация, ампутация);
- ультразвуковой скальпель;
- электрохирургия (электроконизация);
- лазерная эксцизия;
- радиоволновая хирургия.
Обследование больных перед лечением включает: мазок на флору влагалища, кольпоскопию, онкоцитологическое исследование, по показаниям — биопсию шейки матки и выскабливание цервикального канала. Воздействие осуществляется только при нормальной микрофлоре.
Для нежной пунктации характерны мелкие ровненькие точки, картина соответствует L-SIL. Кольпоскопист обязательно оценивает расстояние между точками — межкапиллярную дистанцию. Если все точки расположены примерно на одинаковом расстоянии — это равномерная пунктация, и это хорошо. Если точки крупные, или разных размеров, или расстояние между точками различное — это H-SIL
Если кусочки мозаики мелкие и примерно одинакового размера — это регулярная или равномерная мозаика, это хорошо. Если фрагменты крупные и сильно отличаются размерами — этог нерегулярная мозаика, и это плохо.
Читайте также:

