Монография по раку простаты
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В настоящее время в России и во многих других странах наметилась стойкая тенденция к увеличению числа больных раком простаты. Популяризация знаний об этом заболевании и современные возможности ранней диагностики позволили значительно увеличить выявляемость рака простаты на ранних стадиях, когда лечение может быть максимально эффективным.
При подробном анализе распространенности РПЖ в России выясняется, что почти у половины больных заболевание впервые выявляется на 3–4 стадии, что значительно затрудняет лечение и снижает его эффективность.
Столь широкое распространение РПЖ ставит его в ряд наиболее важных социальных проблем современности. Болезнь исключительно редко развивается раньше 40 лет и становится все более частым явлением с каждым последующим десятилетием жизни. По данным американских источников, никак себя не проявляющие очаги злокачественного перерождения предстательной железы выявляются у 15–30% мужчин старше 50 лет и у 80% мужчин старше 80 лет. Известно, что при наличии РПЖ у кровного родственника риск заболеть повышается в 2–3 раза.
Как и рак молочных желез у женщин, это заболевание на ранних стадиях практически всегда является случайной находкой или результатом специализированного скринингового обследования, поскольку длительное время не имеет никаких специфичных клинических проявлений, маскируясь за симптомами расстройства мочеиспускания, характерными для аденомы простаты, а иногда вовсе не причиняя пациенту никакого беспокойства.
Факторы окружающей среды, особенно различия в диете также играют важную роль в развитии рака простаты. Высокий уровень содержания в пище жиров животного происхождения является доказанным отрицательным фактором прогноза. В то же время было доказано, что азиатская диета, богатая соей, морепродуктами, рисом, грибами шиитаке, рыбой и зеленым чаем, оказывает некоторый защитный эффект и предотвращает развитие РПЖ.
Как было сказано выше, на начальной стадии РПЖ не имеет выраженной клинической симптоматики, что существенно затрудняет его диагностику. Признаки нарушения оттока мочи одновременно из обеих почек с развитием почечной недостаточности или появление болей в костях могут свидетельствовать о распространенности процесса.
Обнаружение простатоспецифического антигена (ПСА) в 1980-е гг. привело к революции в ранней диагностике РПЖ. ПСА – это белок, который выделяется предстательной железой и может определяться в крови в различных концентрациях. Условной границей нормы считается 4 нг/мл, но многие ведущие урологические клиники мира в последние годы склонны снижать норму этого показателя до 2,5 нг/мл, вводя дополнительные понижающие коэффициенты для более молодых мужчин. Тревожным может являться не только высокое абсолютное значение ПСА, но и высокие темпы его годового прироста (более 0,75 нг/мл). Повышение уровня ПСА – не всегда доказательство наличия рака простаты. Чувствительность этого онкомаркера составляет более 95%, а специфичность – около 75%. То есть в 25% случаев повышение уровня ПСА связано с другими причинами: наличием аденомы простаты, хроническим воспалением в предстательной железе и т. д. Так, уровень сывороточного ПСА может увеличиваться при различных манипуляциях с предстательной железой (массаж, биопсия), даже после эякуляции накануне исследования, а также при наличии инфекции.
Выбор тактики зависит от возраста больного, сопутствующих заболеваний, клинической стадии болезни, распространения опухоли и ее гистологических характеристик. Очень важно составить прогноз течения заболевания, что возможно на основании накопленного во всем мире многолетнего опыта наблюдения и лечения больных раком простаты. Хотя диагноз РПЖ на сегодняшний день ставится довольно часто, известно, что только у 25% больных непосредственной причиной смерти будет являться это заболевание.
Возраст больного – один из ключевых показателей при выборе оптимальной тактики лечения. Так, 75% больных младше 65 лет умирают от РПЖ при отсутствии надлежащего лечения. Также было установлено, что 50% пациентов с локализованным высокодифференцированным РПЖ живут более 15 лет от момента установления диагноза, даже если активного лечения не проводится.
Подход к лечению больных РПЖ должен быть сугубо индивидуальным. Максимально радикальное лечение – хирургическое (радикальная простатэктомия) подразумевает полное удаление простаты без вскрытия ее фасции единым блоком с семенными пузырьками. Если эта операция выполнена вовремя, с соблюдением всех онкологических принципов и по показаниям, то она позволяет полностью избавить больного от злокачественной опухоли и обеспечивает хороший прогноз для жизни.
Независимо от выбранной методики идея операции остается неизменной – выделение простаты без повреждения капсулы, отсечение ее от мочевого пузыря и мочеиспускательного канала и наложение соустья между пузырем и мочеиспускательным каналом. При необходимости выполняется удаление регионарных лимфатических узлов. Такая операция может быть рекомендована относительно молодым больным с ожидаемой продолжительностью жизни не менее 10–15 лет без тяжелых сопутствующих заболеваний. Несмотря на сопоставимые онкологические результаты, темпы восстановления после операции, сроки медицинской и социальной реабилитации больных во многом зависят именно от выбранной оперативной методики.
Несмотря на хорошие результаты радикальной операции, как и любое другое хирургическое вмешательство, она имеет ряд осложнений, наиболее характерными из которых являются недержание мочи и эректильная дисфункция. Частота осложнений меньше ассоциирована с методикой выполнения операции, но определенно зависит от опыта хирурга и индивидуальных особенностей пациента. Несомненно, существуют способы борьбы с подобными осложнениями, но лучше проводить профилактику их возникновения. Основополагающим ее элементом является определение показаний к операции. Второй по значимости фактор – соблюдение техники выполнения операции, имеющей много тонкостей и особенностей. Так, в зависимости от стадии процесса, локализации опухоли в простате и исходного уровня сексуальной активности у части больных операция может быть выполнена с сохранением нервов, ответственных за эректильную функцию.
Гормональная и химиотерапия в настоящее время большинством экспертов не одобрены для лечения локализованного рака простаты и должны быть резервированы для пациентов с распространенным онкологическим поражением. В таких случаях хороший результат может дать сочетанное лечение – комбинация медикаментозной и дистанционной лучевой терапии. Известно, что лучевая терапия уже десятилетия используется для лечения онкологических заболеваний. За счет поражающего радиоактивного излучения опухолевые клетки теряют свою репродуктивную активность. Радиоактивное излучение проникает глубоко в ткани. Обычно подбирается индивидуальная доза облучения – в зависимости от клинической стадии болезни. Гормональная терапия – один из стандартов нехирургического лечения распространенного РПЖ. Простата – гормоночувствительный орган, биохимические процессы в котором зависят от уровня тестостерона. Устранение его влияния на ткань простаты позволяет добиться гибели гормоночувствительных клеток, присутствующих в раковой опухоли.
Наряду с дистанционным лучевым воздействием в лечении локализованного РПЖ используется интерстициальная лучевая терапия, или брахитерапия. Источники излучения, введенные непосредственно в опухоль, обеспечивают более локальное воздействие. Опыт подобного лечения в отдельных странах насчитывает более 20 лет. Она применима у пациентов с относительно небольшими размерами простаты и невысокими значениями ПСА и обеспечивает хорошие результаты лечения.
Криотерапия представляет собой аблацию ткани путем локального воздействия очень низкой температуры и также показана пациентам с локализованным РПЖ. В 1996 г. Американская ассоциация урологов признала криоаблацию предстательной железы методом терапии локализованного РПЖ и перестала считать данную методику экспериментальной. В настоящее время криоаблация простаты представляет собой минимально инвазивный высокоэффективный способ лечения РПЖ. Посредством введения в простату 12–20 криоигл можно добиться локального снижения температуры тканей ниже 40°С. При этой температуре целостность клеток нарушается, и опухоль разрушается. В дальнейшем на этом месте происходит процесс рубцевания. Ограничения при выборе пациентов для криоаблации простаты сравнимы с таковыми при брахитерапии – большой объем простаты и выход опухоли за границы простаты. Неоспоримые преимущества криоаблации и брахитерапии – малая травматичность операции, низкий процент осложнений и меньшее количество ограничений в связи с возрастом и общим терапевтическим статусом пациента.
Высокоинтенсивный сфокусированный ультразвук, также относящийся к малотравматичным методам лечения, пока не одобрен мировой урологической общественностью ввиду малой продолжительности наблюдений и остается экспериментальным методом лечения РПЖ.
Важно помнить, что вопрос принятия решения о тактике лечения во многом зависит от выбора самого пациента и является результатом подробной беседы со специалистом, включающей тщательный анализ преимуществ и рисков того или иного метода лечения.
В этой статье мы не преследовали цель дать исчерпывающие знания о принципах диагностики и лечения рака простаты – проблемы сложной и многогранной. Мы лишь пытались создать представление о современных возможностях лечения этого грозного заболевания. Рак простаты хорошо поддается лечению и давно перестал быть приговором.

Рак предстательной железы (РПЖ) – одна из наиболее актуальных проблем современной онкологии и настоящая эпидемия стареющего мужского населения. Во всем мире заболеваемость и смертность от данной патологии неуклонно возрастают. По экспертной оценке ВОЗ в мире ежегодно возникает около 400 тыс. случаев этого заболевания. С ожидаемым увеличением продолжительности жизни у мужчин и встречаемости РПЖ также значительно возрастают экономические затраты на лечение данной группы больных. По опубликованным данным: в России в 2018г выявлено 42 тыс. новых случаев рака простаты, доля в онкологической заболеваемости мужского населения составила 14,9% и по показателю заболеваемости рак простаты уступил только раку легкого. Смертность от рака простаты составила 8,2% в структуре смертности от онкологических новообразований мужского населения России.- 4 место после рака легких, желудка и толстой кишки. За последние 10 лет прирост заболеваемости составил почти 100% и 30% по смертности, несмотря на развитие методов выявления и лечения рака простаты.
Зачем мужчине простата?

Что нужно делать?
Рак простаты редко встречается до 40 лет, но риск развития сильно возрастает после 50 лет. Около 6 из 10 новых случаев рака простаты будет выявлено в возрасте 65 лет и старше. Важен и наследственный фактор.
Если родственник 1й степени родства болен РПЖ, риск возрастает как минимум в 2 раза. Если заболевание диагностировано у 2-х родственников первой степени родства и более, риск увеличивается в 5–11 раз.
Выявление рак простаты основывается на применение диагностической триады: анализа крови на ПСА, пальцевого ректального исследования простаты и мультипараметрической МРТ. Скрининг рака простаты в первую очередь основан на определение ПСА. В настоящий момент, согласно рекомендациям Европейской ассоциации урологов (EAU Guidelines 2019), определение ПСА показано мужчинам старше 50 лет (или с 45 лет с отягощенным семейным анамнезом по раку простаты). Применяется риск-адаптированная стратегия с повторным определением ПСА каждые 2 года у пациентов с уровнем ПСА >1 нг/мл у пациентов 40 лет, или более 2 нг/мл в возрасте 60 лет. В иных случаях повторное определение ПСА целесообразно через 8 лет. Проведение скрининга ПСА у пациентов с продолжительностью жизни менее 15 лет не рекомендовано.
Что такое ПСА?
Простато-специфический антиген (ПСА)- вещество белковой природы, которое вырабатывается клетками предстательной железы, определение которого проводится в сыворотке крови, применяющийся для диагностики и наблюдения за течением рака простаты и аденомы простаты. В норме небольшое количество простат-специфического антигена поступает в эякулят и секрет простаты и очень незначительное количество попадает в кровь. При раке простаты уровень ПСА в крови может существенно повышаться, что делает его ценным опухолевым маркером. Кроме того, ПСА может повышаться при аденоме простаты, воспалительных заболеваниях (простатите), после массажа простаты и инструментальных исследований прямой кишки (воздерживаться от анализа не менее 2х суток). Кроме того, рекомендуется воздерживаться от эякуляции в течение как минимум 48 ч до взятия анализа , что позволит исключить ложное повышение уровня ПСА
ПСА содержится в крови как в свободной, так и в связанной форме. Чем ниже процент свободного ПСА, тем больше вероятность того, что повышение уровня ПСА вызвано раковой опухолью. При интерпретации результатов целесообразно учитывать норму для различных возрастных групп:
- 40-49лет — 2,5 нг/мл
- 50-59 лет — 3,5 нг/мл
- 60-69 лет — 4,5 нг/мл
- более 70 лет — 6,5 нг/мл
Мультипараметрическая МРТ.
В рамках многочисленных клинических исследований доказано, что трансректальное ультразвуковое исследование и другие методы ультразвукового исследования ТРУЗИ в серошкальном режиме не позволяет определить РПЖ с достаточной достоверностью. В настоящий момент основным методом визуализации при раке простаты является мультипараметрическая МРТ, включающая режимТ2-усиления в комбинации не менее чем с одним функциональным режимом, включая диффузионно-взвешенное изображение, динамическое контрастирование и/или H1-спектроскопию. Применение МРТ позволяет 27% мужчинам избежать биопсии простаты, диагностировать клинически значимый рак простаты на 18% чаще, а клинически незначимый на 5% меньше.
Биопсия предстательной железы.
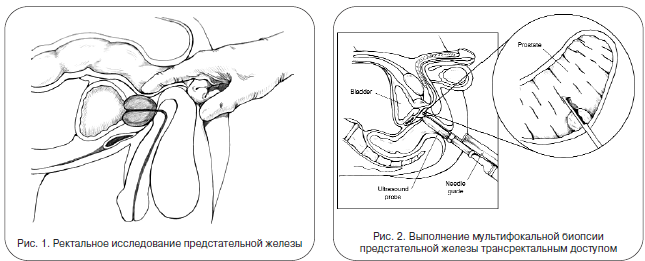
В случае выявления повышения ПСА, положительных данных, полученных при выполнение пальцевого ректального исследования и мультипараметрической МРТ -следующий обязательный этап обследования - морфологическое подтверждение предполагаемого диагноза. Биопсию предстательной железы можно выполнить трансректальным или промежностным доступом.
Выделяют системную и таргетную (прицельную) биопсии простаты. В настоящий момент стандартная системная биопсия простаты, как правило, выполняется трансректально под ультразвуковым контролем, автоматической биопсийной иглой из 10-12 точек из различных зон простаты. Проводится местная анестезия путем перипростатической инфильтрации. При наличии показаний возможно выполнение сатурационной биопсии простаты более чем из 20 точек. Прицельная (таргетная)биопсия предполагает, предварительное выявление патологических очагов в простате, а затем выполнение биопсии непосредственно из них. В урологическом отделение МКНЦ им. А.С.Логинова выполняется таргетная биопсия предстательной железы под навигационным ассистированием с помощью технологии гистосканирования. HistoScanning®- компьютерный анализ отраженных нативных узи сигналов с построением 3х-мерного изображения железы. Метод обеспечивает экранную визуализацию подозрительных участков и количественное представление одновременно в сагиттальной, аксиальной, фронтальной и 3D проекции и осуществляет навигацию при выполнении биопсии простаты.
В дальнейшем выполняется патоморфологическое исследование полученной ткани простаты для ранней диагностики рака простаты. С учетом полученных данных проводится планирование дальнейшего лечения.
Ранняя диагностика рака простаты является приоритетным направлением работы урологического отделения МКНЦ им.А.С.Логинова, врачи отделения располагают огромным опытом в первичном выявление этого заболевания и всегда готовы помочь вам.
Лечение рака простаты. Мы поможем вам!

Урологическое отделение МКНЦ им. А.С. Логинова в настоящий момент располагает опытом выполнения более 600 радикальных робот-ассистированных простатэктомий.
Операция демонстрирует прекрасный профиль безопасности и низкий уровень послеоперационных осложнений.
Онкологические и функциональные результаты наших операции соответствуют данным международных клинических обзоров. Срок пребывания в отделение после операции составляет 5-7 дней.

В настоящее время в распоряжении врача-уролога имеется множество диагностических методик, однако четко не определена роль каждой из них в диагностическом алгоритме обследования больного, как с подозрением, так и верифицированным раком предстательной железы (РПЖ) [3]. Оценка эффективности лечения больных РПЖ на сегодняшний день проводится с применением следующих диагностических процедур: пальцевого ректального исследования, ультразвукового сканирования, определения уровня ПСА в сыворотке крови, магнитно-резонансной томографии и повторной биопсии предстательной железы[13]. Однако пальпаторные и ультразвуковые методы исследования не всегда дают точную оценку состояния предстательной железы. У 64,6 % больных РПЖ, не имевших пальпаторных и ультразвуковых изменений в железе, аденокарцинома носила клинически локализованный, у 28,47 % - местнораспространенный характер и в 6,93 % - имела инвазию в семенные пузырьки[19]. Результаты другого проведенного исследования показали, что у 37,8 % больных с подозрением на РПЖ патологических изменений, характерных для злокачественного процесса, по данным пальцевого ректального исследования, не выявлено. В последующим у 66,7 % из них была верифицирована аденома предстательной железы, а у 26,7 % диагностирован РПЖ [5,12].
В работе Глыбочко П.В., и соавт. [5] найдена корреляция между содержанием ПСА в периферической крови и рядом параметров микроскопического плана, такими, как степень дифференцировки опухолевых клеток, индекс Глисона. В некоторых работах указывается, что на фоне гормонального лечения рост ПСА свидетельствует о потере чувствительности опухоли к гормональному лечению и трансформации андрогензависимого РПЖ в андрогеннезависимый [13, 17].
Таким образом, вопрос об оценки эффективности лечения при помощи данного маркера остается открытым. В отношении повторных биопсий после проведенного лечения как способа контроля за его эффективностью единого мнения на сегодняшний день не существует. Так в своей работе Montironi R. и соавт. [32] сообщают о характерных изменениях в биоптатах предстательной железы после гормональной и лучевой терапии, но не рекомендуют повторную биопсию в качестве контроля за проведенным лечением в силу огромного разнообразия патоморфологических изменений и трудности их интерпретации. Coock J., Hammerer P. [25, 28] высказывают мнение, что при наблюдении за больными после лучевой и комбинированной терапии повторная биопсия предстательной железы не является необходимой [13]. Большинство исследователей считают, что биопсия предстательной железы остаётся основным методом подтверждения наличия местного рецидива РПЖ у пациентов с обнаружением повышения уровня ПСА после радикального лечения. Исследование биоптатов предстательной железы является одним из самых важных этапов диагностического поиска при заболеваниях простаты [4, 11, 12]. Морфометрия обладает самой высокой специфичностью (88 %) и точностью (84 %) в комплексной диагностике РПЖ. Она позволяет формировать группы риска, оценить степень дифференцировки опухолевых клеток и прогнозировать течение распространенного рака простаты [1]. Морфологическая диагностика может быть трудной, и диагноз - не всегда бесспорным, если рак бывает локализованным, так как для установления морфологического диагноза требуется определение комплекса разнообразных гистологических признаков опухоли, таких, как характер роста, ядерная атипия, отсутствие базальных клеток и наличие характерного экстрацеллюлярного материала в малигнизированных железах [26, 27].
Во многих работах указывается, что гистологическое исследование недостаточно для постановки достоверного диагноза, в таких случаях в диагностике помогает иммуногистохимическое исследование [7, 20]. На сегодняшний день оно являются обязательной частью любых исследований, т.к. обеспечивает специфическую визуализацию локализации в тканях различных клеток, гормонов и их рецепторов, ферментов, иммуноглобулинов, компонентов клеток (сократительных и промежуточных филаментов) и даже отдельных генов, а также изучение секреторных и синтетических процессов. Однако и здесь остается большое количество вопросов. Общеизвестно, что развитие злокачественной опухоли - процесс мультифакторный, сопряженный с нарушением или перестройкой большей части внутриклеточных механизмов. В связи с этим составить представление о течении процесса лишь по одному маркеру практически невозможно. Приоритетной задачей в настоящее время является не разработка способов применения каждого маркера в отдельности, а создание набора из доступных маркеров, способного достаточно подробно дать характеристику опухоли [2].
Безусловно, многие аспекты, касающиеся биопсии простаты, остаются не до конца ясными и порождают научные споры, объективных и четких ответов на которые пока нет [16].
Рак предстательной железы — это проблема, с которой может столкнуться, пожалуй, каждый мужчина. К настоящему моменту не существует ни надежных методов профилактики этого заболевания, ни достоверных способов заранее узнать, каков риск столкнуться с бедой в каждом конкретном случае. Однако медики уже научились распознавать рак простаты на самых ранних стадиях, а также успешно лечить опухоли. Поэтому если онколог предполагает наличие рака простаты — не спешите впадать в отчаяние, ведь шансы на выздоровление высоки.
Стадии и особенности протекания рака предстательной железы
Предстательная железа — небольшой орган (размером с шарик для пинг-понга), расположенный у основания мочевого пузыря. Ее основная функция — синтез секрета, входящего в состав спермы, и участие в процессе семяизвержения.
Рак предстательной железы подразумевает появление и увеличение в размерах опухоли, способной к быстрому росту и метастазированию (переносу злокачественных клеток в другие органы и ткани). Это заболевание может возникнуть в любом возрасте, но в подавляющем большинстве случаев диагностируется у мужчин старше 60 лет.
Рак простаты — третье по распространенности онкологическое заболевание у представителей сильного пола в России после рака легких и рака желудка. Он обнаруживается у одного из пятнадцати мужчин старше 40 лет. Каждый год в мире злокачественные опухоли предстательной железы диагностируют у миллиона человек, и примерно каждый третий из них умирает вследствие данной патологии.
Почему развивается рак предстательной железы? Известно, что это сопряжено с изменениями гормонального фона, генетической предрасположенностью, неправильным питанием и воздействием некоторых других факторов, роль которых до сих пор окончательно не установлена.
От момента появления первой раковой клетки до развития симптомов, которые приводят мужчину на консультацию к врачу, обычно проходит несколько лет. По этой причине часто пациент оказывается на приеме у онколога с запущенной, разросшейся опухолью, которую сложно вылечить.
Всего принято выделять четыре стадии рака простаты:
- 1 стадия характеризуется маленькими размерами опухоли, отсутствием вовлечения в патологический процесс лимфатических узлов (туда раковые клетки могут попасть с током лимфы) и хорошим самочувствием больного. Как правило, на этой стадии рак простаты выявляется случайно — в ходе лечения другого заболевания железы. Прогноз для жизни пациента — благоприятный, терапия не занимает много времени.
- 2 стадия рака простаты означает, что новообразование увеличилось в размерах. Его можно прощупать — в ходе ректального осмотра (простата прилегает к передней стенке прямой кишки, поэтому врач способен дотянуться до нее пальцем). При этом симптомы заболевания зачастую по-прежнему не проявляются. Поэтому так важно регулярно проходить профилактическое обследование у уролога. Около 80% больных, у которых рак простаты был диагностирован на 2 стадии, выздоравливают.
- 3 стадия заболевания характеризуется разрастанием опухоли за пределы оболочки простаты. Раковые клетки обнаруживаются в лимфоузлах малого таза и в некоторых соседних органах. К этому моменту больной обычно ощущает дискомфорт: из-за деформации железы нарушается мочеиспускание, появляется боль в промежности. Чтобы победить опухоль, уже недостаточно сделать операцию, поэтому часто онкологи используют комбинированную тактику, сочетая различные подходы к уничтожению раковых клеток. Выживаемость на этой стадии рака простаты составляет менее 40%.
- 4 стадия подразумевает, что, помимо простаты, рак затронул отдаленные органы или лимфоузлы. Метастазы могут обнаруживаться в костях, легких, печени и т. д. Если пациент — пожилой человек с тяжелыми хроническими заболеваниями, врачи примут решение отказаться от операции в пользу щадящих методов терапии, которые продлят жизнь и облегчат страдания больного, хотя и не помогут победить рак.
Как будет проходить лечение рака простаты, зависит не только от стадии болезни. Важное значение имеет тип опухоли — его определяют при биопсии, взяв несколько образцов ткани и изучив их под микроскопом. Некоторые разновидности рака — например полиморфноклеточный рак предстательной железы — склонны к быстрому агрессивному росту, развитие других подвержено влиянию гормонов. Опытный онколог учитывает все эти обстоятельства, а также мнение самого больного, прежде чем принять решение о лечебной тактике.
Немаловажную роль играет и техническая оснащенность клиники. Не секрет, что многие современные технологии и лекарства попросту не доступны в отечественных онкологических центрах или находятся на стадии внедрения. И даже такие классические подходы, как хирургическое удаление простаты, могут значительно отличаться, что сказывается не только на успехе лечения, но и на качестве жизни пациента.
Предстательная железа — орган важный, но взрослый мужчина вполне способен прожить и без него. Поэтому, если рак не перекинулся на соседние органы и ткани, а состояние больного допускает проведение операции, онколог порекомендует мужчине радикальную простатэктомию — удаление простаты. На начальных стадиях болезни такой подход позволяет полностью вылечиться в короткий срок (пребывание в больнице занимает около 7 дней).
Между тем важно помнить, что речь идет о серьезном вмешательстве в работу организма, которое сопряжено с риском для жизни, а также приводит к некоторым неприятным последствиям. Так, больные нередко испытывают проблемы с мочеиспусканием на протяжении многих месяцев после операции, более половины мужчин — жалуются на исчезновение эрекции.
Щадящим вариантом хирургического лечения рака простаты является лапароскопическое вмешательство, при котором удаление простаты осуществляется через небольшие разрезы — всего несколько миллиметров длиной. В результате снижается риск послеоперационных осложнений, а сама процедура переносится пациентом гораздо легче.
Альтернативой традиционному хирургическому вмешательству может стать криохирургия опухоли простаты. Данный метод применим на ранних стадиях заболевания, когда рак еще не вышел за пределы органа. В ходе манипуляции пациенту в простату вводятся специальные иглы, через которые поступает жидкие аргон или азот. Низкие температуры разрушают ткани железы, а врач при помощи УЗИ контролирует, чтобы воздействие не повредило соседние органы. Как результат — железу не приходится удалять (хотя функции ее необратимо нарушаются). В последние годы криохирургию все чаще предлагают в качестве основного способа лечения рака простаты, который подходит больным всех возрастов.
Лучевая терапия назначается как отдельный метод лечения, так и в качестве дополнения к операции: до вмешательства или после него. Речь может идти как о внешней радиотерапии (когда пациент лежит под излучателем), так и о внутренней лучевой терапии, когда в тело больного вводят особые радиоактивные гранулы.
Внешняя лучевая терапия также имеет свои разновидности. Онкологи стремятся минимизировать губительное воздействие радиации на ткани тела, поэтому стараются как можно точнее направить пучок радиации на опухоль. В этом им помогают такие методы, как 3D-конформная лучевая терапия, лучевая терапия модулированной интенсивности (IMRT), стереотоксичечская лучевая терапия (SBRT) и протонная лучевая терапия. Каждый из этих подходов имеет достоинства и недостатки. Часто радиотерапия приводит к устойчивым расстройствам мочеиспускания и к эректильной дисфункции.
Внутренняя лучевая терапия (брахитерапия) значительно увеличивает эффект радиации за счет сокращения расстояния от ее источника до раковых клеток. Радиоактивные гранулы, используемые для процедуры, содержат радиоактивный йод, палладий и другие химические вещества, способные в течение длительного времени воздействовать на окружающие ткани. В зависимости от метода, эти гранулы могут находиться в организме многие месяцы (постоянная брахитерапия) или только во время лечебных сеансов (временная брахитерапия).
Химиотерапия применяется, как правило, в ситуациях, когда рак распространился по организму, поэтому воздействовать на болезнь нужно глобально. Препараты, используемые для лечения злокачественных опухолей простаты, назначают курсами, следя за результатами терапии и развитием побочных эффектов. Химиотерапевтические средства плохо влияют не только на рак, но и на здоровые ткани. Поэтому больные, проходящие такое лечение, часто страдают от расстройств пищеварения, слабости, потери волос и инфекционных заболеваний.
Данный вид лечения направлен на активацию иммунитета пациента. Раковые клетки чужеродны нашему телу, однако благодаря особым приспособительным механизмам они способны уклоняться от иммунного ответа.
Поскольку зачастую рост опухоли провоцируется действием мужских половых гормонов, на поздних стадиях рака простаты врачи могут назначать пациенту препараты, блокирующие синтез этих веществ. Обычно речь идет о пожизненном приеме фармацевтических средств. Такое лечение означает медикаментозную кастрацию: на его фоне затухает сексуальная функция. В сочетании с другими методами — например радиотерапией — прием гормонов способен привести к полному излечению пациентов, которым противопоказана радикальная простатэктомия. При этом медикаментозная кастрация обратима — после отмены лекарств.
Методы лечения рака простаты разнообразны, и каждый год появляется информация о новых эффективных подходах. Другими словами, безнадежных случаев, когда медицина оказывается бессильна помочь пациенту, уже почти не осталось. Важно найти врача, который подберет эффективную лечебную тактику. Не стоит отчаиваться — победа над раком во многом зависит от вас.
Читайте также:

