Могут ли быть метастазы при раке in situ
Злокачественная опухоль – это плохо и страшно, но обнаруженный рак in situ – большая удача: если выявить опасное заболевание на уровне первичных раковых изменений в клетках, то можно вовремя и гарантированно вылечить болезнь, предотвратив неумолимый опухолевый рост.
Раковые изменения в клетках лежат в основе прединвазивной опухоли
Рак in situ
Раковые клетки никогда не появляются неожиданно: перед возникновением злокачественной опухоли всегда имеется этап предраковых изменений в клеточных структурах органа или ткани. Рак in situ – это стадия онкологического процесса, при которой нет опухоли, но на клеточном уровне появились канцерогенные изменения (в организме человека возникло динамическое равновесие между раковым процессом и иммунной защитой). По классификации TNM прединвазивное новообразование относится к нулевой стадии (Tis). Для каждой локализации характерны свои особенности, но суть одна – канцерогенный процесс запущен, рано или поздно клеточные изменения станут классическим инвазивным раком. Поймать этот момент, своевременно выявить рак in situ является большой удачей для врача-онколога – при правильном подходе к терапии можно со 100% гарантией вылечить пациента.
Альтернативные названия
Нет анатомических изменений в виде роста новообразования, но возникли первичные морфологические дефекты на фоне злокачественного перерождения в клетках – рак in situ неумолим и опасен. У заболевания могут быть следующие названия:
- карцинома ин ситу;
- рак на месте;
- внутриэпителиальная опухоль;
- прединвазивный рак;
- интраэпителиальная неоплазия;
- компенсированный рак.
Вне зависимости от названия важно понимать – канцерогенез начался, без лечения прогрессирующая злокачественная опухоль обязательно перейдет в следующую стадию.
Особенности опухоли
Для каждой локализации прединвазия проявляется разными симптомами и признаками, но для всех форм неоплазии характерны следующие особенности:
- временной промежуток от 0 к 1 стадии может быть от нескольких месяцев до нескольких лет;
- часть патологии врач выявит при обычном осмотре, но в большинстве случаев диагностика сложна и трудоемка;
- вероятность появления инвазивной формы рака гарантирована, но когда онкология начнет прогрессировать – непредсказуемо;
- удаление очага прединвазивной опухоли прекращает онкологический процесс, но не гарантирует возникновение новообразования в другом месте.
Карциному in situ не следует рассматривать, как доброкачественный процесс – даже при получении положительного эффекта от консервативного лечения, не следует расслабляться и надеяться на благоприятный исход болезни.
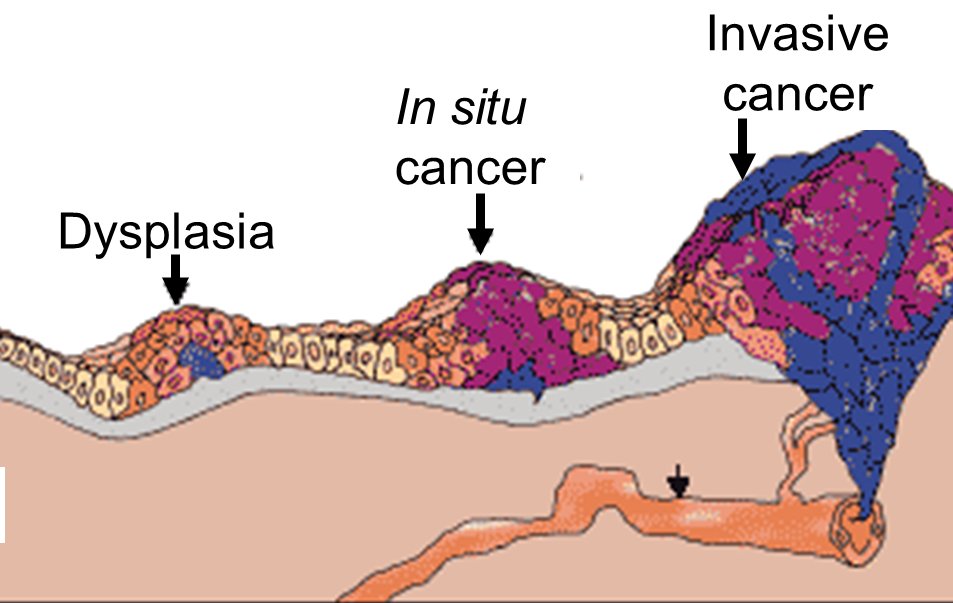
Пути обратно нет: рак in situ – последняя ступень перед злокачественной опухолью
Возможности лечения
Чаще всего предопухолевые изменения можно выявить при патологии следующих органов:
- цервикальный канал и шейка матки;
- эндометрий;
- молочная железа;
- легочная ткань;
- гортань и полость рта;
- мочевой пузырь;
- кожа.
В любых доступных для визуального (обычного или эндоскопического) осмотра органах врач сможет выявить микрокарциному, но только при своевременном обращении к доктору. Подтвердив диагноз цитологическим или гистологическим исследованием, онколог назначит следующие виды терапии:
- Гормонотерапия (при патологии эндометрия);
- Органосохраняющая операция (конизация шейки матки, секторальная резекция);
- Удаление пораженного органа (например, тотальная гистерэктомия).
Выбор метода лечения всегда индивидуален и подбирается для каждого пациента с учетом онконастороженности, наличия факторов риска и вероятности быстрого опухолевого роста.
Прогноз для здоровья и жизни
Обнаружив рак in situ, врач в максимально короткие сроки проведет комплексное обследование и выполнит необходимую для выздоровления операцию. Шансы на излечение при раннем раке максимальны – выживаемость при прединвазивной опухоли равна 100%.
Мысли об онкологии: просто о сложном на Дзен.Канале Onkos

Причины
Наиболее часто данная форма онкологии возникает в протоках молочной железы. Клетки формируются в злокачественное новообразование, но не выходят за пределы протока. Новообразование может нормально существовать рядом со здоровыми тканями, не поражая их и не нарушая их функции. В международной терминологии патология имеет сокращение DCIS.
Другой формой рака in situ является дольковая карцинома молочной железы (LCIS). Для него характерно появление онкологических клеток в дольковой части груди. Они редко выходят за пределы дольки или в другие органы.
Данная патология является достаточно распространенной. За последние несколько десятилетий число женщин с этим диагнозом значительно увеличилось, что связано с ростом количества проведения маммографии. То есть увеличилась диагностируемость заболевания.
Причины появления рака данного вида еще находятся на стадии изучения. Выделяют несколько факторов, которые формируют группы риска развития онкологического заболевания:
- Наследственность. Существует высокая вероятность появления заболевания, если встречались эпизоды патологии у кровных родственников. Поэтому если у матери, тети или сестры был диагностирован рак, то следует обязательно пройти профилактическое обследование;
- Возраст. Патология чаще отмечается у женщин старшего возраста, поэтому на многих предприятиях обязательным пунктом в профилактическом осмотре является маммография (это обследование желательно проходить всем женщинам после 50 лет);
- Беременность после 30 лет;
- Наличие в молочной железе доброкачественных опухолей высокого онкологического риска;
- Длительная (более 5 лет) гормональная терапия, включающая эстрогены и прогестерон;
- Метаболические нарушения.
Симптомы
Выявить патологию в начале развития достаточно сложно, поскольку она может никак не проявлять себя. Поэтому так важно регулярно посещать гинеколога и выполнять маммографию для ранней диагностики заболевания.
Протоковый рак in situ может иметь следующие симптомы:
- Кровянистые выделения из соска;
- Болевые ощущения в молочных железах;
- Появление припухлости или отечности.
Дольковая карцинома in situ может вообще себя никак не проявлять и обнаруживаться случайно (например, при диагностике другого заболевания).
Если на маммографии или МРТ было выявлено подозрительное новообразование, женщине назначают биопсию. Это малоинвазивная процедура, которая выполняется под местным обезболиванием. Это может быть тонкоигольная биопсия (когда аспирация тканей производится с помощью иглы маленького диаметра) или толстоигольная биопсия (используется толстая игла, благодаря чему можно взять больше ткани для исследования). Также назначают исследование для определения рецепторов гормонов клеток (ER и PR).
Лечение
Лечение рака молочной железы in situ будет зависеть от локализации новообразования, его размеров, наличия одной или нескольких пораженных областей, общего состояния здоровья пациентки, наличия опасных онкологических факторов.
В случае дольковой карциномы оперативное вмешательство может не понадобиться. Пациентке необходимо будет только регулярно посещать врача для наблюдения за патологией в динамике. В случае гормон-рецептор-положительной карциномы назначают гормональные препараты, которые связываются с рецепторами раковых клеток и препятствуют их взаимодействию с женскими половыми гормонами. Таким образом можно тормозить развитие раковой опухоли.
При протоковой карциноме обычно рекомендуют хирургическое лечение. Оно может включать резекцию только пораженной области или тотальную мастэктомию. Операция позволяет значительно снизить риск развития инвазивного рака в будущем. Тотальная мастэктомия рекомендуется, если:
- Присутствует несколько протоковых карцином;
- Ранее уже проводилось оперативное вмешательство в этой области, однако раковые клетки все равно обнаруживаются;
- Протоковая карцинома начинает прорастать в соседние ткани.
При наличии показаний дополнительно может потребоваться радиотерапия.
Прогноз
Несмотря на то, что рак in situ молочной железы не несет угрозы для жизни женщины, его наличие значительно повышает риск развития инвазивного рака. Без лечения в 60% случаев он может перерасти в полноценную раковую опухоль через 5-10 лет после постановки первичного диагноза.
В 25-40% случаев рецидив протокового рака in situ или появление инвазивного рака происходит через 5-10 лет после хирургического лечения без лучевой терапии. Онкология также может возникнуть и спустя десятилетия, поэтому следует внимательно относиться к своему здоровью, вести здоровый образ жизни, регулярно посещать врача для профилактического обследования.
Лечение в Москве
В Юсуповской больнице выполняют все мероприятия для лечения рака in situ молочной железы. В клинике онкологии Юсуповской больнице можно выполнить все необходимые обследования на новейшей аппаратуре, что позволит поставить диагноз наиболее точно. На основании исследования высококвалифицированные врачи назначают терапию, которая будет оптимальной в данном конкретном случае. При составлении лечения обязательно учитываются индивидуальные особенности пациентки, семейный анамнез, история болезни.
Хирургическое лечение проводится на базе широкой партнерской сети Юсуповской больницы с привлечением лучших хирургов Москвы. После операции пациентка проходит лечение в комфортном стационаре Юсуповской больницы.
В дальнейшем здесь можно проходить все профилактические обследования для исключения и своевременной диагностики рецидива патологии.

Карцинома in situ (ин ситу) — рак в самой начальной стадии, когда есть только пласт злокачественных клеток, не выходящий за пределы слизистой оболочки и не проникающий в глубину стенки органа. Считается, что в этот период отдаленных метастазов не может быть, но иногда находят скопления раковых клеток в ближайших лимфатических узлах.
- Диагностика
- Чем опасна внутриэпителиальная карцинома
- Карцинома in situ шейки матки
- Карцинома in situ молочной железы
- Карцинома in situ пищевода
- Карцинома желудка in situ
- Рак in situ толстого кишечника
- Рак легкого in situ
- Рак кожи in situ
Диагностика
Начало процесса можно определить при наблюдении за течением предракового процесса, каковой установлен далеко не для всех органов. Официально признаны предраковые состояния кишечника — полипы, матки — дисплазия, пищевода — Баррета, болезнь Боуэна для кожи, поэтому их адекватное лечение исключает вероятность озлокачествления.
Фиброзно-кистозная мастопатия и другая доброкачественная патология молочной железы не относится к предраковому состоянию, потому что у этих патологий с карциномой общее только пролиферация — способность клеток к усиленному воспроизводству.
Официально не установлено облигатных предраковых процессов в желудке и поджелудочной, легком и многих других органах, поэтому ИС в них находят случайно.
Чем опасна внутриэпителиальная карцинома
Без лечения группа злокачественных клеток неуклонно увеличивается, при внутриэпителиальном росте деление и гибель клеток долгое время находятся в равновесии, но через какой-то срок любое равновесие нарушается. Обычно от состояния in situ до инвазивного рака проходит несколько лет, к примеру, при карциноме поджелудочной железы — почти 20 лет, при поражении шейки матки — около 12 лет.
Некоторые виды внутриэпителиального злокачественного процесса, как и обычный рак, имеют несколько градаций агрессивности — от высокодифференцированной до низкой степени дифференцировки, соответственно и скорость перехода от 0 стадии до 1-2 стадии сильно различается.
Предполагается, что у некоторых больных раком молочной железы 0 стадии болезнь никогда не сможет дорасти до клинически определяемой опухоли, поэтому лечить их — только портить женщине жизнь, но абсолютно неизвестно кого какая судьба ожидает, поэтому лечат всех.
Карцинома in situ шейки матки
Наиболее изученная патология, которую выявляют на этапе дисплазии — предрака и лечат. К развитию опухоли и дисплазии приводит деятельность определенных типов вируса папилломы человека, современное обследование легко их обнаруживает внутри клеток. Сегодня у каждой четвёртой пациентки заболевание выявляется на этапе 0 стадии, а можно микроскопический рак обнаруживать у всех 100%.
Дисплазия тяжелой степени часто неотличима от in situ даже при микроскопии, вместе они входят в группу цервикальной интраэпителиальной неоплазии или CIN 3, лечение обеих состояний очень серьезное — операция.
У клеток внутриэпителиальной опухоли уже имеются черты будущей морфологической принадлежности — плоскоклеточного рака или аденокарциномы in situ.
К сожалению, пока не найдено специфического противовирусного лекарства, которое могло бы пресечь прогрессию дисплазии, но у большинства женщин со временем вирус исчезает вместе с приютившей его клеткой слизистой оболочки, умирающей от старости. Только у 20% легкая дисплазия переходит в более тяжелую, если избегать лечения, то ещё у 20% средняя степень перейдет в тяжелую CIN.
У молодых женщин выполняют органосохранную электроконизацию шейки, позволяющую в дальнейшем выносить плод, у вышедших из репродуктивного возраста женщин предпочтительно удаление матки вместе с шейкой.
Карцинома in situ молочной железы
Тотальное маммографическое обследование женщин, начиная с 40-45 лет, позволяет обнаружить 0 степень заболевания, которая проявляется дуктальной (протоковой) или лобулярной (дольковой) неинвазивной карциномой. К сожалению, из двух сотен больных только у 3 процесс выявляют на 0 стадии.
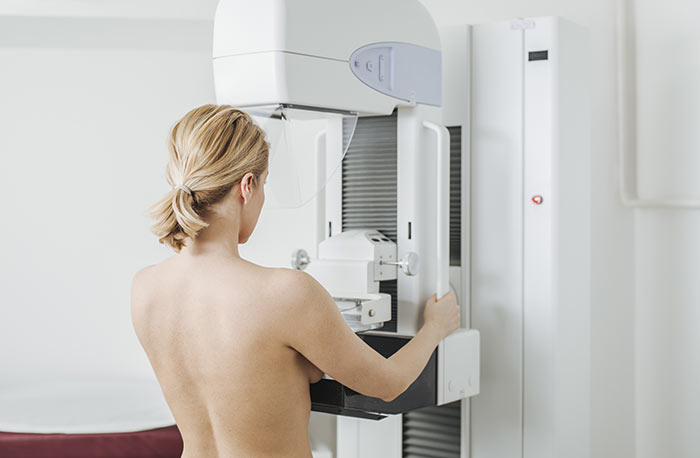
Оперативное лечение обязательно и лучше выполнить мастэктомию, в некоторых ситуациях целесообразно удаление обеих желез или при наличии гормональной зависимости клеток — проведение гормонотерапии тамоксифеном для профилактики рака во второй груди.
Протоковый рак in situ или DCIS может манифестировать выделениями из соска, в том числе с обильной примесью крови. Возможно наличие опухолевого образования и даже нескольких очагов у каждой третьей женщины. Выделен агрессивный гистологический вариант — низкодифференцированный DCIS, с высокой вероятностью с течением времени прогрессирующий в инвазивный рак. Лечение процесса хирургическое — от резекции до мастэктомии, частота рецидива после органосохранной операции доходит до 30%.
Карцинома in situ пищевода
Предраковым процессом в пищеводе считается осложнение хронического заброса желудочного сока — гастроэзофагеальной болезни, так называемый пищевод Баррета, сопровождающийся частичной заменой клеток пищеводной слизистой на желудочные —метаплазией. По наблюдениям, у пациентов с метаплазией слизистой нижнего отдела пищевода чаще возникает аденокарцинома.
Обычно онкологи считают внутриэпительные скопления злокачественных клеток ранним раком пищевода, для лечения которого достаточно эндоскопической резекции в пределах слизистой или подслизистого слоя.
Карцинома желудка in situ
Внутриэпителиальную карциному в желудке обычно считают ранним раком, и разработаны детальные клинические рекомендации по его хирургическому лечению.
Как правило, для полного излечения достаточно эндоскопической резекции участка пораженной слизистой, без вскрытия остальных слоев желудочной стенки.
Рак in situ толстого кишечника
Рак легкого in situ
Морфологическая классификация опухолей легкого предусматривает группу преинвазивных новообразований, в том числе немуцинозную или муцинозную аденокарциному и плоскоклеточную карциному in situ.
В клинической практике выявления процесса на этой стадии — большая редкость, поскольку он не проявляется какими-либо симптомами, а для гистологического анализа необходимо выполнить бронхоскопию с биопсией.
Наиболее вероятно начальный злокачественный процесс выявить при регулярном наблюдении злостных курильщиков с хроническими заболеваниями бронхиального дерева, осложнившиеся развитием метаплазии многослойного плоского эпителия. Микроскопические очаги рака на этой стадии легко обнаруживает флюоресцентная эндоскопия.
В реальной жизни из десяти впервые выявленных больных раком легкого удается прооперировать только одного-двух, потому что основная часть имеет неоперабельный процесс.
Рак кожи in situ
Размеры поражения могут быть внушительными. Образования могут напоминать пигментный невус, воспаленную бородавку и даже меланому. Вероятность их перерождения в плоскоклеточный рак очень высока, поэтому необходимо удаление в пределах здоровых тканей: хирургическое иссечение, сжигание жидким азотом или электрическим током, хорошие результаты дает фотодинамическая терапия и лазерная деструкция.
Карцинома in situ - это вид рака, который описывается как злокачественная опухоль в начальной стадии. Особенность этого вида рака состоит в том, что гистологические клетки скапливаются на одном участке тела, не распространяясь при этом на ткани, которые находятся в непосредственной близости от опухоли.
Что такое карцинома in situ, принцип образования карциномы, факторы риска
Карцинома in situ представляет собой группу аномальных клеток. Некоторые специалисты высказывают мнение, что такой вид карциномы нельзя классифицировать как обычный рак, а лишь как клетки, потенциально могущие стать раковыми.

Рисунок 1. Принцип образования карциномы in situ

Рисунок 2. Кишечные полипы
Факторы риска карциномы in situ
- семейная история рака толстой или прямой кишки;
- некоторые наследственные заболевания, например наследственный неполипозный рак толстой кишки (синдром Линча);
- язвенный колит (язвы в слизистой толстой кишки) или болезнь Крона;
- личная история рака толстой кишки, прямой кишки, яичников, эндометрия или груди;
- наличие полипов толстой или прямой кишки.
Симптомы карциномы in situ
Основные симптомы карциномы проявляются после того, как заболевание из неинвазивной формы перейдет в инвазивную. К ним относится:
- изменение стула;
- наличие крови в стуле;
- диарея, запор, ощущение переполненности толстой кишки;
- частые боли, газообразование, вздутие живота, судороги;
- потеря веса без повода;
- чувство постоянной усталости;
- рвота.
Симптомы карциномы органов пищеварения сложны и довольно многообразны. Основным сигналом для беспокойства должно стать систематическое нарушение стула, кровь в испражнениях, боли в кишечнике, желудке. Могут поменяться пищевые предпочтения, качество переваривания пищи обычно страдает при наличии раковой опухоли. Однако если пациент питается правильно, карцинома может десятилетиями находиться в зачаточном состоянии.
Диагностика карциномы in situ
Диагностические меры при подозрении на карциному так же весьма многообразны. К ним относится прежде всего осмотр тела, ректальный осмотр прямой кишки (позволяет обнаружить уплотнения, опухоли, аномальные образования на стенках)
Также проводится анализ кала на скрытую кровь. Если пациенту был поставлен диагноз карцинома прямой кишки, это не означает, что ситуация безнадежна. Обычно карцинома ограничивается лишь участком слизистой и не проникает в глубину тканей. Чтобы проверить степень распространения рака, используют такие тесты, как ректороманоскопия и сигмоидоскопия. Также выполняют процедуру клизмы с барием. Это помогает при рентгене обнаружить аномально увеличенные участки кишечника.
Колоноскопия проводится при диагностике прямой и толстой кишки на полипы, аномальные зоны и другое. Колоноскоп – это не просто средство диагностики, это еще и устройство для удаления полипов или взятия образцов тканей. Колоноскопия может быть обычной или виртуальной. Виртуальная колоноскопия: процедура, которая использует рентгеновские лучи для получения снимков толстой кишки.
Биопсия проводится только в том случае, когда карцинома располагается в пределах доступности для взятия образца. В других случаях проводится лапароскопическое взятие образца ткани при помощи гибкой трубки.
Карцинома in situ обычно хорошо удаляется хирургическим путем. Хирургическое иссечение часто проводится при помощи колоноскопа. Однако если опухоль уже приобрела большой размер, удаляется и часть пораженного участка (не только кишечника, но и пищевода, желчного, печени).
Лечение карциномы in situ и прогноз
Карциномы, по определению, – это локальное явление, без потенциала метастазирования. Таким образом, их удаление устраняет риск последующего прогрессирования и убирает опасность для жизни пациента.
Некоторые карциномы, например, полипоидные опухоли мочевого пузыря или полипы толстой кишки, можно удалить с помощью эндоскопа, без обычной хирургической резекции. Другие формы (карцинома пищевода, ротовой полости, печени, желчных протоков, ободочной и сигмовидной кишки) требуют серьезной операции и лучевой терапии. На качество лечения влияют такие факторы, как состояние организма пациента, возраст, история раковых заболеваний, наследственность.
Прогноз для карциномы in situ
При своевременном лечении прогноз для карциномы in situ благоприятен. Некоторые пациенты не нуждаются в удалении этого вида клеток, а лишь требуют постоянного наблюдения и контроля над состоянием организма. Чем позднее обнаружилась опухоль, тем неблагоприятнее прогноз. Обычно на этапе появления тяжелых симптомов стадия рака такова, что тяжело судить о выживаемости до проведения лечения и оценки его результатов.
Для пациентов с раком молочной железы с предоперационным диагнозом протоковой карциномы in situ (DCIS) биопсия дозорного лимфатического узла (SN) была предложена в качестве процедуры подмышечной стадии у отдельных пациентов с более высокой вероятностью наличия оккультных инвазивных поражений. С подробным гистологическим исследованием первичных опухолей и молекулярным целым узлом анализа SNs мы стремились проверить, точно ли это избирательное приложение идентифицирует пациентов с метастазированием SN. Субъектами были 336 пациентов с предоперационной игло-биопсийной диагностикой DCIS, которая прошла биопсию SN с использованием одношагового анализа амплификации нуклеиновой кислоты в период 2009-2011 гг. Были исследованы частота и предоперационные показатели превзояемости инвазивного заболевания на конечную патологию и метастазы SN и их корреляцию. Из 336 пациентов 113 (33,6%) имели инвазивное заболевание, а 6 (1,8%) и 17 (5,0%) имели макро- и микрометастазы в подмышечных узлах соответственно. Из 113 пациентов с инвазивным заболеванием 4 (3,5%) и 9 (8,0%) имели макро- и микрометастазы. Предикторы инвазивного заболевания включали ощутимость, маммографическую массу и кальцификацию (распространение> 20 мм) и внутриводную твердую структуру, но не было обнаружено предикторов для метастазов SN. Поэтому, хотя окклюзионная инвазивная болезнь была обнаружена при конечной патологии, у большинства пациентов метастазы или только микрометастазы в подмышечных узлах не было. Предикторы инвазивного заболевания и метастаза SN не были полностью согласованы, поэтому выборочная биопсия SN для пациентов с более высоким риском инвазивного заболевания может не точно идентифицировать пациентов с метастазами SN. Более точное применение биопсии SN требуется пациентам с предоперационной диагностикой DCIS.
Канальная карцинома in situ (DCIS) является наиболее распространенным типом доинвазивного рака молочной железы. По определению DCIS не метастазирует в лимфатические узлы, потому что опухоль ограничена эпителиальным слоем и не распространяется на лимфатические сосуды. Тем не менее, первоначально выявленные поражения DCIS при биопсии иглы иногда перевернуты до инвазивного рака после окончательного отчета об патологии полностью вырезанного образца.1 Это связано с присущими ограничениям методов отбора проб биопсии, при которых небольшое инвазивное поражение может не быть обнаружено в большой области внутриутробного поражения. Мета-анализ показал, что эта перестановка происходит у 25,9% пациентов с ИБП-биопсийным диагнозом DCIS.2
Биопсия узла Sentinel node (SN) представляет собой стандартную процедуру подмышечной стадии для клинически отрицательного узла рака молочной железы.3 Для пациентов с предоперационной диагностикой DCIS предлагается биопсия SN для использования у отдельных пациентов с более высокой вероятностью развития оккультных инвазивных поражений ( т.е. крупная, полноценная, комедоподобная или клиническая / радиологическая масса) и тех, кто подвергается мастэктомии, поскольку SN-сопоставление не может быть выполнено после выявления инвазивной опухоли.1,4 Метаанализ показал, что частота SN метастазы составляют 7,4% у пациентов с предоперационным диагнозом ИИП-биопсии DCIS.4. Однако не было хорошо подтверждено, было ли это выборочное применение биопсии SN у пациентов с более высоким риском инвазивного заболевания точно идентифицировать пациентов с более высокой вероятностью SN metastasis.5-9
Диагностическая точность первичной опухоли и узлового статуса зависит от строгости обследования. Чем меньше образцов первичной опухоли или лимфатических узлов, которые исследуются, тем больше риск того, что небольшие инвазивные повреждения или метастазы не могут быть идентифицированы. В большинстве предыдущих докладов о переходе на инвазивный рак из предварительно диагностированного DCIS процедуры гистологического обследования первичных опухолей подробно не описаны. Таким образом, первичный статус опухоли при конечной патологии может быть недооценен.
Аналогичным образом, обычные гистопатологические исследования могут привести к недооценке узлового статуса: они ограничены в своей способности точно определять метастазы из-за частичной оценки узла. Для преодоления этого ограничения исследования гистопатологического лимфатического узла был разработан анализ одношаговой амплификации нуклеиновой кислоты (OSNA) (Sysmex, Kobe, Japan). Анализ OSNA принимается и регулярно используется в более чем 230 учреждениях в Испании, Японии, Италии, Великобритании, Франции и других странах. Этот анализ может оценивать целые лимфатические узлы, а обнаружение и амплификация мРНК цитокератина 19 (CK19) может дают количественные результаты для выявления клинически значимых узловых метастазов (размером> 0,2 мм) .11 Исследования калибровки и валидации11,12 дали обоснованные доказательства того, что количество копий мРНК CK19, обнаруженное методом OSNA, может обеспечить хорошие оценки макрометастаза, микрометастаза и нет метастазов, в том числе изолированных опухолевых клеток, как это определено в Руководстве по раковой постановке Американского объединенного комитета по раку 13. Анализ цельного узла OSNA обнаруживает большее количество микрометастазов, чем обычные гистопатологические исследования.14-16 В частности, мы показали, что число пациентов с послеоперационным диагнозом DCIS и SN метастазисом значительно увеличилось после введения анализа OSNA для биопсий SN.17
Поэтому, используя подробное гистологическое исследование первичных опухолей и анализ всех узлов OSN SN, первичная опухоль и узловой статус могут быть оценены более точно. В этом одноцентровом ретроспективном исследовании мы исследовали заболеваемость и предикторы инвазивного заболевания при конечной патологии и метастазировании SN и их корреляцию, чтобы проверить, точно ли селективная биопсия SN для пациентов с более высоким риском инвазивного заболевания точно идентифицирует с метастазами SN.
Исследование состояло из пациентов cN0 с предоперационным диагнозом ИИП-биопсии DCIS, который прошел биопсию SN с анализом OSNA в период с апреля 2009 года по август 2011 года в больнице Института рака (Токио, Япония). Каждый пациент, получивший право на лечение, получил как клиническое, так и ультразвуковое исследование состояния дооперационных лимфатических узлов. Когда была возможность узлового метастазирования, по крайней мере, на одном из экзаменов, статус cN0 был подтвержден методом тонкоигольной аспирационной цитологии с использованием ультразвука для подозрительного лимфатического узла. Критерии исключения были следующими: (i) отображение SN без использования радиоизотопного индикатора; (ii) метастазы, обнаруженные только в не-SN; (iii) предыдущее удаление первичной опухоли; (iv) гетерохронный ипсилатеральный рецидив рака молочной железы; (v) неоадъювантная лекарственная терапия; и (vi) многоцентровые опухоли односторонней груди. Это исследование было одобрено Институциональным советом по обзору больницы Института рака.
Присутствие комедо-некроза, интрадуктальной структуры и ядерного сорта гистологически оценивалось в предоперационных игольчатых биопсийных материалах. Интрадуктальные структуры были классифицированы по трем образцам (т.е. плоский / низкий папиллярный, кристаллический / папиллярный и твердый подтипы) независимо от наличия или отсутствия комедокроза. Первичная опухоль и статус узла были классифицированы в соответствии с седьмым изданием Американского Объединенного комитета по руководству по раковым заболеваниям13. Послеоперационный статус pN был классифицирован на основе общего подмышечного статуса, включая статус SN и non-SN у пациентов, которым подверглись подмышечные рассечение.
Все пациенты подвергались картированию SN и идентификации с помощью радиоизотопного индикатора плюс / минус жизненно важного красителя. Все SN от каждого пациента оценивали с использованием анализа OSNA без гистопатологического исследования. Когда один или несколько СН были положительными, немедленно проводилась полная диссекция подмышечных лимфатических узлов. С сентября 2009 года мы также использовали анализ OSNA для non-SNs у пациентов, которым была проведена подмышечная диссекция после метастатической биопсии SN.
Процедура анализа OSNA была ранее описана подробно. Короче говоря, целые лимфатические узлы гомогенизировали с 4 мл раствора для лизисного раствора (Lynorhag, Sysmex) и центрифугировали при 10 000 г при комнатной температуре. Супернатант 2 мкл анализировали с помощью системы RD-100i (Sysmex), автоматизированной системы молекулярного обнаружения, которая использует метод изотермической амплификации с обратной транскрипцией, основанный на петле, 18 и набор LynoampBC Kit (Sysmex). Степень амплификации определяли на основе побочного продукта реакции, пирофосфата.19 Полученное изменение мутности после осаждения пирофосфата магния затем коррелировало с количеством копий мРНК CK19 на микролитр исходного лизата с использованием стандартной кривой, установленной заранее используя три калибратора, содержащие разные копии копий мРНК CK19. Количество копий мРНК CK19 на микролитр экстраполировалось из стандартной кривой как для образца измерения, так и для разбавленного образца 1:10. Обрезание для отрицательного / положительного было установлено в 250 копий / мкл.11. Опухолевая нагрузка ≥250- 20 мм; (iii) маммографический поиск массы, фокальной асимметричной плотности или архитектурных искажений; и (iv) внутренняя твердая структура.
Многомерный анализ инвазивного заболевания на конечную патологию у пациентов, предварительно диагностированных с протоковой карциномой in situ (n = 336)
Читайте также:

