Этиология опухолей онкогенные вирусы
Опухолевый рост - типовая форма нарушения тканевого роста, возникающая под действием канцерогена. Характерезуется атипизмом роста, обмена веществ, структуры и функции.
Опухолевый рост проявляется патологическим разрастанием ткани с атипичными свойствами.
Согласно цитологической и гистологической структуре опухолевых клеток и тканей выделяют доброкачественные и злокачественные опухоли. Доброкачественные опухоли. Клетки их морфологически похожи на нормальные и формируют характерные для данной ткани, высокодифференцированные структуры. Такие опухоли растут медленно и, как правило, не метастазируют.
Злокачественные опухоли. Клетки их морфологически отличаются от нормальных и образуютнизкодифференцированные тканевые структуры. Эти опухоли растут быстро, инвазируют в соседние ткани, формируют метастазы. Выделяют следующие разновидности злокачественных опухолей:
♦ Карциномы - злокачественные опухоли, происходящие из эпителия.
♦ Саркомы - злокачественные опухоли, возникающие из тканей мезенхимального происхождения (соединительных, костной, хрящевой).
Инициальным звеном опухолевого роста является образование опухолевых клеток под воздействием канцерогенов.
Опухолевая трансформация - процесс превращения нормальных клеток в опухолевые вследствие трансформации нормальной генетической программы в программу формирования опухолевого атипизма.
Факторы химической, физической и биологической природы, способные вызвать опухолевую трансформацию, называютканцерогенами.
• Химические канцерогены. Более 75% случаев злокачественных опухолей человека вызвано воздействием химических факторов внешней среды. К возникновению опухолей приводят преимущественно продукты сгорания табака, некоторые компоненты пищи и промышленные соединения. Известно более 1500 химических соединений, обладающих канцерогенным эффектом. Из них не менее 20 опре- делённо являются причиной опухолей у человека. Например, к ним отнесены 2-нафтиламин, бензидин, 2-аминотиофенил, вызывающие рак мочевого пузыря у работников анилинокрасочной и резиновой промышленности; бис-(хлорметил)-эфир, приводящий к возникновению рака бронхов и лёгких.
• Физические канцерогены: ионизирующее излучение (α-, β- и γ-излучение), рентгеновские и ультрафиолетовые лучи, поток нейтронов. Так, врачи-рентгенологи заболевают лейкозами в 8-9 раз чаще, чем врачи других специальностей.
• Онкогенные вирусы.
♦ ДНК-вирусы, вызывающие опухолевую трансформацию, называют онковирусами. Гены ДНК-онковирусов способны непосредственно внедряться в геном клетки-мишени. Участок ДНК-вируса (собственно онкоген), интегрированный с клеточным геномом, может осуществить опухолевую трансформацию клетки. Не исключают также, что один из генов онковируса может играть роль промотора клеточного протоонкогена. К ДНК-содержащим онковирусам относят некоторые аденовирусы, паповавирусы и герпесвирусы (так, вирус Эпстайна-Барр вызывает развитие лимфом, а вирус гепатита B способен инициировать рак печени).
♦ РНК-содержащие вирусы, относящиеся к ретровирусам. Интеграция РНК-генов ретровирусов в клеточный геном происходит не непосредственно, а после образования их ДНК-копий.
ОБЩИЕ ЭТАПЫ КАНЦЕРОГЕНЕЗА
Вне зависимости от конкретной причины опухолевой трансформации клетки, гистологической структуры и локализации новообразования, в процессе канцерогенеза можно выделить несколько общих этапов
• На первом этапе происходит взаимодействие канцерогенов химической, физической или биологической природы с протоонкогенами и антионкогенами (онкосупрессорами) генома нормальной клетки.
• На втором этапе канцерогенеза (в результате воздействия канцерогена на геном) подавляется активность антионкогенов и происходит трансформация протоонкогенов в онкогены. Последующая экспрессия онкогена - необходимое и достаточное условие для опухолевой трансформации.
• На третьем этапе канцерогенеза, в связи с экспрессией онкогенов, синтезируются и реализуют свои эффекты (непосредственно или

с участием клеточных факторов роста и рецепторов к ним) онкобелки. С этого момента генотипически изменённая клетка приобретает опухолевый фенотип.
• Четвёртый этап канцерогенеза характеризуется пролиферацией и увеличением числа опухолевых клеток, что ведёт к формированию новообразования (опухолевого узла).
Этапы химического канцерогенеза
Сами по себе потенциально канцерогенные вещества не вызывают опухолевого роста. В связи с этим их называют проканцерогенами, или преканцерогенами. В организме они подвергаются физико-химическим превращениям, в результате которых становятся истинными, конечными канцерогенами. Считают, что конечными канцерогенами являются алкилирующие соединения, эпоксиды, диолэпоксиды, свободнорадикальные формы ряда веществ.
Выделяют два взаимосвязанных этапа химического канцерогенеза: инициации и промоции.
• На этапе промоции осуществляется экспрессия онкогена, происходит неограниченная пролиферация клетки, ставшей генотипически и фенотипически опухолевой, формируется новообразование.
Этапы физического канцерогенеза
Мишенью канцерогенных агентов физической природы также является ДНК. Допускается либо их прямое действие на геном, либо через посредники - медиаторы канцерогенеза. К последним относят свободные радикалы кислорода, липидов и других органических и неорганических веществ.
• Этап инициации заключается в прямом или опосредованном воздействии агентов физической природы на ДНК. Это вызывает либо повреждение её структуры (генные мутации, хромосомные аберрации), либо эпигеномные изменения. Как первое, так и второе может привести к активации протоонкогенов и последующей опухолевой трансформации клетки.
• На этапе промоции канцерогенеза осуществляется экспрессия онкогена и формирование фенотипа опухолевой клетки. В результате последовательных циклов пролиферации формируется опухоль.
Этапы вирусного канцерогенеза включают пять последовательных событий: проникновение онкогенного вируса в клетку, включение вирусного онкогена в геном клетки, экспрессию онкогена, превращение клетки в опухолевую, образование опухолевого узла.
Причинами развития опухоли являются различные факторы, способные обусловливать преобразование нормальной клетки в опухолевую. Они называются онкогенными, или бластомогенными. По своему происхождению причины развития опухолей делятся на химические, физические и биологические.
Онкогенные факторы обладают следующими свойствами:
• мутагенное действие — способность прямо или опосредованно влиять на геном клетки, приводя к мутациям. Такое свойство имеют химические вещества (углеводороды, нитрозамины и т. п.), физические (ионизирующее излучение) и биологические (вирусы) факторы. Вирусы могут вызывать развитие опухоли также эпигеномным путем. Местом взаимодействия химических онкогенов с нуклеиновыми кислотами является, очевидно, гуанин;
• способность преодолевать наружные и внутренние барьеры. Так, при попадании на кожу развитие опухоли будут вызывать лишь те потенциальные химические онкогенные факторы, которые проникают через ороговевший эпидермис. Поскольку биологические мембраны состоят из липопротеидов, через них проходят прежде всего липидорастворимые вещества, к которым относятся и онкогенные углеводороды;
• дозированное действие онкогенных факторов, обеспечивающее незначительное повреждение клетки, что позволяет ей выжить. В связи с этим для достижения онкогенного эффекта имеют значение доза и степень токсичности онкогенного фактора. Незначительное повышение дозы приводит к увеличению количества опухолей, случаев заболеваний животных и уменьшению сроков развития опухолей. Дальнейшее повышение дозы сопровождается преобладанием токсического эффекта и гибелью животных, прежде чем образуется опухоль. Уменьшение дозы онкогена дало возможность установить, что:
— субпороговые онкогенные дозы отсутствуют (в опытах определяется канцерогенность очень низких доз), однако при этом увеличивается период возникновения новых опухолей);
— действие онкогенов необратимо;
— онкогенам свойственны эффекты суммации и кумуляции. Такая же зависимость наблюдается при действии ионизирующего излучения: высокие дозы обусловливают лучевой ожог и гибель ткани и лишь относительно невысокие дозы создают условия для возникновения опухолей;
• действие вирусов с абортивным течением, а не при острой инфекции (гибель клеток) чаще всего вызывает онкогенез. Вероятность развития онкогенеза повышается по мере продолжительности влияния онкогенного фактора;
• возможность создания условий, благоприятных для проявления канцерогенности одних факторов и неблагоприятных для проявления других, в органах и тканях с различными особенностями проницаемости и метаболизма. Этим можно объяснить существование органотропных онкогенов;
• угнетение онкогенами тканевого дыхания и иммунных реакций;
• активация образования опухоли под действием нескольких онкогенных факторов (синканцерогенез). Иногда факторы, которые сами не относятся к онкогенным, могут усиливать действие онкогенов. Такое явление получило название коканцерогенеза, а вызывающие его факторы — коканцерогенов.
Были открыты следующие группы онкогенных факторов, способных влиять на гены мутационным или эпигеномным путем:
1) химические онкогенные факторы: полициклические ароматические углеводороды (ПАУ), аминоазосоединения, нитрозамины, диоксины, оксиды азота;
2) онкогенные факторы биологического происхождения: продукты грибов и растений, гормоны млекопитающих, в частности половые гормоны, онкогенные вирусы;
3) физические онкогенные факторы: ионизирующее излучение;
4) механические факторы: введение в ткани неживых тел (пластмассовых пленок и комочков).
Химические онкогенные факторы. Через 15 лет после опытов Ямагивы и Итикавы в 1930 г. Кук, Хюитт и Хайджер из 2 т каменноугольной смолы добыли 50 г химически чистого 3,4-бензпирена, который оказался активным онкогенным фактором. Еще раньше, в 1929 г., Кук синтезировал очень активный онкогенный фактор 1,2,5,6-дибензантрацен (ДБА). С того времени началось изучение химически чистых канцерогенных веществ. Была установлена канцерогенность многих соединений, относящихся к различным классам.
Полициклические ароматические углеводороды. К ним относятся 3,4-бензпирен, ДБА и 9,10-диметил-1,2-бензантрацен (ДМБА). Пугем обработки желчных кислот был получен активный онкоген — метилхолантрен. Синтез этого онкогенного фактора впервые натолкнул на мысль о возможной канцерогенности некоторых биологических продуктов, вырабатываемых самим организмом, что со временем подтвердилось.
Онкогенные ПАУ преимущественно оказывают местное канцерогенное действие: при введении под кожу они служат причиной саркомы, при нанесении на кожу — причиной рака. Если способ введения обеспечивает распространение онкогена в организме, ПАУ вызывают образование опухолей в тех органах, где накапливаются: при выделении с молоком образуются опухоли молочных желез, с мочой — опухоли почек и почечных лоханок, при выделении сальными железами кожи — опухоли кожи.
Некоторые ПАУ являются очень сильными онкогенными факторами: подкожное введение мышам 0,2-0,5 мг ДМБА обусловило развитие опухолей почти у всех животных. Более активный онкоген — это 20-метилхолантрен.
Пюльман, пользуясь методами квантовой органической химии, определял плотность электронного облака в молекулярных структурах ПАУ. Выяснилось, что если какое-либо производное антрацена или фенантрена обладает канцерогенной активностью, то возле определенного радикала в одном и том же месте основной циклической структуры наблюдается повышенная плотность электронного облака, достигающая 1,2-е. Эта зона в молекуле углеводорода была названа К-районом (от нем. Krebs — рак). Затем теоретически было просчитано, в каких производных антраценового ряда электронная плотность в К-районе имеет значение, соответствующее канцерогенности. Экспериментально данный расчет подтвердился преимущественно для антраценового и фенантренового рядов.
Онкогенные ПАУ очень распространены в среде обитания человека, поскольку они часто являются продуктами неполного сгорания. ПАУ образуются при температуре 400—600 °C (температура горения табака в сигарете), содержатся в дыме и смоле табака, пережаренном масле, выхлопных газах, копченых продуктах, а также в нефти, битуме, асфальте. У крыс, во время эксперимента находившихся на асфальтированной магистрали, чаще развивались опухоли легких по сравнению с теми, которые находились на полевой дороге.
В процессе длительных наблюдений за курящими людьми было установлено, что частота рака легких и верхних дыхательных путей у них пропорциональна количеству выкуренных сигарет с латентным периодом, составляющим 10 лет. Она в несколько десятков раз выше у курящих по сравнению с некурящими людьми.
Канцерогенные аминоазосоединения и амины обладают выраженной органотропностью. Диметиламиноазобензол (ДАБ) в эксперименте вызывает рак печени в 80 % случаев независимо от того, каким путем он попал в организм. Аналогичное действие оказывает ортоаминоазотолуол. β-Нафтиламин у человека и животных вызывает рак мочевого пузыря. Органотропность онкогенных веществ объясняется образованием в пораженном органе активных веществ из менее активных предшественников. Канцерогенность β-нафтиламина характеризуется действием его метаболитов — аминонафтола-1 и 2-нафтилоксиамина.
Нитрозамины. Особенностью этих веществ также является органотропность, которая может изменяться вследствие относительно незначительных перестроек в молекуле. Так, диэтилнитрозамин вызывает преимущественно рак печени и пищевода, метилнитрозомочевина — опухоли головного мозга, триметилнитрозомочевина — опухоли головного мозга и периферической нервной системы.
Нитрозамины образуются в желудке человека из неканцерогенных предшественников (нитритов и аминов) при наличии хлоридной кислоты. Нитриты, например натрия нитрит, и амины (аминокислоты, амидопирин), попадая в организм с пищей, образуют нитрозамины, приводя к развитию опухолей у 80—100 % подопытных животных.
Диоксины — продукты окисления некоторых полимеров и пластических масс — химически устойчивы и высококанцерогенны; образуются, в частности, при сжигании пластмасс.
Оксиды азота — высококанцерогенные химические соединения.
Онкогенные факторы биологического происхождения вырабатываются в организме, входят в состав пищи, используются в медицине и на производстве. В эту группу также включены вирусы.
Грибы. Aspergillus flavum синтезирует афлатоксин — вещество с резко выраженными канцерогенными свойствами. В дождливое лето весь урожай земляных орехов (арахиса) может быть заражен грибом, продуцирующим афлатоксин. Гриб также паразитирует на кукурузе, рисе, яйцах, порошковом молоке. Еще более распространен Aspergillus nidulans, который вырабатывает канцерогенный стериг-матоцистин.
Канцерогенное действие гонадотропных гормонов гипофиза было выявлено в ходе проведения опытов по пересадке яичника. Эти гормоны вызывают в яичнике пролиферацию фолликулярных клеток. Эстрогены, продуцируемые данными клетками по принципу обратной связи, тормозят выработку фоллитропина. После пересадки яичника в селезенку с одновременным удалением второго яичника первый постоянно подвергается влиянию интенсивной стимуляции фоллитропином, который в 80 % случаев приводит к развитию опухоли. Это свидетельствует о том, что собственные гормоны, если они образовались в большем количестве и больше, чем обычно, атакуют орган-мишень, могут вызвать образование в нем опухоли.
Опухолеобразующие вирусы. В классификации онкогенных вирусов учтены следующие признаки:
1) тип нуклеиновой кислоты, входящий в состав вируса (РНК или ДНК);
2) место и способ размножения вируса в клетке;
• РНК-содержащие вирусы спиралевидной формы, которые размножаются в цитоплазме: вирусы лейкоза мышей и кур, саркомы Рауса, вирус молока Биттнера и т. п.;
• РНК-содержащие вирусы полиэдральной формы. Вирусы обеих этих групп получили название онкорнавирусов (онкогенных вирусов, содержащих РНК), или ретровирусов (вследствие передачи информации в обратном направлении — от РНК к ДНК с помощью обратной транскриптазы (ревертазы));
• ДНК-содержащие вирусы полиэдральной формы, которые размножаются в ядрах клеток. К ним относятся вирусы папилломы кроликов, полиомы, бородавки человека, вакуолизирующий вирус обезьян — SV40. Свойства этих вирусов настолько типичны для всей группы, что их объединили под общим названием Papova, которое происходит от начальных букв названий опухолей и функциональных изменений (papilloma, polioma, vacuolization);
• большие ДНК-содержащие вирусы, которые размножаются в цитоплазме, образуя характерные клеточные включения. К этой группе относятся вирус фибромы Шоупа, вирусы Яба и контагиозного моллюска. Все они очень сходны с вирусом оспы и вызывают преимущественно доброкачественные опухоли.
Большой интерес представляет вирус полиомы, детально изученный Стюартом и Эдди. Этот вирус содержит одну молекулу ДНК, которая имеет вид двойного кольца или двойной линейной молекулы. Он может обусловливать около 27 типов опухолей в различных тканях у семи видов млекопитающих (мышей, крыс, кроликов, хомяков и др.). При введении вируса новорожденным животным заболеваемость достигает 100 %. С возрастом чувствительность к вирусу снижается: если вирус вводят мышам после 14-го дня жизни, опухоль не развивается. Из крови инфицированных животных можно выделить ДНК вируса, способную к индукции опухолей.
Среди опухолей, образующихся у человека и, очевидно, вызванных вирусом, известна лимфома Беркитта, которая поражает под нижнечелюстные лимфатические узлы у детей. Она распространена в низменной местности Африки, где переносчиками инфекции являются москиты.
Установлена связь вирусов с возникновением и развитием некоторых других распространенных опухолей человека: вируса герпеса и рака шейки матки; вируса гепатита В и гепатоцеллюлярной карциномы (рак печени, происходящий из гепатоцитов); аденовирусов и опухолей эпителия верхних дыхательных путей, с которыми, как выяснилось, также связан вирус Эпштейна—Барр (назофарингеальные опухоли), идентифицированный ранее как возбудитель В-клеточной лимфомы Беркитга. Выделен ретровирус (онкогенный РНК-содержащий С-типа) из лейкозных клеток лиц, больных Т-лимфомой человека, — форма Т-лимфоцитарного лейкоза. Вирус назван HTLV (от англ. human T-lymphoma virus). Т-клеточный лейкоз — инфекционная болезнь человека, заражение которой происходит при переливании крови. Установлена четкая связь между онкогенными ДH К-содержащими вирусами папиллом и опухолями половых органов человека.
Физические онкогенные факторы. Онкогенное мутационное действие оказывают такие физические факторы, как ионизирующее и ультрафиолетовое излучение, возможно, тепловая энергия, ультразвук. Кроме того, физические факторы могут играть роль син- или коканцерогенов.
Онкогенное действие ультрафиолетового излучения наблюдали в опыте на животных. Ежедневное 5-часовое пребывание лабораторных крыс на ярком солнце через 10 мес. привело к развитию у многих животных опухоли кожи. Часто опухоль возникает под влиянием рентгеновского излучения и после введения в организм радионуклидов.
У человека наблюдаются профессиональные опухолевые болезни, вызванные влиянием ионизирующего излучения: рак рентгенологов, рак легких у шахтеров, работающих на приисках с радиоактивной рудой.
Трагическими были последствия атомных взрывов в Хиросиме и Нагасаки. Среди 18 тыс. жителей Хиросимы, находившихся вблизи эпицентра взрыва, которые остались в живых, существенным образом повысилась заболеваемость лейкозом.
Выяснено, что одновременное воздействие ионизирующего излучения и химических онкогенных факторов в низких дозах обусловливает чрезвычайно сильную индукцию опухолей, непропорциональную дозам этих факторов, которые приводят к развитию опухоли лишь в незначительном количестве случаев, если действуют отдельно.
Механические факторы. Доказана также канцерогенная роль длительного механического влияния на ткань. В 1948 г. Б. Оппенгеймер, Э. Оппенгеймер и Стоун обнаружили, что у крыс, которым с целью вызвать почечную гипертензию обернули почки целлофаном, развилась саркома. В эксперименте с имплантацией пластмассовых пластинок установлено, что возле пластинок размерами 0,5x0,5 см и более индуцируются злокачественные соединительнотканные опухоли, тогда как введение порошка из этой пластмассы не вызывало образования опухолей. Возможно, металлические или пластмассовые пластинки препятствуют завершению пролиферативной стадии воспаления, что приводит к чрезмерному накоплению индукторов размножения, вызывающих образование опухоли.

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
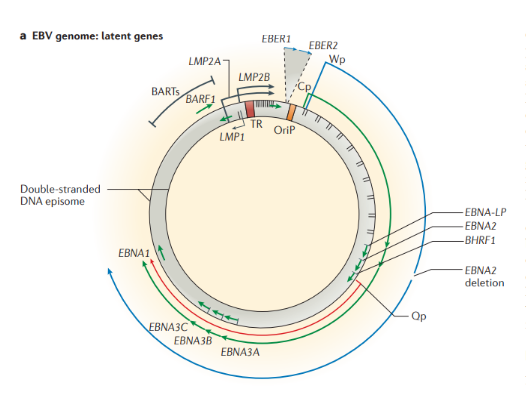
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
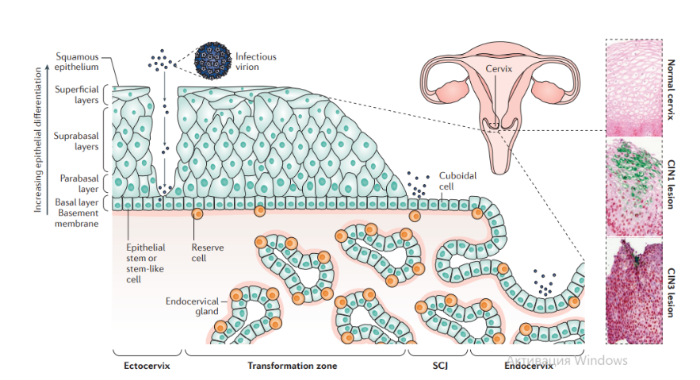
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
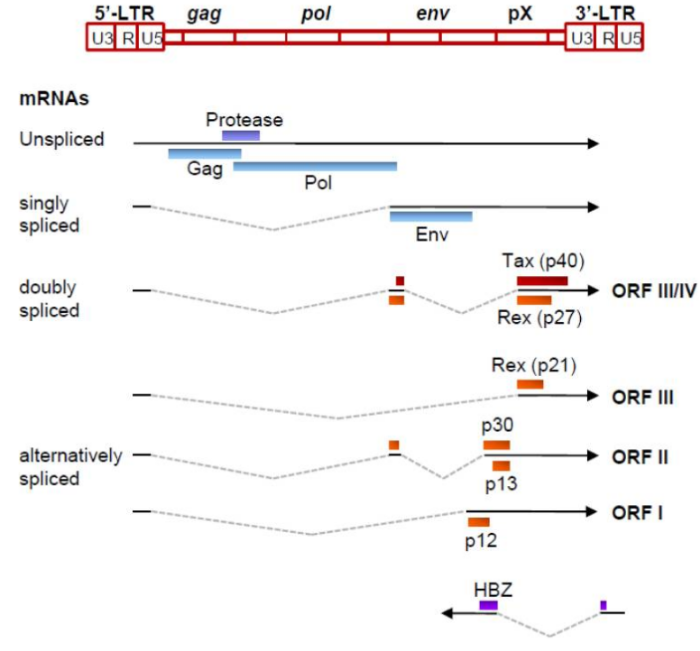
Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV
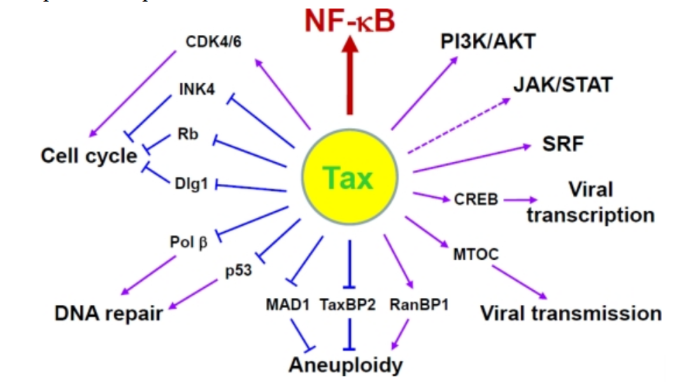
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
Читайте также:

