Миофибробластическая опухоль что это такое
Ювенильная назофарингеальная фиброма (снн. ювенильная ангиофиброма носоглотки) — редкая форма, поражающая, главным образом, лиц мужского пола в возрасте 10— 25 лет. Плотноватый серый или красноватый узел диаметром 2—5 см растет в верхней части заднебоковой стенки полости носа в зоне сочленений клиновидного отростка небной кости, крыловидного отростка клиновидной кости и горизонтального крыла сошника (в перегородке носа). Опухоль склонна к рецидиву it иногда к спонтанной регрессии. Под микроскопом в плотной или рыхлой, иногда отечной строме располагаются в довольно большом количестве мелкие тонкостенные и крупные сосуды.
Ювенильную назофарингеальную фиброму нужно отличать от полипа носовой перегородки и гемангиомы.
Инфантильный миофиброматоз (син: врожденный генерализованный, множественный мультицентрический фиброматоз; инфантильная гемангиоперицитома; врожденная фибросаркома; агрессивный инфантильный фиброматоз: множественные врожденные мезенхнмапьные опухоли: множественная сосудистая лейомиома новорожденных) — одиночный узел (2/3 наблюдений) или множественное поражение (1/3) глубоких мягких тканей новорожденных, детей грудного возраста, реже детей старше 2 лет, крайне редко юношей и взрослых лиц. Локализация: подкожная клетчатка, мышцы и, кроме того, при инфантильном генерализованном варианте — кости, легкие, сердце, желудочно-кишечный тракт и другие внутренние органы.
При инфантильном мультицентрическом варианте с поражением мягких тканей и костей встречается спонтанное самоизлечение. Макроскопически узел обычно имеет Рубцовую консистенцию, диаметр до 5 см, четкие границы, иногда капсулу и петрификаты. Под микроскопом периферические зоны узла сформированы из хаотично переплетающихся пучков миофиб-робластов, центральные зоны — из пучков более мелких, незрелых и делящихся фибробластов. Часто развиты мелкие ветвящиеся сосуды синусоидного типа. Незрелые формы поражения характерны для младенцев, а формы, близкие к десмоиду, — для взрослых лиц. Инфантильный миофиброматоз следует отличать от гемангиоперицитомы, десмоидного фиброматоза, нейрофиброматоза, врожденных лейомиом, лейомиосарком, а также фибросарком и гамартом.
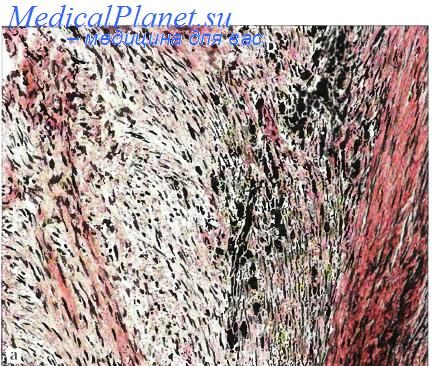
Инфантильный миофиброматоз
Воспалительная миофибробластическая опухоль (син.: воспалительная псевдоопухоль, воспалительная фибросаркома, миофибробластома, смеша нноклеточная псевдоопухоль, фибром и ксо-идная лимфоплазмогистиоцитома) — групповое обозначение довольно редких опухолей, поражающих лиц обоего пола и разного возраста, зачастую детей. Различают легочную и внелегочную формы. В последнем случае поражаются мягкие ткани конечностей, селезенка, забрюшинные и медиастинальные мягкие ткани, кожа, урогенитальная система, желудочно-кишечный тракт и др. Макроскопически представляют собой четко отграниченный, плотноватый, беловато-серый или пестрый узел диаметром от 2 до 20 см. Бывают множественные узлы. Опухоль склонна к рецидивам. Описаны случаи малигнизации (трансформация в саркому). Под микроскопом определяется воспалительный компонент, который сопровождает три разных варианта пролиферации миофибробластов. Первый вариант напоминает обычную грануляционную ткань или нодозный фасциит.
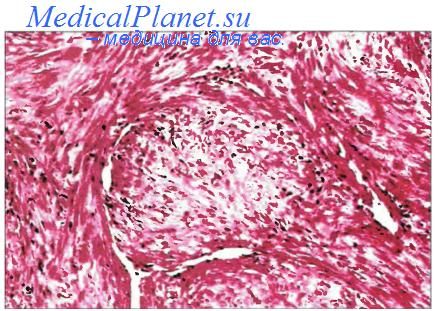
Инфантильный миофиброматоз
Воспалительная миксоглалиновая опухоль конечностей (син. акральная миксовослалительная фибробластная саркома) — весьма редкое новообразование со слабо выраженным злокачественным потенциалом. Пол и возраст больных значения не имеют. Локализация: в большинстве случаев верхние, иногда нижние конечности. Медленно растущий, дольчатый фиброзный узел плотной или желатиновой консистенции, диаметром 1—8 см, располагается обычно в подкожной клетчатке. Отмечена склонность к рецидивам и к метастазированию в регионарные лимфатические узлы. Под микроскопом видны узелки миксоидной ткани, окруженные стромой, богатой атипичными веретеновидными и эпителиоидными клетками. Отмечаются также различное количество элементов воспалительного инфильтрата и повсеместное наличие крупных атипичных клеток с причудливыми ядрами и развитыми ядрышками. Эти клетки напоминают либо ганглиозные клетки, либо, в случае расщепленного ядра, клетки Рид—Штернберга. Они отличаются экспрессией виментина, CD68 и CD34. Изредка обнаруживаются фигуры митоза и отложения гемосидерина. Опухоль следует дифференцировать от теносиновита, воспалительной миофибробластической опухоли, юкстаартикулярной миксомы, миксофибросаркомы.

Для продолжения изучения на мобильном устройстве ПРОСКАНИРУЙТЕ QR-код с помощью спец. программы или фотокамеры мобильного устройства
Случайный выбор
данная функция, случайным образом выбирает информацию для Вашего изучения,
запустите выбор нажав кнопку ниже

Случайный выбор
Обратная связь
Напишите нам
Enter the password to open this PDF file:
Воспалительная миофибробластическая опухоль (IMT, inflammatory myofibroblastic tumor) — редкое пролиферативное заболевание неясной этиологии, характеризующееся пролиферацией веретенообразных или эпителиоидных миофибробластов, смешанных преимущественно с мононуклеарными воспалительными клетками. IMT обычно считается доброкачественным поражением, хотя в некоторых случаях агрессивно ведет себя с точки зрения местного рецидива и метастазирования.
Исследователями из Италии[1] описан случай лечения пациентки с IMT поперечной ободочной кишки и синхронной гастроинтестинальной стромальной опухолью (GIST) желудка.
59-летняя женщина с десятилетним язвенным колитом и эпизодом цитомегаловирусной инфекции в анамнезе, а также сопутствующими патологиями (артериальная гипертензия, мерцательная аритмия) была госпитализирована в клинику с симптомами острого рецидива язвенного колита — болью в животе, диареей, гематохезией и ректальными тенезмами. Выявлены микроцитарная гипохромная анемия и нейтрофильный лейкоцитоз.
При эндоскопическом исследовании толстая кишка имела вид трубы с диффузной гиперемией, эрозиями слизистой и двухсантиметровым полипоидным поражением с нерегулярной формой на уровне поперечной ободочной кишки. Гистопатологическое исследование биоптатов выявило мезенхимальное новообразование с неопределенными признаками злокачественности. В ходе рентгенокомпьютерной томографии органов брюшной полости с болюсным усилением обнаружено неоднородное гиподенсированное образование 2,5 × 1,6 см в диаметре с интенсивным усилением в артериальной фазе, локализованное в поперечной ободочной кишке (рис. 1).
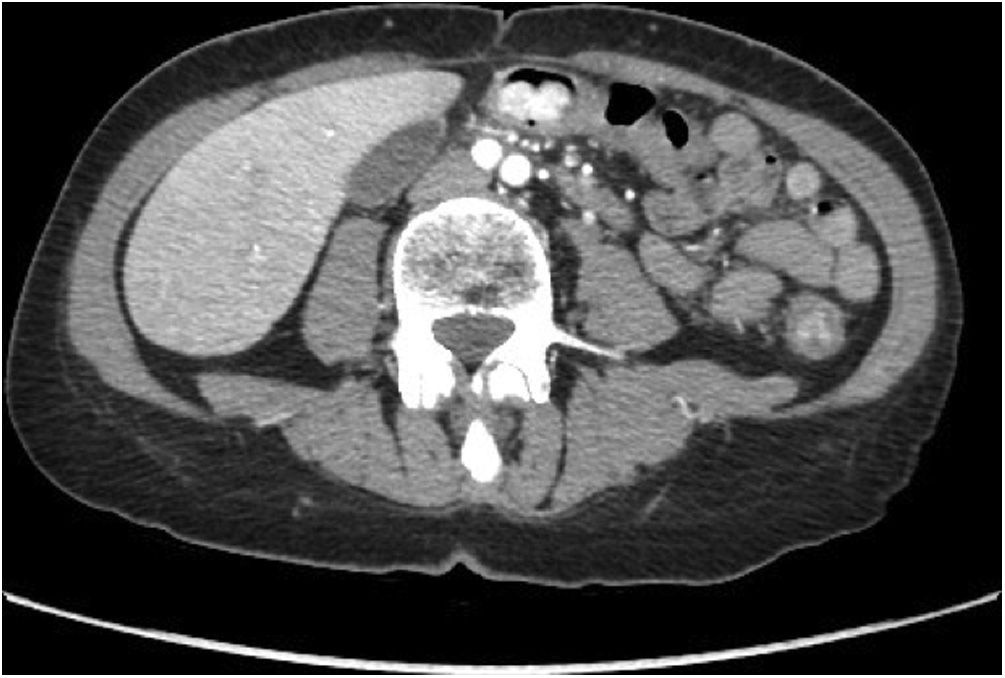
Рисунок 1 [1].
Из-за тяжести воспалительных заболеваний кишечника, устойчивых к иммуносупрессивному и стероидному медикаментозному лечению, пациентка оперирована. Было решено выполнить тотальную колэктомию с терминальной илеостомией. При ревизии органов брюшной полости выявлено новообразование на передней стенке желудка, оно было удалено. Послеоперационных осложнений не отмечалось. Пациентка выписана через 7 дней после операции. Через некоторое время выполнена проктэктомия и формирование J-резервуара. Илеостома ликвидирована через месяц после последней операции.
При патоморфологическом исследовании обнаружено язвенное полипоидное поражение 2 × 2,8 см в диаметре в окружении слизистой оболочки с бархатистостью (рис. 2).
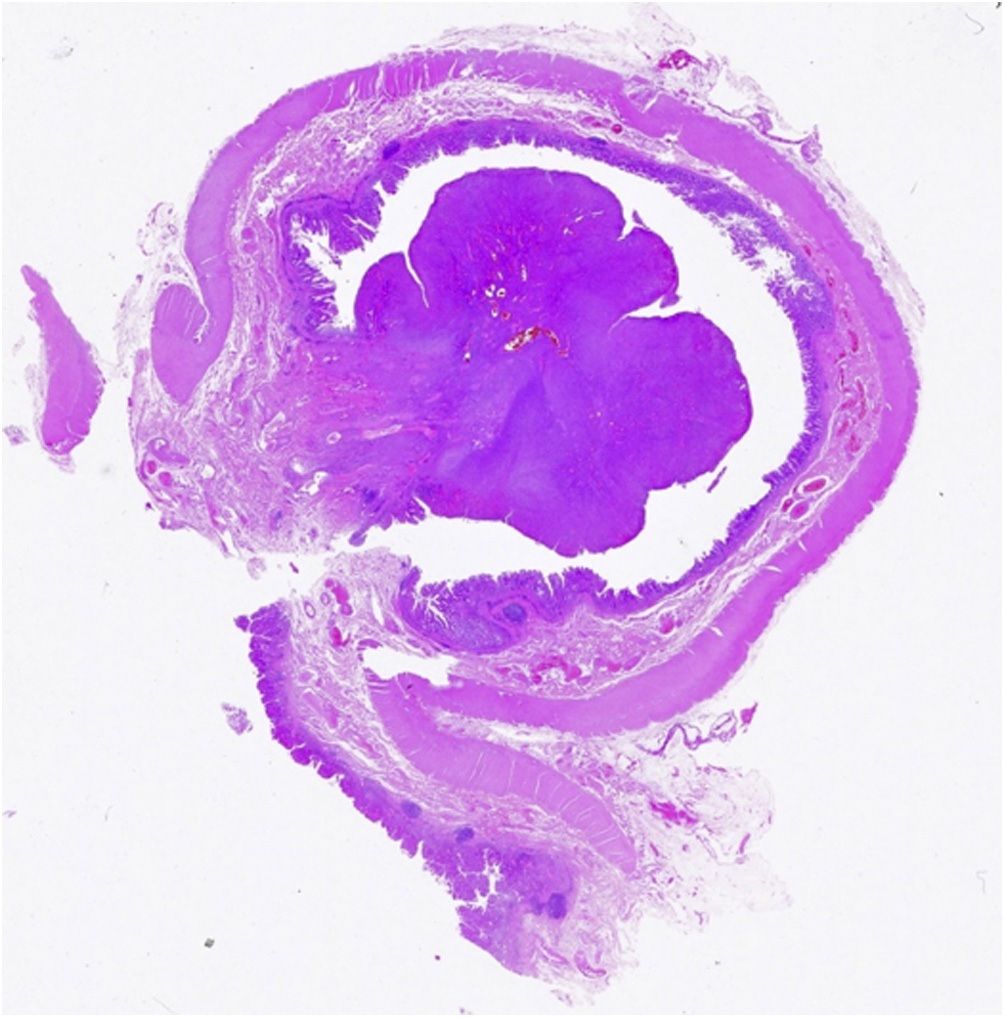
Рисунок 2 [1].
Микроскопическое исследование новообразования показало мезенхимальную пролиферацию, состоящую из веретенообразных клеток — мономорфных и без значительной атипии, организованных в пучки, ассоциированных с диффузной лимфоцитарной инфильтрацией, плазматическими клетками и эозинофилами, распространяющимися на слизистую оболочку и инфильтрирующими подслизистую оболочку (рис. 3, 4).
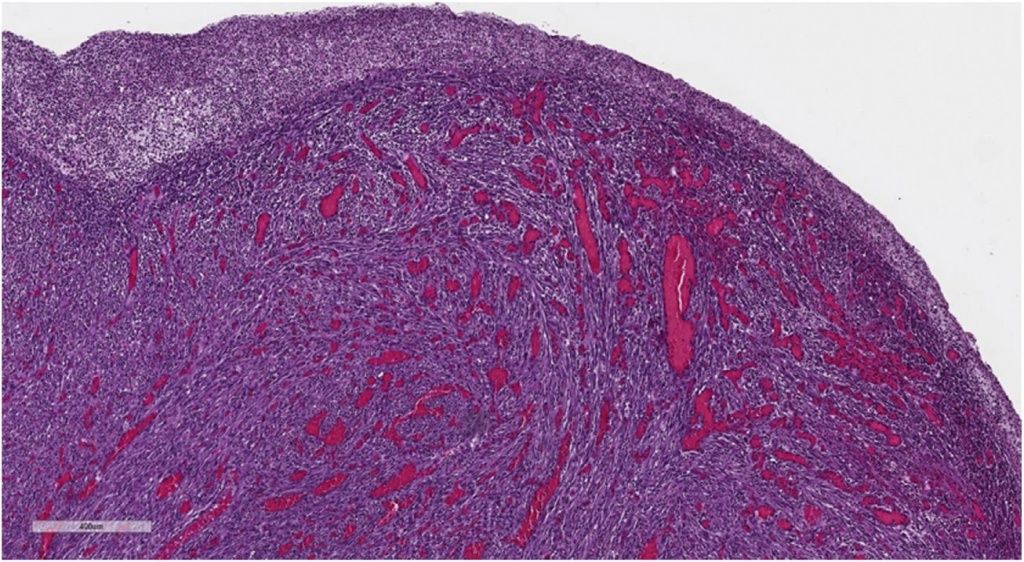
Рисунок 3 [1].
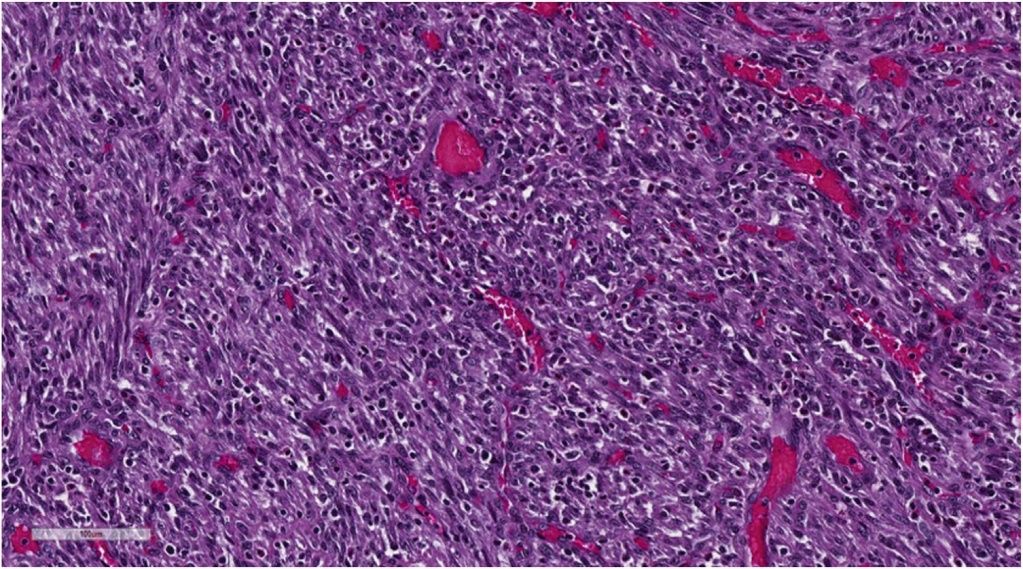
Рисунок 4 [1].
При иммуногистохимическом исследовании: положительно для SMA, отрицательно для цитокератина, десмин, S-100, Мелан-А, CD34, CD117, DOG-1, CD21, CD23, CD1a и ALK. На основании этих результатов диагноз IMT был подтвержден.
Патоморфология удаленного новообразования желудка показала GIST. При КТ-исследовании через 6 месяцев после операции признаков рецидива заболевания не выявлено.
Воспалительная миофибробластическая опухоль (ВМО) — редко встречающееся новообразование мезенхимального происхождения [1]. В классификации опухолей мягких тканей и костей Всемирной организации здравоохранения 2013 года ВМО относится к промежуточным фибробластическим/миофибробластическим опухолям, для которых характерна невысокая частота (до 2%) встречаемости отдаленных метастазов в лимфатические узлы и легкие. В зависимости от локализации первичной опухоли выделяют ВМО с поражением легких и внелегочные ВМО [2]. Чаще всего воспалительная миофибробластическая опухоль встречается в легких, брыжейке кишечника, сальнике. Описана локализация опухоли в ЦНС, сердце, среднем ухе, костях, почках, мочевом пузыре, поджелудочной железе, яичниках, печени. Заболевание выявляется у пациентов в возрасте от 3 до 89 лет, однако наиболее распространено у детей и молодых взрослых (средний возраст - 9 лет) [3].
Клиническое течение ВМО весьма вариабельно. Иногда опухоль может медленно расти и никак не проявляться клинически. В некоторых ситуациях возможен быстрый инфильтративный рост в окружающие ткани и отдаленное метастазирование. На начальных этапах развития опухоли клиническая картина может проявляться потерей массы тела, лихорадкой, анемией и повышением в сыворотке крови концентрации белков острой фазы воспаления. В дальнейшем появляются симптомы сдавления тех органов и тканей, в которых она возникла. Лечение ВМО преимущественно оперативное. В случае технической невозможности выполнения операции при прогрессировании заболевания возможно применение лучевой или химиотерапии.
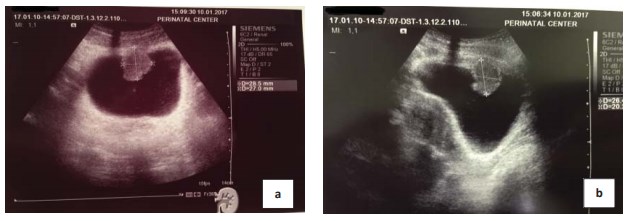
Рисунок 1. УЗИ мочевого пузыря a) поперечное сканирование b) продольное сканирование
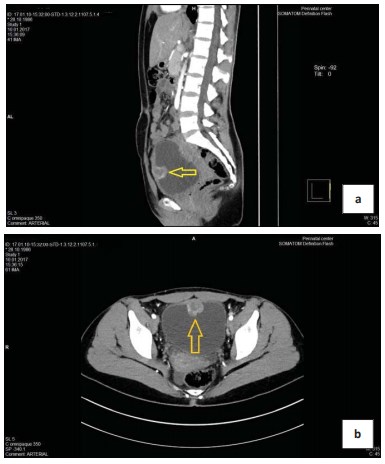
Рисунок 2. Компьютерная томография a) мультипланарная реконструкция b) поперечный скан (стрелкой указана опухоль)
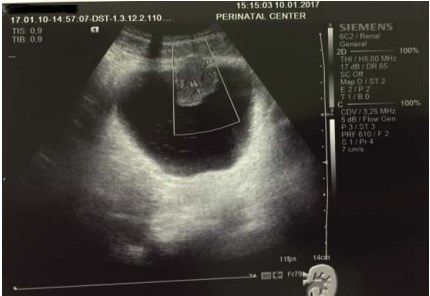
Рисунок 3. УЗИ мочевого пузыря, допплерография
При морфологическом исследовании удаленной ткани выявлены множественные фрагменты опухоли из переплетающихся пучков мономорфных веретеновидных клеток с низкой митотической активностью, участкамимиксоматоза и отека, с зонами эрозий и изъязвлений, частично выстланные уротелием с реактивными изменениями. Отмечается диффузно-очаговая лимфо-плазмоцитарная инфильтрация с примесью большого количества нейтрофилов и эозинофилов. Морфологическая картина соответствует воспалительной миофибробластической опухоли мочевого пузыря (рис. 4). В биопсии из зоны основания опухоли элементов опухоли не обнаружено.
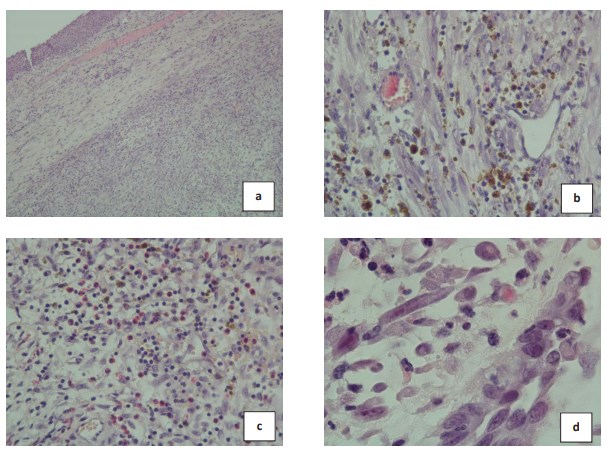
Рисунок 4. Воспалительная миофибробластическая опухоль мочевого пузыря. Окраска гематоксилином и эозином: a) фрагмент опухоли, выстланный уротелием. х40; b) среди клеток воспалительного инфильтрата определяются скопления гранул гемосидерина. х200; c) пролиферация миофибробластов сопровождается диффузно-очаговой лимфо-плазмоцитарной инфильтрацией, с примесью большого количества нейтрофилов и эозинофилов. х100; d) мономорфные веретеновидные миофибробласты с везикулярными ядрами, вперемешку с клетками воспалительного инфильтрата, расположены в рыхлой и миксоидной строме. х400
При контрольной цистоскопии через 3 и 9 месяцев данных за рецидив опухоли не получено, слизистая мочевого пузыря без патологических изменений. В анализах мочи без патологических сдвигов. В последующем планируется проведение динамического наблюдения, как и за больными с уротелиальной карциномой низкой степени злокачественности.
Заключение
В представленном клиническом наблюдении описан опыт успешного эндоскопического лечения пациентки с редким заболеванием — воспалительной миофибробластической опухолью мочевого пузыря.
Литература
- Santos Lopes S, Furtado A, Oliveira R, Cebola A, Graça B, Ferreira Coelho M, Ferrito F, Gomes C. Infl ammatory Myofi broblastic Tumor of the Bladder: 2 Rare Cases Managed with Laparoscopic Partial Cystectomy. Case Rep Urol. 2016;2016:4976150. doi: 10.1155/2016/4976150
- Etani T, Naiki T, Nagai T, Iida K, Ando R, Naiki-Ito A, Kawai N, Tozawa K, Mizuno K, Okada A, Mogami T, Yasui T. Inammatory Myofi broblastic Tumor of the Urinary Bladder: A Case Report. Case Rep Oncol. 2016;9(2):464-469. doi: 10.1159/000448550
- Inamura K, Kobayashi M, Nagano H, Sugiura Y, Ogawa M, Masuda H, Yonese J, Ishikawa Y. A novel fusion of HNRNPA1-ALK in infl ammatory myofi broblastic tumor of urinary bladder. Hum Pathol. 2017;69:96-100. doi: 10.1016/j.humpath.2017.04.022
Статья опубликована в журнале "Вестник урологии" №4 2017, стр. 79-83
представляют весьма многообразную группу необычных псевдоопухолевых локальных процессов, охватывающих широкий спектр гистологических особенностей: от плазмаклеточной инфильтрации до преимущественно миофибробластных узловых образований. Эти своеобразные очаги поражения обнаруживаются не только в верхних и нижних дыхательных путях, но и во многих других органах, включая слюнные железы, моче-половую систему, желудочо-кишечный тракт, печень, поджелудочную железу, эндокринные органы и центральную нервную систему [Wenig B.M.
Широкое разнообразие проявлений объясняет большое количество синонимов в обширной литературе по этому вопросу: воспалительная псевдоопухоль, плазмоцитарная гранулема, псевдосаркоматозная опухоль, миофибробластома [Pettinato G. et al.,1990; Aijaz F. et al.,1994].
Предполагают, что этиология воспалительных миофибробластных нвообразований связана с фоновой инфекцией или травмой. Потенциально травмирующим моментами могут оказаться перенапряжение голоса, резкий кашель и даже регургитация при заболеваниях желудка [Spencer H.,1984; Wenig B.M. et al.,1995].
Некоторые современные авторы связывают опухоль с воздействием вируса Эпштейна-Барр (гибридизация in situ). Нередко выявляется множественность поражения дыхательных путей и ЛОР-органов [Arber D.A. et al.,1994]
Воспалительные псевдоопухоли дыхательных путей известны давно. Однако в случаях явного преобладания в гистологической картине миофибробластов за последние годы наметилась тенденция выделять в виде отдельной нозологической формы “воспалительные миобластные опухоли”. Термин указывает на пролиферативный рост объемного образования. Плазмоклеточные гранулемы представляют противоположное направление фенотипического спектра гистиоцитарно-плазмаклеточного комплекса. Иногда трудно провести границу между доброкачественными пролифератами из миофибробластов и “миофибробластомой” [Spencer H.,1984; Wenig B.M. et al.,1995].
Миофибробласты - составная часть грануляционной ткани, формирующейся при заживлении ран. Эти элементы представляют собой преобразованные фибробласты и играют важную роль в рубцовом стягивании краев дефекта ткани. Хотя клетки внешне напоминают обычные фибробласты, миофибробласты дают прямую реакцию на антигены актина и содержат избыточное количество выстроеных параллельно микрофиламентов в цитоплазме, иногда в сочетании с множественными плотными тельцами, определяемыми при электронной микроскопии.
Средний возраст больных - 59 лет. Половых различий в заболеваемости не отмечено. Нельзя связать опухоль и с избыточным курением. Продолжительность анамнеза - до 4 мес. Нередко в анамнезе отмечается травма или воспалительные процессы в системе дыхания.
Воспалительная миофибробластная опухоль обычно проявляется в виде полипов различной плотности с гладкой поверхностью, до 3 см в диаметре, полностью располагается в подслизистом слое, не выходя за пределы слизистой оболочки. Признаки инвазивного роста отсутствуют. При некоторых локализациях описаны системные проявления опухоли (необъяснимое повышение температуры, анемия, поликлональная гипергаммаглобулинемия, тромбоцитоз, ускорение СОЭ).
Гистологическая структура. Клеточный инфильтрат состоит из элементов веретенобразной или звездчатой формы в фибромиксоидной строме с элементами воспаления. Ядра с плотным хроматином, иногда проявляются эозинофильное ядрышко. Обильная цитоплазма содержит эозинофильные и базофильные фибриллы.
Местами наблюдается небольшой полиморфизм с небольшим количеством митозов. Повышения ядерно-цитоплазматического индекса, атипических митозов или участков некроза не определяется. Число митозов не превышает 1-2 на 10 полей большого увеличения. Встречается гиперплазия покрывающего патологический очаг эпителия, а в некоторых случаях воспалительные процессы или изъязвление. Окраска на муцикармин и ШИК-реакция отрицательны. Строма окрашивается альцианом синим. Миофибробласты дают положительную реакцию на виментин и на актин. Цитокератин, белок S-100, десмин, миоглобин и CD34 не выявляются.
Ультраструктура. Веретенообразные клетки имеют неровный контур, цитоплазматические выпячивания и овальные ядра с глубокими зазубринами. Органеллы цитоплазмы включают хорошо развитый грубый эндоплазматический ретикулум, комплекс Гольджи и пучки микрофиламентов, которые выстроены параллельными рядами вдоль длинной оси клетки. Между этими элементами встречаются плотные тельца. Отмечается фрагментация базальной мембраны и пиноцитарные везикулы. Признаков происхождения клеток из эпителия, как правило, выявить не удается.
Дифференциальная диагностика в первую очередь проводится с веретеноклеточным подтипом плоскоклеточного рака, который имеет внешне сходные гистологические признаки. Опухоль может проявляться сниженной клеточностью с низкой митотичесткой активностью в сочетании с фибромиксоидной стромой. При этом нужно учитывать выраженный полиморфизм клеточных элементов рака и атипические митозы в сочетании с дисплазией эпителия, особенно carcinoma in situ, а тем более инвазивный рост. Следует учитывать, что веретенобразные клетки могут возникать из эпителия [Zarbo R.J. et al.,1986]. Положительные реакции на цитокератин не исключаются и при миобластной опухоли. С другой стороны миогенные маркеры могут проявляться и при плоскоклеточом раке.
При затруднениях в диагностике новообразований трахеи мезенхимального происхождения (фибросаркома, гистиоцитома, миобластомы) следует учитывать, что опухоль из миофибробластов располагается всегда на поверхности, в подслизистом слое. Кроме того, она не содержит гликогена и параллельных линейных включений в цитоплазме при окраске по Массону; отсутствует десмин. Особое внимание следует уделять клиническим особенностям заболевания, локализации опухоли и возрасту больных.
Большинство авторов подчеркивают, что морфологическая картина опухоли не всегда помогает оценить прогноз заболевания. Доброкачественное по своей природе может приводить к летальным исходам в случае обструкции дыхательных путей и диагностических ошибок [Rodgers J.L. et al.,1980].
С другой стороны, эти мезенхимальные очаги пролиферации составляют гетерогенную группу с довольно широким спектром злокачественного потенциала, который трудно оценить гистологически [Hakimi M. et al.,1975; Sanstrom R.E. et al.,1978].
N.Tan-Liu et al. (1989) описали 7 наблюдений экспансивного роста очагов поражения трахеи и бронхов фиброзной природы. При эндоскопическом исследовании и гистологически у всех больных установлен предварительный диагноз “воспалительная псевдоопухоль”. Однако при исследовании удаленного на операции препарата обнаружили признаки инвазивного локального роста. Во всех случаях при микроскопическом исследовании отмечена пролиферация веретеннообразных клеток без признаков воспаления. Высокая клеточность и глубина инвазии указывали на онкологическую природу поражения. У 4 больных пришлось изменить диагноз на “инвазивная фиброзная опухоль”, вплоть до фибросаркомы и злокачественной гистиоцитомы.
Представлено характерное наблюдение инвазивной фиброзной опухоли нижней трети трахеи у ребенка 8 лет. После экономной резекции нижней трети трахеи потребовалась повторная широкая резекция с реконструкцией бифуркации. При тщательном наблюдении в течение многих лет признаков заболевания не выявили.
Воспалительная миофибробластная опухоль дыхательных путей у детей может протекать более агрессивно. Поэтому излеченные больные нуждаются в тщательном мониторинге после операции [Pettinato G. et al.,1990; Coffin C.M. et al.,1994].
Лечение больных с небольшими миофибробластными новообразованиями обычно состоят в локальном удалении очага поражения во время трахеоскопии. Дефект стенки, как правило, хорошо заживает. Описаны случаи существования остаточной опухоли в гортани после нерадикальной операции в течение нескольких лет [Wenig B.M. et al.,1995].
При появлении рецидива миофибробластной опухоли попытка лучевой терапии в дозе 50 Гр оказывается малоэффективной. В таких случаях показана циркулярная резекция трахеи.
Таким образом, злокачественный потенциал фиброзной инвазивной опухоли с одинаковой легкостью можно недооценить и переоценить Особенно важно провести дифференциальную диагностику с фибросаркомой и злокачественной фиброзной гистиоцитомой. В меньшей степени она напоминает лейомиосаркому и злокачественную шванному.
В некоторых случаях небольшого кусочка опухоли, полученного через бронхофиброскоп может оказаться недостаточно для достоверной диагностики. При повторной биопсии во время трахеоскопии жестким аппаратом можно получить больше данных для выбора оптимального метода лечения. Во время операции следует шире использовать возможности для срочного гистологического исследования, уточнения характера взаимодействия патологического очага и окружающих структур.
Определенные трудности могут возникнуть в ситуации, в которой после эндоскопической резекции имеются признаки остаточной опухоли. Больные могут наблюдаться годами без отрицательной динамики. Ткм не менее, всегда следует учитывать возможность злокачественной трансформации очагов гистиоцитарной инфильтрации. При малейшем сомнении в доброкачественности процесса (большие размеры очага, инфильтративный рост), к этой патологии следует относиться как к опухоли низкой злокачественности.
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Саркомы – это группа различных по клиническим и морфологическим признакам злокачественных новообразований, которые происходят из любых неэпителиальных тканей. В этом заключено основное отличие саркомы от рака, ростком которого являются эпителиальные клетки.
Риск возникновения данного заболевания повышается при некоторых генетических патологиях:
- синдром базальноклеточных невусов;
- синдром Вернера;
- синдром Гарднера;
- туберозный склероз;
- кишечный полипоз т.д.
А болезнь Реклингхаузена, или нейрофиброматоз 1 типа, является наиболее распространенным наследственным заболеванием, которое осложняется опухолевыми процессами. При этой патологии нейрофибросаркомы возникают примерно в 15% случаев. Описаны также случаи возникновения саркомы в зоне воздействия ионизированного излучения, как патологического, так и с лечебными целями.
Гистоморфологическая классификация сарком
Зачастую точно определить, из какой именно ткани возникла конкретная опухоль, довольно сложно. Кроме того, выделяется большая группа опухолей, которые имеют неясный гистогенез.
Наиболее часто диагностируются фибросаркомы, липосаркомы и рабдомиосаркомы. Вторыми по частоте встречаемости следует злокачественная гистиоцитарная саркома мягких тканей и саркомы неясного генеза. Ангиосаркомы, синовиальные саркомы, злокачественные шванномы, лейомиосаркомы и прочие типы наблюдаются редко.
Опухоли жировых тканей
Промежуточные (местно-агрессивные) формы:
- атипичный липоматоз;
- высокодифференцированные липосаркомы.
Злокачественные формы:
- недифференцированные липосаркомы;
- миксоидные липосаркомы;
- круглоклеточные липосаркомы;
- полиморфная липосаркома;
- липосаркомы смешанного типа;
- липосаркомы без признаков дифференцировки.
Миофибропластические и фибробластические опухоли
Промежуточные, или местно-агрессивные, формы:
- поверхностные подошвенные или ладонные фиброматозы;
- фиброматозы десмоидного типа;
- липофиброматозы.
Редко метастазирующие формы:
- солитарные фиброзные опухоли;
- гемангиоперицитомы, включая липоматозные гемангиоперицитомы;
- воспалительные миофибропластические опухоли;
- миофибропластические саркомы низкой степени дифференцировки;
- миксоидные фибропластические саркомы;
- инфантильные фибросаркомы.
Злокачественные формы:
- зрелые фибросаркомы;
- миксофибросаркомы;
- медленнорастущие фибромиксоидные саркомы;
- гиалинизирующие веретеноклеточные саркомы;
- склерозирующие эпителиоидные фибросаркомы.
Фиброгистиоцитарные опухоли
Промежуточные, или местно-агрессивные формы:
- плеоморфные фиброгистиоцитарные опухоли;
- гигантоклеточные саркомы мягких тканей.
Злокачественные формы:
- недифференцированные плеоморфные саркомы;
- недифференцированные плеоморфные саркомы с гигантскими клетками;
- недифференцированные плеоморфные саркомы с преобладанием воспаления.
Саркома мышечной ткани
Опухоли скелетных мышц:
- эмбриональные веретеноклеточные и анапластические рабдомиосаркомы;
- альвеолярные солидные и анапластические рабдомиосаркомы;
- плеоморфные рабдомиосаркомы.
Саркома гладких мышц: лейомиосаркома, включая и кожные формы.
Периваскулярные опухоли
- Злокачественные гломусные опухоли;
- миоперицитомы.
Сосудистые опухоли
Промежуточные, или местно-агрессивные формы: гемангиоэндотелиомы типа Капоши.
Редко метастазирующие формы:
- ретиформные гемангиоэндотелиомы;
- папиллярные внутрилимфатические ангиоэндотелиомы;
- смешанные гемангиоэндотелиомы;
- саркомы Капоши.
Злокачественные формы:
- эпителиоидные гемангиоэндотелиомы;
- гемангиосаркома мягких тканей.
Костно-хрящевые опухоли
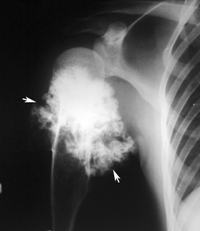
Опухоль костной ткани, или остеогенная саркома:
- обыкновенные: хондробластические, фибробластические, остеобластические;
- телеангиоэктатические;
- мелкоклеточные;
- центральные, имеющие низкую злокачественность;
- вторичные;
- параоссальные;
- периоссальные;
- поверхностные, имеющие высокую злокачественность.
Опухоли хрящевой ткани (хондросаркомы):
- центральные, первичные и вторичные;
- периферические;
- дедифференцированные;
- мезенхимальные;
- светлоклеточные.
Опухоли неясного происхождения
Редко метастазирующие формы:
- ангиоматоидные фиброзные гистиоцитомы;
- оссифицирующие фибромиксоидные опухоли;
- миоэпителиомы;
- парахондромы.
Злокачественные формы:
- синовиальная саркома;
- эпителиоидные саркомы;
- альвеолярная мягкотканная саркома;
- светлоклеточная саркома мягких тканей;
- внескелетные миксоидные хондросаркомы хордоидного типа;
- примитивные нейроэктодермальные опухоли (PNET);
- внескелетные саркомы Юинга;
- десмопластические мелко- и круглоклеточные опухоли;
- внепочечные рабдоидные опухоли;
- злокачественные мезенхимомы;
- миелоидная саркома;
- новообразования, имеющие периваскулярную эпителиоидно-клеточную дифференцировку (PEComa);
- светлоклеточные миомеланоцитарные опухоли;
- интимальные саркомы.
Каждый из названных гистологических типов отличается не только своими морфологическими признаками и гистогенезом, но также имеет определенное клиническое течение. Конечно, подобное многообразие морфологических форм сарком вызывает значительную трудность в их диагностике.
Еще больше гистологическое типирование сарком осложняется в детском возрасте. Обусловлено это тем, что у детей большая часть опухолей происходит из примитивных эмбриональных клеток (эмбриональная саркома) или клеток, которые еще не завершили свое гистогенетическое становление. Такие опухоли, имея большое разнообразие морфологических форм, зачастую не имеют четких признаков гистотиповой дифференцировки, характеризуются резкой анаплазией и вариабельностью клеточного состава. Вместе с тем часто наблюдается и обратная картина: новообразования различного происхождения часто имеют сходные признаки строения. Все это делает типирование опухолей значимой проблемой.
Распределение основных типов сарком по преобладанию в их составе
клеток определенной формы
Рутинная оценка сарком начинается с оценки общего строения опухоли, которая базируется, прежде всего, на ее "узнаваемости" при микроскопии. Описывается общая картина преобладания клеток определенной формы.
Опухоли, состоящие из округлых клеток:
- нейробластома;
- саркома Юинга/PNET;
- мезенхимальная хондросаркома;
- эмбриональная и альвеолярная рабдомиосаркома;
- десмопластичная круглоклеточная саркома;
- круглоклеточная липосаркома;
- малигнизированная рабдоидная опухоль.
Опухоли, состоящие из веретенообразных клеток:
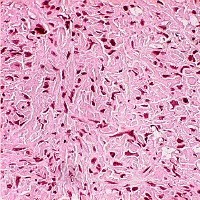
- фибросаркома;
- веретеноклеточная рабдомиосаркома;
- лейомиосаркома;
- злокачественные опухоли периферических нервных стволов;
- веретеноклеточная ангиосаркома;
- монофазная веретеноклеточная синовиальная саркома.
Опухоли, состоящие из эпителиоидных клеток:
- эпителиоидноклеточная синовиальная саркома;
- эпителиоидноклеточная ангиосаркома;
- эпителиоидноклеточные злокачественные опухоли нервного ствола;
- склерозирующая эпителиоидноклеточная фибросаркома;
- злокачественная фиброзная гистиоцитома;
- эпителиоидноклеточная лейомиосаркома.
Остальные гистоморфологические типы сарком, входящие в классификацию, имеют преимущественно смешанную форму клеток. Кроме того, иногда форма злокачественно перерожденных клеток не поддается описанию и определению. В таких случаях опухоль классифицируется как плеоморфная саркома.
Типирование сарком по степени дифференцировки клеток
После определения гистологического типа саркомы оценивается степень ее дифференцировки (G). При этом учитываются такие критерии, как клеточный полиморфизм, митотическая активность и др.
Степени дифференцировки сарком:
- GX – степень дифференцировки клеток определить невозможно;
- G1 – саркома высокодифференцирована;
- G2 – саркома дифференцирована умеренно;
- G3 – саркома низкодифференцирована;
- G4 – недифференцированая саркома.
Дифференциация клеток определяется возможностью установить, к какому именно виду ткани относится конкретная клетка. Чем ниже степень дифференциации клеток, составляющих опухоль, тем более выраженную злокачественность имеет данная саркома. Это напрямую связано с шансами раннего метастазирования в другие органы и ткани. Кроме этого, чем выше злокачественность саркомы, тем быстрее она увеличивается в размерах, тем большую инфильтративность имеет ее рост и тем стремительнее прогрессирует заболевание.
Иммуногистохимическое (ИГХ) типирование сарком
Иммуногистохимическое исследование позволяет:
- провести гистогенетическое типирование опухоли и определить нозологический вариант новообразования;
- определить органопринадлежность первичной опухоли при метастазах неизвестного происхождения;
- определить степень злокачественной трансформации клеток опухоли;
- прогнозировать течение опухолевого заболевания;
- прогнозировать чувствительность и резистентность опухолевых клеток к химиотерапевтическим препаратам и лучевой терапии;
- определить возможность проведения узконаправленной терапии.
Сегодня при верификации сарком используется несколько десятков основных ИГХ-маркеров. Поскольку практически нет ИГХ-маркеров, которые были бы специфичными только для какого-то конкретного типа опухоли, для типирования новообразования должен использоваться набор из нескольких антител.
1. В группу опухолей, состоящих из мелких округлых клеток, относятся новообразования, наиболее часто встречающихся в детском возрасте. Они обычно имеют низкую дифференцировку и высокую степень злокачественности.
- Бластная нейрогенная саркома. Все ее разновидности экспрессируют нейрональные маркеры, такие как нейронспецифическая энолаза (NSE), синаптофизин, хромогранины (CgA), СD56, СD57.
- Рабдомиосаркома. Все ее виды экспрессируют виментин, десмин и мышечный специфический актин (MA), а также СD99. Основными же ее специфическими маркерами является миогенные ядерные регуляторные протеины – миогенин и МуоD1.
- Основными диагностическими маркерами для саркомы Юинга и примитивной нейроэктодермальной опухоли являются СD99 (продукт гена MIC2) и Fli-1. Также клетки этих опухолей экспрессируют виментин, сравнительно часто - синаптофизин, в редких случаях - цитокератины (CK), CD57.
- Клетки мезенхимальной хондросаркомы экспрессируют виментин, S-100 протеин и, реже, СD57.
- Мелкоклеточная остеосаркома характеризуется экспрессией виментина, остеокальцина, может наблюдаться экспрессия СD57 и СD99.
- Мелкоклеточная низкодиференцированная синовиальная саркома мягких тканей, как и другие типы синовиальных сарком (монофазная веретеноклеточная синовиальная саркома, эпителиоидная синовиальная саркома, дедиференцированная полиморфноклеточная саркома), экспрессируют CK, эпителиальный мембранный антиген (EMA), виментин, коллаген IV типа.
- Десмопластическая мелкокруглоклеточная опухоль - очень редкий вид чрезвычайно агрессивного новообразования. Обычно клетки этой опухоли экспрессируют эпителиальные (СК и ЕМА), мезенхимальные (виментин), миогенные (десмин) и нейральные (СD56, NSE) маркеры.
2. К опухолям, состоящим из веретенообразных клеток, прежде всего относятся новообразования, развивающиеся из производных мезенхимы.
- Фибросаркома и инфантильная фибросаркома не имеют специфического иммунопрофиля, но всегда положительны к виментину, а иногда – и к SMA.
- Клетки лейомиосаркомы, как правило, экспрессируют виментин, десмин, МА, SMA, кальдесмон.
- Злокачественная опухоль оболочки периферического нервного ствола экспрессирует виментин, коллаген IV типа и СD57.
- Сосудистая эпителиоидно- и веретеноклеточная саркома, а также саркома Капоши экспрессируют Fli-1, CD31, CD34 и фактор фон Виллебранта (фактор VIII связывающий протеин).
- Гемангиоперицитома и солитарная фиброзная мягкотканая саркома относятся к новообразованиям, пограничным по своему потенциалу злокачественности. Их клетки обычно экспрессируют CD34, CD99, а также bcl-2.
3. Опухоли, состоящие из эпителиоидных клеток, характеризуются признаками, присущими специализированным клеточным элементам соединительной ткани (миофибробластам, эпителиоидным клеткам сосудов, миоэпителиальным клеткам).
- Злокачественная воспалительная миофибробластическая опухоль (воспалительная фибросаркома) демонстрирует иммунореактивность с кальпонином, SMA и десмином.
- Злокачественная фиброзная гистиоцитарная саркома характеризуется коэкспрессией виментина, EMA и CD68, в некоторых случаях наблюдается экспрессия MA, однако не экспрессируются миогенин и МиоD1.
- Периваскулярные эпителиоидноклеточные опухоли (PEC-омы) – это группа опухолей, к которым относятся: ангиомиолипома почек (и других локализаций), светлоклеточная саркома легких ("сахарная" опухоль), лимфангиолейомиоматоз и др. Клетки этих опухолей демонстрируют меланоцитарный иммунофенотип (положительны к: Мелан-А, НМВ45, тирозиназе) с коэкспрессией SMA.
- Эпителиоидная саркома коэкспрессирует виментин и СК.
Помимо гистогенетического типирования опухолей, принципиально важной задачей ИГХ является определение степени злокачественности опухоли и выявление прогностических маркеров. Это позволяет намного более обоснованно и достоверно прогнозировать течение болезни, а также чувствительность опухоли к лечебным средствам.
Читайте также:

