Миелолейкоз гены bcr abl

Что такое хронический миелолейкоз?

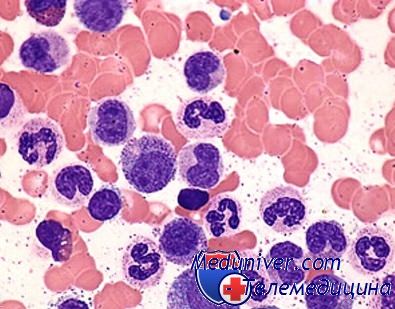
Мазок крови пациента с хроническим миелолейкозом
Хронический миелолейкоз (ХМЛ) — злокачественное новообразование кроветворной ткани, сопровождающееся прогрессирующей пролиферацией незрелых гранулоцитов. Заболевание изначально обладает вялотекущим характером, постепенно перетекая в стадию обострения с выраженной симптоматикой и образованием системных нарушений. Является одной из самых опасных и инвалидизирующих болезней.
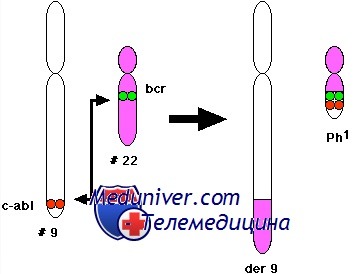
ХМЛ — первое онкологическое заболевание, у которого определена связь между развитием канцерогенеза и мутацией в гене. Характерная аномалия основана на транслокации 9-й и 22-й хромосом, то есть участки данных хромосом меняются местами, образуя аберрантную хромосому. Выявлена мутировавшая хромосома исследователями из Филадельфии, поэтому она получила название филадельфийская или Ph-хромосома.
Причины развития

Негативное воздействие на кроветворение оказывают ядохимикаты
Заболевание известно науке с 1811 года, но до сих пор факторы, провоцирующие мутацию в гене, определить не удалось. Существует ряд причин, способствующих развитию патологии:
- радиоактивное облучение, в том числе при лучевой терапии;
- химиотерапия иных онкологических заболеваний;
- ряд генетических заболеваний, характеризующихся хромосомной аномалией (например, синдром Дауна);
- взаимодействие с химическими соединениями (нефтепродукты, пестициды).
Патогенез хронического миелолейкоза

Патогенез хронического миелолейкоза
Гибридный ген BCR-ABL 1, образованный в результате транслокации хромосом, продуцирует синтез белка BCR-ABL. Данный белок представляет собой тирозинкиназу, которая в норме способствует передаче сигнальных импульсов для роста клетки. Созданная путём мутации тирозинкиназа становится активным фактором пролиферации клеток, они начинают делиться и распространяться уже независимо от факторов роста. Происходит процесс создания клонов мутировавшей клетки.
Бесконтрольное деление сопровождается нарушением апоптоза — запрограммированной гибели клеток. Также гибридная тирозинкиназа подавляет естественные функции восстановления в молекулах ДНК, создавая предпосылки для последующих мутаций, что усугубляет патологический процесс.
Размножающиеся клетки являются незрелыми, бластными предшественниками полноценных элементов крови. Постепенно бластные клетки вытесняют функциональные эритроциты, тромбоциты и лейкоциты. Добавляются нарушения и в других хромосомах, что запускает ускоренный процесс разрушения организма в целом.
Стадии хронического миелолейкоза

Бластный криз — одна из стадий миелолейкоза
- Хроническая — 30% бластных клеток. Стадия характеризуется агрессивным характером мутировавших клеток, состояние пациента резко ухудшается. Дополнительные аномалии как в гене BCR-ABL, так и в геноме в целом, провоцируют цепь патологических реакций, которые уже практически не поддаются лечению. На этом этапе могут поражаться ткани внутренних органов, кожные покровы и слизистые оболочки, миелоидные клетки преобразовываются в саркому.
Симптомы и признаки

Признаки ХМЛ становятся заметны ближе к прогрессирующей стадии.
- Симптомы опухолевой интоксикации: снижение массы тела, быстрая утомляемость, волнообразное повышение температуры, кожный зуд, тошнота, суставные боли.
- Симптомы опухолевой пролиферации — увеличение селезёнки и печени, боль в левом подреберье, поражение кожных покровов.
- Анемический синдром — головокружение, выраженная бледность, учащённое сердцебиение, чувство нехватки воздуха.
- Геморрагический синдром — склонность к кровоточивости слизистых оболочек, сыпь в виде красных точек, длительное кровотечение при незначительных порезах.
Диагностика заболевания

Один из методов диагностики заболевания — рентгенологический
Диагностика ХМЛ включает:
- Первичный осмотр пациента с изучением анамнеза, жалоб, а также исследование при помощи пальпации размеров селезёнки и печени.
- Общий анализ крови выявляет число и характеристики форменных элементов крови.
- Биохимический анализ проводится для определения уровня билирубина, электролитов, глюкозы, ЛДГ, АСТ, АЛТ.
- Гистологическое исследование костного мозга определяет скопления бластных клеток.
- Цитогенетический анализ выявляет транслокацию хромосом.
- На 3-й стадии проводится иммунофенотипирование для идентификации бластных клеток.
- Метод генного секвенирования применяется для выявления генных мутаций.
- Проводится УЗИ внутренних органов, в первую очередь селезёнки и печени.
- Дополнительно назначают рентгенографию органов грудной клетки, ЭКГ, эхокардиографию, ИФА на маркеры различных заболеваний, коагулограмму и другие исследования.
Лечение

Основа лечения — ингибиторы тирозинкиназы
Выбор препарата и доза определяются в зависимости от стадии ХМЛ и риска побочных эффектов. Обычно лечение начинается с приёма иматиниба в дозировке 400 мг/день при начальной стадии, 600 мг/день при последующих стадиях, затем дозу могут увеличивать или снижать. Различные аберрации в генах обусловливают низкую чувствительность к препаратам, поэтому пациенту могут менять одни ингибиторы на другие.

Трансплантация костного мозга
Если терапия не оказывает действия, рекомендуется аллогенная трансплантация костного мозга. Новые стволовые клетки могут выработать здоровые элементы кровеносной системы. Но операция сопряжена с рядом высоких рисков.
Терапия препаратами интерферона назначается обычно в 1-й стадии ХМЛ, так как не обладает эффективностью при последующих.
Для уменьшения массы опухоли и при отсутствии результата в лечении ингибиторами проводится химиотерапия. В стадии бластного криза используется полихимиотерапия аналогично лечению острого лейкоза.
Лучевая терапия может быть назначена в случае выраженной спленомегалии. При риске разрыва селезёнки проводят спленэктомию.
Профилактика и прогноз

Прогноз заболевания определяет врач
Причина образования ХМЛ не установлена, поэтому профилактикой являются меры по избеганию контактов с канцерогенными веществами, воздействия радиоактивного облучения.
Прогноз определяется стадией и тяжестью болезни. Одна из прогностических моделей (Kantarjian H.M.) включает факторы:
- преклонный возраст пациента при постановке диагноза;
- концентрация бластных клеток в крови ≥ 3%, в костном мозге ≥ 5%;
- концентрация базофилов ≥ 7%;
- концентрация тромбоцитов ≥ 700*10 9/л;
- выраженная спленомегалия.
Молекулярно-биологическое исследование, направленное на выявление точечных мутаций в гене BCR-ABL, которые могут обуславливать резистентность хронического миелолейкоза к некоторым ингибиторам тирозинкиназ.
Определение мутаций киназного домена BCR-ABL.
BCR/ABL1, Tyrosine Kinase Inhibitor Resistance, Kinase Domain Mutation Screen; Kinase domain mutation, ABL.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Специальной подготовки не требуется.
Общая информация об исследовании
Хронический миелолейкоз является опухолевым заболеванием кроветворной системы, в результате которого в периферической крови наблюдается повышение уровня определенного вида лейкоцитов. Развитие заболевания связано с возникновением в стволовой клетке крови генетической аномалии, которая получила название филадельфийской хромосомы. У человека на девятой хромосоме локализуется ген ABL, который кодирует образование белка, стимулирующего рост и деление клеток. При хроническом миелолейкозе часть гена ABL перемещается на хромосому 22, такая мутация называется транслокацией. Место разрыва 22-й хромосомы, куда чаще всего встраивается перемещенная часть гена ABL, называется M-bcr (от английского major breakpoint claster region). В норме в этом участке хромосомы расположен ген BCR, кодирующий белок, функция которого в настоящее время достоверно не изучена, однако есть сведения, что он участвует в процессах деления и дифференцировки клеток. В результате транслокации на 22-й хромосоме образуется сливной, или химерный, ген BCR-ABL, при считывании информации с которого продуцируется белок р210. От части гена ABL этот белок получает способности тирозинкиназы – внутриклеточного фермента, участвующего в передаче сигналов пролиферации, а часть, кодируемая геном BCR, способствует его активации. Таким образом, в результате описанной мутации на 22-й хромосоме формируется ген, белковый продукт которого – тирозинкиназа с повышенной активностью – стимулирует деление клеток с полной независимостью от внешних регуляторных механизмов. Лейкозные клетки становятся нечувствительными к сигналам самоуничтожения, приобретают способность выходить из костного мозга в периферическую кровь, не дожидаясь созревания.
В первое время лейкозные клетки полностью контролируются геном BCR-ABL, они сохраняют способность к дифференцировке и функционируют практически полноценно. Однако в процессе течения заболевания ген BCR-ABL индуцирует нестабильность генома, вследствие неконтролируемой пролиферации возникают точечные мутации, в том числе в самом гене BCR-ABL. Некоторые мутации могут приводить к перестройке той части молекулы BCR-ABL-тирозинкиназы, к которой присоединяются таргетные лекарственные препараты, подавляющие её активность. В результате этого препарат теряет способность связываться с мутантной тирозинкиназой и ингибировать её. По этой причине, несмотря на продолжающийся постоянный прием лекарства, отмечается прогрессирование заболевания. К настоящему времени обнаружено свыше 50 различных мутаций гена BCR-ABL, которые могут обуславливать резистентность опухолевого клона к одному или нескольким ингибиторам тирозинкиназ.
Для чего используется исследование?
- Для выявления точечных мутаций в химерном гене BCR-ABL, которые могут менять структуру кодируемого им белка и приводить к резистентности к отдельным препаратам группы ингибиторов тирозинкиназ.
Когда назначается исследование?
- У пациентов с хронической фазой хронического миелолейкоза:
- неудача лечения в установленные контрольные временные точки: недостижение большого цитогенетического ответа к 3 месяцам терапии, недостижение большого молекулярного ответа к 12 месяцам терапии;
- любые признаки утраты ответа (гематологический или цитогенетический рецидив);
- повышение уровня BCR-ABL на 1 логарифм (в 10 раз) и утрата большого молекулярного ответа.
- При прогрессировании заболевания в фазу акселерации или бластного криза.
Что означают результаты?
Результат исследования представляет собой название обнаруженной мутации гена BCR-ABL и сведения о её влиянии на чувствительность к определенным ингибиторам тирозинкиназ.
- Исследование позволяет обнаружить только известные на настоящий момент мутации. В связи с этим отрицательный результат не означает отсутствие редкой, неизученной мутации гена BCR-ABL и, соответственно, резистентности к терапии, особенно если на это указывают другие клинические и лабораторные данные.
- Мутация T315I обуславливает резистентность ко всем существующим ингибиторам тирозинкиназ, кроме понатиниба.
- Помимо точечных мутаций гена BCR-ABL, есть и другие механизмы формирования резистентности к ингибиторам тирозинкиназ: активация дополнительных сигнальных путей, которые в обход BCR-ABL-тирозинкиназы усиливают деление и подавляют гибель опухолевых клеток, избыточное связывание препаратов с транспортными белками крови (например, связывание иматиниба с α1-кислым гликопротеидом приводит к повышению концентрации лекарства в плазме и снижению его поступления в опухолевые клетки), повышенная экспрессия белка множественной лекарственной устойчивости PGP (он подобно насосу выкачивает из цитоплазмы клеток лекарственные препараты). Таким образом, при отрицательных результатах исследования на мутации в гене BCR-ABL лечащий врач может порекомендовать дополнительное обследование для исключения других причин неэффективности терапии.
- Значимость выявленной мутации для смены ингибитора тирозинкиназ определяется исключительно лечащим врачом.
Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с обязательной микроскопией мазка крови)
Кто назначает исследование?
Гематолог, онколог, терапевт, врач общей практики.
Литература
- Wintrobe’s clinical hematology / editors, John P. Greer, Daniel A. Arber, Bertil Glader, Alan F. List, Robert T. Means Jr., Frixos Paraskevas, George M. Rodgers. – 13th edition. Lippincott Williams & Wilkins, 2014. Pages 1711-1712.
- 95 % случаев хронического миелолейкоза
- 20 - 50% случаев острого В-лимфобластного лейкоза взрослых
- Ежегодно регистрируется 1-2 заболевших на 100 тысяч населения
- Пик заболеваемости: 30 - 50 лет
- Госпитализация не требуется
- Стабильное состояние на протяжении 4-5 лет
- Не более 5% бластных клеток в костном мозге и переферической крови
- "Легкие" симптомы: утомляемость, потливость, потеря веса, аритмия
- 85 % пациентов к моменту постановки диагноза находятся в хронической фазе
- 80% дети
- 20% взрослые
Гематология: национальное руководство / под ред. О. А. Рукавицына. - М. : ГЭОТАР-Медиа, 2015. С. 381-398.
Этиология и встречаемость хронического миелоидного лейкоза (ХМЛ). Хронический миелоидный лейкоз (ХМЛ) (MIM №608232) — клональная экспансия трансформированных кроветворных клеток-предшественниц, при которой возрастает число циркулирующих миелоидных клеток. Трансформация клеток-предшественниц происходит за счет экспрессии онкогена BCR-ABL.
Хронический миелоидный лейкоз (ХМЛ) составляет до 15% всех случаев лейкоза у взрослых и встречается с частотой 1-2 на 100 000; скорректированная возрастная встречаемость более высокая среди мужчин, чем среди женщин (1,3-1,7 против 1,0).
Приблизительно 95% пациентов с хроническим миелоидным лейкозом (ХМЛ) имеют филадельфийскую хромосому; остальные — сложные варианты транслокаций. Протоонкоген Абельсона (ABL), кодирующий нерецепторную тирозинкиназу, находится в сегменте 9q34, а ген точечного разрыва кластерного региона (BCR), кодирующий фосфопротеин, — в 22qll.
До настоящего времени функции белков Abl и Bcr в норме окончательно не определены. Белок Abl довольно хорошо сохраняется в ходе эволюции многоклеточных. Он присутствует как в ядре, так и в цитоплазме и связан с внутренней цитоплазматической мембраной. Относительное количество белка Abl в этих частях клетки изменяется в различных типах клеток, а также в ответ на стимулы.
Abl участвует в клеточном цикле, ответе на стресс, передаче сигналов от интегринов и в нервном развитии. Функциональные области Bcr включают двойную спираль для полимеризации с другими белками, область треонин-серин-киназы, область обмена ГДФ-ГТФ, вовлеченную в регуляцию белков семейства Ras, и область активации ГТФ, участвующую в регуляции Rac и Rho ГТФаз.
Экспрессия Abl не приводит к трансформации клеток, вызываемой экспрессией химерного белка Bcr-Abl. У трансгенных мышей, вырабатывающих химерный Bcr-Abl с рождения, развивается острый лейкоз, а инфицирование здоровых мышей ретровирусами, экспрессирующими Bcr-Abl, вызывает ряд острых и хронических лейкозов, в зависимости от генетического фона.
В отличие от белка Abl, химерный белок Bcr-Abl имеет активность конститутивной тирозинкиназы и ограничен цитоплазмой, где энергично связывает микрофибриллы актина. Bcr-Abl фосфорилирует несколько цитоплазматических субстратов и тем самым активизирует сигнальные каскады, управляющие ростом, дифференцировкой и, возможно, адгезией кроветворных клеток.
Неправильная активизация этого сигнального пути приводит к неуправляемому распространению гемопоэтических стволовых клеток, выходу незрелых клеток из костного мозга, и, в конце концов, к хроническому миелоидному лейкозу (ХМЛ).
По мере развития хронического миелоидного лейкоза (ХМЛ) становится все более агрессивным. В ходе этой эволюции клетки опухоли у 50-80% пациентов приобретают дополнительные хромосомные изменения [трисомию 8,i(17q), или трисомию 19], вторую филадельфийскую хромосому. Кроме описанных цитогенетических изменений, при развитии хронического миелоидного лейкоза (ХМЛ) также часто мутируют гены-супрессоры опухолевого роста и протоонкогены.
Хронический миелоидный лейкоз (ХМЛ) — двух- или трехфазная болезнь. Начальный, или хронический этап характеризуется незаметно подкрадывающимся началом с постепенным развитием усталости, недомогания, потери массы тела и минимальным или умеренным увеличением селезенки. Со временем хронический миелоидный лейкоз (ХМЛ) обычно переходит в фазу акселерации и затем в бластный криз, хотя некоторые пациенты переходят непосредственно от хронической фазы в бластный криз.
Развитие хронического миелоидного лейкоза (ХМЛ) включает появление дополнительных хромосомных аномалий в клетках опухоли, прогрессирующего лейкоцитоза, анемии, тромбоцитоза или тромбоцитопении, всевозрастающую спленомегалию, лихорадку и костные нарушения. Властный криз — состояние острого лейкоза, бласты могут быть миелоидными, лимфоидными, эритроидными или недифференцированными. Фаза акселерации — промежуточная между хронической фазой и бластным кризом.
Приблизительно 85% больных диагностируют в хронической фазе. В зависимости от метода исследования, средний возраст постановки диагноза колеблется от 45 до 65 лет, хотя заболеванию подвержены лица любых возрастов. При отсутствии лечения показатель перехода из хронической фазы в бластный криз составляет приблизительно 5-10% в первые 2 года и затем 20% за год. Поскольку бластный криз быстро приводит к летальному исходу, развитие криза равнозначно смерти.
Особенности фенотипических проявлений хронического миелоидного лейкоза (ХМЛ):
• Возраст начала: от середины до конца зрелости
• Лейкоцитоз
• Спленомегалия
• Усталость и недомогание
Выяснение молекулярной основы хронического миелоидного лейкоза (ХМЛ) привело к разработке специфического ингибитора тирозинкиназы Bcr-Abl — иматиниба (гливек). Теперь это лекарство — основной препарат при лечении хронического миелоидного лейкоза (ХМЛ). Более 85% больных дают четкий цитогенетический ответ на терапию иматинибом, с исчезновением t(9;22) в клетках, получаемых при пункции костного мозга.
Цитогенетический ответ соответствует значительному уменьшению тяжести хронического миелоидного лейкоза (ХМЛ) до уровня ниже 10 9 -10 10 лейкемоидных клеток. Тем не менее только у некоторых пациентов (
Что такое BCR-ABL?
BCR-ABL — гибридный белок, продукт гибридного гена BCR-ABL1, формирующегося в результатереципрокной транслокации между хромосомами 9 и 22 (филадельфийская хромосома). BCR-ABL является конститутивно активной тирозинкиназой, ответственной за онкогенную трансформацию клеток (онкобелком). Постоянная активность этой тирозинкиназы делает клетку нечувствительной к воздействию факторов роста и вызывает её избыточную пролиферацию..
Белок BCR-ABL существует в трёх формах: p190, p210 и p230, в зависимости от места прерывания BCR-фрагмента.
BCR-ABL - мишень для нескольких специально разработанных ингибиторов, которые успешно применяются для лечения хронического миелолейкоза.
Ошибочное присоединение части хромосомы 9 (ген ABL) к хромосоме 22 (ген BCR) вызывает образование мутантной хромосомы ( её называют филадельфийской, в честь города, в котором она была обнаружена). Результат этого аномального процесса - новый ген, который называется BCR-ABL.
Новый ген вызывает синтез нового белка, приводящего к формированию злокачественных клеток крови в костном мозге.
BCR - ABL провоцирует:
Хронический миелолейкоз (ХМЛ)
Данная форма лейкоза характеризуется ускоренной и нерегулируемой пролиферацией преимущественно миелоидных клеток в костном мозге с их накоплением в крови.
У абсолютного большинства людей с этим диагнозом наблюдается "филадельфийская хромосома" (BCR-ABL). К факторам риска, способствующим появлению болезни, относятся воздействие бензола и высоких доз радиации.
Большинство пациентов узнают о своей болезни случайно, после получения результатов обычного анализа крови. При данном диагнозе отмечается резкое увеличение количества молодых лейкоцитов. В случае, когда результаты анализа крови вызывают подозрение на лейкоз, пациента направляют на биопсию костного мозга.
Продолжительность хронической фазы зависит от того, насколько рано было диагностировано заболевание, а также от успешности проведённого лечения. Несвоевременное выявление болезни ведет к возникновению ускоренной стадии и острой форме лейкоза.
Лечение ХМЛ: таргетная (целевая) терапия ингибиторами тирозинкиназ: иматиниб, нилотиниб, дазатиниб и др. Данная терапия значительно улучшила показатели выживаемости.
Острый B-лимфобластный лейкоз (ОЛЛ)
Вероятность возникновения ОЛЛ несколько повышена у людей, проходивших лечение с использованием облучения или определенных видов химиотерапии.
Самые неблагоприятные прогнозы и сложное лечение болезни отмечается именно при наличии у больного мутантной филадельфийской хромосомы (BCR-ABL). Без лечения ОЛЛ приводит к гибели в течение нескольких месяцев или даже недель.
Вероятность достижения ремиссии:
Точечная мутация T315I в BCR-ABL области может вызвать резистентность пациента к назначаемым препаратам.
Следовательно, перед началом лечения следует подтвердить или опровергнуть наличие данной мутации.
Хронический миелоидный лейкоз (ХМЛ) — клональное новообразование, развивающееся из стволовых кроветворных клеток. Это первая опухоль человека, при которой был обнаружен характерный хромосомный маркер. Открытие сделано в 1960 г. американскими исследователями Р. С. Nowell и D. A. Hungerford в Филадельфии, поэтому маркер был назван филадельфийской (Ph)-хромосомой. Именно с этой находки началась клиническая цитогенетика в онкологии.
Филадельфийская хромосома — укороченная хромосома из группы так называемых малых акроцентриков. В каждой нормальной женской клетке эта группа включает две пары хромосом — 21-ю и 22-ю, а в мужских клетках таких хромосом не 4, а 5, поскольку в эту группу, кроме 21-й и 22-й хромосомных пар, включена также Y-хромосома.
Ph-хромосома выявляется при обычной окраске (без G-бендинга) практически у всех больных хроническим миелоидным лейкозом (95—98 %). На дифференциально окрашенных (бендинг) хромосомах видно, что укорочена одна из хромосом 22-й пары.
Примерно у 90 % больных Ph-хромосома видна во всех анализируемых метафазах, у остальных пациентов обнаруживают как клетки с Ph-хромосомой, так и нормальные клетки, причем в отдельных случаях Ph-хромосома регистрируется в меньшинстве клеток костного мозга. Транслокация (9;22) наблюдается в миелоидных клетках, эритробластах, В-и Т-лимфоцитах, мегакариоцитах. Этот факт свидетельствует о том, что заболевание начинается с некоммитированной клетки-предшественницы гемопоэза.
Примерно в 10 % случаев наблюдаются атипичные транслокации, при которых стандартное цитогенетическое исследование позволяет увидеть перенос фрагмента хромосомы 22 не на 9-ю, а на какую-либо другую хромосому. Кроме того, иногда при хроническом миелоидном лейкозе обнаруживают сложные Ph-транслокации с участием не двух (9-й и 22-й), а трех или более хромосом.
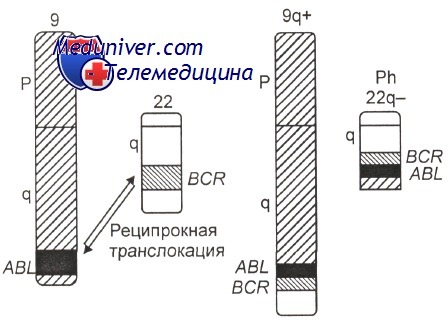
Возникновение химерных генов BCR-ABL и ABL-BCR в результате специфической хромосомной перестройки t(9;22)
Установлено, что практически при всех Ph-транслокациях участвуют хромосомы 9 и 22, однако это не всегда видно при стандартном цитогенетическом исследовании, но обнаруживается при использовании FISH и ПЦР.
Большинство исследователей считают, что тип Ph-транслокации (стандартная, атипичная или сложная) не имеет клинического значения.
Использование молекулярно-генетических методов позволило установить, что в хромосоме 9 разрыв проходит через ген (протоонкоген) ABL, идентифицированный ранее в одном из вирусов лейкоза у мышей. В хромосоме 22 наблюдается разрыв гена ВСЯ. В результате слияния фрагментов названных генов (ABL и BCR) образуется химерный ген BCR-ABL, расположенный, как правило, на делетированной хромосоме 22 (Ph-хромосома) Схематическое изображение молекулярно-генетических событий, приводящих к развитию хронического миелоидного лейкоза, показано на рисунке.
Примерно в 70 % случаев, кроме транскрипта BCR-ABL, обнаруживают продукт (транскрипт) другого химерного гена, образующегося в результате t(9;22) —ABL-BCR на der (9), однако его роль в развитии хронического миелолейкоза неясна.
Установлено, что делеция возникает одновременно с формированием специфической t(9;22), ее частота одинакова в группах больных, обследованных на разных стадиях хронического миелолейкоза. Независимо от метода лечения (даже при использовании программ, включающих гливек) прогноз у больных с интерстициальной делецией в маркере 9q+ существенно хуже, чем у больных без этой аномалии. Длительность хронической фазы и соответственно выживаемость у больных с делецией значительно меньше. Так, при обследовании большой группы больных (241) обнаружено, что медиана выживаемости была 38 мес для больных с делецией (39 человек) и 88 мес для группы больных без делеции (202 человека). Различия статистически значимы.
Применение этого информативного прогностического метода пока, к сожалению, не вошло в широкую клиническую практику, поскольку он весьма сложен и требует дорогостоящих реактивов и оборудования.
Роль делеции маркера 9q+ в прогрессии хронического миелолейкоза пока до конца не выяснена. Выпадение кодирующих последовательностей генов ABL и/или BCR в результате делеции приводит к тому, что экспрессируется только один химерный ген BCR-ABL, но нет экспрессии гена ABL-BCR. Возможно, и это событие играет роль в профессии лейкоза. Обсуждается также возможность инактивации неизвестных пока генов-супрессоров, локализованных в хромосомном районе, который делетируется.
Химерный ген BCR-ABL кодирует белок с мол. м. 210 000, обладающий более высокой протеинкиназной активностью, чем продукт нормального протоонкогена ABL (Р145). При лейкозе, вызванном у мышей вирусом Абельсона, онкогенной активностью обладает белок — продукт гибридного гена gag/abl с высокой протеинкиназной активностью. В эксперименте проводили вырезание гена gag/abl, после этого вирус терял способность вызывать лейкоз у мышей.
Изучение разрывов в генах ABL и BCR при хроническом миелолейкозе показало, что у разных больных их локализация неодинакова. Так, в гене ABL протяженность участка, на котором могут происходить разрывы, велика —до 200 kb, а в гене BCR разрывы локализуются обычно на маленьком участке — 8,5 kb, т. е. имеется кластер разрывов, отсюда название самого гена BCR (breakpoint cluster region).
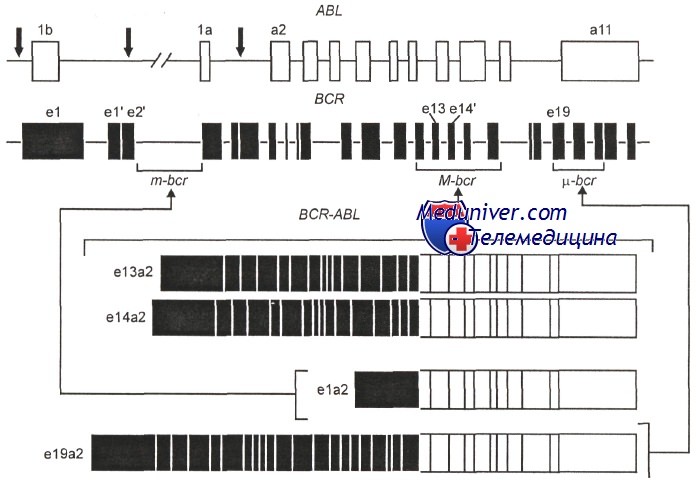
Разрывы в генах ABL и BCR при хроническом миоелоидном лейкозе.
Первый ряд — разрывы в гене ABL; второй ряд — три кластера разрывов в гене BCR: m-BCR, М-BCR и u-BCR. Ниже три типа транскриптов химерных генов BCR-ABL, различающихся по длине вошедших участков гена BCR
В подавляющем большинстве случаев t(9;22) разрывы гена BCR обнаруживают на участке, обозначаемом M-BCR, при этом химерный ген включает длинный фрагмент гена BCR и в результате возникает характерный для хронического миелолейкоза белок P210Bcr/Abl. Кроме того, при t(9;22) разрывы в гене BCR могут локализоваться на одном из двух других типичных участков, называемых m-bcr и u-bcr. Разрывы в области m-bcr приводят к образованию химерного белка Р190Bcr/Abl, т. е. белка меньшей величины, чем Р210Bcr/Abl. При локализации разрывов в u-bcr образуется более крупный белок Р230Bcr/Abl.
Как отмечалось, коррелятивная связь между типом химерного белка (P190Bcr/Abl, Р210Bcr/Abl или Р230Bcr/Abl) и клинико-гематологичесой картиной лейкоза не является строгой. Любой из этих белков может быть обнаружен при классической картине хронического миелолейкоза. Есть также сообщения о нередком сочетании двух типов белков (Р210Bcr/Abl| и Р190Bcr/Abl) при типичном хроническом миелолейкозе и при остром лимфобластном лейкозе.
Решающая роль гена BCR-ABL и его продукта — белка Р210 в развитии хронического миелолейкоза продемонстрирована на разных модельных системах in vivo и in vitro. Так, трансдукция bcr/abl в стволовые гемопоэтические клетки мыши с последующей трансплантацией этих клеток облученным сингенным животным вызывает у них миелопролиферативное заболевание, сходное с хроническим миелолейкозом человека. Установлено, что онкогенный потенциал химерного белка BCR-ABL обусловлен его высокой тирозинкиназной активностью. Дерегуляция тирозинкиназной активности — одно из центральных событий в злокачественной трансформации клеток.
При введении клеток, экспрессирующих р210Bcr/Abl, группе летально облученных мышей в условиях одного и того же эксперимента у одних животных развивался лейкоз, очень похожий на хронический миелолейкоз человека, а у других — самые разнообразные новообразования из гемопоэтических клеток: миеломоноцитарные лейкозы, макрофагальные опухоли, пре-В- и Т-клеточные лимфомы, ретикулоклеточные саркомы и эритроидные опухоли. Причина различий не выяснена. Эти опыты, как и эксперименты с трансгенными мышами, показывают, что вся цепь событий, приводящая к развитию картины хронического миелолейкоза, пока еще не установлена.
Получены данные, свидетельствующие о том, что масса кроветворных элементов и клеток крови в организме больных хроническим миелолейкозом существенно увеличена, главным образом за счет резкого повышения времени жизни этих клеток, поскольку активированный ген ABL (в гене BCR-ABL) ингибирует апоптоз — запрограммированную клеточную смерть. Кроме того, этот ген усиливает пролиферацию миелоидных клеток. Есть основания считать, что при хроническом миелолейкозе изменена функция специальных клеточных белков — интегринов, в результате чего нарушается адгезия молодых миелоидных клеток к стромальным элементам, и стволовые лейкемические клетки избегают негативных регуляторных влияний.
Читайте также:

