Миелограмма при остром лимфобластном лейкозе
Глава 20. Патология белой крови
Допущено
Всероссийским учебно - методическим центром
по непрерывному медицинскому и фармацевтическому образованию
Министерства здравоохранения Российской Федерации
в качестве учебника для студентов медицинских институтов
20.1.1. Лейкоцитоз
Лейкоцитоз - увеличение количества зрелых клеток от 8 до 40 х 10 9 в литре крови. От него следует отличать лейкемоидную реакцию (увеличение количества зрелых клеток более 40 х 10 9 с появлением незрелых лейкоцитов, лимфоцитов, моноцитов).
Этиология - чаще всего инфекционная. Патогенез: бактерии и/или их токсины увеличивают продукцию фагоцитами лейкопоэтинов, которые стимулируют деление полустволовых унипотентных клеток и созревание промежуточных форм (гранулярного и моноцитарного рядов).
Виды лейкоцитозов: а) нейтрофильный, симптом гнойного воспаления. Основная функция - фагоцитоз; б) эозинофильный, симптом аллергических реакций. Основная функция - инактивация биологически активных веществ (гистамина,например); в) базофпльный, симптом системных заболеваниях крови, например, при эритремии. Основная функция - депо биологически активных веществ; г) лимфоцитоз, симптом системных заболеваний крови, например, лимфолейкоз. Основная функция - участие в иммунных реакциях; д) моноцитоз, симптом острых вирусных заболеваний. Основная функция - фагоцитоз.
20.1.2. Лейкопении
Лейкопении - уменьшение количества зрелых клеток менее 4 х 10 9 в литре крови. Диагностическая ценность лейкопении низка, т.к. она отражает лишь тяжесть процесса.
Этиопатогенез: токсическое действие цитоcтатиков (ксенобиотики, ионизирующие излучение) приводит к угнетению деления стволовых и полустволовых клеток костного мозга. Поэтому токсический агранулоцитоз часто сочетается с анемией и тромбоцитопенией. Иммунный агранулоцитоз возникает в результате образования аутоантител к лейкоцитам при длительном лечении некоторыми медикаментами (амидопирин, сульфаниламиды).
Важным дифференциально - диагностическим признаком является то, что при иммунном агранулоцитозе отмечается избирательное уменьшение количества лейко- и лимфоцитов, а при токсическом регистрируется угнетение всех ростков крови.
Гемобластоз - опухолевое заболевание кроветворной ткани с обязательным поражением костного мозга.
Классификация (наиболее часто встречающиеся формы):
20.2.1. Этиология гемобластозов
Это генетические или хромосомные мутации (Ph - хромосома), которые приводят к появлению активного онкогена в ДНК какой-либо одной из клеток - родоначальниц ростков костного мозга и к появлению целого опухолевого клона (потомства одной этой клетки). Они далее в своем росте уже не нуждаются в факторе, который вызвал мутацию.
Условием развития гемобластозов, как и всех опухолей, является наличие иммунодефицита (первичного, наследственного или вторичного). Каждая опухолевая клетка имеет продукт деятельности онкогена - онкобелок, "индикатор" опухолевой клетки. Связываясь с ним, ее то и уничтожает разновидность лимфоцитов-убийц - естественные киллеры. При нарушении клеточного иммунитета эта противоопухолевая защита ломается. В старческом возрасте или при лечении цитостатиками возникают вторичные иммунодефицптные состояния, что, вероятно, служит причиной более высокой частоты опухолей у этих лиц.
20.2.2. Патогенез гемобластозов
Первичные процессы, 4 основные закономерности:
- Поражение системы кроветворения (костный мозг и кроветворные органы) и метастазирование по системе кроветворения с самого начала, так как источником опухоли являются ближайшие потомки полустволовой или унипотентной клеток, которые в норме обязаны образовывать кроветворные колонии (кроветворные органы). Еще раз можно повторить - в основе патогенеза лейкозов лежит не извращение деятельности всей системы кроветворения, а появления сначала одной, а из нее множества опухолевых клеток - клона лейкозных клеток.
- Угнетение нормального кроветворения и, прежде всего, того ростка, который послужил источником опухолевого клона, так как опухолевые клетки имеют более быстрый рост. Например, при хроническом лимфолейкозе прежде всего угнетается образование лимфоцитов, так как избыток опухолевых (полустволовых или унипотентных) клеток-предшественников тормозит дифференцирование нормальных полустволовых или унипотентных клеток своего и других ростков.
- Дифференцированные клетки, составляющие опухоль в начале (гранулоциты при хроническом миелолейкозе, лимфоциты при лимфогранулематозе), сменяются бластными. Происходит так называемый бластный криз. Общие свойства бластных клеток при лейкозах характерны для опухолевых клеток вообще и проявляются в утрате специфичности (возврат к набору ферментов "материнской" клетки). Клетки различных ростков, например, миелоидного, становятся морфологически и цитохимически неотличимы.
- По мере развития гемобластоза опухолевые клетки приобретают способность расти вне органов кроветворения: независимые клоны появляются часто во внутренних органах (лимфоузлах, селезенке, печени, мозговых оболочках, коже, яичках, легких, почках). Эти колонии называются лейкемическими инфильтратами.
Вторичные процессы (симптомы и патогенез).
- Септические поражения - результат снижения количества лейкоцитов и лимфоцитов, ведущего к ослаблению неспецифической противомикробной активности и иммунодефицитного состояния.
- Кровоточивость - связана с уменьшением количества тромбоцитов, а также с повреждением сосудов лейкемическими инфильтратами.
- Анемия - результат уменьшения количества эритроцитов.
- Увеличение внутренних органов и нарушение их функций (лейкемические инфильтраты) - следствие появления новых очагов кроветворения в коже, костях черепа и т.д.
- Изменение картины костно-мозгового пунктата с разрастанием соответствующего клона опухолевых клеток.
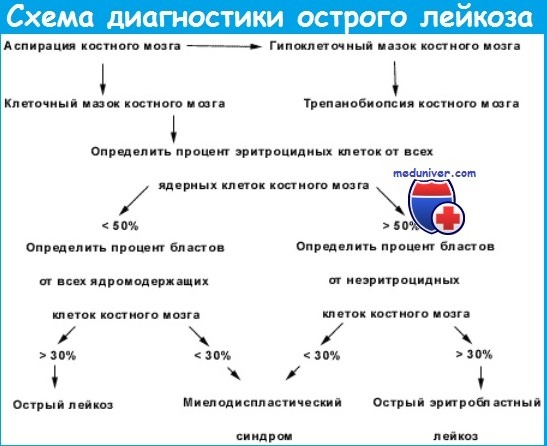
Диагностика складывается из оценки первичных процессов в системе кроветворения (периферическая кровь и пунктаты костного мозга, получаемые путем стернальной пункции, трепанобиопсии, пунктаты внутренних органов и лимфоузлов), а также учета вторичных процессов.
| Гемограмма острого лимфобластного лейкоза | ||
| ОАК | Больная | Норма |
| Нb | 8,5 г/л | 120 г/л |
| Эритроциты | 2,8x10 12 /л | 4-5x10 12 |
| ЦП | 0,9 | 1,0 |
| Лейкоциты | 2x10 10 | 4-8x10 9 |
| Базофилы | 0% | 0-1% |
| Эозинофилы | 0 % | 2-4% |
| п/я | 3% | 3-5% |
| с/я | 8% | 51-67% |
| Лимфоциты | 19,5% | 21-35 % |
| Моноциты | 2% | 2% |
| Тромбоциты | 12x10 10 | 18х10 10 |
| Бласты | средних размеров с высоким ядерно-цитоплазматическим отношением, зернистости в цитоплазме нет | |
| СОЭ | 52 мм/ч | 2-15 мм/ч |
Так как решающий диагноз гемобластозов - гематологический (изменения в периферической крови, пунктатах костного мозга или внутренних органов), необходимо знать общие отличия в пунктате костного мозга (миелограмма).
При остром лейкозе это:
- патологическая пролиферация и прекращение нормального созревания лейкозных (бластных) клеток;
- замещение бластами нормальной кроветворной ткани, иногда бластные клетки составляют до 60-80% клеток какого-либо ростка. При этом отмечается угнетение эритроидного и тромбоцитарного ростков.
Для хронического лейкоза характерны:
- меньшая степень перерождения стволовых клеток с сохранением способности к созреванию;
- угнетение нормального кроветворения не развивается многие годы.
Картина крови при острых лейкозах (гемограмма). В периферической крови возможны следующие виды изменений;
- Количество лейкоцитов:
- лейкемия (количество лейкоцитов до 10-30 х 10 11 на литр крови с появлением большого числа патологических клеток). Ее вариант - алейкемия - увеличение количества лейкоцитов без появления патологических клеток;
- лейкопения (уменьшение количества лейкоцитов до Катастрофических цифр 2-3 х 10 8 на литр крови.Норма - 6-8 х 10 9 )
- Лейкемическое зияние - клоны опухолевых (бластных клеток) утрачивают ферментную специфичность и способность к созреванию, однако в кровь из костного мозга выходят. Но так как они потеряли способность к созреванию, то промежуточных форм, образующихся из них, в крови мало или вовсе нет. С другой стороны, в крови еще сохраняются зрелые формы клеток (лейкоциты, моноциты, лимфоциты). Классический бласт - ядро нежнохроматинной тонкосетчатой структуры с равномерной окраской и калибром нитей хроматина.
- Анемия, тромбоцитопения отмечаются с самого начала болезни.
20.3.1. Острый миелобластный лейкоз - опухоль, возникающая из унипотентной клетки - предшественницы миелопоэза. В гемограмме регистрируется до 90-95% миелобластов (средних размеров, форма правильная, ядерно-цитоплазматическое отношение невысокое, ядро нежной структуры с несколькими нуклеолами, цитоплазма базофильная, зернистая).
20.3.2. Острый лимфобластный лейкоз - опухоль, возникающая из унипотентной клетки-предшественницы лимфопоэза. В 25% из Т-лимфоцитов, чаще ни Т-, ни В-формы. Наиболее часто возникает у детей.
В гемограмме наибольшую часть составляют лимфобласты (средних размеров, правильной формы, ядерно-цитоплазматическое отношение высокое, ядро без вырезки, цитоплазма без зернистости).
Большое значение при распознавании острого лейкоза имеют следующие симптомы со стороны полости рта:
- кровоточивость десен и их набухание на язычной поверхности, в отличие от гингивита отек достигает до 2/3 коронковой поверхности зуба;
- некроз - на межзубных сосочках бурный, с изъявлением, вокруг язв нет воспаления, слизистая синюшного цвета. При подозрении на острый лейкоз следует помнить, что хирургическое вмешательство может привести к вспышке скрытого острого лейкоза.
20.3.3. Хронических лейкозах
Гемограмма
- Количество лейкоцитов. В отличие от острого лейкоза характерен лейкемический вариант, причем количество клеток белой крови повышается за счет абсолютного лейко- лимфо- и моно- цитоза.
- Лейкемического зияния нет, так как наряду с бластами (составляющими единицы процентов) и зрелыми клетками имеются промежуточные незрелые формы (про-, миело- и метамиелоциты при хроническом миелолейкозе). Но проявляются очень характерные изменения в зрелых формах (Ph-хромосома при миелолейкозе, тени Боткина-Гумпрехта при лимфолейкозе).
- Анемия, тромбоцитопения обнаруживаются лишь на последних стадиях развития процесса, а не в начальных, как при остром лейкозе.
Миелограмма - в пунктате костного мозга регистрируется повышенное число клеток: миелоцитов, лимфоцитов или моноцитов в зависимости от вида хронического лейкоза.
Клинические симптомы - увеличение лимфоузлов на шее, подмышечных впадинах, затем средостении, паховой области.
| Показатели | Гемограммы | ||
| Норма | больного миелолейкозом | больного лимфолейкозом | |
| Hb г/л | 120 | 116 | 123 |
| Эр./ л | 2,8х10 12 | 3,8х10 12 | 4,1х10 12 |
| ЦП | 0,8-1,0 | 0,9 | 0,9 |
| Лейкоциты | 4-8x10 9 | 12х10 10 | 5х10 10 |
| баз. | 0-1 | 6,5% | - |
| эоз. | 2-4% | 10% | 0,5% |
| Промиелоциты | - | 1% | - |
| Миелоциты | - | 24% | - |
| Мета миелоциты | - | 21% | - |
| п/я | 3-5% | 15-5 | 1% |
| с/я | 51-67% | 14,5 | 24,5% |
| Моноциты | 2% | - | 2% |
| Лимфоциты | 21-35% | 7,5 | 72% |
| Тромбоциты | 18х10 10 | 35х10 10 | 21х10 9 |
| СОЭ,мм/ч | 2-15 | 10 | 17 |
20.3.3.1. Хронический миелолейкоз - опухоль, возникающая из унипотентной клетки-предшественницы нейтрофилов.
Гемограмма - абсолютный лейкоцитоз с резким ядерным сдвигом влево. Миелограмма - повышенное количество миелоцитов. Почти во всех делящихся клетках этого роста обнаруживается филадельфийская хромосома (Ph). Она образуется путем транслокации (переноса) части 22 хромосомы на 9-ю, в результате возникает укорочение плеча 22 хромосомы. Вначале лишь небольшая часть полустволовых или унипотентных клеток оказывается с данной хромосомной мутацией. Перенесенный и активировавшийся онкоген приводит к ускорению деления клеток этого клона, постепенно они захватывают весь костный мозг (тотальная генерация).
20 3.3.2. Хронический лимфолейкоз - опухоль, возникающая из унипотентной клетки, чаще всего предшественницы В-лимфоцитов. Однако, во многих случаях из Т-лимфоцитов.
Гемограмма - абсолютный лимфоцитоз, единичные лимфобласты. Имеются лимфоциты с полуразрушенными ядрами - тени Боткина-Гумпрехта. В цельной крови их нет, они образуются при окрашивании мазка. Глыбчатые, лишь чуть разрушенные ядра лимфоцитов с остатками нуклеол. Редко, но обнаруживаются при тяжелых инфекциях, острых лейкозах. Миелограмма - преобладают лимфоциты.
Со стороны полости рта при хроническом лимфолейкозе мало симптомов. Десны кровоточат при малейшем прикосновении, однако картины воспаления нет. Эта комбинация может указывать на лейкоз.
20.3.4. Гематосаркомы - опухоли кроветворной системы, возникающие вначале вне костного мозга с вовлечением его в дальнейшем и развитием лейкоза (лейкемизация).
В качестве примера можно назвать лимфогранулематоз, при котором первично возникают опухолевые изменения в лимфоузлах н внутренних органах. Гематограмма непостоянна. Миелограмма малохарактерна.
Решающее значение в диагностике принадлежит пунктату лимфоузлов с обязательным выявлением клеток Березовского - Штернберга. Для них характерны большие размеры, многодольчатое, закрученное ядро с крупными долями (базохромафин представлен интенсивно окрашенными скоплениями, отделенными друг от друга более светлыми участками).
20.3.5. Принципы лечения гемобластозов
Принципы лечения такие же, как и для других опухолевых процессов:
- Использование цитостатиков и облучение лейкемических инфильтратов.
- Устранение иммунодефицита путем иммуностимуляции:
- а) живыми аллогенными (от другого больного) лейкозными клетками. Метод предложен в России. Лечебный эффект предположительно объясняется тем, что бласты других больных отличаются от собственных бластов больного по HLА антигенам. Считается, что стимулируется клеточный иммунитета больного не только против сильных чужих антигенов HLA, но и против лейкозных антигенов (онкобелков), общих для бластов хозяина и донора. С этой целью вводят криоконсервированные лейкозные клетки через 6 месяцев после ремиссии для предотвращения рецидива. Показано, что через указанный срок после лечения цитостатиками иммунная система восстанавливает способность отвечать адекватной реакцией на антигенную стимуляцию;
- б) введением других иммуностимуляторов, например, гормонов тимуса.
Клинический анализ крови при остром лейкозе. У большинства больных острым лейкозом (ОЛ) на момент диагностики заболевания имеется нормохромная нормоцитарная анемия, в большей степени выраженная при остром миелобластном лейкозе. При развитии геморрагических осложнений может отмечаться гипохромия вследствие дефицита железа. Количество лейкоцитов периферической крови варьирует в очень широких пределах (от 1 • 10 9 /л до 200 • 10 9 /л), но чаще остается на сублейкемическом уровне и не превышает 20-30 • 10 9 /л.
У 20% пациентов количество бластных клеток превышает 50 • 109/л, а у 10% бласты в периферической крови отсутствуют (при этом обычно отмечаются панцитопения и относительный лимфоцитоз). При уровне лейкоцитов выше 100 • 10 9 /л резко повышается риск развития лейкостатических осложнений (неврологические нарушения, острый респираторный дистресс-синдром, у мужчин, кроме того, приапизм).
Тромбоцитопения выявляется у подавляющего числа больных острым лейкозом и более выражена при остром миелобластном лейкозе (ОМЛ) (у половины больных число тромбоцитов менее 50 • 10 9 /л). В то же время у 1-2% пациентов отмечается тромбоцитоз (более 400 • 10 9 /л).
У части больных может отмечаться увеличение протромбинового и парциального тромбопластинового времени; при остром промиелоцитарном лейкозе часто наблюдается снижение уровня фибриногена и другие признаки синдрома ДВС. Следует отметить, что развитие синдрома ДВС возможно при любом варианте острого лейкоза.
Миелограмма при остром лейкозе. Исследование аспирата костного мозга необходимо для диагностики и установления варианта острого лейкоза. Количество миелокариоцитов обычно повышено, мегакариоциты отсутствуют или их количество снижено. При подсчете миелограммы выявляется не менее 20% бластов, сужение нормальных ростков гемопоэза. Для верификации варианта острого лейкоза необходимо проведение цитохимических, иммунологических и цитогенетических исследований, результаты которых имеют прогностическое значение и позволяют планировать лечебную тактику.
Цитологическое исследование спинномозговой жидкости при остром лейкозе выполняется у всех больных острым лейкозом до начала лечения. При отсутствии патологии при остром лимфобластном лейкозе, миеломонобластных и монобластных острых лейкозов в дальнейшем проводится профилактика нейролейкоза. При развитии нейролейкоза проводят его лечение, результаты которого оцениваются на основании анализа клеточного состава спинномозговой жидкости.
Биохимические исследования при остром лейкозе. В большинстве случаев биохимические показатели находятся в пределах нормальных величин, однако при отдельных вариантах острого лейкоза (ОЛЛ, монобластный лейкоз) может отмечаться нарушение функции почек (повышение уровня креатинина) вследствие их инфильтрации опухолевыми клетками. Специфическая инфильтрация почек и/или их увеличение могут быть документированы с помощью УЗИ или компьютерной томографии. В ряде случаев (при остром лейкозе с гиперлейкоцитозом, острый лимфобластный лейкоз с органомегалией) уже в дебюте заболевания выявляется синдром лизиса опухоли.
Чаще, однако, этот синдром наблюдается при быстром лизисе клеток на фоне химиотерапии и характеризуется гипокальциемией, гиперкалиемией, повышением уровня ЛДГ и гиперурикемией с развитием почечной недостаточности.
Инструментальные исследования при остром лейкозе не имеют решающего значения при остром лейкозе, однако их результаты могут влиять на характер проводимого лечения и прогноз заболевания. Так, рентгенография органов грудной клетки позволяет выявить увеличение лимфатических узлов средостения, пневмонию; электрокардиография — нарушения ритма и/или проводимости, обусловленные специфической инфильтрацией миокарда, антрациклиновой кардиомиопатией и т. д.
Казалось бы, о состоянии системы крови можно и нужно судить по общему анализу – с детства известной рутинной медицинской процедуре. Но на самом деле, данные этого анализа — отражение процессов, происходящих в кроветворной системе, и ее главном органе – костном мозге. Поэтому при подозрении на болезнь кроветворной системы анализируют состояние костного мозга. Пункция костного мозга – это вмешательство, которое позволяет получить 0,5-1мл. этой субстанции для дальнейшего исследования.
Что такое костный мозг и зачем его изучают?
Красный костный мозг находится в плоских костях – ребрах, грудине, позвонках, костях черепа и таза – и в эпифизах (концевых частях) трубчатых костей. Он состоит из двух типов клеток – стромы, или, говоря простым языком, основной структуры, и кроветворных ростков из которых, собственно, и формируются форменные элементы: эритроциты, лейкоциты и тромбоциты.

Все элементы крови развиваются из одинаковых стволовых клеток-предшественников. Созревая (в медицине этот процесс называется дифференцировкой), клетки формируют два ростка кроветворения: лимфоидный, из которого потом созревают лимфоциты и миелоидный, создающий остальные форменные элементы. Незрелые клетки крови называются бластами. Обычно 90% всех стволовых клеток находятся в состоянии покоя.
В организме взрослого мужчины в сутки созревает 300г. форменных элементов крови, то есть 9 кг за год и около 7 тонн за 70 лет жизни. Новые клетки формируются взамен состарившихся или погибших по другим причинам (например, в борьбе с инфекциями).
В норме количество вновь созревших клеток строго равно числу погибших. При гемобластозах (лейкозах) клетки кроветворного ростка мутируют, перестают реагировать на регуляторные сигналы организма, и начинают бесконтрольно делиться. Если активность этого процесса настолько велика, что вновь сформированные клетки не успевают созреть, лейкоз называется острым. Если преобладают зрелые формы – хроническим.
Прежде чем выйти в кровоток, измененные лейкозные клетки накапливаются в красном костном мозге. И только инфильтрировав (заполонив) его, поступают сосуды. Изменения в анализе крови далеко не всегда соответствуют происходящему в костном мозге: на некоторых стадиях развития лейкоза количество форменных элементов в крови может не только не увеличиваться, но и уменьшаться.
Именно по этим причинам пункцию костного мозга и миелограммы выполняют при подозрении на любые болезни кроветворной системы.
Как и для чего выполняют пункцию костного мозга?
Чтобы получить материал для исследования, нужно проткнуть (пунктировать) кость там, где она находится близко к коже. В зависимости от возраста (а количество костного мозга в разных анатомических структурах изменяется со временем), это могут быть:
- у детей младше 2 лет – пяточная или большеберцовая кость;
- у детей старшего возраста – гребень подвздошной кости;
- у взрослых – грудина или гребень подвздошной кости.
Прокол делают специальной иглой с ограничителем – иглой Кассирского. 
Она может выглядеть по-разному. Но суть в том, что ограничитель позволяет зафиксировать глубину прокола.
Иногда полученный материал бывает неинформативен. Тогда (и при некоторых других показаниях) делается трепанобиопсия – метод, при котором специальной толстой иглой одним блоком забирают не только красный костный мозг, но и участок костного фрагмента над ним. Такую биопсию обычно делают в области гребня подвздошной кости.

Место прокола закрывается стерильной повязкой или пластырем. Боль может беспокоить и некоторое время после процедуры. Если нет противопоказаний, можно принять обезболивающие. Место прокола нельзя мочить в течение суток, соответственно, не рекомендуют принимать душ или ванну. Какого-то дополнительного ухода после пункции костного мозга не требуется.
Процедура эта безопасна, единственное абсолютное противопоказание – тяжелые нарушения свертывающей системы крови, когда любая травма приводит к обширным гематомам. Относительные противопоказания (когда сравнивают возможную пользу и вред), это:
- острый инфаркт миокарда;
- декомпенсированная сердечнососудистая патология;
- декомпенсированный сахарный диабет;
- гнойные поражения кожи в области предполагаемой пункции.
- кровотечение;
- инфицирование;
- аллергия – при непереносимости обезболивающих средств;
- сквозной прокол грудины, перелом (если пункция выполняется из грудины).
Вероятность осложнений невелика – по данным Британского общества гематологов за время с 1995 по 2001 год на 54890 проведенных пункций пришлось 26 осложнений разной степени тяжести.
Расшифровка и оценка результатов: миелограмма.
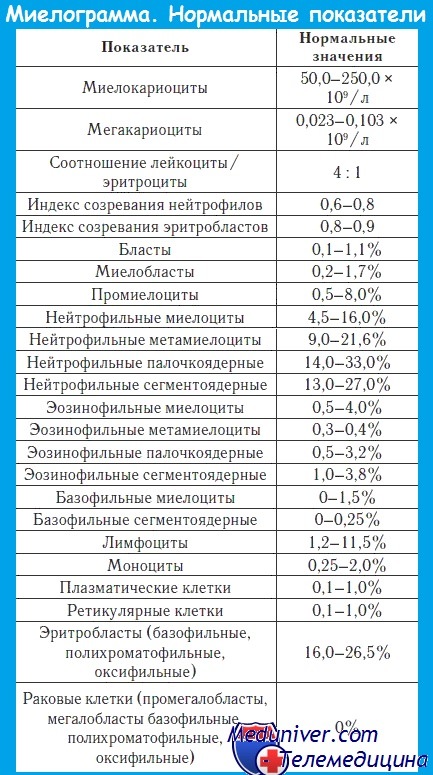
В первую очередь, в счетной камере подсчитываются мегакариоциты и миелокариоциты.
Мегакариоциты – это крупные клетки с большими ядрами, предшественники тромбоцитов. Их должно быть более 20, но менее 50 в 1 мкл.
Далее в окрашенных мазках подсчитывают процентные соотношения клеток различных рядов кроветворения. Полученный результат называется миелограммой.

Чтобы оценить по миелограмме качество костного мозга, важно знать не только процентное и количественное содержание гемопоэтических (кроветворных) элементов, но и их соотношение. Вот расшифровка некоторых показателей.
Высчитывается по формуле: (Промиелоциты + миелоциты + метамиелоциты) / (Палочкоядерные + сегментоядерные нейтрофилы). Нормальное значение 0,6 – 0,8.
Формула расчета: (Полихроматофильные + оксифильные нормобласты) / (Все ядросодержащие клетки красного ростка этого пунктата). Норма 0.8 – 0.9 и снижение индекса говорит о чрезмерно медленном наполнении гемоглобином эритроцитов (например, при железодефицитной анемии).
Как и у любого инструментального исследования, референсные значения (нормы) миелограммы могут изменяться в зависимости от лаборатории и используемых аппаратов.
Особенности миелограммы при лейкозах.
Как при остром, так и при хроническом лейкозе усиленный рост патологических клеток сопровождается уменьшением количества эритроцитов и тромбоцитов на всех стадиях созревания.
Если в миелограмме видны признаки лейкоза, пунктат костного мозга дополнительно проходит иммуногистохимическое, цитохимическое и генотипическое исследования – они нужны чтобы определить характерные особенности мутации опухолевого клона. Это важно для выбора схемы лечения конкретного пациента.
Острые миелоидные лейкозы
Острые миелоидные лейкозы (ОМЛ) представляют гетерогенную группу клональных заболеваний, при которых неопластическая трансформация наблюдается в мультилинейной стволовой клетке или в стволовой клетке с линейной дифференцировкой.
Поскольку мультипотентная стволовая клетка дает начало гранулоцитам, моноцитам, эритроцитам и мегакариоцитам, при ОМЛ возможно поражение всех или отдельных клеточных линий.
В целом неопластический клон прекращает дифференцировку на стадии бласта, что ведет к прогрессирующему накоплению бластов в костном мозге (КМ) с последующим их выходом в периферическую кровь (Рис. 1, 2).

Рис. 1. Схема кроветворения

Рис. 2. Мезенгиогенез. Мезенхимальная стволовая клетка (МСК)
ОМЛ составляют около 20% от всех лейкозов и диагностируются в любом возрасте, однако частота их возникновения увеличивается с возрастом, медиана возраста составляет 60-65 лет.
Заболеваемость составляет 2-3 человека на 100000 населения в год. Этиология острого миелоидного лейкоза неизвестна, однако причинными факторами могут быть: алкилирующие препараты, некоторые химические вещества, пестициды, рентгенконтрастные вещества, красители, миелотоксические агенты, ионизирующее излучение.
Дозы, превышающие 100 рад, оказывают дозо-зависимый эффект в отношении возникновения ОМЛ. Генетическая аномалия - трисомия Хр21 (синдром Дауна) вызывает повышенную частоту развития ОМЛ, хотя в большинстве случаев при этом синдроме развивается острый лимфобластный лейкоз (ОЛЛ).
Повышен риск развития ОМЛ при синдроме Блума, анемии Фанкони, атаксии-телеангиэктазии, нейрофиброматозе Реклингаузена и т.п. Гематологические нарушения - апластическая анемия, хронический миелопролиферативный синдром, миелодиспластические состояния, пароксизмальная ночная гемоглобинурия повышают риск развития острого миелоидного лейкоза.
Клинические проявления неспецифичны. Жалобы на общую слабость, недомогание, головокружение могут задолго предшествовать диагнозу. Нередко отмечается бледность кожных покровов, повышение температуры тела без наличия инфекции, довольно часто отмечается геморрагический синдром по петехиально-пятнистому типу, иногда кровотечения.
Оссалгии отмечаются у 20% больных. Гепатоспленомегалия не является диагностическим признаком ОМЛ, но отмечается у 50% больных. Лейкемиды кожи и инфильтрация десен обычно характерны для миеломоно- и монобластного варианта. Исходное поражение ЦНС встречается редко - при гиперлейкоцитозе и/или монобластном варианте ОМЛ.
Цитохимическими маркерами бластов гранулоцитарного ряда являются липиды, миелопероксидаза (МПО), ASD-хлорацетатэстераза (ASD-ХАЭ). Определение последнего фермента имеет небольшую диагностическую ценность вследствие невысокой ее активности. В диагностике М5а и М5в вариантов ОМЛ главную роль играет исследование неспецифической эстеразы (НЭ), подавляемой фторидом натрия (NaF), антилизоцима.
Применение иммунофенотипирования для диагностики острого миелоидного лейкоза позволяет определить линейность и/или этап дифференцировки бластов, начиная с уровня стволовых клеток-предшественников. Изучение кариотипа бластных клеток позволило выявить закономерные изменения, характерные для отдельных вариантов острых лейкозов.
При цитогенетическом исследовании у 70-80% больных ОМЛ можно выявить неслучайные приобретенные хромосомные аберрации. Некоторые из них, при которых образуется химерный сливной белок, могут служить маркером наличия опухолевого клона. Данные цитогенетического исследования используются для уточнения отдельных вариантов ОМЛ, определения прогноза заболевания, а также для контроля качества и эффективности проводимой терапии.
Таблица 1. Характеристика бластов при ОМЛ (М.А.Френкель, 2001)

Согласно FAB-классификации, выделяют следующие варианты острого миелоидного лейкоза.
Острые миелобластные лейкозы (М0, М1, М2). Этот термин объединяет три подтипа заболевания, которые отличаются друг от друга по степени дифференцировки лейкемических клеток -миелобластов.
М0 составляет около 3-5% ОМЛ. Диагноз может быть установлен только при выполнении иммунофенотипирования. Бласты экспрессируют CD13, CD31. С помощью моноклональных антител (антимиелопероксидазы) - анти-МПО в бластах можно обнаружить фермент миелопероксидазу.
М1 составляет около 15% всех ОМЛ. Морфологически бласты имеют круглое или овальное ядро с рыхлым хроматином, несколько нуклеол и небольшой ободок серо-голубой цитоплазмы без гранул. Тельца Ауэра (первичные лизосомы) выявляются в 10% случаев. При этом варианте определяется минимальная степень миелоидной дифференцировки.
Иммунофенотипическими маркерами является выявление антигенов CD13, 33, 34, HLA-DR. В единичных клетках выявляется транслокация хромосом (Хр) (t 9; 22) и инверсия Хр3. МПО и/или липиды содержатся более чем в 3% бластов.
М2 составляет около 25-32% всех ОМЛ. Более 10% бластов содержит зернистость в цитоплазме в виде нежных темно-красных гранул. Бласты содержат МПО, липиды, гранулоцитарную эстеразу (ГЭ) в большинстве клеток, ШИК-вещество в диффузной форме; бласты экспрессируют антигены CD11, 13, 15, 33, анти-МПО. Примерно в 20-40% случаев выявляется t (8; 21); при этом отмечаются спленомегалия, хлоромы, эозинофилия в периферической крови.
При данной транслокации на длинном плече Хр8 образуется химерный ген AML1-ETO, продуктом деятельности которого является патологический белок CBFa-ETO. При связывании его с ДНК происходит ингибирование транскрипции и, соответственно, нарушаются механизмы дифференцировки миелоидных клеток.
М2 базофильно-клеточный представлен в единичных случаях. Бласты содержат грубую базофильную зернистость, не содержат миелопероксидаза, липиды и ГЭ. Цитогенетически в этих случаях может выявляться t (6; 9). В сыворотке крови повышено содержание гепарина и серотонина. При этой форме острого лейкоза прогноз крайне неблагоприятный.
М3 составляет около 10% случаев острого миелоидного лейкоза. Ядра бластов имеют характерную лопастную форму, цитоплазма содержит обильную азурофильную зернистость и палочки Ауэра. В зависимости от величины гранул выделяют макрогранулярный и микрогранулярный (M3v) варианты данного заболевания. Бласты содержат большое количество МПО, липидов, ГЭ, умеренное количество НЭ, неподавляемой NaF; ШИК-вещество в диффузной форме.
Поскольку в гранулах и тельцах Ауэра содержатся сульфатированные мукополисахариды, обладающие активностью типа тканевого тромбопластина, в большинстве случаев развивается ДВС-синдром (диссеминированное внутрисосудистое свертывание). Бласты экспрессируют антигены CD 11, 13, 15, 33, анти-МПО. В 1977 г. J.D.Rowley и соавторы установили, что в 95% случаев острого промиелоцитарного лейкоза (ОПЛ) обнаруживается t (15; 17).
Вследствие этого PML-ген (ген промиелоцитарного лейкоза), расположенный на Хр15, переносится на длинное плечо Хр17 в область, где находится ген а-рецептора ретиноевой кислоты (RARA). В норме этот ген участвует в регуляции дифференцировки миелоидных клеток. Ген PML является регулятором роста и играет роль в созревании и активации различных клеток.
Продуктом химерного гена PML-RARA является патологический белок, который накапливается в цитоплазме и ядре миелоидных клеток, что приводит к блоку дифференцировки клеток на уровне промиелоцитов. Кроме того, этот белок блокирует механизмы апоптоза, что поддерживает жизнеспособность опухолевых клеток.
В М4 варианте ОМЛ выделяют биклональный (1), бифенотипический (2) и миело-монобластный эозинофильный М4ЕО (3) подварианты. Биклональный вариант составляет около 17% всех случаев, при нем бласты представлены двумя типами клеток -миелобластами и монобластами, и экспрессируют антигены анти-МПО, анти-лизоцим, CD 13, 14, 15, 33. Цитогенетические исследования могут выявить t (8; 21).
Бифенотипический вариант крайне редок. Морфологически бласты характеризуются как миелобласты при М2 варианте, однако во всех бластах одновременно содержится МПО, ГЭ и НЭ, подавляемая NaF.
М5а составляет около 10% острого миелоидного лейкоза. Бласты не имеют специфических морфологических признаков, содержат НЭ, подавляемую фторидом NaF. Отдельные бласты содержат небольшое количество миелопероксидазы и/или липидов. Бласты экспрессируют антигены CD 13, 14, 15, 33, антилизоцим. Иногда (часто после проведенной полихимиотерапии) выявляется аномалия Хр11.
М5в встречается редко. Морфологически бласты имеют моноцитоидную форму ядер, содержат значительное количество НЭ, подавляемой NaF, небольшое количество МПО или липидов. Бласты экспрессируют антигены CD 13, 14, 15, 33, антилизоцим. Как и в предыдущем варианте, может выявляться аномалия Хр11.
Мб (1) - острый эритробластный лейкоз. Характеризуется наличием расширенного патологического красного ростка. Бласты имеют морфологические и цитохимические признаки миелобластов варианта М1. Клетки красного ряда имеют мегалобластоидные изменения с признаками морфологической и цитохимической дисплазии, содержат тельца Жолли, усилена сидерофилия.
Мб (2) - эритромиелоз. В костном мозге преобладает бластная популяция, которая состоит из миелобластов и эритробластов. Бласты не имеют специфических морфоцитохимических признаков, экспрессируют гликофорин А - эритроидный антиген. Цитогенетически можно выявить множественные хромосомные перестройки. Есть мнение, что изменения со стороны клеток красного ряда представляют реакцию на уже имеющийся ОМЛ. Цитогенетические исследования показывают наличие аномалий Хр5,7.
М7 встречается крайне редко. Мегакариобласты в большом количестве в костном мозге с их выходом в периферическую кровь. Цитохимически в бластах находят большое содержание а-нафтил-ацетатэстеразы, не ингибируемой NaF, и некоторое количество а-бутиратэстеразы, выявляется положительная ШИК-реакция. Бласты экспрессируют тромбоцитарные антигены CD 41 и/или CD 61.
Острые лимфобластные лейкозы
Острые лимфобластные лейкозы представляют гетерогенную группу клональных заболеваний лимфопоэтической ткани, характеризующуюся накоплением лимфобластов в КМ. Прогрессирующая инфильтрация опухолевыми лимфобластами костного мозга подавляет продукцию нормальных гемопоэтических клеток. ОЛЛ составляют 10% от всех лейкозов, причем 60% от этого количества наблюдается у детей.
В Европе ОЛЛ является наиболее частым опухолевым заболеванием детского возраста. Пик заболеваемости приходится на возраст 3-7 лет, второй, не очень выраженный пик, отмечается в возрасте 50-60 лет. Заболеваемость острым лимфобластным лейкозом ниже на Среднем Востоке и в Азии. В США частота заболеваемости белого населения в 2 раза выше, чем негроидного.
Подтип В-клеточного ОЛЛ составляет 80% всех случаев ОЛЛ, почти во всех остальных случаях диагностируется Т-ОЛЛ. Крайне редко определяется нуль-клеточный вариант.
Этиология ОЛЛ неизвестна. Не выявлено связи с миелотоксическими агентами, химикатами, ретровирусами, хотя внедрение ретровируса в геном при лечении агаммаглобулинемии Бруттона в некоторых случаях приводило к развитию острого лимфобластного лейкоза.
Умеренное повышение заболеваемости ОЛЛ отмечено под воздействием высоких доз ионизирующего излучения и при некоторых иммунодефицитных состояниях. Хотя вирус Эпштейн-Барра инкорпорируется в геном клеток при африканском варианте лимфомы Беркитта, вирусный геном отсутствует при лимфобластном L3 варианте ОЛЛ. Заболеваемость ОЛЛ в 15-20 раз выше при синдроме Дауна.
В патогенезе ОЛЛ основным является прогрессирующее накопление лимфобластов в КМ, что снижает потенциал дифференцировки и созревания. Для популяции лейкемических лимфобластов характерна остановка дифференцировки трансформированных лимфопоэтических стволовых клеток на специфической стадии, что снижает также уровень апоптоза.
Лейкемические лимфобласты имеют удлиненное время генерации (3 суток) в сравнении с нормальными лимфоидными предшественниками (1 сутки). Поскольку лимфобласты не созревают до более дифференцированной стадии, они накапливаются в костном мозге. Клинически это проявляется анемией, гранулоцитопенией и тромбоцитопенией.
Клиника ОЛЛ обычно представлена неспецифическими симптомами, хотя дебют может быть острым. Наиболее часто отмечаются слабость, сонливость, оссалгии, артралгии, не связанное с инфекцией повышение температуры тела. Иногда единственной жалобой являются оссалгии при отсутствии лимфоаденопатии, органомегалии и изменений в анализах периферической крови.
При вовлечении в процесс ЦНС отмечаются головная боль, тошнота, рвота. Бактериальная инфекция встречается при выраженной нейтропении. При физикальном обследовании может отмечаться бледность кожных покровов, геморрагический синдром по петехиально-пятнистому типу, лимфоаденопатия (чаще в области шеи), гепатоспленомегалия. Крайне редко бывают лейке -миды кожи.
В анализе крови в 60% случаев отмечается сублейкоцитоз, в 10% - гиперлейкоцитоз свыше 100,0х10 9 /л, тромбоцитопения менее 50,0х10 9 /л - у 60% больных в момент диагностики. При гиперлейкоцитозе почти всегда отмечается лимфоаденопатия, гепато- и спленомегалия. Анемия является непостоянным признаком.
В пунктате КМ отмечается гиперклеточность с наличием более 20% бластов. Для установления диагноза необходимо комплексное (морфологическое, цитохимическое, иммунофенотипическое, цитогенетическое) исследование бластных клеток.
Цитогенетическое изучение выявило некоторые аномалии количества хромосом или их структуры в 90% случаев острого лимфобластного лейкоза. Гипердиплоидность (47 или более хромосом) выявлена у 1/3 больных. Обычно существуют хромосомные транслокации, вовлекающие протоонкогены; большинство из них демонстрируют транслокацию c-myc протоонкогена Хр8 в регион гена Хр14, кодирующий иммуноглобулины (Ig). - t (8; 14).
В случаях В-ОЛЛ встречаются t (2; 8) или t (8; 22). Это специфические транслокации, т.к. локус с c-myc дерегулируется промотором Ig. При пре-В-клеточном варианте острого лимфобластного лейкоза специфическая транслокация t (1; 19) наблюдается в 25% случаев. В результате гибридный ген Хр19 кодирует белок, который нарушает регуляцию транскрипции.
Описаны транслокации при Т-клеточном остром лимфобластном лейкозе, вовлекающие Хр11 и локус Т-клеточного рецептора (TCR) на Хр14 и Хр7, а также делеции Хр6, Хр9, Хр12, так что в этих случаях может происходить потеря опухолевых генов-супрессоров. Филадельфийская хромосома (Ph), t (9; 22) выявляется в 20% ОЛЛ у взрослых и менее чем в 5% у детей. Патологический белок, кодируемый гибридным геном при этой транслокации, при ОЛЛ отличается от белка, продуцируемого химерным геном BCR/ABL при хроническом миелолейкозе.
Лимфобласты при ОЛЛ всегда весьма гетерогенны.
Выделяют три подтипа острого лимфобластного лейкоза:
L1 - лимфобласты малой величины, имеют круглое или овальное ядро с тонко организованным хроматином, единичными нуклеолами и ободком голубой цитоплазмы.
L2 - лимфобласты средней и большой величины, имеют ядро неправильной формы с рыхлым хроматином, одну или более нуклеол и ободок умеренно серо-голубой цитоплазмы.
L3 - лимфобласты крупных размеров, с круглым или овальным ядром, содержащим глыбчатый хроматин, 2-5 нуклеол и ободок темно-голубой и частично вакуолизированной цитоплазмы.
С учетом иммунологических маркеров можно выделить четыре подтипа ОЛЛ, три из них В-клеточного и один - Т-клеточного происхождения.
Имеются два подтипа, состоящие из предшественников В-клеток:
- пре-пре-В клеточный ОЛЛ (морфологически - L1 вариант),
- пре-В клеточный ОЛЛ (морфологически - L2 вариант).
Третий подтип В-клеточного ОЛЛ состоит из более зрелых В-клеток (L3 вариант).
Около 20% случаев ОЛЛ происходят из предшественников Т-клеток и относятся морфологически к L2 варианту. Демонстрируется реаранжировка генов в- или гамма-цепей рецептора Т-клеток (TCR).
ОЛЛ из нуль-клеток - это малая пропорция случаев ОЛЛ, отличающаяся по маркерам от В- или Т-линии лимфоцитов и поэтому называемая нуль-ОЛЛ или неклассифицируемым ОЛЛ.
При цитохимическом исследовании характерно наличие терминальной динуклеотидил-трансферазы (Тс1Т) в 95% случаев пре-пре-В-, пре-В клеточного ОЛЛ и Т-клеточном ОЛЛ.
Активность фермента снижена в зрелых В-лимфоцитах и при L3 варианте ОЛЛ. При ОНЛЛ активность фермента выявляется только в 5-10% случаев.
Таблица 2. Характеристика бластов при ОЛЛ (М.А. Френкель, 2001)

Реакции на МПО, специфические и неспецифические эстеразы, ШИК-реакция - отрицательные. Реакция на окрашивание масляным красным - положительная.
Читайте также:

