Миелодиспластический синдром тельца жолли
Диагноз миелодиспластического синдрома (МДС) основывается на обнаружении качественных нарушений кроветворения в одном или нескольких ростках гемопоэза (дизэритропоэз, дизгрануломоноцитопоэз, дизмегакариоцитопоэз). Вариант заболевания определяется на основании анализов крови и костного мозга.
Анализ периферической крови при миелодиспластическом синдроме. У больных миелодиспластическим синдромом (МДС) выявляются различные варианты цитопении: в 60-70% случаев — панцитопения (анемия, лейкои нейтропения, тромбоцитопения), у 30-40% пациентов — двуростковая цитопения, у 5% — одноростковая цитопения.
Анемия наблюдается более чем у 90% больных, имеет нормо- или макроцитарный характер, сопровождается умеренным анизо- и пойкилоцитозом. Уровень ретикулоцитов обычно снижен. Качественные изменения эритроцитов (дизэритропоэз) характеризуются наличием мегалоцитов, эритроцитов с базофильной пунктацией, тельцами Жолли; могут встречаться единичные нормоциты.
Лейко- и нейтропения отмечаются у 60% больных миелодиспластическим синдромом (МДС). В 10-20% случаев количество лейкоцитов в норме или повышено (при хроническом миеломоноцитарном лейкозе). Дизгранулоцитопоэз проявляется прежде всего псевдопельгеровской аномалией (пельгеризацией), которая наблюдается более чем у 80% пациентов. Наряду с этим могут встречаться гиперсегментированные и двуядерные нейтрофилы, а также клетки, содержащие фрагменты ядра.
В цитоплазме нейтрофилов выявляется либо резкое снижение зернистости (вплоть до полной дегрануляции), либо, напротив, аномально большие гранулы. При определенных формах миелодиспластического синдрома (МДС) в периферической крови выявляются бластные клетки. Для хронического миеломоноцитарного лейкоза характерен абсолютный моноцитоз (более 1 • 10 9 /л).
У большинства пациентов в периферической крови выявляется тромбоцитопения. Дизмегакариоцитопоэз характеризуется появлением в периферической крови качественно измененных тромбоцитов (гигантские клетки с бедным грануломером), а также фрагментов мегакариоцитов.

При исследовании аспирата костного мозга в большинстве случаев выявляется его нормальная или повышенная клеточность. Уменьшение количества миелокариоцитов отмечается менее чем у 15% больных. Основное при анализе миелограммы у больных миелодиспластическим синдромом — выявление качественных изменений гемопоэза и подсчет количества бластных клеток.
В первую очередь страдает эритропоэз, что проявляется гиперплазией эритроидного ростка, признаками мегалобластоидного кроветворения, наличием гигантских эритроидных клеток (до 20 мкм и более), многоядерных нормоцитов с фрагментами ядра, тельцами Жолли, кариорексисом и пикнозом ядер; цитоплазма клеток содержит базофильную пунктацию и вакуолизацию.
У больных с рефрактерной анемией с кольцевыми сидеробластами (РАКС) увеличено количество сидеробластов, имеются их кольцевидные формы. Дизэритропоэз является самой ранней находкой при миелодиспластическом синдроме и доминирует при рефрактерной анемии (РА) и РАКС.
Количество бластных клеток в пунктате костного мозга зависит от формы миелодиспластического синдрома и колеблется от нормального количества до 20%.
Дизгранулопоэз характеризуется псевдопельгеровской аномалией, гипо- и агрануляцией цитоплазмы или, напротив, появлением аномально крупных гранул. Количество мегакариоцитов в норме или уменьшено. Признаки дизмегакариоцитопоэза включают появление микромегакариоцитов, клеток с однои двулопастными ядрами или с множеством отдельно расположенных ядер небольших размеров с гигантскими аномальными гранулами. Может отмечаться плазмоцитарная реакция костного мозга (4-8%).
Трепанобиопсия дает более полное представление о клеточности костного мозга и признаках дизмегакариоцитопоэза (микромегакариоциты обнаруживаются чаще, чем в миелограмме). Выявляются также признаки дизэритро- и дизгранулоцитопоэза.
Биохимигеские исследования не имеют патогномоничного значения для диагностики миелодиспластического синдрома. В ряде случаев отмечается снижение уровня пируваткиназы, увеличение фетального гемоглобина в крови и лизоцима — в крови и моче.
Цитогенетические нарушения отмечаются у 50% больных первичным миелодиспластическим синдромом и более чем у 80% пациентов со вторичным миелодиспластическим синдромом. Для первичного миелодиспластического синдрома характерны del 5q, +8 и -7. При вторичном миелодиспластическом синдроме чаще выявляются del 7q и del 5q.
Изолированные хромосомные аберрации могут иметь благоприятное (del 5q и del 20q), неблагоприятное значение (del 7q) либо существенно не влиять на прогноз. Выявление любых множественных (не менее 3) цитогенетических аномалий сопровождается неблагоприятным прогнозом.
Некоторые формы миелодиспластического синдрома (МДС) (РА и РАКС) необходимо дифференцировать от апластической и В12-дефицитной анемии. Цитологическое и гистологическое исследование костного мозга, выявляющее выраженную дисплазию клеток миелоидного ростка при отсутствии аплазии кроветворения, позволяют поставить правильный диагноз.
Трудности могут возникнуть при дифференциальной диагностике МДС и острого эритромиелоза (М6 по FAB-классификации острого лейкоза), поскольку для обоих заболеваний характерны выраженный анемический синдром, бицитопения или панцитопения, гиперплазия и дисплазия эритроидного ростка костного мозга. В то же время при остром эритромиелозе в крови определяются ретикулоцитоз и нормоцитоз, в миелограмме выявляется 20% и более бластных клеток, а также уродливые нормоциты и многоядерные эритробласты при отсутствии качественных изменений гранулоцитарного ряда.
Дифференциальный диагноз РАИБ с другими вариантами острых лейкозов основывается на количестве бластов в миелограмме (при миелодиспластическом синдроме — всегда менее 20%).
Дальнейшие исследования позволили выявили у больных с резистентной к терапии анемией, как с увеличением количества бластных клеток в костном мозге, так и без, ряд особенностей. Эти особенности касались в первую очередь морфологии костного мозга (нарушение архитектоники ростков гемопоэза, изменения стромальной ткани, признаки дисплазии кроветворных клеток). Кроме того, при выполнении цитогенетического исследования у таких больных часто выявлялись изменение кариотипа гемопоэтических клеток.
Цитогенетическими и ферментными методами была доказана клональная (опухолевая) природа заболевания. Характерной особеностью клеток, происходящих из опухолевого клона, при миелодиспластическом синдроме является их морфологическая и функциональная неполноценность.
Дальнейшие наблюдения позволили установить, что миелодиспластический синдром является неоднородной группой. У больных миелодиспластическим синдромом отмечались существенные различия в тяжести клинических проявлений, длительности течения заболевания (сроках выживаемости больных), в частоте и скорости озлокачествления заболевания — трансформации в острый лейкоз. Различия в течение заболевания требовали и различной тактики ведения больных, то есть возникла необходимость выделения самостоятельных нозологических форм.
Миелодиспластический синдром (МДС) — это группа заболеваний костного мозга, носящих клональный характер и возникающих в результате мутации стволовой клетки крови. При этом потомки мутировавшей стволовой клетки сохраняют способность к дифференцировке до зрелых клеток. Однако процесс дифференцировки носит неэффективный характер, в результате чего зрелые клетки крови изменены морфологически, уменьшены в количестве и ослаблены в функции.
Сегодня общепринятой является классификация МДС разработанная Франко-Америко-Британской исследовательской группой (FAB) и опубликованная в 1982 году. В основе классификации лежат четыре признака:
— количество бластов в костном мозге;
— количество бластов в периферической крови;
— количество атипичных (кольцевидных) сидеробластов в костном мозге;
— количество моноцитов в периферической крови.
Такой набор признаков позволяет разделить группу схожих заболеваний на самостоятельные нозологические формы (таблица 1), которые отличаются по частоте встречаемости, длительности течения, вероятности озлокачествления (трансформации в острый лейкоз) и требуют различной тактики лечения больных. Частота встречаемости различных заболеваний, выделяемых в группе МДС, длительность выживания больных и вероятность трансформации в острый лейкоз представлены в таблице 2.
Таблица 1. FAB-классификация миелодиспластического синдрома (по Bennett et al., 1982).
а) количество бластов в костном мозге менее 5%
б) количество кольцевых сидеробластов в костном мозге менее 15%
в) количество бластов в периферической крови менее 1%
г) количество моноцитов в периферической крови менее 1х10^9/л
2.Рефрактерная анемия с кольцевыми сидеробластами:
а) количество бластов в костном мозге менее 5%
б) количество кольцевых сидеробластов в костном мозге не менее 15%
в) количество бластов в периферической крови менее 1%
г) количество моноцитов в периферической крови менее 1х10^9/л
3.Рефрактерная анемия с избытком бластов:
а) количество бластов в костном мозге более 5%, но менее 20%
б) количество кольцевых сидеробластов в костном мозге менее 15%
в) количество бластов в периферической крови менее 5%
г) количество моноцитов в периферической крови менее 1х10^9/л
4.Рефрактерная анемия с избытком бластов на стадии трансформации:
а) количество бластов в костном мозге более 20%, но менее 30%
б) количество кольцевых сидеробластов в костном мозге менее 15%
в) количество бластов в периферической крови менее 1%
г) количество моноцитов в периферической крови менее 1х10^9/л
5.Хронический миеломоноцитарный лейкоз:
а) количество бластов в костном мозге менее 20%
б) количество кольцевых сидеробластов в костном мозге любое
в) количество бластов в периферической крови менее 5%
г) количество моноцитов в периферической крови не менее 1х10^9/л
Таблица 2. Частота встречаемости каждого из нозологических вариантов МДС, длительность выживания и вероятность трансформации в острый лейкоз.
частота (%) выживаемость (мес) вероятность(%)
1.Рефрактерная анемия: 25 37 11
2.Рефрактерная анемия с кольцевыми сидеробластами: 18 49 5
3.Рефрактерная анемия с избытком бластов: 28 9 23
4.Рефрактерная анемия с избытком бластов
на стадии трансформации: 12 6 48
5.Хронический миеломоноцитарный лейкоз: 17 22 20
Эпидемиология. МДС — патология старшей возрастной группы. 80% случаев МДС приходится на лиц старше 60 лет. В европейских странах среди лиц 50 — 69 лет регистрируется 40 новых случаев МДС на 1 млн населения, а среди лиц 70 лет и старше — 150 новых случаев на 1 млн населения.
Этиология. Несмотря на многочисленные исследования, причины вызывающие развитие МДС остаются во многом неясными. В группе этиологических факторов рассматривают факторы, способные вызывать мутации клеток и тем самым приводить к развитию опухоли: вирусы, ионизирующее излучение, химические агенты. На сегодняшний день каких-либо этиологических факторов, специфичных для МДС не установлено. В ряде случаев развитию МДС предшествует химиотерапия солидных опухолей.
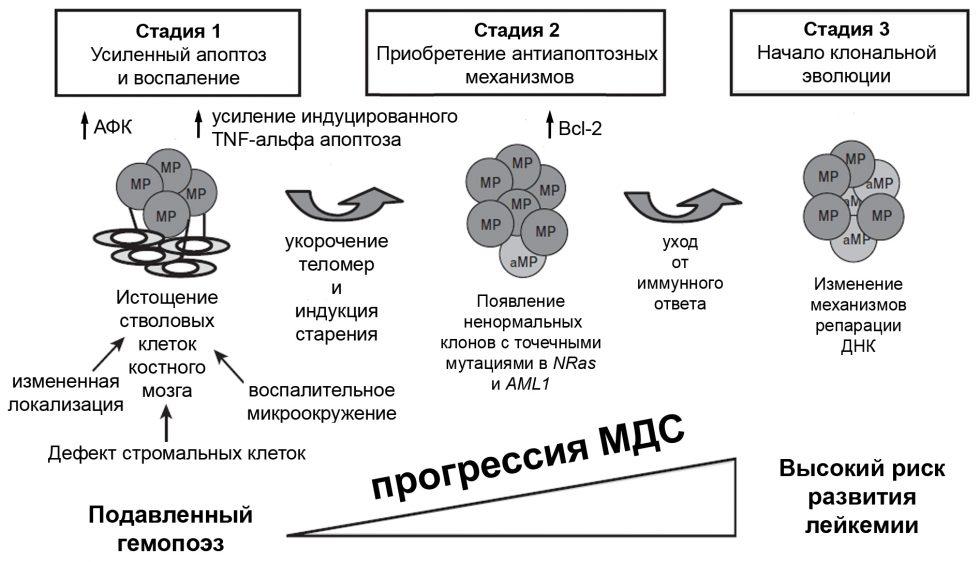
Патогенез. Отправной точкой в развитии МДС является мутация стволовой клетки крови. Потомки мутировавшей клетки получают биологическое преимущество перед нормальными гемопоэтическими клетками, что позволяет им полностью колонизировать костный мозг, вытесняя нормальные гемопоэтические клетки. Особенностью мутации стволовой клетки крови при МДС является частичное сохранение ее потомками способности к созреванию до зрелых клеток крови. Однако, процесс созревания носит неэффективный характер, что приводит к уменьшению количества зрелых клеток в периферической крови. Кроме количественных изменений в составе клеток периферической крови имеет место и снижение их функциональной активности.
Немаловажную роль в развитии патологического клона гемопоэтических клеток играет стромальное микроокружение, однако конкретные механизмы вовлечение стромальной ткани в патологический процесс при МДС изучены еще недостаточно.
Неэффективный характер гемопоэза (дисплазия кроветворения) имеет хорошо выраженный морфологический эквивалент — изменение как морфологических признаков гемопоэтических клеток, так и их расположения внутри костномозговой полости (изменение архитектоники). Третью составляющую морфологических признаков дисплазии кроветворения образуют изменения стромальной ткани. Основные морфологические признаки дисплазии дисплазии кроветворения представлены в таблице 4 и таблице 5.
Таблица 4. Морфологические признаки дисплазии кроветворения при исследовании аспирата костного мозга (по Bartl R, Frisch B и Baumgart R, 1992).
— большие мегакариоциты с одним или несколькими мелкими круглыми ядрами
— увеличение бластных клеток
— гипо- и гипергранулярность
— базофилия цитоплазмы зрелых клеток
— эозинофилы с кольцевыми ядрами
— моноциты с множественными вытянутыми лопастями цитоплазмы
— афзурофильные гранулы в цитоплазме
Ниже представлены несколько фотографий, иллюстрирующих морфологические признаки дисплазии кроветворения.

Рисунок 1. Дисплазия эритроидного ростка в костном мозге: мегалобластоидность, асинхронность ядер, тельца Жоли.

Рисунок 2. Дисплазия мегакариоцитарного ростка в костном мозге: микромегакариоцит.

Рисунок 3. Дисплазия гранулоцитарного ростка в костном мозге: значительная редукция числа гранул.

Рисунок 4. Костный мозг больного рефрактерной сидеробластной анемией: кольцевые сидеробласты.
Таблица 5. Гистологические признаки дисплазии кроветворения при исследовании биоптата костного мозга (по Bartl R, Frisch B и Baumgart R, 1992).
Клеточность костного мозга:
— гиперклеточный (свыше 50% случаев)
— нормоклеточный (30-40% случаев)
— гипоклеточный (менее 20% случаев)
— атипичная локализация незрелых предшественников
— атипичная локализация эритроцитарных предшественников
— атипичная локализация мегакариоцитов
— интраваскулярное расположение гемопоэтических клеток
— расширение синусоидов со склерозом стенок
— интростициальный и парамегакариоцитарный фиброз
— увеличение тучных клеток
— увеличение костного преобразования
В неопластическом клоне могут происходить вторичные мутации клеток. В ряде случаев это приводит к развитию в костном мозге клона гемопоэтических клеток, потерявших способность к созреванию в большей степени, чем гемопоэтические клетки из предшествующего клона. Морфологическим эквивалентом этого события является увеличение в костном мозге количества незрелых клеток — бластов. Если количество бластов в цитологическом препарате костного мозга превышает 30%, то говорят о трансформации в острый лейкоз. При этом следует понимать, что данная ситуация не означает развитие нового (второго) заболевания, а является закономерным продолжением течения данной нозологической фомы миелодиспластического синдрома, подчиняющегося закону опухолевой прогрессии. Трансформация в острый лейкоз при МДС эквивалентна развитию бластного криза при хроническом миелолейкозе.
Клиническая картина. Клиническая картина при различных формах МДС схожа и во многом определяется показателями периферической крови. Изменения периферической крови прямо зависят от степени нарушения созревания гемопоэтических клеток. Анемия постоянный и обязательный признак. Для нее характерны гиперхромия (высокий цветовой показатель) и макроцитоз. Уровень снижения гемоглобина может варьировать от умеренного до значительного. От степени и скорости нарастания анемии будет зависеть самочувствие больного. При медленном снижении гемоглобина организм успевает адаптироваться к гипоксии и количество жалоб у больных может быть минимальным. Если анемия развивается быстро, больные предъявляют жалобы на общую слабость, утомляемость, сердцебиение, одышку. Может утяжеляться течение ишемической болезни сердца, появляются признаки сердечной недостаточности.
Снижение количества зрелых гранулоцитов (нейтропения), а также их функциональная несостоятельность влекут за собой инфекционные осложнения. У 10 % больных развиваются стоматиты, гингивиты, пневмонии, инфекция мочевыводящих путей, абсцессы различной локализации, сепсис. У 20 % больных данной группы инфекционные осложнения становятся причиной смерти. Наиболее многочислены осложнения бактериальной природы, возбудителями которых являются Escherichia coli, Pseudomonas pyocyanea, Klebsiella pneumoniae, Staphylococcus aureus и Streptococcus fecalis. Также достаточно часто тяжелые инфекционные осложнения вызываются Pneumocystic carinii, Cryptococcus neoformous, Candida albicaus, Aspergillus fumigatus и цитомегаловирусом, что связано с функциональной неполноценностью Т-лимфоцитов при МДС.
Клинически значимая тромбоцитопения (приводящая к развитию геморрагического диатеза с петехиально-пятнистым типом кровоточивости) встречается у 15 % больных МДС. У половины из них кровотечение или кровоизлияния становятся причиной смерти. В некоторых случаях МДС, как правило у больных рефрактерной анемией, может отмечаться тромбоцитоз. Проявления гиперпластического синдрома в виде спленомегалии, гепатомегалии, лимфоаденопатии и специфического поражения кожи (лейкемиды) имеют место в основном у больных ХММЛ.
Спленомегалия встречается у 17 % таких больных, гепатомегалия у 13 %, а лейкемиды у 10 %.
Диагностика.Отправной точкой диагностического поиска являются, как правило, жалобы связанные со снижением уровня гемоглобина, подкрепляемые выявлением гиперхромной, макроцитарной анемии при исследовании периферической крови. Выявление при первичном осмотре, наряду с анемическими жалобами, явлений геморрагического диатеза и/или гиперпластического синдрома позволяют сформировать представление о
В качестве вспомогательного метода диагностики может быть использовано цитогенетическое исследование кариотипа гемопоэтических клеток. Различные хромосомные поломки выявляются у 48 % больных МДС. Частота аномалий кариотипа варьирует в зависимости от нозологического варианта МДС. Так у больных РА хромосомные поломки обнаруживаются в 30 % случаев, а у больных РАИБтранс в 60 %. Выявление хромосомных аномалий имеет большое значение для определения прогноза течения заболевания.
Наиболее часто встречающимся изменением кариотипа у больных РА является делеция (утрата) части длинного плеча пятой хромосомы (5q-). Данная аномалия чаще выявляется у женщин (соотношение мужчин и женщин среди заболевших составляет 1:5). Для больных с такой хромосомной поломкой характерны ярко выраженые морфологические аномалии мегакариоцитов (микромегакариоциты), тромбоцитоз периферической крови и достаточно благоприятное течение заболевания с низкой частотой трансформации в острый лейкоз.
Диагноз складывается из морфологически подтвержденного представления о наличии у больного миелодиспластического синдрома и окончательно формулируется (нозологическая форма) на основании количественных критериев миелограммы и гемограммы (FAB-классификация):
РА — бласты костного мозга 5%, моноциты периферической крови
Миелодиспластическим синдромом называют группу гетерогенных клональных заболеваний крови, объединенных следующими признаками: неэффективный гемопоэз, периферическая цитопения, дисплазия в одном или более ростке кроветворения с высоким потенциалом трансформации в острый миелоидный лейкоз.
Недостаточное кроветворение проявляется анемией, повышенной кровоточивостью и подверженностью инфекциям. Миелодиспластический синдром (МДС) встречается у людей любого возраста, в том числе и детского, но в большей степени ему подвержены люди после 60 лет.
По МКБ-10 миелодиспластическим синдромам присваивается код D46.
Причины
Клетки крови синтезируются и созревают главным образом в костном мозге (этот процесс называется миелопоэзом, а ткань, в которой он происходит, называется миелоидной), затем, выполнив свою функцию и состарившись, уничтожаются селезенкой, а на их место приходят новые. При миелодиспластическом синдроме костный мозг теряет способность к воспроизводству клеток крови (всех – эритроцитов, лейкоцитов, тромбоцитов или только некоторых) в необходимом организму количестве, в кровь попадают незрелые клетки (бласты), в результате чего она хуже выполняет свои функции. Это проявляется характерной для МДС симптоматикой. Примерно в 30% случаев процесс миелопоэза становится со временем полностью бесконтрольным, количество бластных форм кровяных клеток увеличивается, вытесняя нормальные, зрелые клетки. Когда количество бластов в крови превышает 20% (ранее пороговым значением было 30%), ставится диагноз острого миелоидного лейкоза.
В зависимости от того, известна ли причина нарушения функции костного мозга, или нет, МДС делится на первичный, или идиопатический, и вторичный. Вторичный возникает в результате угнетения костномозговой функции после химиотерапевтического или лучевого воздействия. Такое воздействие обычно является частью противоопухолевой терапии, т. е. проводится по поводу какого-либо вида рака. В этом случае МДС можно рассматривать как осложнение.
Первичный, или идиопатический МДС возникает спонтанно, без какой-либо предшествующей патологии и по неизвестной причине. Возможно, предрасполагающим фактором является генетический, поскольку при некоторых видах синдрома обнаруживаются хромосомные изменения.
Факторами, способствующими развитию МДС, являются:
- курение;
- контакт с канцерогенными химическими веществами (пестициды, гербициды, бензол);
- воздействие ионизирующей радиации;
- пожилой возраст.
Формы заболевания
Как уже указывалось выше, МДС делится на два вида, первичный и вторичный.
Чаще встречается первичный МДС (около 80% всех случаев), большинство заболевших – пожилые люди (65-75 лет). Вторичным МДС также в основном страдают пожилые люди, по той причине, что и злокачественные опухоли, а значит, и их осложнения, у них встречаются чаще. Вторичный МДС хуже поддается терапии и связан с худшим прогнозом.
Кроме того, МДС делится на клинические типы в зависимости от типа бластных клеток, их количества и наличия хромосомных изменений, эта классификация предложена Всемирной Организацией Здравоохранения (ВОЗ). Согласно классификации ВОЗ, выделяют следующие формы МДС:
- рефрактерная (т. е. устойчивая к классической терапии) анемия;
- рефрактерная цитопения с мультилинейной дисплазией;
- МДС с изолированной делецией 5q;
- МДС неклассифицируемый;
- рефрактерная анемия с кольцевидными сидеробластами;
- Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами;
- рефрактерная анемия с избытком бластов-1;
- рефрактерная анемия с избытком бластов-2.
Стадии заболевания
В протекании МДС выделяют три стадии, которые, однако, не всегда клинически четко отличаются между собой, различия определяются лабораторно. Это стадия анемии, стадия трансформации (промежуточная между анемией и острым лейкозом), и острый миелоидный лейкоз. Не все исследователи согласны с определением острого миелоидного лейкоза как стадии миелодиспластического синдрома, поскольку он относится к миелопролиферативным нарушениям (т. е. тем, которые характеризуются бесконтрольным клеточным ростом), тем самым не полностью соответствуя характеристикам МДС.
Симптомы
Основные симптомы МДС связаны с проявлениями анемии. Пациенты предъявляют жалобы на повышенную утомляемость, приступы головокружения, одышку при физической нагрузке, которая ранее переносилась легко. Анемия связана с нарушением продукции эритроцитов, следствием чего является низкий уровень гемоглобина в крови.
В некоторых случаях развивается геморрагический синдром, который характеризуется повышенной кровоточивостью. Пациент начинает замечать, что даже незначительные поверхностные повреждения вызывают длительно не останавливающееся кровотечение, может появиться кровоточивость десен, частые и спонтанные носовые кровотечения, петехии на коже и слизистых оболочках, а также множественные гематомы (синяки) либо без связи с какой-либо запоминающейся пациенту травмы, либо после незначительного ушиба или даже надавливания. Геморрагический синдром связан с нарушениями тромбоцитопоэза.
У больных с МДС также обнаруживается подверженность инфекционным болезням. Они часто болеют простудными заболеваниями, кожными бактериальными и грибковыми инфекциями. Такое состояние обусловлено нейтропенией (недостаточностью нейтрофилов).
Кроме того, признаками МДС могут быть:
- беспричинное повышение температуры, часто до высоких значений (38 °С и выше);
- снижение веса, уменьшение аппетита;
- гепатомегалия;
- спленомегалия;
- болевой синдром.
В ряде случаев МДС ничем себя не проявляет и обнаруживается случайно во время лабораторного исследования крови по другому поводу.
Диагностика
Основной метод диагностики МДС – лабораторный. При подозрении на миелодисплазию проводятся:
- Клинический анализ крови. При этом обнаруживается анемия (макроцитарная), ретикулоцитопения, лейкопения, нейтропения, при синдроме 5q – тромбоцитоз. Примерно у половины пациентов выявляется панцитопения.
- Биопсия костного мозга. Цитоз обычно в норме или увеличен, но примерно у 10% пациентов он снижен (гипопластический вариант МДС), есть признаки нарушенного гемопоэза одного или нескольких ростков кроветворения, может обнаруживаться повышенное содержание бластных форм, патологических сидеробластов (эритроциты, содержащие отложения железа). Для идентификации аномальных фенотипов проводят исследование иммунофенотипа костномозговых клеток, это позволяет проводить дифференциальную диагностику МДС и неклональных цитопений, что важно для прогноза.
- Цитогенетический анализ. У 40–70 % пациентов обнаруживаются клональные цитогенетические аномалии, особенно часто наблюдается делеция (моносомия) 7 хромосомы (7q), которая является прогностически неблагоприятной.
- Определение уровня железа и феритина в сыворотке. Уровни повышены.
- Определение эндогенного эриропоэтина (при Диагностика МДС проводится лабораторными методами
Для определения МДС разработаны специальные критерии, т. е. условия, при соблюдении которых ставится данный диагноз. Диагностические критерии следующие:
- 1-, 2- или 3-ростковыя периферическая (т. е. обнаруживаемая в периферической крови) цитопения;
- дисплазия: признаки нарушения гемопоэза не менее 10% клеток не менее одного кроветворного ростка;
- характерные цитогенетические изменения (наличие патологического клона).
Цитопения должна быть стабильной и наблюдаться в течение не менее шести месяцев, однако если обнаруживается специфический кариотип, или ей сопутствует дисплазия не менее двух ростков кроветворения, достаточно двух месяцев.
Для постановки диагноза должны быть исключены другие заболевания, сопровождающиеся клеточной дисплазией и цитопенией.
При выявлении цитопении без других признаков МДС диагностируют идиопатическую цитопению, значение которой не установлено; при выявлении дисплазии без цитопении – идиопатическую дисплазию, значение которой не установлено. При этом требуется постоянное наблюдение пациента с повторным исследованием костного мозга через 6 месяцев, поскольку оба этих диагноза способны прогрессировать до МДС и острого миелоидного лейкоза (или другого миелопролиферативного заболевания).
МДС дифференцируется со следующими заболеваниями:
- анемии (прежде всего, мегалобластическая, сидеробластическая и апластическая);
- острый миелоидный лейкоз;
- лейкопения с нейтропенией;
- первичная иммунная тромбоцитопения;
- клональный гемопоэз с неопределенным потенциалом;
- первичный миелофиброз;
- ВИЧ;
- тяжелая интоксикация различной этиологии.
Лечение
В 1997 году была разработана специальная шкала, называемая шкалой IPSS (International Scoring Prognostic System, Международная шкала оценки прогноза), разделяющая пациентов на группы риска. В соответствии с определенной группой риска выбирается лечебная тактика, и, что следует из названия, оценивается прогноз.
Баллы присваиваются с учетом трех факторов:
- количество бластных форм;
- количество пораженных кроветворных ростков;
- цитогенетическая категория.
Миелодиспластический синдром (МСД) – это тяжелая гематологическая патология, которая плохо поддается лечению и относится к группе онкологических заболеваний. Прогноз выживаемости для пациента зависит от степени и формы патологии. Реальный шанс сохранения жизни — радикальные терапевтические мероприятия на ранних этапах развития заболевания.

Описание
Патология опасна сбоем в системе миелоидного кроветворения и возникновением острого лейкоза. Риск развития опасной патологии растет с возрастом, имеется и гендерная зависимость. Чаще данный синдром выявляется у мужчин после 60 лет. Женщины реже болеют этим заболеванием. В детском возрасте миелодиспластический синдром практически никогда не встречается.
Справка! За последние годы статистические данные свидетельствуют о росте количества случаев заболевания у людей работоспособного возраста. Они связывают это с экологическим загрязнением окружающей среды.
Терапия данного синдрома проходит в отделении гематологии и онкологии. До недавнего времени лечение носило исключительно симптоматический характер, но в настоящий момент появились новые методики. Даже сегодня это заболевание остается одной из сложнейших проблем современной гематологии.
Чем опасна патология
Недостаток кровяных клеток приводит к развитию целого ряда опасных патологий: нарушение сердечно-сосудистого кровообращения, малокровие, различные заболевания инфекционной природы. Легче всего поддается лечению синдром, развившийся на фоне анемии. Пациенты в этом случае страдают от головокружений и хронической усталости.
Недостаток белых кровяных клеток приводит к тому, что больной становится крайне уязвимым для различных инфекций. Угнетение иммунитета приводит к развитию различных заболеваний, протекающих в тяжелой форме – от стоматита до пневмонии.
Поскольку недостаток тромбоцитов влияет на свертываемость крови, любая незначительная травма, вызывает обильную кровопотерю. В некоторых случаях травмы приводят к летальному исходу.
Причины и группы риска
Этиологию развития патологии ученые пока назвать не могут, но уже известны факторы, которые оказывают непосредственное влияние на развитие заболевания.
МДС идиопатического типа, то есть его первичная форма – это самый частый вид. В группе риска лица:
- подвергающиеся воздействию радиации;
- контактирующие с продуктами нефтяной промышленности, пестицидами, растворителями и прочими токсичными соединениями;
- злоупотребляющие курением;
- имеющие генетические заболевания, в том числе болезнь Дауна, нейрофиброматоз, анемию Фанкни;
- принимающие медикаментозные препараты, подавляющие иммунную систему;
- в пожилом возрасте.
Вторичная форма МСД встречается реже, всего в каждом 5-10 случае. Этот тип заболевания развивается в результате лечения онкопатологий химиотерапией.
Спровоцировать вторичный МДС могут следующие препараты:
- Циклофосфан;
- Топотекан;
- Иринотекан;
- Этопозид.
Классификации и виды
Во многих странах разработаны и утверждены собственные системы дифференцирования патологии.
Классификация миелодиспластического синдрома ВОЗ выглядит следующим образом:
- Анемия рефрактерного типа – данная форма может продолжаться более полугода. Характерна дисплазия эритроидного отростка костного мозга и отсутствие бластных кровяных клеток.
- Рефрактерная анемия с сидеробластами кольцевого типа.
- Цитопения рефрактерного типа с многолинейной дисплазией – изменения затрагивают незначительную часть клеток костного мозга (до 1/10 части). Бласты составляют 4-6%, в крови они практически никогда не наблюдаются. Фиксируется увеличение уровня моноцитов и снижение количества всех остальных клеток крови.
- Анемия рефрактерного типа с увеличением количества бластов-1 – нарушения касаются сразу нескольких клеточных уровней, концентрация бластов более 10%, в крови их содержание достигает 6%. Фиксируется увеличение уровня моноцитов.
- Форма миелодиспластического синдрома рефрактерной анемии с избытком блатов-2 – содержание бластных клеток в костном мозге достигает 20%, а в крови — 18%. Появляются тельца Ауэра.
- МДС-Н (не поддается классификации) – дисплазия фиксируется в одном ростке костного мозга. Бластных клеток в кровяном русле нет, в костном мозге их концентрация достигает 4%.
- МДС параллельно с изолированной 5q-делецией – в некоторых случаях фиксируется тромбоцитоз, чаще малокровие. В крови и в КМ имеются бласты (не более 6%).
Симптомы
Длительное время МДС протекает без видимых симптомов, его трудно дифференцировать от других заболеваний. Больные не обращают внимание на незначительные изменения здоровья и не торопятся с посещением врача. На ранних стадиях диагноз МДС обнаруживается во время плановых медосмотров.

- Анемический синдром – пациенты жалуются на быструю утомляемость и общую слабость, отсутствие аппетита, нарушения координации, одышку, костную и суставную боль, резкую потерю веса, нервозность, нарушение сердцебиения, обморочное состояние, тремор, гул в ушах и прочее.
- Нейтропения – наблюдается уязвимость организма к инфекциям – бактериям и вирусам, больные жалуются на повышение температуры, слабость, потливость, увеличение лимфоузлов. При возникновении у таких больных сепсиса и пневмонии прогноз крайне неблагоприятный.
- Тромбоцитопения – появляются гематомы, кровоточат десна, возникают частые носовые кровотечения, таким пациентам сложно остановить кровь даже после незначительных хирургических вмешательств.
- Признаком развития МДС являются гепатомегалия, лимфаденит, спленомегалия, лейкемиды – специфическое кожное поражение.
Диагностика
Для постановки диагноза специалисты используют следующие диагностические методы:
- Клинический анализ крови. В пробе крови определяется количество кровяных клеток, их форма и размер. Чтобы исключить анемию приводят исследование сыворотки крови, в ходе которого оцениваются запасы в организме железа, фолиевой кислоты, витамина В12, эритропоэтина – белка, который синтезируется в почках при низком уровне кислорода в тканях. Он стимулирует производство эритроцитов в костном мозге.
- Исследование аспирата костного мозга. В процессе выявляется процентное содержание бластов и клеток с признаками дисплазии, содержание железа в эритроидной серии клеток, хромосомные аномалии.

Применяются и визуальные методы диагностики, например, ультразвуковое исследование печени и селезенки. В тяжелых случаях эти органы увеличиваются.
В дальнейшем у больных проводятся повторные анализы, которые необходимы для определения клинического статуса патологии и для оценки эффективности проводимого лечения.
Лечение
Метод лечения зависит от возраста, состояния пациента и категории риска. В некоторых случаях терапия может не назначаться, поскольку требуется только динамическое наблюдение.
Радикальное лечение МДС – аллогенная трансплантация гемопоэтических стволовых клеток. Исход данного способа лечения зависит от совместимости донора и реципиента. Несмотря на то что это единственный способ, при котором возможно полное излечение пациента, его нельзя назвать 100% эффективным. Существует риск ранних и поздних осложнений.
Другие методы лечения:
- Индукционная терапия.
- Терапия Азатидином.
- Лечение Леналидомидом.
- Комбинированная иммуносупрессивная терапия.
- Переливание тромбоцитов, эритроцитарной массы.
- Терапия иммунодепрессивными препаратами.
- Низкодозная химиотерапия – Циторабин, Децитабин. Назначается молодым пациентам, у которых наблюдается высокий риск трансформации МДС в острый лейкоз назначают химиотерапию, она позволяет добиться длительной ремиссии.

Основная задача специалиста во время лечения миелодиспластического синдрома — облегчение состояния человека. Проблема заключается в угнетении работы костного мозга, поэтому используются средства для ее стимуляции. Усиливающий кроветворение препарат — Эритропоэтин. С его помощью можно устранить проявления анемии и всех связанных с ней негативных проявлений. Эффективный иммуностимулятор — препарат Ревлимид, который провоцирует синтез иммунных клеток, в результате чего прогноз заболевания несколько улучшается.
Так как при панцитопении защита организма существенно слабеет, оправдано использование антибактериальных препаратов широкого спектра действия для профилактики сепсиса.
Важно! Лечение синдрома методами народной медицины абсолютно бесперспективно.
Прогноз и профилактика
У пациентов из группы низкого риска средняя выживаемость достигает 6 лет после диагностирования заболевания, у пациентов из группы высокого риска – менее полугода. Пятилетней выживаемости можно добиться при проведении аллогенной трансплантации гемопоэтических стволовых клеток.
Поскольку точные причины возникновения МДС неизвестны, никаких специфических мер профилактики пока не разработано. Специалисты рекомендуют снизить влияние на организм факторов, которые способны спровоцировать патологию или ускорить ее течение.
Читайте также:

