Метастазами опухоли в сальник
Рак яичников с метастазами в сальник
Моей маме 78 лет. Она никогда ничем не болела, вела активный образ жизни. Но в начале апреля 2009 года у нее определили рак яичников с возможными метастазами в сальник. Положили ее в онкогинекологию, провели обследование, которое показало, что остальные органы здоровы. Давление нормальное, самочуствие хорошее, настроение бодрое.
Хирург назначил операцию, анестезиолог сказал, что операцию делать можно. Единственное, иногда (не каждый раз) наблюдается аритмия в сердце. Чтобы укрепить сердце, мы показали ее кардиологу, который выписал сердечные лекарства, которые мама пьет.
И вот теперь заведующий отделением запрещает делать операцию, мол подлечите сначала сердце, а после праздников, т.е. 11 мая, приходите снова, тогда может быть, сделаем операцию. Хотя анестезиолог сказал, что такая аритмия не является противопаказанием к операции, хирург тоже согласен делать операцию. А время идет! Ждать середины мая не хочется!
Чтобы не терять времени хирург предложил начать лечение химиотерапией. Но я очень волнуюсь, все таки мама старенькая, мне кажется, что ей трудно будет перенести химиотерапию. Мне кажется, что гораздо лучше было бы сделать операцию? Как Вы посоветуете?
С уважением, Белка.
Если она операбельна с точки зрения онкогинеколога и анестезиолога, лучше начать с операции, но химию проводить все равно придется, только поске операции.
Спасибо большое за совет, Владимир Борисович. Так мы и поступим. Подлечим ее сердце и после праздников положим на операцию.
С уважением, Белка.
Здравствуйте, Владимир Борисович.
15 мая сделали маме операцию, но к сожалению, от левого яичника пошли метастазы не только в сальник, но и по всему кишечнику, яичники матка и кишечник образовали конгломерат, поэтому удалить удалось только сальник.
На следующий день после операции ее перевели в палату, но у нее началась тошнота, поставили зонд в желудок через нос. 2 суток по зонду выходила желчь. Стимулировали кишечник, удалось восстановить проходимость кишечника. Сейчас ей гораздо лучше, тошнота прошла, давление нормальное. Кормим ее жидкой смесью Унипит. Может немного ходить по палате с поддержкой.
Хирург сказал, что со временем метастазы могут полностью перекрыть кишечник. Сказал, что назначит дробную химиотерапию, которая растворит эти метастазы, а потом можно будет сделать еще одну операцию, удалить их.
Я маме не сказала всей правды, сказала, что операция прошла успешно, но нужна последующая химиотерапия. У мамы настроение решительное, сильная воля к жизни. Деньги на лечение у меня есть.
Прошу Вас дать мне рекомендации:
Вопрос 1. Насколько целесообразно проводить химиотерапию и последующую операцию учитывая возраст 78 лет, какие шансы на выживание. Стоит ли мучить ее?
Вопрос 2. Если все таки продолжить лечение, какие лучше применять препараты химиотерапии, чтобы она легче перенесла их? Какие посоветуете лекарства, облегчающие химиотерапию?
P.S. Извините за большой текст, я старалась излагать только факты, без эмоций.
С уважением, Белка.
целесообразность химии и операции опеределяется функциональным статусом больной, букетом терапевтических заболеваний и многим другим, по интернету такое не определишь.
лучше всего для больной 78 лет наверное карбоплатин, возможно, в комбинации с таксолом. таксол часто вышибает из колеи пожилых больных, а карбоплатин переносится неплохо, когда назначается в правильной дозе.
Добрый день. Спасибо за советы, Владимир Борисович. Будем надеяться на лучшее.
С уважением, Белка.
Добрый день, Владимир Борисович.
Получила выписку с диагнозом:
C-r ovariorum St III (T3N1M0) Асцит. Метастаз в большой сальник. Канцероматоз органов брюшной полости.
Сопутствующие заболевания: Артериальная гипертензия III степени. ИБС стенокардия напряжения. ФК III. Диффузный кардиосклероз. XCH IIа. Хр. бронхит в ст. неполной ремиссии. ДН I.
15.05.09 произведена Циторедуктивная операция лапаротомия Оментэктомия. Дренирование брюшной полости.
Гистологическое исследование: Элементы папиллярной аденокарциномы. Послеоперационный период протекал без осложнений. Заживление раны первичным натяжением. Выписывается в удовлетворительном состоянии под наблюдение онкогинеколога.
После этого мама сдала анализ крови:
WBC лейкоциты 11,3
Ly% лимфоциты 25,6
МО моноциты 3,1
GR% гранулоциты Палочкоядерные 5
GR% гранулоциты Сегментоядерные 66,3
RBC эритроциты 4,3
Hgb гемоглобин 107 г/л
НСТ гематокрит 31,9
MVC средний объем эритроцитов ц/п 0,74
MCH среднее содержание гемоглабина в эритроците 24,7
MCHC средняя концентрация гемоглобина в эритроците 33,5
RDW показатель диапазона объема эритроците 14,7
PLT тромбоциты 466
PCT тромбокрит 0,358
PDW показатель объема тромбоцита 9,5
MPV средний объем тромбоцитов 7,7
СОЭ 39
Общий анализ мочи:
Количество 20,0
Цвет желт
Прозрачность сл/мутн
Удельный вес 1030
pH 5 кисл
Лейкоциты 10-12
Аскорбин к-та отсутствует
Белок следы
Глюкоза отсутствует
Кетоны отсутствуют
Уробилиноген норма
Билирубин отсутствует
Эритроциты отсутствуют
Слизь +
Соль ураты+++
Микрофлора мочи
- Бактерии +++
- Дрожжи отсутствуют
Цилиндры
- гиалиновые отсутствуют
- восковидные отсутствуют
- зернистые отсутствуют
Эпителий
- плоский 2-3
- переходный отсутствует
- почечный отсутствует
Кардиограмма:
Ритм синусовый регулярный с ЧСС 89 уд/мин.
Горизонтальное положение электрической оси сердца.
Снижение амплитуды Т в боковых отведениях.
Неспецифическое нарушение внутрижелудочковой проводимости.
Когда мы обратились к химиотерапевту, он отказал в лечении, обосновывая это возрастом больной (78 лет): проведение химиотерапии нецелесообразно и бесперспективно.
Таким образом, мама обречена на гибель. Мы не сказали маме, что во время операции не удалось ничего удалить, кроме сальника. Сегодня утром мама сказала мне, что продолжается покалывание в области левого яичника и мочевого пузыря, которое у нее было до операции "как будто ничего не удаляли" (!).
Я прошу у Вас совета: может стоит настаивать на химиотерапии? Чувствует она себя хорошо, готова перенести химиотерапию, даже уже подстриглась коротко. Ведь иначе мы лишим ее всякого шанса.
Различают первичные и вторичные (метастатические) опухоли брюшины.
Первичные доброкачественные и злокачественные опухоли (эндотелиома, псаммома) брюшины и сальника встречаются редко. Среди доброкачественных опухолей наблюдается фиброма, ангиома, лимфангиома, нейрофиброма и липома (чаще сальника). Среди злокачественных опухолей относительно чаще встречаются вторичные метастатические опухоли. Первичная злокачественная опухоль брюшины (эндотелиома, мезотелиома) наблюдается очень редко и диагностируется только при биопсии или на секционном столе. В этой группе обычно описывают и псевдомиксомы (скопление слизистых масс в толще брюшины).
Первичные раки брюшины отличаются от раков других органов прежде всего тем, что они диффузно распространяются по поверхности брюшины и не прорастают в органы. Прогноз обычно плохой, если опухоль не ограничивается одним сальником. В подавляющем большинстве случаев злокачественные опухоли брюшины бывают вторичными в результате прорастания из органов брюшной полости.
Метастатические (из яичника, желудка) раки имеют вид узелков, рассеянных на большой поверхности (карциноматоз). В животе при этом обычно наблюдается прозрачный, нередко кровянистый выпот. Клинически карциноматоз брюшины проявляется неприятными болевыми ощущениями в животе. При сращениях могут наблюдаться явления НК. Большое скопление жидкости в животе внешне проявляется увеличением живота, тупыми болями. Как правило, диагноз устанавливается только во время лапаротомии.
Различают ограниченное поражение брюшины (псевдомиксома) — скопление слизистых масс в брюшной полости, диффузное обсеменение ее псевдомиксомных разрастаний (псевдомиксоматоз брюшины) и псевдомиксоглобулез (накопление на брюшине слизевых масс).
Псевдомиксома носит имплантационный характер. Она образуется из первичного источника в яичнике или из 40. Слизь, попавшая на поверхность брюшины, прорастает соединительной тканью или инкапсулируется, в результате чего образуются множественные кисты. Часто таким процессом поражается также сальник. Разорвавшиеся кисты продолжают продуцировать слизь, в результате чего увеличивается объем живота.
В большинстве случаев правильный диагноз ставится только во время операции. При разрыве озлокачествленной слизистой кисты вместе со слизью на брюшину попадают жизнеспособные эпителиальные клетки, которые имплантируются в нее и становятся источником образования слизи. Псевдомиксомы по клиническому течению часто являются злокачественными.
Клиника и диагностика. Заболевание может протекать с симптомами хронического аппендицита или опухоли желудка. Нередко единственным признаком является увеличение живота. Диагноз ставится на основании наличия в животе тупости, не смещающейся при перемене положения тела, что позволяет предположить слизистый характер жидкости. Для диагностики широко применяется лапароскопия, РИ с использованием пневмоперитонеума. Но окончательный диагноз дает лишь биопсия операционного материала.
Лечение хирургическое. Доброкачественные опухоли удаляют в пределах здоровых тканей. При карциноматозе брюшины оперативное лечение невозможно. При локализованных формах мезотелиомы радикальное удаление опухоли дает излечение больного. При диффузных формах оперативное лечение не показано.
Прогноз при карциноматозе брюшины неблагоприятный. При доброкачественном течении заболевания после операции можно рассчитывать на выздоровление, при злокачественном — операция не предотвращает дальнейшее накопление слизи.
Перейти к списку условных сокращений
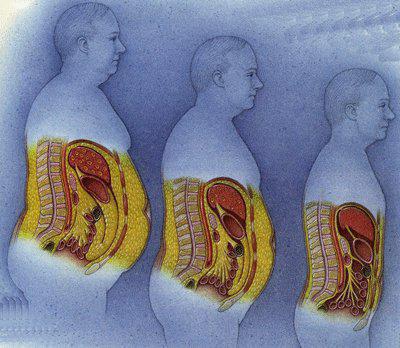
Жировые клетки сальника, большой жировой прокладки, покрывающей кишечник, питают раковые клетки яичника и, тем самым способствуют быстрому распространению процесса. Жировые клетки сальника чрезвычайно богаты высокоэнергетическими жирами, обеспечивающими злокачественные клетки питательными веществами и энергией для быстрого роста опухоли.
Рак яичников находится на пятом месте среди причин смерти от злокачественных опухолей у женщин. Этот тип злокачественной опухоли имеет тенденцию преимущественно образовывать метастазы в сальнике, а не в отдаленных органах. У большинства женщин к моменту постановки диагноза злокачественной опухоли уже имеются метастазы в сальник, и зачастую опухолевые конгломераты в нем значительно больших размеров, чем первичное новообразование.
Для того чтобы попытаться больше узнать о роли жировых клеток в метастазировании рака яичников, ученые выполнили ряд экспериментов на культуре клеток овариального рака у живых мышей.
Когда в брюшную полость здоровых мышей вводили овариальные клетки злокачественной опухоли, им требовалось всего 20 минут, чтобы достигнуть сальника. Исследователи обнаружили, что в сальник овариальные раковые клетки привлекал межклеточный сигнальный белок адипокин. Когда эти сигналы были заблокированы, миграция уменьшилась более чем в два раза.
Как только опухолевые клетки достигали сальника, они немедленно приступали к реализации механизмов, позволяющих им использовать питательные вещества и энергию жировой ткани. Как оказалось, опухолевые клетки перепрограммируют метаболизм жировых клеток, запуская прямую передачу липидов от адипоцитов овариальным раковым клеткам.
При исследовании культуры клеток в лабораторных условиях также было подтверждено, что в качестве источника энергии раковые клетки в состоянии использовать и сами жировые клетки. При совместном культивировании в жировых клетках активируется распад жировых накоплений, а в раковых клетках окисление, что означает, что жировые клетки выступают в качестве источника энергии для опухолевых клеток.
Также было обнаружено, что связывающий жирные кислоты и ответственный за их транспорт в клетку белок может играть важную роль в злокачественном процессе и быть потенциальной целью для терапии рака яичников.
Сравнивая клетки первичной опухоли и её метастазов в сальник, ученые заметили, что рядом с жировыми клетками в сальнике раковые клетки выделяли высокие уровни специфического белка, тогда как вне сальника клетки его не продуцировали. Ингибирование этого белка значительно снижало транспорт питательных веществ из жировых клеток в метастазы рака яичников в сальнике. Это существенно замедлило рост метастатических очагов и их способность к прорастанию новых сосудов в опухоль.
Ученые предполагают, что жировой обмен может также быть существенным фактором и при других вариантах злокачественных опухолей, где также присутствует богатый источник жировых клеток, таком как рак молочной железы.
Данное исследование наталкивает на мисль, что необходимо проводить тщательное исследование всех возможных источников опухолевого процесса. Часто онкологи подобные одиночне, случайно выявленные образования в сальнике склонны наблюдать. Но подобные образования как раз не наблюдают, а оперируют с целью гистологического исследования и подтверждения рака яичников, определения дальнейшей тактики лечения пациентки.
Задать вопрос врачу онкологу
Диагностка и лечение онкологии в медицинских центрах Израиля подробная информация
Подпишитесь на рассылку Новости онкологии и будьте в курсе всех событий и новостей в мира онкологии.

Метастазы в брюшине могут развиться при всех злокачественных процессах, но при раке яичников и желудка — это типичная и самая частая локализация. В большинстве случаев метастазирование в брюшной полости отсекает возможность радикального хирургического лечения, только больные раком яичников находятся в выигрышном положении — их активно и результативно оперируют.
- Механизм формирования метастазов
- Пути распространения метастазов
- Способы диагностики метастазов
- Какой рак может дать метастазы в брюшину?
- Симптомы возникновения метастаз в брюшине
- Что делать, если пошли метастазы в брюшной полости?
- Лечение метастаз в брюшине
- Прогноз при метастазах в брюшине
Механизм формирования метастазов
Механизм образования метастазов — одна из основополагающих характеристик злокачественного процесса. Метастатический узел образуется из одной злокачественной клетки, получившей способность жить без помощи материнской опухоли и выживать на удалении от неё. К путешествию по организму злокачественную клетку понуждают образующиеся в ней и в её окружении специфические белковые комплексы — факторы роста опухоли.
В кровеносном и лимфатическом русле больного раком циркулирует огромное число злокачественных клеток, 99.9% которых погибает. Мизерное число злокачественных клеток находит приют в небольших сосудах разных органов, образуя там фиксированный раковый эмбол. По какому-то сигналу начинается размножение раковых клеток, образующих микроскопическое злокачественное сообщество, разъедающее стенку сосуда своими ферментами. Дальше клеточная группа внедряется в здоровую ткань, чтобы сначала стать микрометастазом, а после и клинически определяемым метастатическим узлом.
Пути распространения метастазов
Серозные листки организма, к которым относятся брюшина, плевра и сердечная сумка — перикард восприимчивы к опухолевым клеткам, которые попадают на них несколькими путями:
- в разветвленную сеть кровеносных сосудов внутренних органов раковые эмболы приносятся с кровотоком — гематогенное метастазирование;
- лимфатическая сеть брюшины вырабатывает влагу для исключения трения внутренних органов при дыхательных движениях, создавая отличные условия для приживления заносимых лимфой злокачественные клеток — лимфогенное метастазирование;
- лимфогематогенный путь предполагает сочетанное действие двух описанных патогенетических механизмов;
- клетки отрываются от ракового конгломерата внутреннего органа и путешествуют вместе с внутрибрюшной жидкостью, контактно внедряясь в подходящий по условиям участок серозной оболочки — это имплантационный вид распространения.
В большинстве случаев действуют все механизмы метастазирования.
Способы диагностики метастазов
Диагностика зависит от анатомической области:
- метастатические образования в коже и мягких тканях определяются на ощупь — при пальпации, их границы хорошо видны при УЗИ;
- в легких метастазы находят при рентгене, КТ и МРТ, также и в костях, но совсем крошечные очаги обнаруживают только при сцинтиграфии;
- в органах брюшной полости метастазы обнаружат УЗИ, КТ и МРТ, в желудочно-кишечном тракте большую пользу приносят эндоскопические методы обследования;
- очаговые метастатические образования в головном мозге выявляет МРТ и КТ;
- в любом месте опухолевый очаг найдет изотопное исследование — ПЭТ.
Какой рак может дать метастазы в брюшину?
Любой рак может осложниться метастазами в брюшину, но самый высокий процент отмечается при карциномах яичников, желудка, толстой кишки и поджелудочной железы.
Уже на 1-2 стадиях карциномы яичников в брюшной полости находят свободно циркулирующие раковые клетки, при 3 стадии на листках брюшины развиваются видимые метастазы разных размеров.
При карциномах всех других органов метастазы переводят процесс в неоперабельный и констатируется 4 стадия, радикальное лечение невозможно, но при случае и с пользой для пациента может выполнятся циторедукция — удаление всех видимых опухолевых образований.
Симптомы возникновения метастаз в брюшине
Клинические проявления внутрибрюшинного метастазирования часто протекают скрытно — где-то кольнуло, что-то потянуло, какая-то непонятная слабость. Симптомы появляются при значительном увеличении живота в размере за счёт образования в полости избыточного количества жидкости — асцита. Опухолевые узлы на листках брюшины находят только при УЗИ, КТ или МРТ.
Нередко прогрессирующее опухолевое поражение брюшины так и остается бессимптомным, на первый план выходят признаки накопления внутрибрюшной жидкости и вызываемые асцитом симптомы сердечно-легочной недостаточности: одышка, отеки нижней половины тела, застой в легких, кашель, нарушение сердечной деятельности, слабость. Болевой синдром, как правило, очень слабый.
Что делать, если пошли метастазы в брюшной полости?
При раке яичников с сохраненной подвижностью опухолевого конгломерата в малом тазу обязательно предложат циторедуктивную операцию, при которой убирается всё опухолевое, что можно удалить, и метастатические узелки буквально срезаются с брюшины. Цель циторедукции — удалить всю злокачественную ткань по максимуму, узелки меньше сантиметра эффективно уничтожаются лекарствами. Далее больной предстоит длительная химиотерапия с производными платины и таксанами.
При других нозологических формах рака метастазирование отрезает путь к радикальной операции, только паллиативные вмешательства по поводу осложнений и создания обходящих опухоль путей для беспрепятственного движения пищевых или каловых масс, больному предстоит системная и локальная — внутрь брюшной полости химиотерапия.
Лечение метастаз в брюшине
Системная химиотерапия помогает при чувствительных к цитостатикам злокачественных процессах: раке молочной железы, лимфомах. Карциномы органов желудочно-кишечного тракта неактивно отзываются на лекарственное лечение, но нельзя не использовать возможность их уменьшения, особенно при агрессивных быстро прогрессирующих процессах.
При раке желудка предлагается 18 недель химиотерапии, при опухоли толстой кишки — не менее 4 месяцев, при панкреатической карциноме — до прогрессирования заболевания. Схема определяется состоянием пациента, тяжелым больным проводится симптоматическое лечение при необходимости с эвакуацией асцита.
Повысить противоопухолевый эффект химиотерапии удается при локальном введении цитостатика — внутрибрюшинно. При необходимости частых введений цитостатика внутрь полости устанавливается порт-система, исключающая тягостные симптомы классического лапароцентеза. Сложности неизбежны, поскольку постоянная выработка асцитической жидкости снижает концентрацию химиопрепарата, а тяжесть состояния ограничивает спектр цитостатиков.
Прогноз при метастазах в брюшине
Прогноз определяется чувствительностью злокачественных клеток к лекарствам, но в любом случае метастазирование по брюшине относится к самым неблагоприятным, исключая рак яичников. При карциномах кишки, когда удаётся провести паллиативную операцию и максимально удалить метастатические новообразования, трёхлетняя выживаемость приближается к 20%, 2 года переживает только каждый третий. Проведение химиотерапии улучшает выживаемость, но она хуже, чем при метастазах другой локализации.
В нашей клинике никогда не отступают перед раком, предлагая пациенту оптимальные и все известные онкологии методики противоопухолевого воздействия. Мы не ограничиваемся одним оружием, используя комбинацию лекарств, паллиативных вмешательств и неинвазивных методик. Наша цель — сохранить и улучшить жизнь наших пациентов, и нам это удается.
Практически все органы человеческого тела покрыты тонкой прозрачной тканью, которая предотвращает трение их друг об друга, выполняет трофическую функцию, адсорбирует избыток жидкости и способствует поддержанию постоянства внутренней среды. Эта ткань называется брюшиной, и в некоторых местах, например по передней поверхности кишечника, она формирует что-то наподобие фартука.
Большой и малый сальник
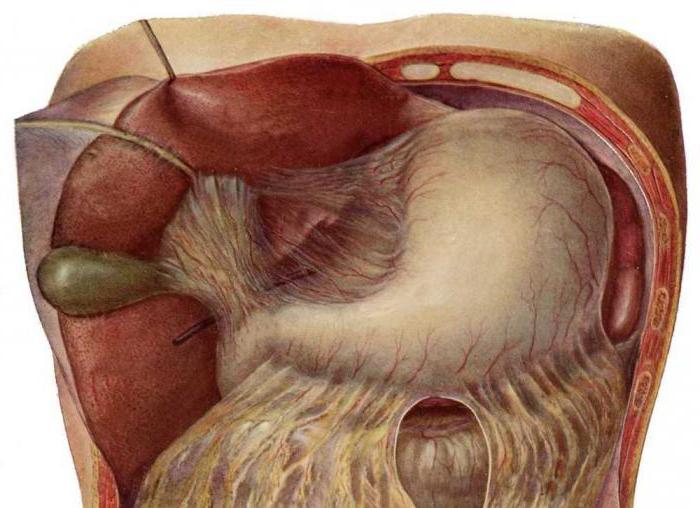
В процессе эволюции человек встал на ноги, и это сделало беззащитным его живот и внутренние органы. Для того чтобы уменьшить их возможную травматизацию, образовался дополнительный орган. Большой сальник - это дубликатура брюшины (четыре листка), которая начинается от боковой поверхности желудка и спускается к поперечно-ободочной кишке. Этот участок анатомы называют желудочно-кишечной связкой. В ней проходят сосуды и нервы. Свободный край сальника спускается ниже и, как фартук, покрывает петли тонкого кишечника. Дубликатура брюшины также идет и позади поперечно-ободочной кишки, вплетаясь в брыжейку, а затем и в париетальную брюшину.
- печеночно-двенадцатиперстная (начинается от ворот печени до горизонтальной ветви двенадцатиперстной кишки);
- печеночно-желудочная (от печени до малой кривизны желудка);
- связка диафрагмы.
Сальниковая сумка
Это большая щель, образованная брюшиной. Впереди сумку ограничивают задняя стенка желудка, малый и большой сальник (желудочно-кишечная связка). Сзади расположен париетальный листок брюшины, участок поджелудочной железы, нижняя полая вена, верхний полюс почки и надпочечник. Вверху находится хвостатая доля печени, а снизу – брыжейка поперечно-ободочной кишки.
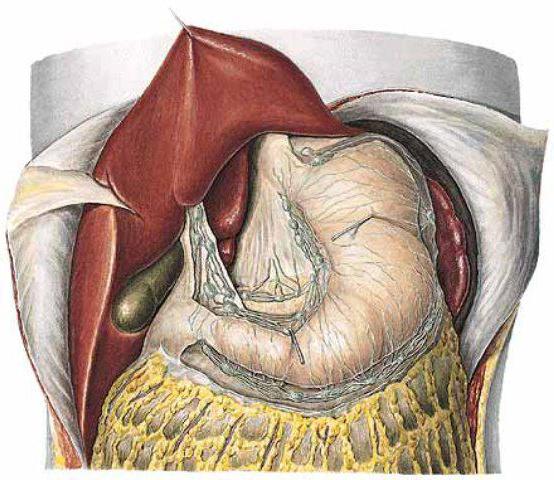
В сальниковой сумке имеется полость, названная отверстием Винслови. Значение данного органа, как и всего остального сальника, сводится к тому, что при ранениях брюшной полости он закрывает повреждения, не давая инфекции распространяться по организму, а также предотвращает эвентрацию органов. Если возникает воспалительный процесс, такой как аппендицит, то сальник спаивается с висцеральной брюшиной и ограничивает орган или его часть от остального пространства брюшной полости.
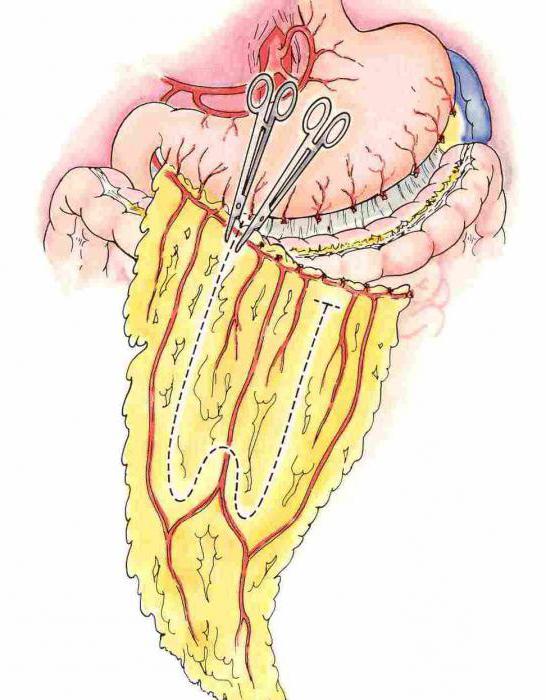
Удаление сальника
Удаление большого сальника – это не самостоятельная операция, а часть лечения онкологических заболеваний кишечной трубки. Этот шаг делается с целью уничтожить все метастазы, которые в большом количестве обнаруживаются в толще брюшины. Удалять их по одному не целесообразно.
Важной особенностью является то, что брюшная полость вскрывается широким продольным разрезом, чтобы открыть хороший доступ в операционную рану. Если большой сальник удаляется через поперечный доступ, то есть опасность оставить пораженный участок и спровоцировать рецидив заболевания. Для организма не будет никаких последствий после удаления этого органа.
Опухоли сальника
Существует такое понятие, как первичные опухоли сальника. Они бывают доброкачественными (кисты, дермоиды, липомы, ангиомы, фибромы и прочие) и злокачественными (саркомы, эндотелиомы, рак). Вторичные образования проявляют себя метастазами из желудка или кишечника, а также любого другого органа. В терминальной стадии заболевания большой сальник густо покрыт измененными лимфоузлами и новообразованиями. Он принимает вид сморщенного валика и легко определяется при глубокой пальпации брюшной стенки. Это явление может вызывать непроходимость кишечника.
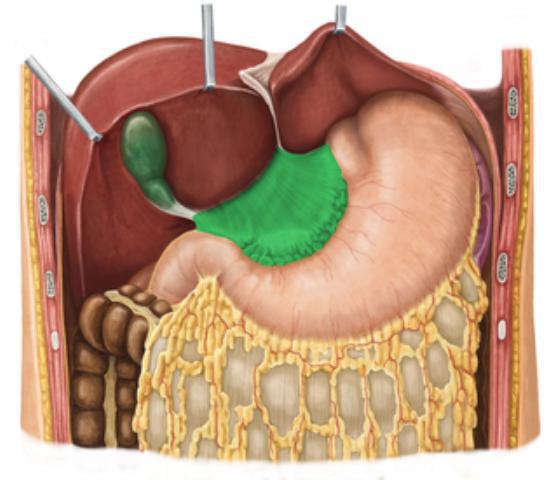
Доброкачественные опухоли сальника – явление достаточно редкое. Они не причиняют дискомфорта пациентам, поэтому могут достигать значительных размеров. Диагностировать их трудно: нет специфических симптомов, маркеров и каких-либо других индикаторов. Из злокачественных опухолей наиболее часто встречаются саркомы. Они проявляют себя синдромом интоксикации, а также задержкой стула и потерей веса. Эти настораживающие признаки должны натолкнуть врача на мысль об онкологическом заболевании.
Синдром натянутого сальника
Сальники большого диаметра появляются из-за развивающегося воспалительного процесса. Участки органа срастаются с брюшиной в различных областях брюшной полости и растягивают его. Такие спайки могут развиться после оперативного вмешательства, при хронических воспалениях мочеполовой системы.
Растяжение сальника вызывает боль и нарушает проходимость кишечной трубки. Чаще всего больные предъявляют жалобы на постоянную боль в области пупка и над лоном после еды, а также вздутие живота и рвоту. Характерным симптомом заболевания является усиление боли, если пациент пытается прогнуться назад. Окончательный диагноз ставится после ультразвукового исследования, компьютерной томографии, рентгенограммы. Идеальный вариант для диагностики – лапароскопическая операция. При необходимости доступ можно расширить и удалить спайки.
Киста сальника
Киста возникает из-за обтурации лимфатических сосудов или в результате разрастания облитерированного участка лимфоидной ткани, который не связан с общей системой. Кисты эти напоминают тонкие круглые мешочки, наполненные прозрачной жидкостью. Величина их может варьироваться от пяти миллиметров до нескольких сантиметров. Заболевание никак себя не проявляет, но когда образование достигает значительных размеров, его можно прощупать через переднюю брюшную стенку.
Лечение этой патологии исключительно хирургическое. Удаляют кисты и область сальника, сохраняя большую его часть. Прогноз для таких больных благоприятный.
Аннотация научной статьи по клинической медицине, автор научной работы — Халикова Л. В.
В обзоре освещена анатомия, структурная организация и защитные свойства большого сальника . Обсуждаются свойства, строение и состав млечных пятен, которые играют определенную роль в фомировании метастазов . Рассмотрена клиническая значимость большого сальника в онкологии.
Похожие темы научных работ по клинической медицине , автор научной работы — Халикова Л. В.
GREATER OMENTUM: MORPHOFUNCTIONAL CHARACTERISTICS AND CLINICAL SIGNIFICANS IN ONCOLOGY
The review highlights the anatomy,structural organization and protective properties of the greater omentum . Discusses the properties, structure and composition of the milky spots , which play a role in formining metastasis . Reviewed clinical significans of greater omentum in oncology.
БОЛЬШОЙ САЛЬНИК: МОРФОФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ И КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ
ГБОУ ВПО Башкирский Государственный медицинский университет,
кафедра хирургии и онкологии с курсами онкологии и патологической анатомии
ГБУЗ Республиканский клинический онкологический диспансер, г. Уфа
Халикова Лариса Вячеславовна, аспирант кафедры хирургии
и онкологии с курсами онкологии и патологической анатомии,
450075, Россия, Республика Башкортостан,
г. Уфа, пр. Октября, д. 73/1,
тел. 8 (347) 237-43-58,
В обзоре освещена анатомия, структурная организация и защитные свойства большого сальника. Обсуждаются свойства, строение и состав млечных, пятен, которые играют определенную роль в фомировании метастазов. Рассмотрена клиническая значимость большого сальника в онкологии.
Ключевые слова: большой сальник, млечные пятна, метастазы, раковые клетки.
GREATER OMENTUM: MORPHOFUNCTIONAL CHARACTERISTICS AND CLINICAL SIGNIFICANS IN ONCOLOGY
Bashkir State Medical University, Surgery and Oncology Chair with oncology and pathanatomy courses Clinical oncology dispensary, Ufa
The review highlights the anatomy structural organization and protective properties of the greater omentum. Discusses the properties, structure and composition of the milky spots, which play a role in formining metastasis. Reviewed clinical significans of greater omentum in oncology.
The key words: greater omentum, milky spots, metastasis, cancer cells.
Рецидивы с локализованными формами злокачественных опухолей яичников возникают у 20-30% больных [13].
Основными методами лечения рака яичников являются комбинированный и комплексный методы, включающие в себя хирургическое вмешатель-
ство, химио- и лучевую терапию [3]. Хирургическое лечение выполняется в объеме ампутации матки с придатками, а также резекции большого сальника [3]. По некоторым данным метастатическое поражение большого сальника при раке яичников занимает второе место и доходит до 80% [4]. Пораженный метастазами, сальник вызывает комплекс симптомов, отягощающих состояние больных. Иногда большой сальник представляет сплошной опухолевый инфильтрат, превышающий массу первичной опухоли и является постоянным источником дальнейшего метастазирования [4]. Очевидно, что большой сальник играет большую роль в процессе диссеминации рака яичников [4]. Несмотря на большое количество научных и клинических данных о хирургическом лечении злокачественных новообразований яичников, остается дискутабельным ряд вопросов, касающихся удаления макроскопически
неизмененного большого сальника. Объемы омен-тэктомии так же остаются спорным вопросом в онкологии [3, 7, 19, 20]. Так, J. Wharton (1976) писал, что остается недоказанным тот факт, что оментэк-томия улучшает выживаемость в случаях макроскопически неизмененного сальника, и рекомендовал удалять его лишь при наличии видимых метастазов [4]. M. Reshchyshyn и соавт. (1978) считали, что при 1а и 1в стадиях оментэкомия необязательна, но полагали необходимой дальнейшую оценку пользы удаления сальника [4].
Существует обратное мнение о том, что частичная или полная оментэктомия является неотъемлемой частью хирургического вмешательства при раке яичников [4]. А.И. Серебров (1965) полагает, что если во время операции оставить сальник, то рано или поздно в нем появятся метастазы [4]. S.E. Order и соавт. (1982) видят целесообразность омен-тэктомии для адекватного стадирования, а так же рекомендуют удаление червеобразного отростка в ввиду возможности выявления в нем микрометастазов [4].
Имеется несколько путей метастазирования рака яичников: гематогенный, лимфогенный и им-плантационный.
Гематогенная диссеминация имеет место при образовании отдаленных метастазов в эндометрии, печени, головном и костном мозге, легких, костях и коже. В то же время практически отсутствуют изолированные гематогенные метастазы.
Лимфогенное метастазирование наблюдается не у каждой больной. Так, по данным И.Д. Нечаевой и Д.Г. Котовой (1972), метастатическое поражение тазовых лимфатических узлов обнаружено у 9 из 18 больных [4]. Лимфографические исследования некоторых авторов показали, что при злокачественных опухолях яичников метастатическое поражение лимфоузлов бывают значительно чаще, чем распознаются клинически.
Топография большого сальника и его тесная взаимосвязь с соседними органами брюшной полости способствуют распространению опухоли [4,6,10]. Основанием для предположения имплантацион-ного пути метастазирования явились такие особенности большого сальника, как резорбция жидкости из брюшной полости [10]. Образующаяся при раке яичников асцитическая жидкость содержит раковые клетки. Массивность имплантационного метастазирования не оставляет шансов для реализации гематогенного и лимфатического путей [4,14,31,32]. Интактные лимфатические узлы брюшной полости при наличии метастазов в большом сальнике также говорят об имплантационном механизме [9,14,30]. Однако до сих пор отсутствуют убедительные данные о преимуществе какого-либо из вышеназванных путей метастазирования в большой сальник.
В последнее время некоторые авторы высказывают мнение о том, что особую роль в метастазиро-вании в большой сальник играют млечные пятна, являясь при этом неким барьером для распространения опухолевого процесса [6,10, 23]. Проведен ряд исследований, в ходе которых обнаружено, что
В то же время проведен ряд исследований, в ходе которых обнаружилось, что выживаемость больных раком яичников выше у тех лиц, у которых хирургическое лечение проводилось в режиме: ампутация матки с придатками + оментэтомия + лучевое лечение [14].
Есть мнение и о том, что оментэктомия ведет к сокращению титра антител и к заметному снижению сопротивляемости организма [1]. Являясь мишенью для метастатического поражения при злокачественных опухолях яичника с одной стороны, большой сальник является иммуннокомпетентным органом с другой [1,15].
В дальнейшем исследовалась структура этих пятен, в них были выявлены фагоцитирующие клетки [24]. Впервые дифференцировали млечные пятна от лимфатических узлов в 1920 году [31]. По мнению Seifert, их отличие от лимфоузлов заключается в том, что лимфатический узел имеет капсулу, содержит синусы и ростковый центр, а млечное пятно лишено этого, но обладает собственной капиллярной сетью и имеет специфический клеточный состав, а также покрыто специализированным мезотелием. Строму млечного пятна составляют мезотелиальные и ретикулярные клетки, которые легко дифференцируются.
В зависимости от возраста и общего состояния органов брюшной полости и организма в целом, меняется клеточный состав пятна [10]. Учитывая данные о строении этих пятен их стали считать ретикулоэндо-телиальной системой [31]. Скопления лимфоидной ткани в большом сальнике и считались млечными пятнами, функция которых рассматривалась в связи с лимфатической системой [36].
Функции млечных пятен
Млечные пятна - это специализированные образования, участвующие в специфических иммунологических реакциях. Клетки, входящие в состав млечного пятна, осуществляют фагоцитоз инородных структур, поглощают бактерии, микрочастицы и различные красители, а также синтезируют антитела [10]. Благодаря этому сальник имеет способность к очищению брюшной полости. Считается, что млечные пятна также участвуют в резорбции жидкости брюшной полости [2].
Млечные пятна имеют овоидную, округлую или неправильную форму, непрозрачны, белесоваты, бледно-желтого цвета и очень похожи на жировые скопления [10]. Их можно легко увидеть на сальнике новорожденного и детей раннего возраста [18].
Площадь млечного пятна составляет 0,5-3,5 мм. Число их не постоянно и индивидуально. Млечные пятна встречаются на всей поверхности большого сальника, но вдоль сосудов и разветвлений их концентрация возрастает. Выделяют 3 типа млечных пятен: первичные (у новорожденных и детей до 5 лет), пассивные (содержат жировые клетки) и активные вторичные [31] . Каждый тип имеет свой клеточный состав. Первичные млечные пятна содержат большое количество недифференцированных мезенхим-ных клеток и почти не имеют жировых клеток [10].
У пассивных млечных пятен количество мезен-химных клеток уменьшается, зато возрастает количество жировых, вследствие чего происходит трансформация млечного пятна в жировую ткань. При этом сохраняется капиллярная сеть и малое количество мезенхимных клеток.
При различных повреждениях или воздействиях химических, биологических, бактериологических агентов происходит активация млечных пятен. При активации млечного пятна оно увеличивается в размерах, исчезают жировые клетки, и появляются такие клеточные элементы, как макрофаги, лимфо-
циты и плазматические клетки, иногда встречаются недифференцированные мезенхимальные клетки и фибробласты [31]. Некоторые авторы обнаружили сходство в структуре млечных пятен с лимфатическими узлами, наблюдаемыми после антигенной стимуляции [35]. Эти изменения обратимы, но, в конечном счете, при постоянном превращении пассивного пятна в активное оно кальцифицируется, фиброзируется, и происходит дегенерация капилляров. А в пожилом возрасте это и вовсе становится обычным явлением [10].
В составе млечных пятен были обнаружены многочисленные макрофаги, лимфоциты, плазматические, тучные клетки. Благодаря своему клеточному составу и стабильной структуре они являются источником выхода свободных макрофагов и лимфоцитов в брюшную полость с дальнейшим фагоцитозом и образованием антител [25, 31].
В начале века были представлены работы, указывающие на обильное содержание в большом сальнике лимфатических сосудов, объясняя тем самым его высокую резорбционную способность [1.Вготап 1904]. Предпологали также и то, что есть две группы лимфатических узлов, находящихся на поверхности и сообщающихся с соковыми канальцами Реклинга-узена [I. Norris, 1908]. Вместе с тем существовала и другая точка зрения, которая отрицала наличие лимфатических сосудов в большом сальнике [22].
В настоящее время развивается концепция о статусе большого сальника как иммунокомпетент-ного органа [1]. Впервые опубликованы сведения о его реакции на инородное тело и фагоцитозе в 1895 году [26]. А в 1898 году появились первые научные подтверждения данного факта [29]. Год спустя было проведено исследование, установившее миграционные свойства сальника [24]. Образование антител в сальнике впервые было установлено Рог^ В. в 1924 г. Им был исследован фагоцитоз под воздействием инородных тел в млечных пятнах [27]. Далее его мысль была продолжена в других работах, где было обнаружено, что интраперитонеальное введение антигена вызывало увеличение антител. Вскоре установили, что продуцирование антител происходит в млечных пятнах, которые возрастают в количестве после воздействия антигена [35].
Анатомо-физиологические свойства большого сальника на протяжении многих лет привлекают внимание врачей различных специальностей: хирургов, трансплантологов, маммологов, кардиохирургов, онкологов. Активное участие в защитных реакциях организма и пластические свойства позволяют широко использовать в реконстуктивных операциях. Тем не менее, не до конца ясна роль большого сальника при злокачественных новообразованиях яичников.
В заключение необходимо подчеркнуть функциональное многообразие и уникальность большого сальника для организма онкобольного. Все вышесказанное ставит врача- онколога во время операции перед тщательным выбором и дифференцированным подходом при любых манипуляциях на большом сальнике.
1. Березовская С.Э., Марков И.И. Функциональная анатомия большого сальника как иммуноком-петентного органа // Физиология вегетативной нервной системы. - 1988. - №5. - С.17-18.
2. Борисов А.В. Лимфатические капилляры и сосуды млечных пятен большого сальника человека // Арх. анат. - 1963. - №3. - С. 115-120.
3. Бохман Я.В. Руководство по онкогинекологии.
- СПб.: Фолиант, 2002. - 542 с.
4. Винокуров В.Л. Рак яичников: закономерности метастазирования и выбор адекватного лечения больных. - СПб.: Фолиант, 2004. - 336 с.
5. Гатауллин Н.Г., Ганцев Ш.Х., Хунафин С.Н. Диагностика и лечение заболеваний большого сальника. - Уфа: Башк. кн. изд-во, 1988. - 96 с.
6. Жетимкаримов Д.С., Островский В.К. Анатомия и хирургия большого сальника и связок желудка. - Ульяновск: СВНЦ, 1999. - 100 с.
7. Жорданиа К.И. Злокачественные эпителиальные опухоли яичников // Современная онкология.
- 2000. - № 2(2). - С.15-23.
8. 3уфаров К.А., Тухтаев К.Р. Органы иммунной системы (структурные и функциональные аспекты).
- Ташкент: Фан, 1987. - 184 с.
9. Колосов А.Е. Опухоли яичников и прогноз для больных. - Киров, 1996. -240 с.
10. Либерман-Мефферт Д. Большой сальник: Пер. с англ. Д. Либерман-Мефферт, Х.М. Уайт. - М.: Медицина, 1989. - 336 с.
11. Макурина О.Н. Сосудистые конструкции и иммунные структуры большого сальника человека // Вестник Самарского Гос. Университета. - 2002. -№4(22). - C. 199.
12. Нечипоренко Ф.П Анатомические варианты большого сальника и их практическое значение в хирургии // Нов. хир. арх. - 1957. - №3. - С. 45-50.
13. Новикова Е.Г. и соавт. Органосохраняющие лечение больных злокач. неэпит. опухолями яичников I ст. // Материалы VI Российской онкологической конференции. - М., 2002.
14. Новикова Е.Г., Шевчук А.С., Пронин С.М. Резекция большого сальника у больных со злокачественными опухолями яичников // Рос. Вест. Ак.- Ги-нек. - 2005. - № 4. - С. 36-40.
15. Новикова Е.Г., Чиссов В.И., Чулкова О.В. и др. Органосохраняющее лечение в онкогинеколо-гии. - М.: ВИДАР-М, 2000. - 105 с.
16. Ромодановский К.В. Молочные пятна брюшины собаки // Проблемы морфологии - 1958. -№3. - С. 59-65.
17.Черенков В.Г., Байдо С.В., Иванченко В.В., Субботина О.Ю. Хирургические аспекты лечения злокачественных опухолей яичников // Новые подходы к скринингу, диагностике и лечению опухолей яичников // Матер. науч.-практ. конф. - Великий Новгород, 2001. - C. 112.
18. Шифрин В.И. Хирургическая анатомия большого сальника у детей раннего возраста // Вестн. хир. - 1966. - №7. - С. 130-132.
19. Brigewater J.A., Rustin G.J. Management of non-epithelial ovarian tumors // Oncology. - 1999. -Vol. 57(2). - P. 89-98.
20. Bristow R.E. Surgical standards in the management of ovarian Cancer // Curr Opin Oncol. - 2000. -Vol. 12(5) - P. 474-480.
21. Ellis H. The aetiology of post-operative abdominal adhesions(an experemental study) // Br.J.Surg.1962. -Vol.50. - P. 10-16.
22. Lambert F.G., Milky spots in the greater omentum // Cancer Immunol Immunother. - 1998. - Vol.47.
23. Liebermann-Meffert D. The greater omentum. Anatomy, embryology, and surgical applications // Surg Clin North Am. - 2000. - Vol.80. - P. 275-293.
24. Milian G.La mobilite defensive de l epiploon // Gaz.Hop. - 1899. - Vol.72. - P. 681-686.
25. Mironov V.A., Gusev S.A.,Baradi A.F. Mes-othelial stomata overlying omental milky spots:scan-ning electron microscopic study // Cell. Tiss. - 1979.
- Vol.201. - P. 327-330.
26. Muscatello G. Ueber den Bay und das Aufsau-gungsvermogen des peritonaum // Virchows Arch. -1895. - Vol.142. - P. 327-357.
27. Ohtsuka H, Shioya N. The fate of free omental transfers // Br J Plastic Surg. - 1985. - Vol.38. - P. 478482.
28. Portis B. Role of omentum of rabbits, dogs and Gvinea pigs in antibody production // J.Infect.Dis. -1924. - Vol.34. - P. 159-185.
29. Roger M. Role protectur du grand epiploon // C.R.Soc.Biol. - 1898. - Vol.50. - P. 197-198.
30. Sakai K., Kamura T., Hirakawa T.,Saito T., Kaku T., Nakano H. Relationship between pelvic lymph node involvement and other disease sites in patients with ovarian cancer // Gynec. Oncol. - 1997. - Vol. 65. - №1.
31. Seirfert E. Studien am Omentum majus des Menschen // Langenbecks Arch. Klin. Chir. - 1923. -Vol.123. - P. 608-683.
32. Shi Y.F. Cheng Y.P. Omental metastasis in primary ovarian cancer // Chung Hua Fu Chan Ko Tsa Chin. - 1990. - Vol.25(2). - P. 70-72.
33. Shimotsuma M., Simpson-Morgan M.W., Taka-hashi T., Hagiwara A. Activation of omental milky spots and milky spot macrophages by intraperitoneal administration of a streptococcal preparation, OK-432 // Cancer Res. - 1992. - Vol.52. - P. 5400-5402.
34. Tsujimoto H., Hagiwara A., Shimotsuma M., Sakakura C., Osaki K., Sasaki S., Ohyama T.,Ohgaki M., Imanishi T., Yamazaki J., Takahashi T. Role of milky spots as selective implantation sites for malignant cells in peritoneal dissemination in mice // Cancer Res Clin Oncol. - 1996. - Vol.122. - P. 590-595.
Читайте также:

